Ronen Shavit1, Maya Ilouze, Tali Feinberg, Yaacov Richard Lawrence, Yossi Tzur, Nir Peled
1 Centro di ricerca e rilevamento del cancro toracico, Sheba Medical Center Tel Hashomer, Ramat-Gan, 52621, POB 244, Israele.
e-mail: [email protected]
URL: http://medicine.mytau.org/peled/
Y. R.Lawrence
Center for Translational Research in Radiation Oncology, Sheba Medical Center, Ramat-Gan, Israele
M. Ilouze : N. Peled
Thoracic Cancer Service, Davidoff Cancer Center, Rabin Medical Center, Petach Tikva, Israele
Corrispondenza: [email protected]
Accettato: 10 dicembre 2014
Pubblicato: 7 gennaio 2015
Abstract
Introduzione: Il tumore del polmone è la principale causa di morte per cancro. La radioterapia svolge un ruolo fondamentale nel suo trattamento. Le radiazioni ionizzanti inducono la morte cellulare attraverso le aberrazioni cromosomiche, che innescano la catastrofe mitotica e l’apoptosi. Tuttavia, molti pazienti affetti da carcinoma polmonare mostrano resistenza alle radiazioni. Il dicloroacetato (DCA) è una piccola molecola che può promuovere l’attivazione mitocondriale aumentando l’afflusso di piruvato. In questa sede abbiamo verificato se il DCA possa aumentare la sensibilità delle cellule di carcinoma polmonare non a piccole cellule (NSCLC) alle radiazioni attraverso questo meccanismo.
Metodi: Due linee cellulari rappresentative di NSCLC (A549 e H1299) sono state testate per la loro sensibilità alle radiazioni con e senza pre-esposizione al DCA. L’efficacia del trattamento è stata valutata utilizzando un saggio di sopravvivenza clonogenica. È stato utilizzato un analizzatore di flusso extracellulare per valutare l’effetto del DCA sul consumo di ossigeno cellulare come marker surrogato dell’attività mitocondriale.
Risultati: Abbiamo scoperto che il DCA aumenta il tasso di consumo di ossigeno nelle cellule A549 e H1299 rispettivamente del 60% (p = 0,0037) e del 20% (p = 0,0039). La pre-esposizione al DCA un’ora prima delle radiazioni ha aumentato il tasso di morte citotossica di 4 volte nelle cellule A549 (dal 55 al 13%, p = 0,004) e di 2 volte nelle cellule H1299 (dal 35 al 17%, p = 0,28) rispettivamente, rispetto alle sole radiazioni.
Conclusioni: L’induzione mitocondriale da parte del DCA può fungere da radio-sensibilizzatore nel carcinoma polmonare non a piccole cellule.
Parole chiave: NSCLC; DCA; Mitocondri; Radiazioni; Radio-sensibilizzatore; Effetto Warburg
© Società internazionale di oncologia cellulare 2015
INTRODUZIONE
Il tumore del polmone è la principale causa di morte per cancro negli Stati Uniti, con un tasso di sopravvivenza globale a 5 anni per tutti gli stadi pari a ~17% [1-4]. La radioterapia (RT) svolge un ruolo importante nella gestione clinica dei pazienti affetti da carcinoma polmonare, in particolare quelli con malattia in stadio IIIB candidati alla chemio-radioterapia definitiva. Inoltre, la radioterapia può essere applicata come terapia neoadiuvante o adiuvante nello stadio IIIA, o in modo ablativo quando si applica la radioterapia stereotassica del corpo (SBRT). La polmonite indotta da radiazioni (RIP) è il fattore limitante nel trattamento dei pazienti con RT. Per ridurre al minimo la RIP, gli oncologi mirano a mantenere il V20 (cioè la percentuale di volume polmonare che riceve una dose di radiazioni ≥20 Gy) al di sotto del 22% [5]. I radiosensibilizzanti possono aumentare l’efficacia citotossica delle radiazioni, migliorando così potenzialmente i tassi di guarigione senza aumentare il V20.
La RT uccide le cellule causando rotture del doppio filamento di DNA. Le rotture del DNA non riparate provocano aberrazioni cromosomiche che, a loro volta, portano alla “catastrofe mitotica”, una modalità di morte cellulare che deriva dall’ingresso prematuro o inappropriato delle cellule nella mitosi [6,7]. Inoltre, le radiazioni possono influenzare direttamente le membrane cellulari e gli organelli. Sebbene questi ultimi cambiamenti siano ancora poco conosciuti, possono portare a cambiamenti nella trasduzione del segnale, nell’espressione genica, nella stabilità delle proteine, negli stati redox cellulari e nella regolazione del ciclo cellulare, tutti fattori che possono portare all’apoptosi [8]. Inoltre, le radiazioni possono indurre la produzione di specie reattive dell’ossigeno (ROS) mitocondriali, accompagnata da una up-regulation delle funzioni della catena di trasporto degli elettroni mitocondriali, aumentando così il potenziale di membrana mitocondriale, la respirazione mitocondriale e la produzione di ATP mitocondriale [9,10]. Tuttavia, le alterazioni genetiche limitano la capacità delle cellule tumorali di subire l’apoptosi, suggerendo che i microambienti tumorali ipossici possono fornire una pressione selettiva verso un fenotipo tumorale resistente all’apoptosi e, di conseguenza, alla RT [11]. A causa di questo fenotipo resistente alla radioterapia e dei significativi effetti collaterali causati dalla radioterapia stessa, è di cruciale importanza esplorare modi per radiosensibilizzare le cellule tumorali del polmone al fine di ridurre le dosi di radiazioni e migliorare la risposta alla terapia.
Molte cellule tumorali presentano elevati livelli di assorbimento del glucosio e ridotti livelli di fosforilazione ossidativa. Questa paradossale iperglicolisi e mancanza di attività mitocondriale in presenza di ossigeno è nota come effetto Warburg (illustrato nella Fig. 1) [12]. Il metabolismo unico della maggior parte dei tumori solidi deriva dal rimodellamento delle funzioni mitocondriali per produrre un fenotipo glicolitico e una forte resistenza all’apoptosi [13]. Un numero crescente di prove indica che i mitocondri possono essere i bersagli primari per la terapia del cancro [14-17]. Il rimodellamento specifico del cancro può essere invertito da una piccola molecola chiamata dicloroacetato (DCA) [18], che inibisce la piruvato deidrogenasi chinasi (PDK), aumentando così l’afflusso di piruvato nei mitocondri e promuovendo la sua ossidazione attraverso l’attività mitocondriale rispetto alla glicolisi in vari tipi di cancro (illustrati nella Fig. 1) [13,18]. Un aumento dell’attività mitocondriale provoca un incremento sia della quantità che dell’entità del rilascio di radicali liberi (ROS) nella cellula, con conseguente aumento dell’attività apoptotica cellulare [13].
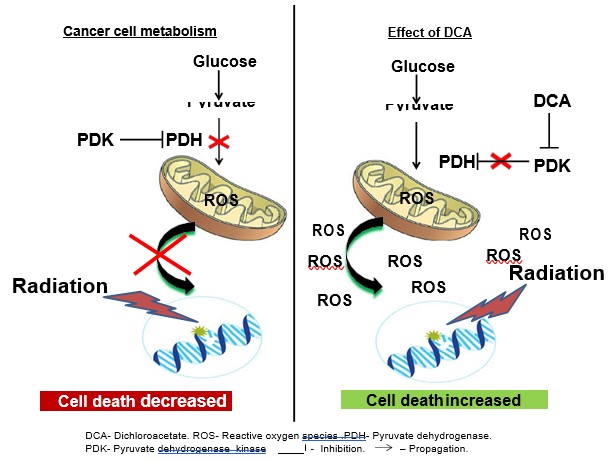
Qui abbiamo studiato il potenziale effetto radio-sensibilizzante del DCA nelle cellule di NSCLC. I nostri risultati indicano che l’attivazione mitocondriale da parte del DCA aumenta la sensibilità alle radiazioni sia nelle cellule A549 che in quelle H1299 derivate da NSCLC.
Materiali e metodi
Colture cellulari
In questo studio sono state utilizzate due linee cellulari di carcinoma polmonare non a piccole cellule (NSCLC): A549, derivata da un adenocarcinoma umano e H1299, derivata da un carcinoma umano a grandi cellule. Entrambe le linee cellulari sono state acquistate dall’ATCC. Le cellule sono state coltivate in terreno RPMI-1640 integrato con il 10% di siero fetale bovino (FBS), l’1% di penicillina/streptomicina e l’1% di glutammato a 37 °C in un’atmosfera umidificata al 5% diCO2.
Condizioni di trattamento
Il dicloroacetato(DCA, Sigma 34795) è stato aggiunto ai terreni di coltura per 1 ora prima dell’irradiazione a 10 e 20 mM nel caso delle cellule H1299 e a 40 e 60 mM nel caso delle cellule A549, secondo i rispettivi valori di IC50. Le cellule sono state irradiate con un irradiatore Kimtron Polaris a un rateo di dose di 0,9 Gy/min a temperatura ambiente.
Saggio di sopravvivenza clonogenica
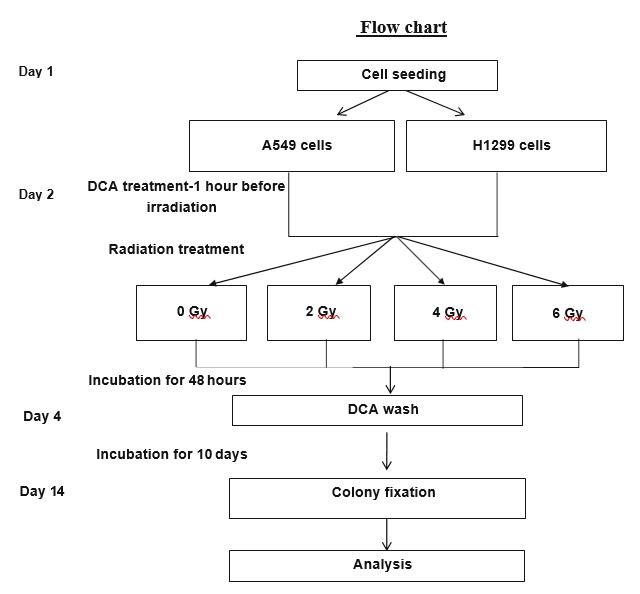
Il saggio di sopravvivenza clonogenica che abbiamo utilizzato è stato precedentemente descritto [19]. In breve, le cellule sono state staccate con tripsina, sospese in terreno di coltura completo, contate e seminate in piatti da 3 ml a una densità di 200 cellule per piatto, quindi lasciate aderire e stabilizzarsi per una notte. Il giorno successivo, i gruppi di test sono stati trattati con DCA (o controllo) 1 ora prima delle radiazioni, alle concentrazioni indicate. Le cellule sono state irradiate a dosi di 0, 2, 4 e 6 Gy. Dopo 48 ore di incubazione, i terreni di coltura sono stati rimossi e sostituiti con terreni di coltura freschi senza DCA (tutti i gruppi). Le cellule sono state incubate per altri 10 giorni per consentire la formazione di colonie. Successivamente, le colonie sono state fissate e colorate con cristalvioletto allo 0,5% in etanolo al 96%. Sono state contate le colonie contenenti almeno 50 cellule vitali (Fig. 2). Ogni esperimento è stato eseguito in doppio e la media e la deviazione standard sono state calcolate da 3 esperimenti indipendenti.
Valutazione della sinergia
Per valutare se i programmi di trattamento mostrano effetti sinergici, sono stati realizzati grafici delle medie e delle deviazioni standard delle percentuali di sopravvivenza rispetto alle dosi di radiazioni. Sono state calcolate le percentuali di sopravvivenza, sia per i gruppi trattati che per quelli non trattati con DCA, rispetto a quelle delle cellule non irradiate:
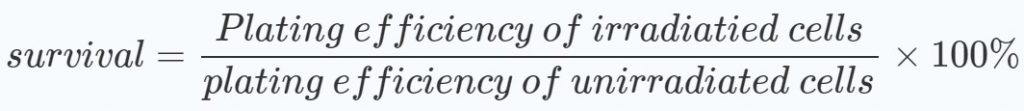
dove:
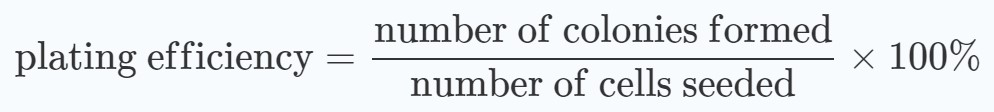
In particolare, la formazione di colonie di entrambi i gruppi trattati con DCA e non trattati con DCA senza trattamento con radiazioni è stata normalizzata al 100%. Gli effetti sinergici sono stati determinati con un’ANOVA a due vie (valore p <0,05) [20].
Test del consumo di ossigeno
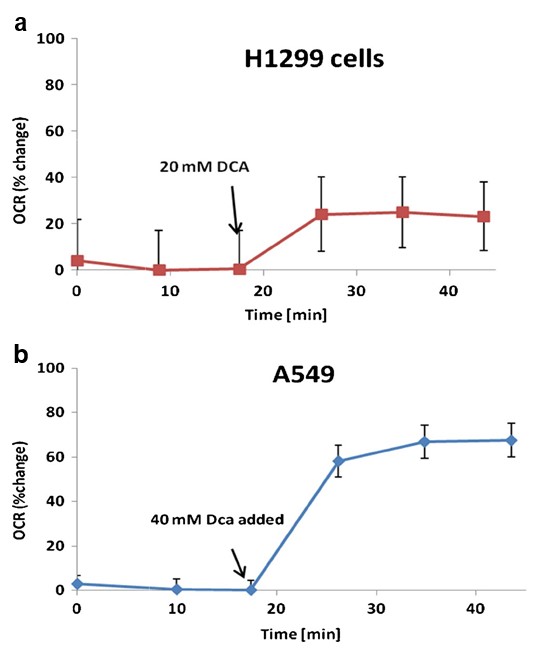
Il consumo diossigenoè stato utilizzato come marker surrogato dell’attività mitocondriale. Le misurazioni sono state effettuate con un analizzatore di flusso extracellulare XF24 (Seahorse Biosciences). Questo dispositivo utilizza sensori ottici a fluorescenza e piastre multipozzetto personalizzate per eseguire misurazioni ripetute del consumo di ossigeno di cellule intatte che crescono in monostrato. Le cellule H1299 e A549 sono state seminate in piastre di coltura cellulare Seahorse XF24 rispettivamente a 10.000 e 20.000 cellule per pozzetto, in terreno di crescita. Le cellule sono state incubate per 48 ore a 37 °C con il 5% diCO2. Successivamente, le cellule sono state lavate e trasferite in terreno di saggio XF/PBS e incubate per 60 minuti a 37 °C senzaCO2 prima di iniziare l’esperimento. Dopo aver stabilito i tassi di consumo di ossigeno di base, alle cellule H1299 e A549 sono stati aggiunti rispettivamente 20 e 40 mM di DCA. Le misurazioni del consumo di ossigeno sono proseguite per 25 minuti. I dati sono stati acquisiti da almeno tre piastre replicate per linea cellulare. I risultati sono rappresentati come percentuale del tasso di respirazione di base.
Analisi statistica
La significatività statistica è stata valutata utilizzando il test t di Student. La sinergia è stata valutata con un’ANOVA a due vie [20]. Un valore di p< 0,05 è stato considerato significativo.
Risultati
IlDCA radio-sensibilizza le cellule di NSCLC
Il dicloroacetato(DCA) è noto per aumentare l’attività mitocondriale [10,15] e in precedenza ha dimostrato di agire come radio-sensibilizzatore in diverse linee cellulari tumorali derivate da tumori della prostata, del colon-retto e del cervello [21, 22]. In questa sede è stato studiato il suo effetto su due linee cellulari derivate dal carcinoma polmonare non a piccole cellule (NSCLC), ovvero A549 (adenocarcinoma) e H1299 (carcinoma a grandi cellule). Le concentrazioni di DCA utilizzate per ciascuna linea cellulare corrispondevano ai rispettivi valori di IC50 (A549: 63 mM e H1299: 36 mM; Fig. 3a e b).
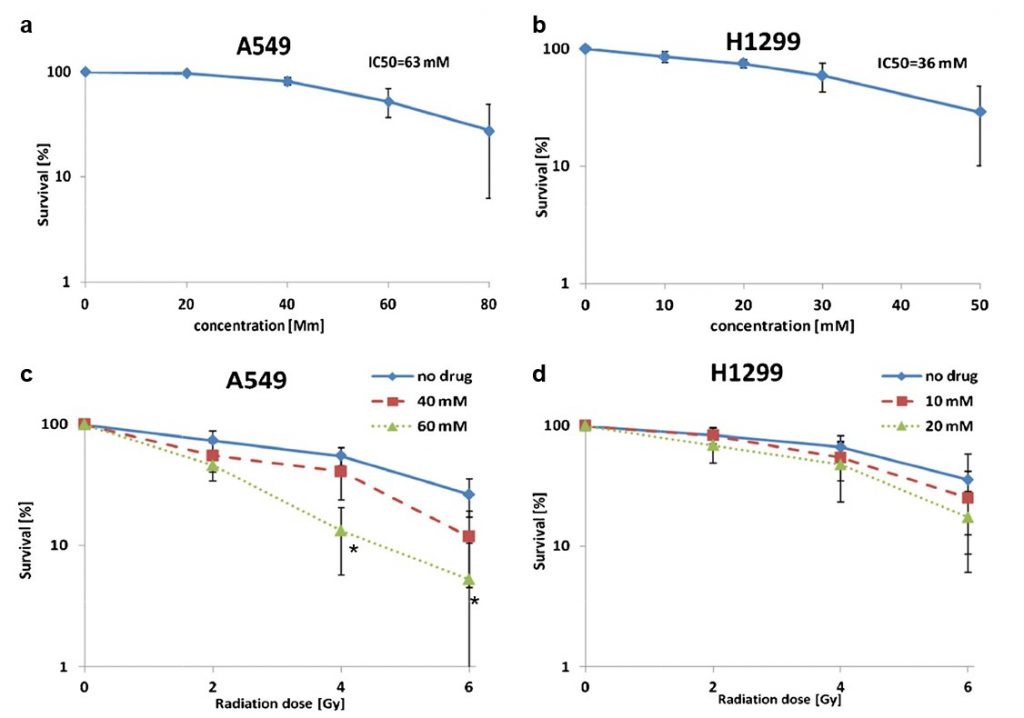
Abbiamo riscontrato che l’esposizione pre-radiazione con DCA ha aumentato la morte cellulare in entrambi i campioni di cellule A549 e H1299. L’effetto massimo nelle cellule A549 è stato osservato a 4 Gy, dove il trattamento con DCA (40 e 60 mM) ha ridotto la sopravvivenza cellulare da ~55 al 40% (p= 0,27) e al 13% (p= 0,004), rispettivamente (Fig. 3c). Nelle cellule H1299, l’effetto massimo è stato raggiunto a 6 Gy. A questa dose di radiazioni, il trattamento con DCA (10 e 20 mM) ha ridotto la sopravvivenza cellulare dal 35% (solo radiazioni) al 25 e 17%, rispettivamente (non statisticamente significativo; Fig. 3d). La pre-esposizione delle cellule A549 al DCA (60 mM) ha aumentato l’effetto citotossico della radiazione di 4 Gy di 4 volte rispetto alla sola radiazione. Un’analisi ANOVA a due vie ha indicato un effetto sinergico solo nelle cellule A549.
IlDCA aumenta il consumo di ossigeno nelle cellule A549 e H1299
Un aumento del tasso di consumo di ossigeno cellulare (OCR) è indice di una maggiore attività mitocondriale [23]. Abbiamo riscontrato che il DCA aumenta l’OCR in entrambe le cellule A549 e H1299 rispettivamente del 60% (p= 0,0037) e del 20% (p= 0,0039) rispetto all’OCR basale (Fig. 4).
Discussione
Testando la sensibilità alle radiazioni con e senza pre-esposizione al dicloroacetato (DCA), abbiamo scoperto che l’attivazione mitocondriale da parte del DCA è in grado di sensibilizzare alle radiazioni due distinte linee cellulari derivate dal carcinoma polmonare non a piccole cellule (NSCLC) (cioè A549 e H1299). In questo studio di prova, è stata utilizzata un’ampia gamma di concentrazioni di DCA, con l’obiettivo di adattare la dose al valore IC50 di ciascuna cellula. L’effetto sinergico del DCA è risultato statisticamente significativo nelle cellule A549, mentre ha sfiorato la significatività nelle cellule H1299. È possibile che un effetto ancora più robusto possa essere ottenuto con dosi più elevate di DCA. Abbiamo anche dimostrato che il DCA aumenta il consumo di ossigeno sia nelle cellule A549 che in quelle H1299, un marker surrogato dell’aumento dell’attività mitocondriale.
Le radiazioni ionizzanti regolano la funzione della catena di trasporto degli elettroni mitocondriale e aumentano il potenziale di membrana mitocondriale e la produzione di ATP [9]. L’iperattivazione mitocondriale da parte del DCA aumenta ulteriormente la quantità e l’entità dei radicali liberi (ROS) rilasciati dai mitocondri stessi [13]. Questi fattori possono spiegare l’effetto sinergico osservato con la pre-esposizione delle cellule al DCA prima dell’inizio delle radiazioni.
Atkinson et al. [15] hanno dimostrato che l’inibizione della citocromo c perossidasi e il rilascio di citocromo c dai mitocondri attenuano la morte cellulare indotta dalle radiazioni. Lee et al. [24] hanno osservato una diminuzione dell’inibizione della morte cellulare mediata dai ROS bloccando la risposta antiossidante dipendente dal fattore nucleare eritroide 2 (nrf2), che aumenta la radiosensibilità delle cellule H1299, A549 e H640. Questi studi hanno dimostrato la capacità di influenzare la reazione cellulare alle radiazioni interferendo con i processi legati al citocromo c e ai ROS, sottolineando così la nostra ipotesi che il DCA radio-sensibilizzi le cellule tumorali attraverso l’attivazione mitocondriale che consente il rilascio di ROS.
Anche Cao et al. [21] hanno riportato che il DCA agisce come radio-sensibilizzante nelle cellule di cancro alla prostata. Zwicker et al. [22] hanno scoperto che il DCA agisce come radio-sensibilizzante in vitro ma non in vivo nelle cellule WIDR (colon-retto) e LN18 (glioma). La mancanza di sinergia nel modello di xenotrapianto WIDR in vivo è stata spiegata da un effetto tampone dell’ambiente, che potrebbe aver permesso alle cellule tumorali di mantenere il loro programma metabolico glicolitico. Gli studi che dimostrano l’effetto in vivo di DCA e radiazioni nel NSCLC devono ancora essere eseguiti.
La radioterapia è una terapia comune per i pazienti affetti da tumore al polmone. Il notevole danno che provoca ai tessuti normali circostanti, tuttavia, ne limita l’applicazione. Negli ultimi due decenni gli inibitori farmacologici delle molecole di segnalazione che regolano il potenziale apoptotico si sono dimostrati promettenti come radio-sensibilizzatori in vitro [25,29]. Sebbene il DCA sia stato segnalato come radio-sensibilizzante nel cancro alla prostata [21], il suo uso clinico nel NSCLC non è stato finora dimostrato. Qui dimostriamo la capacità del DCA di ridurre le dosi di radiazioni nelle cellule NSCLC A549 e H1299 senza compromettere il livello di effetto. Inoltre, dimostrando che il trattamento con DCA aumenta il consumo di ossigeno delle cellule A549 e H1299, abbiamo scoperto il potenziale del DCA di agire come attivatore mitocondriale. Pertanto, concludiamo che l’attivazione mitocondriale può svolgere un ruolo nella terapia del NSCLC se integrata con il trattamento radiante. Inoltre, ipotizziamo che l’induzione dell’aumento dell’attività mitocondriale, cioè l’aumento del rilascio di radicali liberi e dell’apoptosi da parte del DCA, sia la causa principale del potenziale del DCA nella radio-sensibilizzazione delle cellule NSCLC.
In sintesi, abbiamo dimostrato che l’induzione mitocondriale in vitro da parte del DCA sensibilizza significativamente le cellule NSCLC A549 in modo sinergico. Questa osservazione merita un’ulteriore valutazione in un contesto in vivo.
Ringraziamenti
Gli autori ringraziano la dottoressa Shoshana Paglin (Sheba Medical Center) per la guida e le proficue discussioni su questo lavoro.
Questo lavoro è stato eseguito in parziale adempimento dei requisiti della tesi di dottorato della Facoltà di Medicina Sackler dell’Università di Tel Aviv ed è stato sostenuto dallo Sheba Medical Center. (Ronen Shavit)
Conflitto di interessi
Gli autori dichiarano di non avere conflitti di interesse.
RIFERIMENTI
1 R. Siegel, C. DeSantis, K. Virgo, K. Stein, A. Mariotto, T. Smith, D. Cooper, T. Gansler, C. Lerro, S. Fedewa, C. Lin, C. Leach, R.S. Cannady, H. Cho, S. Scoppa, M. Hachey, R. Kirch, A. Jemal, E. Ward, Cancer treatment and survivorship statistics, 2012. CA Cancer J. Clin. 62(4), 220-241 (2012)2 Q. Wu, Y.F. Chen, J. Fu, Q.H. You, S.M. Wang, X. Huang, X.J. Feng, S.H. Zhang, Short hairpin RNA-mediated down-regulation of CENP-A attenuates the aggressive phenotype of lung adenocarcinoma cells. Cell. Oncol. 37(6), 399-407 (2014)
3 A. Koren, H. Motaln, T. Cufer, Cellule staminali del cancro del polmone: una prospettiva biologica e clinica. Cell. Oncol. 36(4), 265-275 (2013)
4 N. Peled, M.W. Wynes, N. Ikeda, T. Ohira, K. Yoshida, J. Qian, M. Ilouze, R. Brenner, Y. Kato, C. Mascaux, F.R. Hirsch, Insulin-like growth factor-1 receptor (IGF-1R) as a biomarker for resistance to the tyrosine kinase inhibitor gefitinib in non-small cell lung cancer. Cell. Oncol. 36(4), 277-288 (2013)
5 M.V. Graham, J.A. Purdy, B. Emami, W. Harms, W. Bosch, M.A. Lockett, C.A. Perez, Analisi clinica dell’istogramma dose-volume per la polmonite dopo il trattamento 3D per il tumore polmonare non a piccole cellule (NSCLC). Int. J. Radiat. Oncol. Biol. Phys. 45(2), 323-329 (1999)
6 H. Vakifahmetoglu, M. Olsson, B. Zhivotovsky, Death through a tragedy: mitotic catastrophe. Cell Death Differ. 15(7), 1153-1162 (2008)
7 J. Thoms, R.G. Bristow, DNA repair targeting and radiotherapy: a focus on the therapeutic ratio. Semin. Radiat. Oncol. 20(4), 217-222 (2010)
8 C. Coleman, Beneficial liaisons: radiobiology meets cellular and molecular biology. Radiother Oncol: J. Eur. Soc. Ther. Radiol. Oncol. 28(1), 1-15 (1993)
1 T. Yamamori, H. Yasui, M. Yamazumi, Y. Wada, Y. Nakamura, H. Nakamura, O. Inanami, Ionizing radiation induces mitochondrial reactive oxygen species production accompanied by upregulation of mitochondrial electron transport chain function and mitochondrial content under control of the cell cycle checkpoint. Free Radic. Biol. Med. 53(2), 260-270 (2012)
10 I. Szumiel, Ionising radiation-induced oxidative stress, epigenetic changes and genomic instability: the pivotal role of mitochondria. Int J Radiat Biol. 1-55 (2014)
11 B.A. Rupnow, S.J. Knox, The role of radiation-induced apoptosis as a determinant of tumor responses to radiation therapy. Apoptosis 4(2), 115-143 (1999)
12 R.A. Cairns, I.S. Harris, T.W. Mak, Regolazione del metabolismo delle cellule tumorali. Nat. Rev. Cancer 11(2), 85-95 (2011)
13 E.D. Michelakis, L. Webster, J.R. Mackey, Il dicloroacetato (DCA) come potenziale terapia di targeting metabolico per il cancro. Br. J. Cancer 99(7), 989-994 (2008)
14 X. Wang, S. Peralta, C.T. Moraes, Mitochondrial alterations during carcinogenesis: a review of metabolic transformation and targets for anticancer treatments. Adv. Cancer Res. 119, 127-160 (2013)
15 J. Atkinson, A.A. Kapralov, N. Yanamala, Y.Y. Tyurina, A.A. Amoscato, L. Pearce, J. Peterson, Z. Huang, J. Jiang, A.K. Samhan-Arias, A. Maeda, W. Feng, K. Wasserloos, N.A. Belikova, V.A. Tyurin, H. Wang, J. Fletcher, Y. Wang, I.I. Vlasova, J. Klein-Seetharaman, D.A. Stoyanovsky, H. Bayir, B.R. Pitt, M.W. Epperly, J.S. Greenberger, V.E. Kagan, A mitochondria-targeted inhibitor of cytochrome c peroxidase mitigates radiation-induced death. Nat. Commun. 2, 497 (2011)
16 S.H. Kim, Y.H. Yoo, J.H. Lee, J.W. Park, Mitochondrial NADP(+)-dependent isocitrate dehydrogenase knockdown inhibits tumorigenicity of melanoma cells. Biochem. Biophys. Res. Commun. 451(2), 246-251 (2014)
17 Z. Tatarkova, S. Kuka, M. Petras, P. Racay, J. Lehotsky, D. Dobrota, P. Kaplan, Why mitochondria are excellent targets for cancer therapy. Klin. Onkol. 25(6), 421-426 (2013)
18 S. Bonnet, S.L. Archer, J. Allalunis-Turner, A. Haromy, C. Beaulieu, R. Thompson, C.T. Lee, G.D. Lopaschuk, L. Puttagunta, G. Harry, K. Hashimoto, C.J. Porter, M.A. Andrade, B. Thebaud, E.D. Michelakis, A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth. Cancer Cell 11(1), 37-51 (2007)
19 N.A. Franken, H.M. Rodermond, J. Stap, J. Haveman, C. van Bree, Saggio clonogenico di cellule in vitro. Nat. Protoc. 1(5), 2315-2319 (2006)
20 B.K. Slinker, La statistica del sinergismo. J. Mol. Cell. Cardiol. 30(4), 723-731 (1998)
21 W. Cao, S. Yacoub, K.T. Shiverick, K. Namiki, Y. Sakai, S. Porvasnik, C. Urbanek, C.J. Rosser, Il dicloroacetato (DCA) sensibilizza in vitro alle radiazioni sia le cellule di cancro alla prostata wild-type che quelle che esprimono Bcl-2. Prostata 68(11), 1223-1231 (2008)
22 F. Zwicker, A. Kirsner, P. Peschke, F. Roeder, J. Debus, P.E. Huber, K.J. Weber, Il dicloroacetato induce una radiosensibilità tumore-specifica in vitro ma attenua il ritardo di crescita tumorale indotto dalle radiazioni in vivo. Strahlenther. Onkol. 189(8), 684-692 (2013)
23I. Papandreou, R.A. Cairns, L. Fontana, A.L. Lim, N.C. Denko, HIF-1 media l’adattamento all’ipossia attraverso la downregolazione attiva del consumo di ossigeno mitocondriale. Cell Metab. 3(3), 187-197 (2006)
24 S. Lee, M.J. Lim, M.H. Kim, C.H. Yu, Y.S. Yun, J. Ahn, J.Y. Song, An effective strategy for increasing the radiosensitivity of Human lung Cancer cells by blocking Nrf2-dependent antioxidant responses. Free Radic. Biol. Med. 53(4), 807-816 (2012)
25 S.J. Chmura, H.J. Mauceri, S. Advani, R. Heimann, M.A. Beckett, E. Nodzenski, J. Quintans, D.W. Kufe, R.R. Weichselbaum, Decreasing the apoptotic threshold of tumor cells through protein kinase C inhibition and sphingomyelinase activation increases tumor killing by ionizing radiation. Cancer Res. 57(19), 4340-4347 (1997)
26 V. Bhardwaj, Y. Zhan, M.A. Cortez, K.K. Ang, D. Molkentine, A. Munshi, U. Raju, R. Komaki, J.V. Heymach, J. Welsh, L’inibitore di C-Met MK-8003 radiosensibilizza le cellule di cancro al polmone non a piccole cellule con espressione di c-Met indotta da radiazioni. J. Thorac. Oncol. 7(8), 1211-1217 (2012)
27 E.J. Bernhard, G. Kao, A.D. Cox, S.M. Sebti, A.D. Hamilton, R.J. Muschel, W.G. McKenna, The farnesyltransferase inhibitor FTI-277 radiosensitizes H-ras-transformed rat embryo fibroblasts. Cancer Res. 56(8), 1727-1730 (1996)
28 H.J. Boeckman, K.S. Trego, J.J. Turchi, Il cisplatino sensibilizza le cellule tumorali alle radiazioni ionizzanti attraverso l’inibizione della giunzione terminale non omologa. Mol. Cancer Res. 3(5), 277-285 (2005)
29 N. Balaban, J. Moni, M. Shannon, L. Dang, E. Murphy, T. Goldkorn, The effect of ionizing radiation on signal transduction: antibodies to EGF receptor sensitize A431 cells to radiation. Biochim. Biophys. Acta 1314(1-2), 147-156 (1996)
Contenuti correlati: