Ronen Shavit1, Maya Ilouze, Tali Feinberg, Yaacov Richard Lawrence, Yossi Tzur, Nir Peled
1 Thoracic Cancer Research and Detection Center, Sheba Medical Center Tel Hashomer, Ramat-Gan, 52621, POB 244, Israel.
e-mail: [email protected]
URL: http://medicine.mytau.org/peled/
Y. R. Lawrence
Center for Translational Research in Radiation Oncology, Sheba Medical Center, Ramat-Gan, Israel
M. Ilouze : N. Peled
Thoracic Cancer Service, Davidoff Cancer Center, Rabin Medical Center, Petach Tikva, IsraelCorrespondence
:
[email protected]: 10 December 2014Published
: 7 January 2015
Zusammenfassung
Einleitung: Lungenkrebs ist die häufigste Todesursache bei Krebserkrankungen. Die Strahlentherapie spielt bei seiner Behandlung eine Schlüsselrolle. Ionisierende Strahlung führt zum Zelltod durch Chromosomenaberrationen, die eine mitotische Katastrophe und Apoptose auslösen. Viele Lungenkrebspatienten zeigen jedoch eine Resistenz gegen Strahlung. Dichloracetat (DCA) ist ein kleines Molekül, das die mitochondriale Aktivierung fördern kann, indem es den Zufluss von Pyruvat erhöht. Hier haben wir getestet, ob DCA die Strahlenempfindlichkeit von Zellen des nicht-kleinzelligen Lungenkrebses (NSCLC) durch diesen Mechanismus erhöhen kann.
Methoden: Zwei repräsentative NSCLC-Zelllinien (A549 und H1299) wurden auf ihre Empfindlichkeit gegenüber Strahlung mit und ohne vorherige DCA-Exposition getestet. Die Wirksamkeit der Behandlung wurde mit einem klonogenen Überlebenstest bewertet. Ein extrazellulärer Flux-Analysator wurde verwendet, um die Wirkung von DCA auf den zellulären Sauerstoffverbrauch als Surrogatmarker für die mitochondriale Aktivität zu bewerten.
Ergebnisse: Wir fanden heraus, dass DCA die Sauerstoffverbrauchsrate sowohl in A549- als auch in H1299-Zellen um 60% (p = 0,0037) bzw. 20% (p = 0,0039) erhöht. Die DCA-Exposition eine Stunde vor der Bestrahlung erhöhte die zytotoxische Todesrate bei A549-Zellen um das Vierfache (55 bis 13 %, p = 0,004) und bei H1299-Zellen um das Zweifache (35 bis 17 %, p = 0,28) im Vergleich zur Bestrahlung allein.
Schlussfolgerung: Die Induktion von Mitochondrien durch DCA kann als Radiosensibilisator bei nicht-kleinzelligem Lungenkrebs dienen.
Schlüsselwörter: NSCLC; DCA; Mitochondrien; Strahlung; Radio-Sensibilisator; Warburg-Effekt
© Internationale Gesellschaft für Zelluläre Onkologie 2015
EINLEITUNG
Lungenkrebs ist die Hauptursache für krebsbedingte Todesfälle in den Vereinigten Staaten mit einer 5-Jahres-Gesamtüberlebensrate für alle Stadien von ~17 % [1-4]. Die Strahlentherapie (RT) spielt bei der klinischen Behandlung von Lungenkrebspatienten eine wichtige Rolle, insbesondere bei Patienten im Stadium IIIB, die für eine definitive Chemo-Strahlentherapie in Frage kommen. Darüber hinaus kann die RT als neoadjuvante oder adjuvante Therapie im Stadium IIIA oder ablativ bei der stereotaktischen Körperbestrahlung (SBRT) eingesetzt werden. Strahleninduzierte Pneumonitis (RIP) ist der limitierende Faktor bei der Behandlung von Patienten mit RT. Um die RIP so gering wie möglich zu halten, versuchen Onkologen, den V20-Wert (d. h. den Prozentsatz des Lungenvolumens, der eine Strahlendosis von ≥20 Gy erhält) unter 22 % zu halten [5]. Radiosensibilisatoren können die zytotoxische Wirksamkeit der Bestrahlung erhöhen und damit möglicherweise die Heilungsraten verbessern, ohne die V20 zu erhöhen.
RT tötet Zellen, indem sie DNA-Doppelstrangbrüche verursacht. Nicht reparierte DNA-Brüche führen zu Chromosomenaberrationen, die wiederum zu einer „mitotischen Katastrophe“ führen – einer Form des Zelltods, die sich aus dem verfrühten oder unangemessenen Eintritt der Zellen in die Mitose ergibt [6,7]. Außerdem kann sich die Strahlung direkt auf Zellmembranen und Organellen auswirken. Auch wenn die letztgenannten Veränderungen noch nicht ausreichend erforscht sind, können sie zu Veränderungen in der Signalübertragung, der Genexpression, der Proteinstabilität, dem zellulären Redoxzustand und der Zellzyklusregulation führen, die alle zur Apoptose führen können [8]. Darüber hinaus kann die Strahlung die Produktion reaktiver Sauerstoffspezies (ROS) in den Mitochondrien induzieren, was mit einer Hochregulierung der Funktionen der mitochondrialen Elektronentransportkette einhergeht, wodurch sich das mitochondriale Membranpotenzial, die mitochondriale Atmung und die mitochondriale ATP-Produktion erhöhen [9,10]. Genetische Veränderungen schränken jedoch die Fähigkeit von Krebszellen ein, sich der Apoptose zu unterziehen, was darauf hindeutet, dass hypoxische Tumormikroumgebungen einen selektiven Druck in Richtung eines apoptoseresistenten Krebsphänotyps und folglich einer Resistenz gegenüber RT ausüben können [11]. Aufgrund dieses RT-resistenten Phänotyps und der erheblichen Nebenwirkungen der RT selbst ist es von entscheidender Bedeutung, Wege zu erforschen, um Lungenkrebszellen strahlenresistent zu machen, um die Strahlendosen zu verringern und das Ansprechen auf die Therapie zu verbessern.
Viele Tumorzellen weisen eine erhöhte Glukoseaufnahme und eine verminderte oxidative Phosphorylierung auf. Diese paradoxe Hyperglykolyse und fehlende Mitochondrienaktivität in Gegenwart von Sauerstoff ist als Warburg-Effekt bekannt (siehe Abb. 1) [12]. Der einzigartige Stoffwechsel der meisten soliden Tumoren beruht auf einer Umgestaltung der mitochondrialen Funktionen, die zu einem glykolytischen Phänotyp und einer starken Resistenz gegen Apoptose führt [13]. Es gibt immer mehr Hinweise darauf, dass Mitochondrien die primären Ziele für Krebstherapeutika sein könnten [14-17]. Das krebsspezifische Remodeling kann durch ein kleines Molekül namens Dichloracetat (DCA) [18] rückgängig gemacht werden, das die Pyruvat-Dehydrogenase-Kinase (PDK) hemmt und dadurch den Zufluss von Pyruvat in die Mitochondrien erhöht und seine Oxidation über die mitochondriale Aktivität gegenüber der Glykolyse in verschiedenen Krebsarten fördert (siehe Abb. 1) [13,18]. Ein Anstieg der mitochondrialen Aktivität führt zu einem Anstieg sowohl der Menge als auch des Ausmaßes der Freisetzung von freien Radikalen (ROS) in der Zelle, was zu einem Anstieg der zellulären apoptotischen Aktivität führt [13].
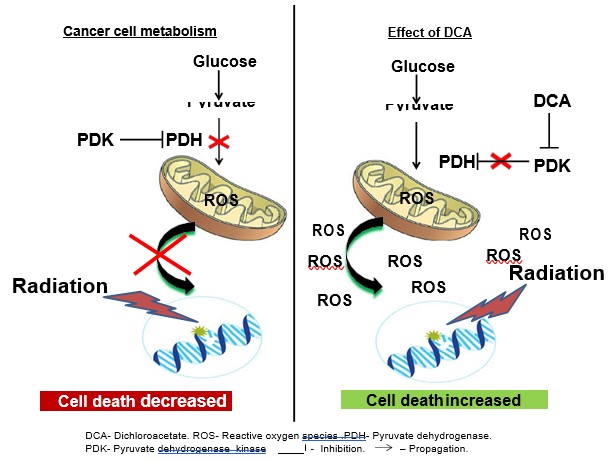
Hier untersuchten wir die potenziell radiosensibilisierende Wirkung von DCA in NSCLC-Zellen. Unsere Ergebnisse deuten darauf hin, dass die mitochondriale Aktivierung durch DCA die Strahlenempfindlichkeit sowohl der A549- als auch der H1299-Zellen des NSCLC erhöht.
Materialien und Methoden
Zellkulturen
In dieser Studie wurden zwei nicht-kleinzellige Lungenkrebs-Zelllinien (NSCLC) verwendet: A549, abgeleitet von einem menschlichen Adenokarzinom, und H1299, abgeleitet von einem menschlichen großzelligen Karzinom. Beide Zelllinien wurden von der ATCC erworben. Die Zellen wurden in RPMI-1640-Medium kultiviert, das mit 10 % fötalem Rinderserum (FBS), 1 % Penicillin/Streptomycin und 1 % Glutamat bei 37 °C in einer mit 5 %CO2 befeuchteten Atmosphäre ergänzt wurde.
Behandlungsbedingungen
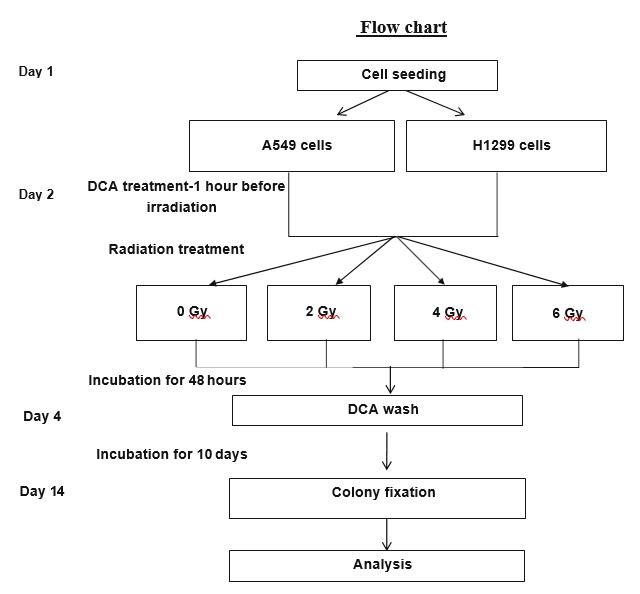
Dichloracetat (DCA, Sigma 34795) wurde dem Kulturmedium 1 Stunde vor der Bestrahlung in einer Konzentration von 10 und 20 mM im Falle von H1299-Zellen und 40 und 60 mM im Falle von A549-Zellen zugesetzt, entsprechend den jeweiligen IC50-Werten. Die Zellen wurden mit einem Kimtron-Polaris-Bestrahlungsgerät bei einer Dosisleistung von 0,9 Gy/min bei Raumtemperatur bestrahlt.
Klonogener Überlebenstest
Der von uns verwendete klonogene Überlebenstest wurde bereits beschrieben [19]. Die Zellen wurden mit Trypsin abgetrennt, in komplettem Kulturmedium suspendiert, gezählt und in 3-ml-Schalen mit einer Dichte von 200 Zellen pro Schale ausgesät und über Nacht stabilisiert. Am nächsten Tag wurden die Testgruppen 1 Stunde vor der Bestrahlung mit DCA (oder Kontrolle) in den angegebenen Konzentrationen behandelt. Die Zellen wurden mit Dosen von 0, 2, 4 und 6 Gy bestrahlt. Nach einer Inkubationszeit von 48 Stunden wurden die Kulturmedien entfernt und durch frische Kulturmedien ohne DCA ersetzt (alle Gruppen). Die Zellen wurden für weitere 10 Tage bebrütet, um die Koloniebildung zu ermöglichen. Anschließend wurden die Kolonien fixiert und mit 0,5 % Kristallviolett in 96 %igem Ethanol gefärbt. Kolonien mit mindestens 50 lebensfähigen Zellen wurden gezählt (Abb. 2). Jeder Versuch wurde in zweifacher Ausführung durchgeführt, und der Mittelwert und die Standardabweichung wurden aus 3 unabhängigen Versuchen berechnet.
Bewertung der Synergie
Um zu beurteilen, ob die Behandlungspläne synergistische Wirkungen zeigen, wurden Diagramme der Durchschnittswerte und Standardabweichungen der Überlebensraten im Verhältnis zu den Strahlungsdosen erstellt. Die prozentualen Überlebensraten wurden sowohl für die mit DCA behandelten als auch für die nicht mit DCA behandelten Gruppen im Verhältnis zu den nicht bestrahlten Zellen berechnet:
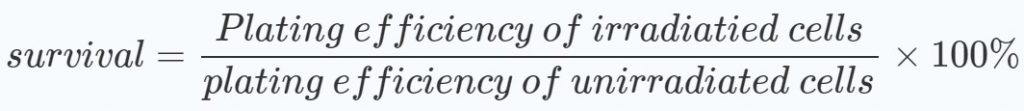
wobei:
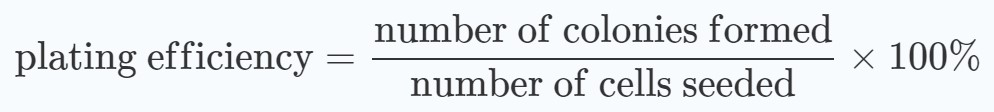
Die Koloniebildung der DCA-behandelten und DCA-unbehandelten Gruppen ohne Strahlenbehandlung wurde auf 100 % normiert. Synergistische Effekte wurden durch eine zweifache ANOVA (p-Wert <0,05) ermittelt [20].
Sauerstoffverbrauchstest
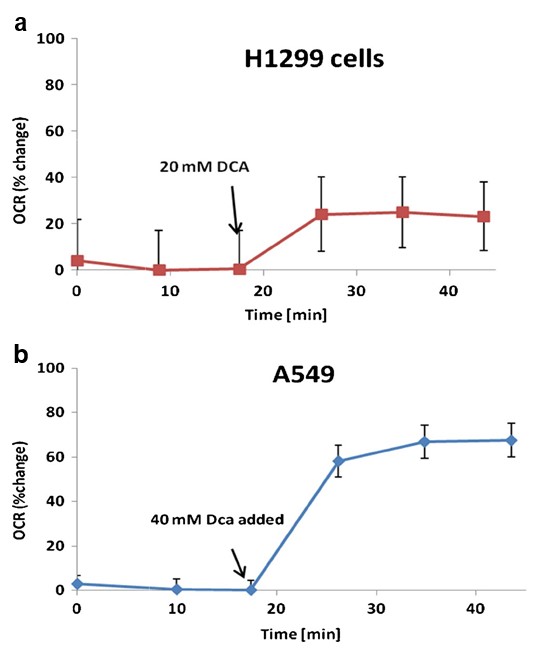
Der Sauerstoffverbrauchwurde als Surrogatmarker für die mitochondriale Aktivität verwendet. Die Messungen wurden mit einem extrazellulären Fluxanalysator XF24 (Seahorse Biosciences) durchgeführt. Dieses Gerät verwendet fluoreszenzbasierte optische Sensoren und kundenspezifische Multiwell-Platten, um wiederholte Messungen des Sauerstoffverbrauchs intakter, in Monolayern wachsender Zellen durchzuführen. H1299- und A549-Zellen wurden in Seahorse XF24-Zellkulturplatten mit 10.000 bzw. 20.000 Zellen pro Vertiefung in Wachstumsmedium ausgesät. Die Zellen wurden 48 Stunden lang bei 37 °C und 5 %CO2 inkubiert. Anschließend wurden die Zellen gewaschen, in XF-Assay-Medium/PBS überführt und 60 Minuten bei 37 °C ohneCO2 inkubiert, bevor der Versuch gestartet wurde. Nach der Ermittlung der Grundlinien-Sauerstoffverbrauchsraten wurden H1299- und A549-Zellen 20 bzw. 40 mM DCA zugesetzt. Die Messungen des Sauerstoffverbrauchs wurden für 25 Minuten fortgesetzt. Die Daten wurden von mindestens drei Wiederholungsplatten pro Zelllinie erfasst. Die Ergebnisse werden als Prozentsatz der Grundlinienatmungsrate dargestellt.
Statistische Analyse
Die statistische Signifikanz wurde mit dem Student’s t-Test ermittelt. Die Synergie wurde mit einer Zwei-Wege-ANOVA [20] bewertet. Ein Wert von p< 0,05 wurde als signifikant angesehen.
Ergebnisse
DCA sensibilisiert NSCLC-Zellen
Dichloracetat (DCA) erhöht bekanntermaßen die mitochondriale Aktivität [10,15] und hat sich bereits bei mehreren Krebszelllinien aus Prostata-, Kolorektal- und Gehirntumoren als Radiosensibilisator erwiesen [21, 22]. Hier wurde seine Wirkung auf zwei Zelllinien von nicht-kleinzelligem Lungenkrebs (NSCLC) untersucht, nämlich A549 (Adenokarzinom) und H1299 (großzelliges Karzinom). Die für jede Zelllinie verwendeten DCA-Konzentrationen entsprachen den jeweiligen IC50-Werten (A549: 63 mM und H1299: 36 mM; Abb. 3a und b).
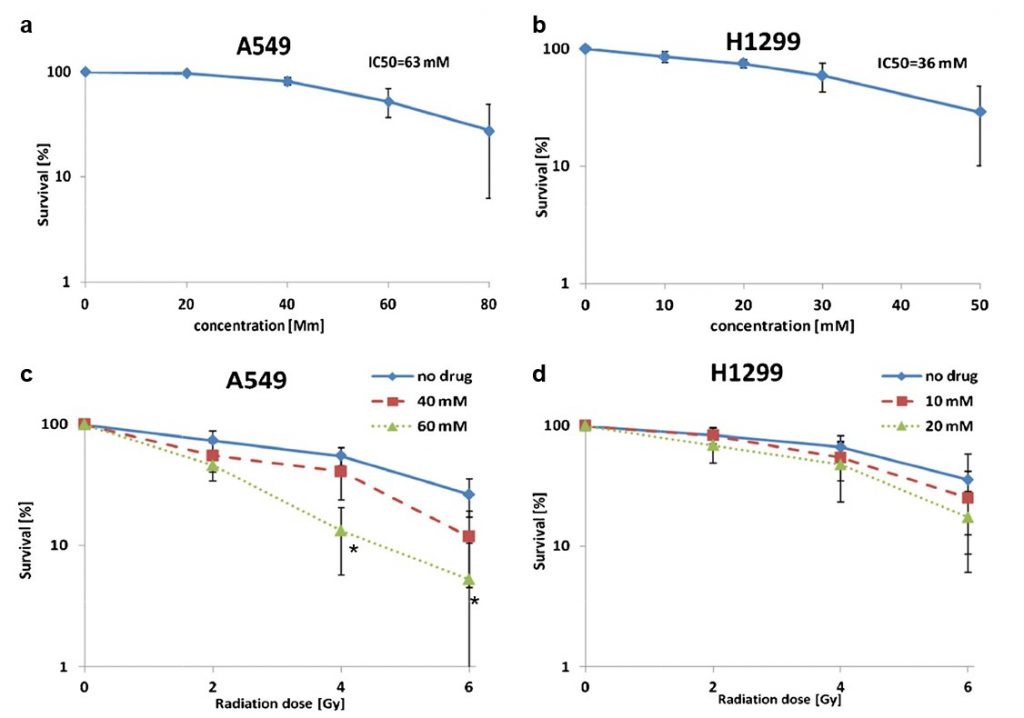
Wir fanden heraus, dass die Exposition mit DCA vor der Bestrahlung den Zelltod sowohl in A549- als auch in H1299-Zellproben erhöhte. Die maximale Wirkung bei A549-Zellen wurde bei 4 Gy beobachtet, wo die DCA-Behandlung (40 und 60 mM) die Zellüberlebensrate von ~55 auf 40 % (p= 0,27) bzw. 13 % (p= 0,004) verringerte (Abb. 3c). Bei H1299-Zellen wurde die maximale Wirkung bei 6 Gy erreicht. Bei dieser Strahlendosis verringerte die DCA-Behandlung (10 und 20 mM) die Überlebensrate der Zellen von 35 % (nur Strahlung) auf 25 bzw. 17 % (statistisch nicht signifikant; Abb. 3d). Die Vorbehandlung der A549-Zellen mit DCA (60 mM) erhöhte die zytotoxische Wirkung der 4-Gy-Strahlung um das Vierfache im Vergleich zur alleinigen Bestrahlung. Eine Zwei-Wege-ANOVA-Analyse zeigte nur bei A549-Zellen einen synergistischen Effekt.
DCA erhöht den Sauerstoffverbrauch sowohl in A549- als auch in H1299-Zellen
Eine erhöhte zelluläre Sauerstoffverbrauchsrate (OCR) ist ein Hinweis auf eine erhöhte mitochondriale Aktivität [23]. Wir fanden heraus, dass DCA die OCR sowohl in A549- als auch in H1299-Zellen um 60 % (p= 0,0037) bzw. 20 % (p= 0,0039) im Vergleich zur basalen OCR erhöht (Abb. 4).
Diskussion
Bei der Prüfung der Strahlenempfindlichkeit mit und ohne vorherige Exposition gegenüber Dichloracetat (DCA) haben wir festgestellt, dass die mitochondriale Aktivierung durch DCA zwei verschiedene Zelllinien von nicht-kleinzelligem Lungenkrebs (NSCLC) (d. h. A549 und H1299) gegen Strahlung sensibilisieren kann. In dieser Proof-of-Concept-Studie wurde eine breite Palette von DCA-Konzentrationen verwendet, um die Dosis auf den IC50-Wert der einzelnen Zellen abzustimmen. Die synergistische Wirkung von DCA war bei A549-Zellen statistisch signifikant, während sie bei H1299-Zellen nur annähernd signifikant war. Möglicherweise kann mit höheren DCA-Dosen eine noch stärkere Wirkung erzielt werden. Wir haben auch gezeigt, dass DCA den Sauerstoffverbrauch sowohl in A549- als auch in H1299-Zellen erhöht, was ein Surrogatmarker für eine erhöhte mitochondriale Aktivität ist.
Ionisierende Strahlung reguliert die Funktion der mitochondrialen Elektronentransportkette, erhöht das mitochondriale Membranpotenzial und die ATP-Produktion [9]. Die Hyperaktivierung der Mitochondrien durch DCA erhöht zudem die Menge und das Ausmaß der von den Mitochondrien selbst freigesetzten freien Radikale (ROS) [13]. Diese Faktoren könnten den synergistischen Effekt erklären, der beobachtet wurde, als die Zellen vor Beginn der Bestrahlung mit DCA behandelt wurden.
Atkinson et al. [15] zeigten, dass die Hemmung der Cytochrom c-Peroxidase und die Freisetzung von Cytochrom c aus den Mitochondrien den strahleninduzierten Zelltod abschwächt. Lee et al. [24] beobachteten eine Abnahme der Hemmung des ROS-vermittelten Zelltods durch die Blockierung der vom Nuklearfaktor Erythroid 2 (nrf2) abhängigen antioxidativen Reaktion, was die Strahlenempfindlichkeit von H1299-, A549- und H640-Zellen erhöht. Diese Studien haben gezeigt, dass DCA in der Lage ist, die zelluläre Reaktion auf Strahlung zu beeinflussen, indem es in Prozesse eingreift, die mit Cytochrom c und ROS zusammenhängen, was unsere Annahme unterstreicht, dass DCA Krebszellen durch mitochondriale Aktivierung, die die Freisetzung von ROS ermöglicht, radioempfindlich macht.
Cao et al. [21] berichteten ebenfalls, dass DCA als Radiosensibilisator in Prostatakrebszellen wirkt. Zwicker et al. [22] fanden heraus, dass DCA in vitro, aber nicht in vivo in WIDR- (Darmkrebs) und LN18- (Gliom) Zellen als Radiosensibilisator wirkt. Die fehlende Synergie im In-vivo-WIDR-Xenograft-Modell wurde mit einem Puffereffekt der Umgebung erklärt, der es den Tumorzellen ermöglicht haben könnte, ihr glykolytisches Stoffwechselprogramm beizubehalten. Studien zum Nachweis der In-vivo-Wirkung von DCA und Bestrahlung bei NSCLC stehen noch aus.
Die RT ist eine gängige Therapie für Lungenkrebspatienten. Die erheblichen Schäden, die sie am umliegenden Normalgewebe verursacht, schränken ihre Anwendung jedoch ein. In den letzten zwei Jahrzehnten haben sich pharmakologische Inhibitoren von Signalmolekülen, die das apoptotische Potenzial regulieren, als vielversprechende Radiosensibilisatoren in vitro erwiesen [25,29]. Obwohl DCA als Radiosensibilisator bei Prostatakrebs bekannt ist [21], wurde seine klinische Anwendung bei NSCLC bisher nicht nachgewiesen. Hier zeigen wir die Fähigkeit von DCA, die Strahlendosis in A549- und H1299-NSCLC-Zellen zu verringern, ohne den Wirkungsgrad zu beeinträchtigen. Darüber hinaus haben wir gezeigt, dass die Behandlung mit DCA den Sauerstoffverbrauch sowohl der A549- als auch der H1299-Zellen erhöht und damit das Potenzial von DCA, als mitochondrialer Aktivator zu wirken, aufgedeckt. Daraus schließen wir, dass die mitochondriale Aktivierung eine Rolle bei der Therapie von NSCLC spielen könnte, wenn sie mit einer Strahlenbehandlung kombiniert wird. Darüber hinaus stellen wir die Hypothese auf, dass die Induktion einer erhöhten mitochondrialen Aktivität, d.h. eine erhöhte Freisetzung freier Radikale und Apoptose durch DCA, die Hauptursache für das Potenzial von DCA bei der Radiosensibilisierung von NSCLC-Zellen ist.
Zusammenfassend zeigen wir, dass die in vitro-Induktion der Mitochondrien durch DCA die A549 NSCLC-Zellen auf synergistische Weise signifikant strahlenempfindlich macht. Diese Beobachtung rechtfertigt eine weitere Bewertung in einer In-vivo-Umgebung.
Danksagungen
Die Autoren danken Dr. Shoshana Paglin (Sheba Medical Center) für die Anleitung und die fruchtbaren Diskussionen zu dieser Arbeit.
Diese Arbeit wurde in teilweiser Erfüllung der Anforderungen für die Doktorarbeit an der Sackler-Fakultät für Medizin der Universität Tel Aviv durchgeführt und wurde vom Sheba Medical Center unterstützt. (Herr Ronen Shavit)
Interessenkonflikt
Die Autoren erklären, dass sie sich in keinem Interessenkonflikt befinden.
REFERENZEN
1 R. Siegel, C. DeSantis, K. Virgo, K. Stein, A. Mariotto, T. Smith, D. Cooper, T. Gansler, C. Lerro, S. Fedewa, C. Lin, C. Leach, R.S. Cannady, H. Cho, S. Scoppa, M. Hachey, R. Kirch, A. Jemal, E. Ward, Cancer treatment and survivorship statistics, 2012. CA Cancer J. Clin. 62(4), 220-241 (2012)2 Q. Wu, Y.F. Chen, J. Fu, Q.H. You, S.M. Wang, X. Huang, X.J. Feng, S.H. Zhang, Short hairpin RNA-mediated down-regulation of CENP-A attenuates the aggressive phenotype of lung adenocarcinoma cells. Cell. Oncol. 37(6), 399-407 (2014)
3 A. Koren, H. Motaln, T. Cufer, Lung cancer stem cells: a biological and clinical perspective. Cell. Oncol. 36(4), 265-275 (2013)
4 N. Peled, M.W. Wynes, N. Ikeda, T. Ohira, K. Yoshida, J. Qian, M. Ilouze, R. Brenner, Y. Kato, C. Mascaux, F.R. Hirsch, Insulin-like growth factor-1 receptor (IGF-1R) as a biomarker for resistance to the tyrosine kinase inhibitor gefitinib in non-mall cell lung cancer. Cell. Oncol. 36(4), 277-288 (2013)
5 M.V. Graham, J.A. Purdy, B. Emami, W. Harms, W. Bosch, M.A. Lockett, C.A. Perez, Clinical dose-volume histogram analysis for pneumonitis after 3D treatment for non-small cell lung cancer (NSCLC). Int. J. Radiat. Oncol. Biol. Phys. 45(2), 323-329 (1999)
6 H. Vakifahmetoglu, M. Olsson, B. Zhivotovsky, Death through a tragedy: mitotic catastrophe. Cell Death Differ. 15(7), 1153-1162 (2008)
7 J. Thoms, R.G. Bristow, DNA repair targeting and radiotherapy: a focus on the therapeutic ratio. Semin. Radiat. Oncol. 20(4), 217-222 (2010)
8 C. Coleman, Beneficial liaisons: radiobiology meets cellular and molecular biology. Radiother Oncol: J. Eur. Soc. Ther. Radiol. Oncol. 28(1), 1-15 (1993)
1 T. Yamamori, H. Yasui, M. Yamazumi, Y. Wada, Y. Nakamura, H. Nakamura, O. Inanami, Ionizing radiation induces mitochondrial reactive oxygen species production accompanied by upregulation of mitochondrial electron transport chain function and mitochondrial content under control of the cell cycle checkpoint. Free Radic. Biol. Med. 53(2), 260-270 (2012)
10 I. Szumiel, Ionising radiation-induced oxidative stress, epigenetic changes and genomic instability: the pivotal role of mitochondria. Int J Radiat Biol. 1-55 (2014)
11 B.A. Rupnow, S.J. Knox, The role of radiation-induced apoptosis as a determinant of tumor responses to radiation therapy. Apoptosis 4(2), 115-143 (1999)
12 R.A. Cairns, I.S. Harris, T.W. Mak, Regulation des Krebszellstoffwechsels. Nat. Rev. Cancer 11(2), 85-95 (2011)
13 E.D. Michelakis, L. Webster, J.R. Mackey, Dichloracetat (DCA) als potenzielle metabolische zielgerichtete Therapie für Krebs. Br. J. Cancer 99(7), 989-994 (2008)
14 X. Wang, S. Peralta, C.T. Moraes, Mitochondrial alterations during carcinogenesis: a review of metabolic transformation and targets for anticancer treatments. Adv. Cancer Res. 119, 127-160 (2013)
15 J. Atkinson, A.A. Kapralov, N. Yanamala, Y.Y. Tyurina, A.A. Amoscato, L. Pearce, J. Peterson, Z. Huang, J. Jiang, A.K. Samhan-Arias, A. Maeda, W. Feng, K. Wasserloos, N.A. Belikova, V.A. Tyurin, H. Wang, J. Fletcher, Y. Wang, I.I. Vlasova, J. Klein-Seetharaman, D.A. Stoyanovsky, H. Bayir, B.R. Pitt, M.W. Epperly, J.S. Greenberger, V.E. Kagan, A mitochondria-targeted inhibitor of cytochrome c peroxidase mitigates radiation-induced death. Nat. Commun. 2, 497 (2011)
16 S.H. Kim, Y.H. Yoo, J.H. Lee, J.W. Park, Mitochondrial NADP(+)-dependent isocitrate dehydrogenase knockdown inhibits tumorigenicity of melanoma cells. Biochem. Biophys. Res. Commun. 451(2), 246-251 (2014)
17 Z. Tatarkova, S. Kuka, M. Petras, P. Racay, J. Lehotsky, D. Dobrota, P. Kaplan, Why mitochondria are excellent targets for cancer therapy. Klin. Onkol. 25(6), 421-426 (2013)
18 S. Bonnet, S.L. Archer, J. Allalunis-Turner, A. Haromy, C. Beaulieu, R. Thompson, C.T. Lee, G.D. Lopaschuk, L. Puttagunta, G. Harry, K. Hashimoto, C.J. Porter, M.A. Andrade, B. Thebaud, E.D. Michelakis, A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth. Krebszelle 11(1), 37-51 (2007)
19 N.A. Franken, H.M. Rodermond, J. Stap, J. Haveman, C. van Bree, Clonogenic assay of cells in vitro. Nat. Protoc. 1(5), 2315-2319 (2006)
20 B.K. Slinker, Die Statistik des Synergismus. J. Mol. Cell. Cardiol. 30(4), 723-731 (1998)
21 W. Cao, S. Yacoub, K.T. Shiverick, K. Namiki, Y. Sakai, S. Porvasnik, C. Urbanek, C.J. Rosser, Dichloroacetate (DCA) sensitizes both wild-type and over-expressing Bcl-2 prostate cancer cells in vitro to radiation. Prostata 68(11), 1223-1231 (2008)
22 F. Zwicker, A. Kirsner, P. Peschke, F. Roeder, J. Debus, P.E. Huber, K.J. Weber, Dichloracetat induziert tumorspezifische Radiosensitivität in vitro, dämpft aber die strahleninduzierte Verzögerung des Tumorwachstums in vivo. Strahlenther. Onkol. 189(8), 684-692 (2013)
23I. Papandreou, R.A. Cairns, L. Fontana, A.L. Lim, N.C. Denko, HIF-1 mediates adaptation to hypoxia by actively downregulating mitochondrial oxygen consumption. Cell Metab. 3(3), 187-197 (2006)
24 S. Lee, M.J. Lim, M.H. Kim, C.H. Yu, Y.S. Yun, J. Ahn, J.Y. Song, An effective strategy for increasing the radiosensitivity of Human lung Cancer cells by blocking Nrf2-dependent antioxidant responses. Free Radic. Biol. Med. 53(4), 807-816 (2012)
25 S.J. Chmura, H.J. Mauceri, S. Advani, R. Heimann, M.A. Beckett, E. Nodzenski, J. Quintans, D.W. Kufe, R.R. Weichselbaum, Decreasing the apoptotic threshold of tumor cells through protein kinase C inhibition and sphingomyelinase activation increases tumor killing by ionizing radiation. Cancer Res. 57(19), 4340-4347 (1997)
26 V. Bhardwaj, Y. Zhan, M.A. Cortez, K.K. Ang, D. Molkentine, A. Munshi, U. Raju, R. Komaki, J.V. Heymach, J. Welsh, C-Met inhibitor MK-8003 radiosensitizes c-Met-expressing non-small-cell lung cancer cells with radiation-induced c-Met-expression. J. Thorac. Oncol. 7(8), 1211-1217 (2012)
27 E.J. Bernhard, G. Kao, A.D. Cox, S.M. Sebti, A.D. Hamilton, R.J. Muschel, W.G. McKenna, The farnesyltransferase inhibitor FTI-277 radiosensitizes H-ras-transformed rat embryo fibroblasts. Cancer Res. 56(8), 1727-1730 (1996)
28 H.J. Boeckman, K.S. Trego, J.J. Turchi, Cisplatin sensibilisiert Krebszellen für ionisierende Strahlung durch Hemmung der nicht-homologen Endverbindung. Mol. Cancer Res. 3(5), 277-285 (2005)
29 N. Balaban, J. Moni, M. Shannon, L. Dang, E. Murphy, T. Goldkorn, The effect of ionizing radiation on signal transduction: antibodies to EGF receptor sensitize A431 cells to radiation. Biochim. Biophys. Acta 1314(1-2), 147-156 (1996)
Verwandter Inhalt: