Wolfgang Fiebiger1, Ulrike Olszewski2, Ernst Ulsperger2, Klaus Geissler2, Gerhard Hamilton2,3
1 Dipartimento di Medicina Interna I, Divisione di Oncologia, Ospedale St. Poelten, St. Poelten, Austria
2 Ludwig Boltzmann Cluster of Translational Oncology, C/o Balderichgasse, 26/13, 1170 Vienna, Austria
e-mail: [email protected]
G. Hamilton
3 Dipartimento di Chirurgia, Medical University Vienna, Vienna, Austria
Ricevuto: 1 aprile 2010
Accettato: 6 giugno 2010
Abstract
Introduzione: La chemioterapia per i carcinoidi ben differenziati in stadio avanzato è caratterizzata da bassi tassi di risposta e da una breve durata delle risposte. Il presente studio si proponeva di valutare l’attività in vitro di nuovi farmaci chemioterapici a base di platino in combinazione con il dicloroacetato (DCA), un sensibilizzatore dell’apoptosi, contro linee cellulari di carcinoide polmonare.
Metodi: Tre linee cellulari permanenti (UMC-11, H727 e H835) sono state esposte a 14 diversi farmaci citotossici consolidati e ai nuovi composti a base di platino come satraplatino, JM118 e picoplatino in combinazione con il DCA, e la vitalità delle cellule è stata misurata utilizzando un saggio con colorante a base di tetrazolio.
Risultati: Ad eccezione della linea UMC- 11, altamente chemioresistente, le linee cellulari di carcinoide (H727, H835) sono risultate sensibili alla maggior parte dei chemioterapici in vitro. Tra i farmaci a base di platino, il carboplatino e l’oxaliplatino hanno mostrato la massima efficacia. Le cellule H835 cresciute come sferoidi multicellulari sono risultate 2,7-8,7 volte più resistenti al picoplatino, al satraplatino e al suo metabolita rispetto alle sospensioni di singole cellule. Il DCA (10 mM) ha inibito la crescita delle cellule UMC- 11 del 22% e ha sensibilizzato queste cellule altamente resistenti a carboplatino, satraplatino e JM118 di 1,4-2,4 volte.
Conclusioni: Le cellule carcinoidi polmonari UMC-11, altamente resistenti, sono sensibili al carboplatino, all’oxaliplatino e al metabolita del satraplatino JM118, ma la crescita sferoidale multicellulare, osservata nella linea cellulare H835 e nei tumori polmonari, sembra aumentare notevolmente la chemioresistenza. L’attività del carboplatino e del JM118 è significativamente e specificamente aumentata in combinazione con il sensibilizzatore dell’apoptosi DCA, che promuove la respirazione mitocondriale rispetto alla glicolisi aerobica. In sintesi, tra i nuovi farmaci a base di platino, il satraplatino ha un potenziale per il trattamento dei carcinoidi polmonari e il DCA potenzia la citotossicità di alcuni farmaci a base di platino.
Parole chiave: Carcinoide; Chemosensibilità; Resistenza ai farmaci; Complesso di platino; Picoplatino; Satraplatino; Dicloroacetato
INTRODUZIONE
I carcinoidi derivano dalle cellule enterocromaffini del sistema di cellule neuroendocrine ampiamente distribuite nell’organismo [1-3]. Questi tumori piuttosto rari hanno un’incidenza di 2,0-2,5 casi su 100.000 persone per i carcinoidi clinicamente evidenti [4]. I carcinoidi dell’intestino anteriore rappresentano il 20% di tutti i tumori carcinoidi e comprendono i carcinoidi timici e polmonari (che rappresentano il 2% dei tumori polmonari primari) oltre ai carcinoidi gastrici e duodenali [5]. In base alle loro caratteristiche istologiche, questi tumori eterogenei sono classificati come tumori neuroendocrini ben differenziati con cellule piccole e nuclei regolari (carcinoide tipico) o carcinomi neuroendocrini ben differenziati con atipia nucleare e aree necrotiche (carcinoide atipico) [6, 7]. La “sindrome da carcinoide”, indotta dalla secrezione di sostanze vasoattive, si verifica in meno del 5% dei carcinoidi polmonari [8]. Dal 13 al 22% dei pazienti presenta metastasi a distanza al momento della presentazione [4]. Le procedure diagnostiche primarie comprendono test biochimici, in particolare l’analisi della serotonina e dell’acido 5-idrossiindoleacetico (5-HIAA) urinario. La tecnica più sensibile per la localizzazione dei tumori è la scintigrafia dei recettori della somatostatina, integrata dalla TC per la visualizzazione delle metastasi epatiche e dalla concomitante biopsia per la verifica istopatologica [9]. Poiché oltre l’80% dei tumori carcinoidi esprime il recettore della somatostatina di tipo 2, il 111-indio-DTPA-octreotidecome tracciante può essere in grado di predire l’utilità di una prossima terapia con analoghi della somatostatina [10, 11].
La guarigione chirurgica dei pazienti affetti da carcinoide polmonare può essere ottenuta mediante resezione, ma una frazione di tumori dà origine a metastasi diffuse entro due-quattro anni dall’intervento primario [12]. A differenza dei tumori neuroendocrini ben differenziati, più indolenti, che presentano metastasi in meno del 15% dei casi e rivelano un tasso di sopravvivenza a cinque anni superiore al 90%, i carcinomi neuroendocrini ben differenziati sono più aggressivi, con metastasi nel 30-50% dei casi e un tasso di sopravvivenza a cinque anni tra il 40 e il 60% [1, 2, 13]. I pazienti con carcinoidi maligni presentano un tasso di sopravvivenza a cinque anni di circa il 20%, con una sopravvivenza mediana di due anni in presenza di metastasi epatiche [14-16]. Il trattamento medico della malattia metastatica comprende analoghi della somatostatina, α-interferoni e chemioterapia [1, 17].
Gli studi clinici sono solitamente di piccole dimensioni, con criteri di inclusione e disegno dello studio variabili a causa della rarità di questi tumori [1, 16]. Fondamentalmente, la chemioterapia può essere presa in considerazione per i pazienti con malattia progressiva sottoposti a terapia non citotossica, a condizione che sia associata a sintomi significativi e prognosi sfavorevole. La doxorubicina, il 5-fluorouracile (5-FU), la dacarbazina, la streptozotocina, la ciclofosfamide, il cisplatino e l’etoposide sono stati utilizzati come agenti singoli e in combinazione con tassi di risposta inferiori al 20% solo per brevi periodi e pertanto non sono stati raccomandati nella pratica clinica di routine [1, 3, 16-18].
Nel presente studio, abbiamo testato l’attività in vitro di nuovi farmaci chemioterapici, tra cui gemcitabina, camptothecin, oxaliplatino e paclitaxel, rispetto ai farmaci citotossici attualmente utilizzati per la chemioterapia, utilizzando le tre linee cellulari permanenti di carcinoide polmonare UMC11, H727 e H835. I carcinoidi polmonari sono strettamente correlati al carcinoma polmonare a piccole cellule (SCLC), che viene trattato principalmente con una combinazione di cisplatino ed etoposide [3,19]. I farmaci di terza generazione a base di platino, come il satraplatino e il picoplatino, sono attualmente in fase di studio clinico per il SCLC e potrebbero essere attivi anche contro i carcinoidi polmonari [20]. Pertanto, il farmaco orale satraplatino [JM216; platino(IV) bisacetatoammina diclorido cicloesilammina], i suoi metaboliti attivi JM149 [cis-ammina diclorido (cicloesilammina) diidrossidoplatino(IV)] e JM118 [platino(II) cis-ammina diclorido cicloesilammina], nonché il picoplatino [JM473, ZD-0473, AMD-473; cis-ammina diclorido 2-metilpiridina platino(II)], sono stati studiati per la loro potenza citotossica in vitro utilizzando le tre linee cellulari di carcinoide polmonare. L’efficacia dei complessi di platino dovrebbe essere ulteriormente migliorata in combinazione con il dicloroacetato (DCA), che ha come bersaglio la piruvato deidrogenasi chinasi. Pertanto, è stato ulteriormente studiato l’effetto additivo di questo composto sulla citotossicità dei farmaci a base di platino [21].
Materiali e metodi
Prodotti chimici e linee cellulari
La gemcitabina è stata ottenuta da Eli Lilly (Londra, Regno Unito), la dacarbazina da Medac (Amburgo, Germania), l’oxaliplatino da Sanofi (Parigi, Francia) e tutti gli altri farmaci da Sigma-Aldrich (St. Louis, MO, USA). Il satraplatino e i suoi metaboliti JM149 e JM118 e il picoplatino sono stati sintetizzati su misura da Chiracon (Luckenwalde, Germania). Il DCA sodico è stato preparato come soluzione madre 1 M. Le linee cellulari di carcinoide polmonare UMC-11, H727 e H835 del National Cancer Institute (NCI) sono state acquistate dall’American Tissue Culture Collection (ATCC, Manassas, VA, USA). Le cellule sono state coltivate in terreno RPMI-1640 integrato con 10% di siero fetale bovino e 4 mM di glutammina (Seromed, Berlino, Germania). Le cellule UMC-11 e H727 sono state subcoltivate mediante tripsinizzazione (soluzione di tripsina/EDTA al 2,5%, Boehringer Mannheim, Germania), mentre le cellule H835, che crescevano in sospensione, sono state mantenute mediante sostituzione del terreno.
Distribuzione del ciclo cellulare e saggi del tempo di raddoppiamento
Per analizzare la distribuzione del ciclo cellulare, aliquote di colture cellulari sono state lavate con PBS, risospese in 100 µl di PBS e fissate con 1 ml di etanolo al 70% a -20°C per 30 minuti. Quindi, le cellule sono state centrifugate, lavate con PBS e colorate con una soluzione di 20 µg/ml di ioduro di propidio (PI) in 0,5% Triton X100/PBS integrato con 5 µg/ml di RNAse A per 24 ore a temperatura ambiente. Gli istogrammi sono stati acquisiti con un sistema di citometria a flusso FACS Scan (Becton Dickinson, Mountain View, CA, USA) e la distribuzione del ciclo cellulare è stata calcolata con il software Multicycle AV (Phoenix, San Diego, CA, USA). I tempi di raddoppiamento delle linee cellulari sono stati determinati mediante misurazioni giornaliere del numero di cellule di tre colture indipendenti per sei giorni consecutivi, utilizzando un microcontatore (Sysmex, Tokyo, Giappone). Gli ammassi di cellule H835 sono stati dispersi mediante trattamento con tripsina per ottenere sospensioni di cellule singole per il conteggio.
Saggio di proliferazione cellulare
Le cellule sono state raccolte, contate e distribuite in piastre di microtitolazione in 100 µl di terreno a una densità di 1×104 cellule/pozzetto. Le diluizioni appropriate dei composti in esame sono state aggiunte a un volume totale di 200 µl/pozzetto e le piastre sono state incubate in condizioni di coltura tissutale per quattro giorni. Le soluzioni stock dei composti sono state preparate in etanolo al 70% o in dimetilsolfossido e diluite più di 100 volte per i test. In tutti i test sono stati inclusi controlli con solventi. Le curve dose-risposta sono state ottenute valutando la proliferazione cellulare a due diluizioni di farmaco in triplicato e utilizzate per il calcolo dei valori di IC50. La crescita cellulare è stata quantificata utilizzando un saggio con colorante tetrazolio modificato (MTT; EZ4U, Biomedica, Vienna, Austria) e misurando il colorante formazano ridotto alla lunghezza d’onda di 450 nm (controllo del mezzo impostato al 100% di proliferazione).
Analisi statistica
Le differenze tra due gruppi indipendenti sono state determinate utilizzando l’ANOVA e il test U di Mann-Whitney. p<0,05 è stato considerato statisticamente significativo. Tutti i calcoli sono stati effettuati con il software Statistica (Statsoft, Tulsa, OK, USA). I tempi di raddoppiamento delle linee cellulari sono stati analizzati utilizzando un calcolatore online (Roth V. 2006, disponibile presso ).
Risultati
Distribuzione del ciclo cellulare e tempo di raddoppiamento delle tre linee cellulari di carcinoide polmonare
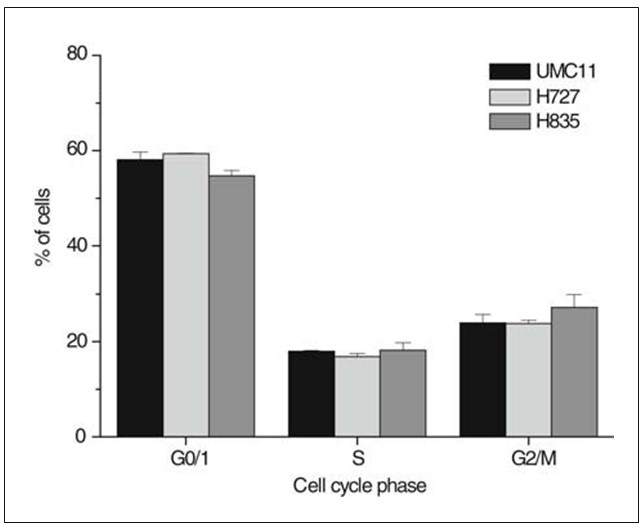
Le percentuali di cellule carcinoidi in specifiche fasi del ciclo cellulare sono state determinate mediante colorazione PI di cellule fissate derivate da colture subconfluenti, analisi citometrica a flusso e adattamento della curva degli istogrammi risultanti (Fig. 1). Le linee cellulari hanno mostrato una frazione di cellule in fase S superiore al 17% e frazioni G0/1 inferiori al 54% della popolazione cellulare totale, rispettivamente. Le frazioni della fase S delle linee cellulari di carcinoide UMC-11, H727 e H835 non erano significativamente diverse. I tempi di raddoppiamento delle linee cellulari sono stati determinati mediante conteggio giornaliero delle cellule di sei colture indipendenti e sono risultati pari a 20,8 h per H727, 27,0 h per UMC-11 e 35,7 h per H835, rispettivamente.
Test di chemiosensibilità con farmaci clinicamente stabiliti
Le cellule sono state esposte ai singoli farmaci chemioterapici in vitro e i valori IC50 sono stati calcolati dalla relazione dose-risposta dopo la quantificazione delle cellule sopravvissute mediante saggi MTT. Tutti i test sono stati eseguiti per quattro giorni, ad eccezione dei test condotti con la dacarbazina per sette giorni, poiché il metabolita attivo (5-amino-imidazolo 4-carbossamide) si forma lentamente in vitro. La Tabella 1 mostra i risultati dei saggi di chemiosensibilità per 14 farmaci testati contro le tre linee cellulari di carcinoide. I valori IC50 sono stati confrontati con le seguenti concentrazioni plasmatiche di picco raggiungibili (PPC): vinblastina 8,5 ng/ml [22], taxolo 3,5±1,4 µM [23], topotecan derivato della camptoteina (TPT) 65±20 nM [24], 5-FU 0,6 µM/l [25], doxorubicina 73,5±26.4 ng/ml [26], gemcitabina 50 µM [27], tamoxifene 0,4 µM [28], cisplatino 6,3 µM [29], oxaliplatino 9,1±1.25 µM [30], carboplatino 105 µM [31], mitomicina C 345±151 ng/ml [32], streptozotocina 100±10 µg/ml [33], etoposide 5,6±2,5 µg/ml [34] e dacarbazina 8,6±0,6 µg/ml [35]. Le cellule UMC-11 hanno mostrato una marcata chemioresistenza nei confronti della maggior parte dei farmaci, ad eccezione di vinblastina, camptothecin, oxaliplatino, carboplatino, mitomicina C e dacarbazina, per i quali i valori di IC50 erano inferiori a PPC per i rispettivi farmaci. Le altre due linee cellulari permanenti H727 e H835 sono risultate sensibili rispettivamente a 10/14 e 9/14 dei farmaci qui utilizzati. Rispetto alla linea cellulare H835, la linea H727, che è p53 wildtype, è risultata inoltre sensibile alla dacarbazina. Tutte e tre le linee cellulari sembravano avere una sensibilità simile all’oxaliplatino e al carboplatino, in contrasto con la loro elevata resistenza al cisplatino.
| Farmaco | Linea cellulare di carcinoide polmonare | Linea cellulare di carcinoide polmonare | Linea cellulare di carcinoide polmonare | Linea cellulare di carcinoide polmonare |
| UMC-11 (IC50) | H727 (IC50) | H835 (IC50) | PPC | |
| Vinblastina ( ng/ml) | 2.0±0.35 | 8.0±2.7 | 2.0±0.3 | 8.5 |
| Taxolo (ng/ml) | 10.0±4.4 | 8.0±3.8 | 9.0±3.9 | 1.0 |
| Camptothecin (nM ) | 18.0±5.0 | 0.5±0.1 | 6.5±4.3 | (65) |
| 5-Fluorouracile (µM ) | 30.0±4.6 | 20.0±5.9 | 45.0±8.7 | 0.6 |
| Doxorubicina (nM) | 370.7±72.4 | 24.1±5.2 | 73.1± 2.4 | 73.5 |
| Gemcitabina (nM) | 833.3±103 | 30.0±6.7 | 30.0±20 | 50.0 |
| Tamoxifene (µM) | 9.0±3.3 | 25.0±8.1 | 7.0±2.4 | 0.4 |
| Cisplatino (µM) | 33.3±15 | 83.3±21 | 33.3±7.0 | 6.3 |
| Oxaliplatino (µM ) | 5.0±0.25 | 11.3±5.3 | 6.3±0.51 | 9.1 |
| Carboplatino (µM) | 36.4±7.1 | 3.4±0.4 | 35.8±9.9 | 105 |
| Mitomicina (ng/ml) | 156.0±15 | 10.0±3.0 | 35.0±9.0 | 345.0 |
| Streptozotocina (µg/ml) | 180±33 | 50±21 | 60±19 | 100 |
| Etoposide (µg/ml) | 45.0±12.3 | 0.13±0.03 | 0.25±0.02 | 5.6 |
| Dacarbazina (µg/ml) | 4.2±2.3 | 2.2±1.3 | 16.5±3.9 | 8.6 |
I valori di IC50 sono indicati come media±SD (n=3), e i PPC clinici sono mostrati per confronto
Attività citotossica dei farmaci di terza generazionea basedi platino nelle linee cellulari di carcinoide polmonare
I nuovi farmaci a base di platino satraplatino e picoplatino sono stati testati per la citotossicità utilizzando le tre linee cellulari di carcinoide in vitro. In vivo, il satraplatino viene rapidamente convertito in JM149 e nel metabolita altamente attivo JM118, che sono stati inclusi in questo test di chemiosensibilità (Fig. 2). Le CPP ottenibili erano rispettivamente 15,9 µM per il picoplatino, 1,4 µM per il satraplatino e 2,2 µM per il JM118. Le cellule H835 sono state testate sia come sospensione cellulare singola che come aggregati globulari con un diametro di circa 150-250 µM. I test di chemiosensibilità hanno mostrato che il picoplatino e il JM118 hanno raggiunto concentrazioni IC50 inferiori alle rispettive CPP nelle cellule H727 e H835, rispettivamente. Inoltre, le cellule H727 si sono dimostrate sensibili a JM149. Le cellule H835 cresciute come sferoidi multicellulari sono risultate più resistenti a picoplatino (2,7 volte), JM216 (7,9 volte), JM149 (4,3 volte) e JM118 (8,7 volte).

Citotossicità di combinazioni di farmaci a base di platino con DCA in linee cellulari di carcinoide polmonare
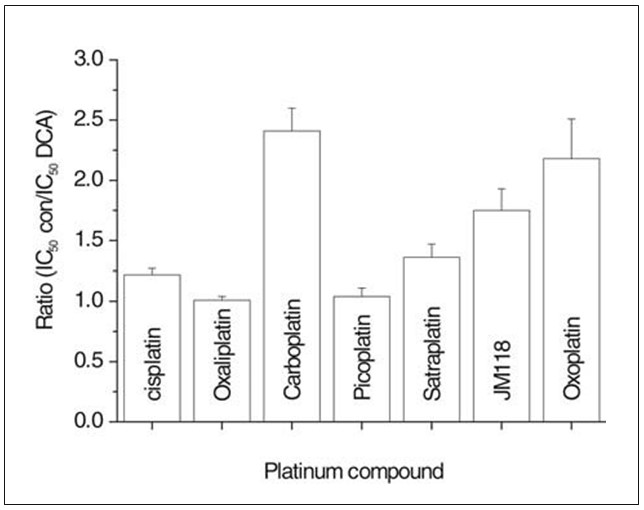
I saggi di chemioresistenza descritti in precedenza sono stati inoltre eseguiti utilizzando la linea cellulare resistente UMC-11 in assenza o in presenza continua di 10 mM di DCA (Fig. 3). Questa concentrazione di DCA ha ridotto la proliferazione delle cellule UMC-11 del 22,2±3,2% e ha abbassato i valori di IC50 (fattore di sensibilizzazione: media±SD dell’IC50 del composto di platino nel solo terreno di coltura diviso per l’IC50 del rispettivo composto di platino nel terreno di coltura integrato con 10 mM di DCA; IC50 del composto di platino in presenza di DCA) per il carboplatino (2,41±0,19; 13,5±0,19).41±0,19; 13,1±0,2 µM), satraplatino (1,36±0,11; 7,8±0,4 µM), il metabolita JM118 (1,75±0,18; 1,22±0,05 µM) e oxoplatino (2,18±0,33; 4,8±0,14 µM). Al contrario, cisplatino (1,22±0,9; 25,3±0,75 µM), oxaliplatino (1,01±0,03; 4,4±0,16 µM) e picoplatino (1,04±0,02; 28,6±0,6 µM) hanno mostrato una modulazione bassa o assente della loro citotossicità da parte del DCA. L’oxoplatino [cis, trans, cis diammina diidrossido dicloruro di platino(IV)] è attualmente in fase di studio come farmaco orale a base di platino.
Discussione
Il trattamento di successo dei tumori carcinoidi maligni richiede un approccio multimodale, che comprende la resezione, la riduzione del tumore mediante legatura dell’arteria epatica per le metastasi epatiche e la terapia sistemica con farmaci citostatici e/o citotossici [1-3, 8]. L’Octreotide e diversi analoghi della somatostatina a lunga durata d’azione hanno prodotto tassi di risposta biochimica dell’ordine del 30-70%, ma una contrazione oggettiva del tumore in meno del 10% dei pazienti [36]. La chemioterapia a singolo agente dei tumori carcinoidi ha dato tassi di risposta molto bassi, non superiori al 20% per la monoterapia con doxorubicina [37]. Gli studi clinici che includevano streptozotocina più ciclofosfamide o 5-FU non hanno generato tassi di risposta significativamente migliori, compresi tra il 26 e il 33% [18]. In sintesi, i carcinoidi possono essere controllati farmacologicamente mediante il trattamento con analoghi della somatostatina e interferone, nonché con farmaci citotossici, come streptozotocina, dacarbazina, 5-FU, ciclofosfamide, doxorubicina per un periodo prolungato; tuttavia, i tumori alla fine progrediscono verso uno stato refrattario [3, 16, 38, 39].
La citotossicità di un’ampia gamma di terapici è stata qui testata utilizzando le tre linee cellulari permanenti UMC-11, H727 e H835 derivate da carcinoidi broncopolmonari da Giaccone et al. [40]. H727 e H835 possono essere considerate principalmente cellule sensibili ai farmaci, insensibili a taxolo, 5-FU, cisplatino e tamoxifene. Al contrario, le cellule UMC-11 hanno mostrato una marcata chemioresistenza, ad eccezione della sensibilità a dacarbazina, vinblastina, mitomicina, carboplatino e oxaliplatino. Il confronto dei valori IC50 dei chemioterapici ottenuti in vitro con le CPP ottenibili clinicamente fornisce una stima approssimativa dell’efficacia clinica attesa. I valori IC50 in vivo delle cellule tumorali possono essere ridotti in caso di applicazione prolungata di un farmaco o più elevati se si tiene conto delle concentrazioni tissutali più basse e della minore accessibilità delle cellule tumorali. Sebbene tutte e tre le linee cellulari mostrassero una frazione di fase S simile nelle misurazioni della distribuzione del ciclo cellulare, i loro tempi di raddoppio differivano e ammontavano a 20,8 e 35,7 h per le linee chemioresistenti H727 e H835, rispettivamente, e a 27,0 h per le cellule UMC-11. Secondo questi dati, la chemioresistenza delle tre linee cellulari carcinoidi non è dovuta a differenze nella loro frazione di fase S o nei tempi di raddoppio. I risultati in vitro ottenuti per streptozotocina, dacarbazina, cisplatino, etoposide, 5-FU, doxorubicina e tamoxifene sono in buon accordo con la limitata attività clinica (tasso di risposta <30%) di questi farmaci nei pazienti con carcinoidi avanzati [16]. È stato riportato che il carboplatino possiede un’attività insuffi ciente in uno studio clinico che coinvolgeva pazienti con carcinoidi; tuttavia, non è chiaro se alcuni di questi pazienti avessero carcinoidi dell’intestino anteriore [41]. L’elevata espressione della proteina excision repair cross-complementation group 1 (ERCC1), un componente chiave del meccanismo di riparazione del DNA danneggiato dagli addotti del platino, nei carcinoidi tipici sembra essere collegata alla resistenza al platino in questi pazienti [42].
Dopo lo sviluppo di regimi chemioterapici per i carcinoidi avanzati basati su streptozotocina/dacarbazina, 5-FU, ciclofosfamide o altri, sono stati introdotti diversi nuovi farmaci che hanno dimostrato di possedere una significativa attività antitumorale nei tumori correlati, sia come agenti singoli che in combinazione [3, 43, 44]. Questi agenti includono l’oxaliplatino, un composto di platino altamente attivo, il paclitaxel, un taxano che ha come obiettivo la polimerizzazione dei microtubuli, gli analoghi dell’inibitore della topoisomerasi I camptothecin e l’antimetabolita gemcitabina. Il paclitaxel si è rivelato meno citotossico della vinblastina e della gemcitabina, attive contro le due linee cellulari carcinoidi sensibili. Il paclitaxel è stato recentemente valutato in uno studio clinico che ha coinvolto 14 pazienti con tumori carcinoidi e nove pazienti con tumori delle isole, ottenendo un tasso di risposta globale dell’8%, associato a una significativa tossicità ematologica [45]. Il composto progenitore altamente attivo camptothecin (CPT) è stato abbandonato per l’uso clinico a causa dell’elevata tossicità locale in caso di applicazione endovenosa, ma è attualmente in fase di rivalutazione in nuove formulazioni. Due derivati consolidati, ovvero CPT-11 (irinotecan) e topotecan, sono stati modificati per ottenere una maggiore solubilità in acqua e hanno dimostrato di possedere un’attività clinica in un’ampia gamma di tumori [46]. Le CPP ottenibili, pari a circa 65 nM per il topotecan e >70 nM per il metabolita attivo del CPT-11, SN38, sono nello stesso intervallo del valore IC50 ottenuto per la CPT [32, 47]. Un rapporto sulla chemioresistenza in colture primarie di carcinoidi tipici ha rilevato una sensibilità relativamente elevata a 5-FU, doxorubicina, etoposide e dacarbazina, ma un’alta resistenza a cisplatino, gemcitabina, vinblastina e carboplatino [48]. Tuttavia, solo sei dei 60 campioni tumorali analizzati erano carcinoidi dell’intestino anteriore e non tutti gli agenti sono stati applicati a ciascun campione tumorale. Pertanto, i carcinoidi polmonari possono presentare un modello di chemiosensibilità distinto da quello dei tumori dell’intestino medio e posteriore, come riscontrato nel presente studio.
I nostri risultati mostrano che l’oxaliplatino è citotossico contro tutte e tre le linee cellulari di carcinoide, comprese le cellule UMC-11, che mostrano un’ampia resistenza ai farmaci. Inoltre, è stata riportata una risposta clinica al cisplatino in un singolo paziente affetto da carcinoide [49]. I nuovi complessi di platino satraplatino e picoplatino non sono stati finora testati nei pazienti con carcinoide, ma hanno mostrato una promettente attività clinica negli studi sul cancro del polmone [20, 50]. Le cellule UMC-11 sono insensibili al picoplatino. JM118, il metabolita altamente attivo del satraplatino, ha mostrato una significativa citotossicità contro tutte e tre le linee cellulari di carcinoide polmonare. La sensibilità ai nuovi composti del platino è notevolmente ridotta negli sferoidi di cellule H835 rispetto alle sospensioni di singole cellule e dipende dalla dimensione molecolare e dalla lipofilia del rispettivo farmaco. Pertanto, l’accesso limitato dei chemioterapici alle cellule carcinoidi e i conseguenti livelli insufficienti di farmaco possono essere associati alla resistenza ai farmaci nei tumori carcinoidi in vivo [49].
L’ampia resistenza ai farmaci citotossici può essere attribuita a una maggiore soppressione della morte apoptotica delle cellule tumorali attraverso alterazioni delle caratteristiche dei mitocondri [51]. Il metabolismo della maggior parte dei tumori solidi comprende la glicolisi aerobica (effetto Warburg) e in queste condizioni i mitocondri non riescono a fornire fattori proapoptotici essenziali. Il DCA è una piccola molecola inibitrice della piruvato deidrogenasi chinasi, disponibile per via orale, che aumenta il flusso di piruvato nei mitocondri, favorendo così l’ossidazione del glucosio rispetto alla glicolisi [52]. Questo inverte l’apoptosi mitocondriale soppressa nel cancro e determina l’inibizione della crescita tumorale in vitro e in vivo per il cancro al seno, alla prostata e all’endometrio [53]. Oltre agli effetti cellulari indotti dal DCA da solo, potrebbe essere in grado di potenziare la morte cellulare se combinato con farmaci citotossici. Il DCA non ha avuto un effetto additivo nelle due linee cellulari di cancro al polmone non a piccole cellule A549 e H719 con paclitaxel, etoposide o cisplatino. Tuttavia, il mitaplatino, un composto in cui due molecole di DCA sono state aggiunte alle posizioni assiali di un centro Pt(IV) a sei coordinate, ha mostrato un’attività promettente [54, 55]. I nostri risultati dimostrano che il DCA inibisce la crescita della linea cellulare UMC-11 resistente ai chemioterapici e sensibilizza le cellule al carboplatino, al JM118 e all’oxoplatino a concentrazioni raggiungibili in vivo [56]. Il meccanismo di questa selettività del DCA per specifici composti del platino deve ancora essere chiarito. In conclusione, i complessi di platino come l’oxaliplatino, il carboplatino e il satraplatino possono avere un potenziale per il trattamento dei carcinoidi polmonari e la sensibilizzazione delle cellule tumorali a selezionati farmaci a base di platino indotta dal DCA può avere un’applicazione più ampia nella chemioterapia citotossica.
Riconoscimento
Desideriamo ringraziare il Dr. Z. Salama per averci fornito i complessi di platino e per le utili discussioni. Questo progetto è stato sostenuto da una sovvenzione della Banca Nazionale Austriaca (n. 13345) al Dr. K. Geissler. Il Dr. W. Fiebiger e il Dr. U. Olszewski PhD hanno contribuito in egual misura a questo studio.
Conflitto di interessi
Gli autori dichiarano di non avere alcun conflitto di interessi in relazione alla pubblicazione di questo manoscritto.
RIFERIMENTI
1 Öberg K (2003) Diagnosi e trattamento dei tumori carcinoidi. Expert Rev Anticancer Ther 3:863-8772 Modlin IM, Kidd M, Latich I et al (2005) Current status of gastrointestinal carcinoids. Gastroenterologia 128:1717-1751
3 Pinchot SN, Holen K, Sippel RS, Chen H (2008) Carcinoid tumors. Oncologo 13:1255-1269
4 Zuetenhorst JM, Taal BG (2005) Tumori carcinoidi metastatici: una revisione clinica. Oncologo 10:123-131
5 Granberg D, Oberg K (2005) Tumori neuroendocrini. Cancer Chemother Biol Response Modif 22:471-483
6 Capella C, Heitz PU, Hofler H et al (1995) Revised classification of neuroendocrine tumors of the lung, pancreas and gut. Virchows Arch 425:547-560
7 Warren WH, Gould VE, Faber LP et al (1985) Neuroendocrine neoplasms of the bronchopulmonary tract: a classification of the spectrum of carcinoid to small cell carcinoma and intervening variants. J Thorac Cardiovasc Surg 89:819-825
8 Plockinger U, Rindi G, Arnold R et al (2004) European Neuroendocrine Tumour Society: guidelines for the diagnosis and treatment of neuroendocrine gastrointestinal tumours. Una dichiarazione di consenso a nome della European Neuroendocrine Tumour Society (ENETS). Neuroendocrinologia 80:394-424
9 Öberg K, Eriksson B (2005) Nuclear medicine in the detection, staging and treatment of gastrointestinal carcinoid tumours. Best Pract Res Clin Endocrinol Metab 19:265-276
10 Dousset B, Saint-Marc O, Pitre J et al (1996) Metastatic endocrine tumors: medical treatment, surgical resection and liver transplantation. World J Surg 20:908-915
11 Raderer M, Kurtaran A, Leimer M et al (2000) Valore della scintigrafia dei recettori peptidici con (123) I- peptide intestinale vasoattivo e (111)In-DTPAD-Phe1-octreotide in 194 pazienti con carcinoide: Esperienza dell’Università di Vienna, dal 1993 al 1998. J Clin Oncol 18:1331-1336
12 Smolle-Juttner FM, Popper H, Klemen H et al (1993) Caratteristiche cliniche e terapia dei tumori carcinoidi bronchiali “tipici” e “atipici” (carcinoma neuroendocrino di grado 1 e 2). Eur J Cardiothorac Surg 7:121-125
13 Marty-Ane CH, Costes V, Pujol JL et al (1995) Carcinoid tumors of the lung: do atypical features require aggressive management? Ann Thorac Surg 59:78-83
14 Moertel CG, Sauer WG, Dockerty MB, Baggenstoss AH (1961) Life history of the carcinoid tumor of the small intestine. Cancro 14:901-912
15 Goodwin JD (1975) Carcinoid tumors: an analysis of 2837 cases. Cancro 36:560-569
16 Bertino EM, Confer PD, Colonna JE et al (2009) Pulmonary neuroendocrine/carcinoid tumors: a review article. Cancro 115:4434-4441
17 Moertel CG (1983) Trattamento del tumore carcinoide e della sindrome da carcinoide maligno. J Clin Oncol 1:727-740
18 Sun W, Lipsitz S, Catalano P et al (2005) Phase II/III Study of doxorubicin with fluorouracil compared with streptozocin with fluorouracil or dacarbazine in the treatment of advanced carcinoid tumors: Eastern Cooperative Oncology Group Study E1281. J Clin Oncol 23:4897-4904
19 Dowell JE (2010) Small cell lung cancer: are we making progress? Am J Med Sci 339:68-76
20 Shah N, Dizon DS (2009) Agenti platinici di nuova generazione per i tumori solidi. Future Oncol 5:33-42
21 Dhar S, Lippard SJ (2009) Mitaplatin, una potente fusione di cisplatino e del farmaco orfano dicloroacetato. Proc Natl Acad Sci U S A 106:22199-22204
22 Chong CD, Logothetis CJ, Savaraj N et al (1988) The correlation of vinblastine pharmacokinetics to toxicity in testicular cancer patients. J Clin Pharmacol 28:714-718
23 Rowinsky EK, Burke PJ, Karp JE et al (1989) Studio di fase I e farmacodinamico del taxolo nelle leucemie acute refrattarie. Cancer Res 49:4640-4647
24 Dennis MJ, Beijnen JH, Grochow LB, van Warderdam LJC (1997) An overview of the clinical pharmacology of topotecan. Semin Oncol 24:12-18S
25 Ho DH, Pazdur R, Covington W et al (1998) Comparison of 5-fluorouracil pharmacokinetics in patients receiving continuous 5-fluorouracil infusion and oral uracil plus N1-(2′-tetrahydrofuryl)-5-fluorouracil. Clin Cancer Res 4:2085-2088
26 Wihlm J, Limacher JM, Leveque D et al (1997) Pharmacokinetic profile of high-dose doxorubicin administered during a 6 h endovenous infusion in breast cancer patients. Bull Cancer 84:603-608
27 Touroutoglou N, Gravel D, Raber MN et al (1998) Risultati clinici di una strategia basata sulla farmacodinamica per un dosaggio più elevato di gemcitabina in pazienti con tumori solidi. Ann Oncol 9:1003-1008
28 Kivisto KT, Villikka K, Nyman L et al (1998) Le concentrazioni di tamoxifene e toremifene nel plasma sono notevolmente ridotte dalla rifampicina. Clin Pharmacol Ther 64:648-654
29 Bonetti A, Franceschi T, Apostoli P et al (1995) Farmacocinetica del cisplatino con un programma di cinque giorni durante cicli ripetuti di chemioterapia nei tumori a cellule germinali. Ther Drug Monit 17:25-32
30 Graham MA, Lockwood GF, Greenslade D et al (2000) Clinical pharmacokinetics of oxaliplatin: a critical review. Clin Cancer Res 6:1205-1218
31 Oguri S, Sakakibara T, Mase H et al (1988) Clinical pharmacokinetics of carboplatin. J Clin Pharmacol 28:208-215
32 Schilcher RB, Young JD, Ratanatharathorn V et al (1984) Clinical pharmacokinetics of highdose mitomycin C. Cancer Chemother Pharmacol 13:186-190
33 Adolphe AB, Glasofer ED, Troetel WM et al (1975) Fate of streptozotocin (NSC-85998) in patients with advanced cancer. Cancer Chemother Rep 9:547-556
34 Hande K, Messenger M, Wagner J et al (1999) Inter- and intrapatient variability in etoposide kinetics with oral and intravenous drug application. Clin Cancer Res 5:2742-2747
35 Chabot GG, Flaherty LE, Valdivieso M, Baker LH (1990) Alterazione della farmacocinetica del DTIC dopo somministrazione di interleuchina-2 in pazienti affetti da melanoma. Cancer Chemother Pharmacol 27:157-160
36 Kvols LK, Moertel CG, O’Connell MJ et al (1986) Treatment of the malignant carcinoid evaluation of a long-acting somatostatin analog. N Engl J Med 315:663-666
37 Engstrom PF, Lavin PT, Moertel CG et al (1984) Streptozotocin plus fluorouracil versus doxorubicin therapy for metastatic carcinoid tumor. J Clin Oncol 8:865-890
38 Vilar E, Salazar R, Pérez-García J et al (2007) Chemioterapia e ruolo del marcatore di proliferazione Ki-67 nei tumori neuroendocrini digestivi. Endocr Relat Cancer 14:221-23
39 García-Yuste M, Matilla JM, Cueto A et al (2007) Typical and atypical carcinoid tumours: analysis of the experience of the Spanish Multi-centric Study of Neuroendocrine Tumours of the Lung. Eur J Cardiothorac Surg 31:192-197
40 Giaccone G, Battey J, Gazdar AF et al (1992) La neuromedina B è presente nelle linee cellulari del cancro del polmone. Cancer Res 52:2732s-2736s
41 Saltz L, Lauwers G, Wiseberg J, Kelsen D (1993) Uno studio di fase II del carboplatino in pazienti con tumori APUD avanzati. Cancro 72:619-622
42 Skov BG, Holm B, Erreboe A et al (2010) ERCC1 e Ki67 nel carcinoma polmonare a piccole cellule e in altri tumori neuroendocrini del polmone: distribuzione e impatto sulla sopravvivenza. J Thorac Oncol 5:453-459
43 Kelly K (2000) Nuovi agenti chemioterapici per il carcinoma polmonare a piccole cellule. Chest 117:156-162S
44 Teicher BA (2008) Nuovi agenti citotossici: attaccare il cancro in modo ampio. Clin Cancer Res 14:1610-1617
45 Ansell SM, Pitot HC, Burch PA et al (2001) A phase II study of high-dose paclitaxel in patients with advanced neuroendocrine tumors. Cancro 91:1543-1548
46 Iyer L, Ratain MJ (1998) Farmacologia clinica delle camptotecine. Cancer Chemother Pharmacol 42:S31-S43
47 Catimel G, Chabot GG, Guastalla JP et al (1995) Studio di fase I e farmacocinetico di irinotecan (CPT-11) somministrato giornalmente per tre giorni consecutivi ogni tre settimane in pazienti con tumori solidi avanzati. Ann Oncol 6:133-140
48 Lyons JM 3rd, Abergel J, Thomson JL et al (2009) Test di chemioresistenza in vitro in tumori carcinoidi ben differenziati. Ann Surg Oncol 16:649-655
49 Porter AT, Ostrowski MJ (1988) Successful treatment of malignant carcinoid tumor with intravenous cisplatinum. Eur J Surg Oncol 14:703-704
50 Olszewski U, Hamilton G (2010) Un farmaco antitumorale migliore a base di platino deve ancora arrivare? Agenti antitumorali Med Chem 10:293-301
51 Wasilewski M, Scorrano L (2009) The changing shape of mitochondrial apoptosis. Trends Endocrinol Metab 20:287-294
52 Michelakis ED, Webster L, Mackey JR (2008) Dichloroacetate (DCA) as a potential metabolictargeting therapy for cancer. Br J Cancer 99:989-994
53 Sun RC, Fadia M, Dahlstrom JE et al (2010) Reversal of the glycolytic phenotype by dichloroacetate inhibits metastatic breast cancer growth in vitro and in vivo. Breast Cancer Res Treat 120:253-260
54 Otterson GA, Wang L, Wu X et al (2008) Effetto del dicloroacetato in combinazione con la chemioterapia sulle cellule di cancro al polmone umano. J Clin Oncol 26S:14637
55 Dhar S, Lippard SJ (2009) Mitaplatin, una potente fusione di cisplatino e del farmaco orfano dicloroacetato. Proc Natl Acad Sci U S A 106:22199-22204
56 Li T, Schultz I, Keys DA et al (2008) Quantitative evaluation of dichloroacetic acid kinetics in human: a physiologically based pharmacokinetic modeling investigation. Tossicologia 245: 35-48