Wolfgang Fiebiger1, Ulrike Olszewski2, Ernst Ulsperger2, Klaus Geissler2, Gerhard Hamilton2,3
1 Departamento de Medicina Interna I, División de Oncología, Hospital St. Poelten, St. Poelten, Austria
2 Ludwig Boltzmann Cluster of Translational Oncology, C/o Balderichgasse, 26/13, 1170 Viena, Austria
e-mail: [email protected]
G. Hamilton
3 Departamento de Cirugía, Universidad Médica de Viena, Viena, Austria
Recibido: 1 de abril de 2010
Aceptado: 6 de junio de 2010
Resumen
Introducción: La quimioterapia para carcinoides avanzados bien diferenciados se caracteriza por bajas tasas de respuesta y corta duración de las respuestas. El presente estudio tiene como objetivo evaluar la actividad in vitro de nuevos fármacos quimioterapéuticos basados en platino en combinación con dicloroacetato (DCA), un sensibilizador a la apoptosis, contra líneas celulares carcinoides pulmonares.
Métodos: Se expusieron tres líneas celulares permanentes (UMC-11, H727 y H835) a 14 fármacos citotóxicos establecidos diferentes y a los nuevos compuestos a base de platino como satraplatino, JM118 y picoplatino en combinación con DCA, y se midió la viabilidad de las células mediante un ensayo con colorante a base de tetrazolio.
Resultados: A excepción de la línea UMC- 11, altamente quimiorresistente, las líneas celulares carcinoides (H727, H835) fueron sensibles a la mayoría de los quimioterápicos in vitro. Entre los fármacos basados en el platino, el carboplatino y el oxaliplatino mostraron la mayor eficacia. Las células H835 que crecían como esferoides multicelulares eran entre 2,7 y 8,7 veces más resistentes al picoplatino, al satraplatino y a su metabolito en comparación con las suspensiones de células individuales. El DCA (10 mM) inhibió el crecimiento de las células UMC-11 en un 22% y sensibilizó estas células altamente resistentes al carboplatino, satraplatino y JM118 en 1,4-2,4 veces.
Conclusiones: Las células carcinoides pulmonares UMC-11 altamente resistentes son sensibles al carboplatino, al oxaliplatino y al metabolito del satraplatino JM118, pero el crecimiento esferoidal multicelular, como se observa en la línea celular H835 y en los tumores pulmonares, parece aumentar notablemente la quimiorresistencia. La actividad del carboplatino y del JM118 aumenta de forma significativa y específica en combinación con el sensibilizador de la apoptosis DCA, que promueve la respiración mitocondrial frente a la glucólisis aeróbica. En resumen, entre los nuevos fármacos de platino, el satraplatino tiene potencial para el tratamiento de los carcinoides pulmonares y el DCA potencia la citotoxicidad de determinados fármacos de platino.
Palabras clave: Carcinoide; Quimiosensibilidad; Farmacorresistencia; Complejo de platino; Picoplatino; Satraplatino; Dicloroacetato
INTRODUCCIÓN
Los carcinoides derivan de las células enterocromafines del sistema celular neuroendocrino que está ampliamente distribuido en el organismo [1-3]. Estos tumores bastante raros tienen una incidencia de 2,0-2,5 casos por cada 100.000 personas para los carcinoides clínicamente conspicuos [4]. Los carcinoides del intestino anterior comprenden el 20% de todos los tumores carcinoides e incluyen el timo y el pulmón (que representan el 2% de los cánceres primarios de pulmón), además de los carcinoides gástricos y duodenales [5]. Según sus características histológicas, estos tumores heterogéneos se clasifican como tumores neuroendocrinos bien diferenciados con células pequeñas y núcleos regulares (carcinoide típico) o carcinomas neuroendocrinos bien diferenciados con atipia nuclear y áreas necróticas (carcinoide atípico) [6, 7]. El «síndrome carcinoide», inducido por la secreción de sustancias vasoactivas, se produce en menos del 5% de los carcinoides pulmonares [8]. Entre el 13 y el 22% de los pacientes presentan metástasis a distancia en el momento de la presentación [4]. Los procedimientos diagnósticos primarios incluyen pruebas bioquímicas, en particular análisis de serotonina y ácido 5-hidroxiindolacético (5-HIAA) urinario. La técnica más sensible para la localización de los tumores es la gammagrafía de receptores de somatostatina complementada con TC para la visualización de metástasis hepáticas y biopsia concomitante para la verificación histopatológica [9]. Dado que más del 80% de los tumores carcinoides expresan receptores de somatostatina de tipo 2, la 111indium-DTPA-octreotidacomo trazador puede ser capaz de predecir la utilidad de un próximo tratamiento con análogos de la somatostatina [10, 11].
La curación quirúrgica de los pacientes con carcinoide pulmonar puede lograrse mediante resección, pero una fracción de los tumores da lugar a metástasis generalizadas entre dos y cuatro años después de la operación primaria [12]. A diferencia de los tumores neuroendocrinos bien diferenciados más indolentes, que presentan metástasis en menos del 15% de los casos y revelan una tasa de supervivencia a cinco años superior al 90%, los carcinomas neuroendocrinos bien diferenciados son más agresivos, con metástasis en el 30-50% de los casos y una tasa de supervivencia a cinco años entre el 40 y el 60% [1, 2, 13]. Los pacientes con carcinoides malignos presentan una tasa de supervivencia a cinco años de aproximadamente el 20%, con una mediana de supervivencia de dos años en presencia de metástasis hepáticas [14-16]. El tratamiento médico de la enfermedad metastásica incluye análogos de la somatostatina, α-interferones y quimioterapia [1, 17].
Los ensayos clínicos suelen ser pequeños, con criterios de inclusión y diseño de estudio variables, debido a la rareza de estos tumores [1, 16
]. Básicamente, la quimioterapia puede considerarse para pacientes con enfermedad progresiva bajo terapia no citotóxica, siempre que se asocie con síntomas significativos y mal pronóstico. La doxorrubicina, el 5-fluorouracilo (5-FU), la dacarbazina, la estreptozotocina, la ciclofosfamida, el cisplatino y el etopósido se han utilizado como agentes únicos y en combinaciones que han dado lugar a tasas de respuesta inferiores al 20% sólo durante periodos cortos y, por lo tanto, no se han recomendado para la práctica clínica habitual [1, 3, 16-18
].
En el presente estudio, probamos la actividad in vitro de los nuevos fármacos quimioterapéuticos, incluyendo gemcitabina, camptotecina, oxaliplatino y paclitaxel, en comparación con los fármacos citotóxicos utilizados actualmente para la quimioterapia, empleando las tres líneas celulares carcinoides pulmonares permanentes UMC11, H727 y H835. Los carcinoides pulmonares están estrechamente relacionados con el cáncer de pulmón microcítico (CPM), que se trata principalmente con una combinación de cisplatino y etopósido [3,19]. Los fármacos de tercera generación basados en el platino, como el satraplatino y el picoplatino, se están investigando actualmente en ensayos clínicos para el CPCP y es posible que también sean activos contra los carcinoides pulmonares [20]. Por lo tanto, el profármaco oral satraplatino [JM216; bisacetatoammina diclorido ciclohexilamina platino(IV)], sus metabolitos activos JM149 [cis-ammina diclorido (ciclohexilamina) dihidroxidoplatino(IV)] y JM118 [cis-ammina diclorido ciclohexilamina platino(II)], así como picoplatino [JM473, ZD-0473, AMD-473; cis-ammina diclorido 2-metilpiridina platino(II)], se estudió su potencia citotóxica in vitro utilizando las tres líneas celulares carcinoides pulmonares. Se espera que la eficacia de los complejos de platino mejore aún más en combinación con dicloroacetato (DCA), dirigido contra la piruvato deshidrogenasa cinasa. Así pues, se investigó además el efecto aditivo de este compuesto sobre la citotoxicidad de los fármacos de platino [21].
Materiales y métodos
Productos químicos y líneas celulares
La gemcitabina se obtuvo de Eli Lilly (Londres, Reino Unido), la dacarbazina de Medac (Hamburgo, Alemania), el oxaliplatino de Sanofi (París, Francia), y todos los demás fármacos procedían de Sigma-Aldrich (St. Louis, MO, EE.UU.). El satraplatino y sus metabolitos JM149 y JM118, así como el picoplatino, fueron sintetizados a medida por Chiracon (Luckenwalde, Alemania). El DCA sódico se preparó como solución madre 1 M. Las líneas celulares carcinoides pulmonares UMC-11, H727 y H835 del Instituto Nacional del Cáncer (NCI) se adquirieron a la American Tissue Culture Collection (ATCC, Manassas, VA, EE.UU.). Las células se cultivaron en medio RPMI-1640 suplementado con un 10% de suero bovino fetal y 4 mM de glutamina (Seromed, Berlín, Alemania). Las células UMC-11 y H727 se subcultivaron mediante tripsinización (solución de tripsina/EDTA al 2,5%, Boehringer Mannheim, Alemania), y las células H835, que crecían en suspensión, se mantuvieron mediante sustitución del medio.
Distribución del ciclo celular y ensayos de tiempo de duplicación
Para analizar la distribución del ciclo celular, se lavaron alícuotas de cultivos celulares con PBS, se resuspendieron en 100 µl de PBS y se fijaron con 1 ml de etanol al 70% a -20°C durante 30 min. A continuación, se centrifugaron las células, se lavaron con PBS y se tiñeron con una solución de 20 µg/ml de yoduro de propidio (PI) en 0,5% de Triton X100/PBS suplementada con 5 µg/ml de ARNasa A durante 24 h a temperatura ambiente. Los histogramas se adquirieron mediante un sistema de citometría de flujo FACS Scan (Becton Dickinson, Mountain View, CA, EE.UU.), y la distribución del ciclo celular se calculó utilizando el software Multicycle AV (Phoenix, San Diego, CA, EE.UU.). Los tiempos de duplicación de la línea celular se determinaron mediante mediciones diarias del número de células de tres cultivos independientes durante seis días consecutivos utilizando un microcontador de células (Sysmex, Tokio, Japón). Los grupos de células H835 se dispersaron mediante tratamiento con tripsina para obtener suspensiones de células individuales para el recuento.
Ensayo de proliferación celular
Las células se cosecharon, contaron y distribuyeron en placas de microtitulación en 100 µl de medio a una densidad de 1×104 células/pocillo. Se añadieron diluciones apropiadas de los compuestos de ensayo a un volumen total de 200 µl/pocillo y las placas se incubaron en condiciones de cultivo tisular durante cuatro días. Se prepararon soluciones madre de los compuestos en etanol al 70% o dimetilsulfóxido y se diluyeron más de 100 veces para los ensayos. En todos los ensayos se incluyeron controles de disolvente. Las curvas dosis-respuesta se obtuvieron evaluando la proliferación celular a diluciones de fármaco dos veces por triplicado y se utilizaron para calcular los valores de IC50. El crecimiento celular se cuantificó mediante un ensayo modificado con colorante de tetrazolio (MTT; EZ4U, Biomedica, Viena, Austria) y por medición del colorante de formazano reducido a una longitud de onda de 450 nm (control del medio ajustado al 100% de proliferación).
Análisis estadístico
Las diferencias entre dos grupos independientes se determinaron mediante ANOVA y la prueba U de Mann-Whitney. p<0,05 se consideró estadísticamente significativo. Todos los cálculos se realizaron con el programa Statistica (Statsoft, Tulsa, OK, EE.UU.). Los tiempos de duplicación de las líneas celulares se analizaron utilizando una calculadora en línea (Roth V. 2006, disponible en ).
Resultados
Distribución del ciclo celular y tiempo de duplicación de las tres líneas celulares carcinoides pulmonares
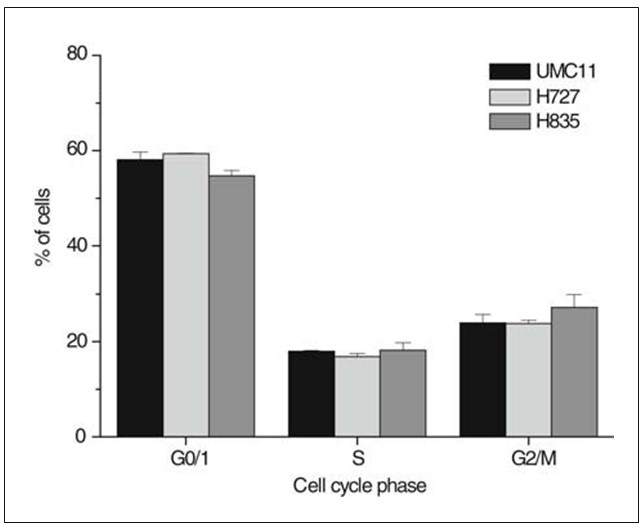
Los porcentajes de células carcinoides en fases específicas del ciclo celular se determinaron mediante tinción con PI de células fijadas derivadas de cultivos subconfluyentes, análisis de citometría de flujo y ajuste de curvas de los histogramas resultantes (Fig. 1). Las líneas celulares presentaban una fracción de células en fase S superior al 17% y fracciones G0/1 inferiores al 54% de la población celular total, respectivamente. Las fracciones de fase S de las líneas celulares carcinoides UMC-11, H727 y H835 no fueron significativamente diferentes. Los tiempos de duplicación de las líneas celulares se determinaron mediante recuento diario de células de seis cultivos independientes y resultaron ser de 20,8 h para H727, 27,0 h para UMC-11 y 35,7 h para H835, respectivamente.
Pruebas de quimiosensibilidad con fármacos clínicamente establecidos
Se expusieronlas célulasa los distintos fármacos quimioterapéuticos in vitro y se calcularon los valores IC50 a partir de las relaciones dosis-respuesta tras la cuantificación de las células supervivientes mediante ensayos MTT. Todos los ensayos se llevaron a cabo durante cuatro días, excepto los ensayos con dacarbazina durante siete días, ya que el metabolito activo (5-amino-imidazol 4-carboxamida) se forma lentamente in vitro. La Tabla 1 muestra los resultados de los ensayos de quimiosensibilidad de 14 fármacos ensayados contra las tres líneas celulares carcinoides. Los valores IC50 se compararon con las siguientes concentraciones plasmáticas máximas alcanzables (CPP) individuales: vinblastina 8,5 ng/ml [22], taxol 3,5±1,4 µM [23], topotecán derivado de la camptotecina (TPT) 65±20 nM [24], 5-FU 0,6 µM/l [25], doxorrubicina 73,5±26.4 ng/ml [26], gemcitabina 50 µM [27], tamoxifeno 0,4 µM [28], cisplatino 6,3 µM [29], oxaliplatino 9,1±1.25 µM [
], carboplatino 105 µM [31], mitomicina C 345±151 ng/ml [32], estreptozotocina 100±10 µg/ml [33], etopósido 5,6±2,5 µg/ml [34] y dacarbazina 8,6±0,6 µg/ml [35]. Las células UMC-11 mostraron una marcada quimiorresistencia frente a la mayoría de los fármacos, a excepción de la vinblastina, la camptotecina, el oxaliplatino, el carboplatino, la mitomicina C y la dacarbazina, cuyos valores de IC50 fueron inferiores a PPC para los respectivos fármacos. Las otras dos líneas celulares permanentes H727 y H835 fueron sensibles a 10/14 y 9/14, respectivamente, de los fármacos aquí utilizados. En comparación con la línea celular H835, la línea H727 que es de tipo p53 salvaje fue además sensible a la dacarbazina. Las tres líneas celulares parecían tener una sensibilidad similar al oxaliplatino y al carboplatino, en contraste con su alta resistencia al cisplatino.
| Fármaco | Línea celular carcinoide pulmonar | Línea celular carcinoide pulmonar | Línea celular carcinoide pulmonar | Línea celular carcinoide pulmonar |
| UMC-11 (IC50) | H727 (IC50) | H835 (IC50) | PPC | |
| Vinblastina ( ng/ml) | 2.0±0.35 | 8.0±2.7 | 2.0±0.3 | 8.5 |
| Taxol (ng/ml) | 10.0±4.4 | 8.0±3.8 | 9.0±3.9 | 1.0 |
| Camptotecina (nM ) | 18.0±5.0 | 0.5±0.1 | 6.5±4.3 | (65) |
| 5-Fluorouracilo (µM ) | 30.0±4.6 | 20.0±5.9 | 45.0±8.7 | 0.6 |
| Doxorrubicina (nM) | 370.7±72.4 | 24.1±5.2 | 73.1± 2.4 | 73.5 |
| Gemcitabina (nM) | 833.3±103 | 30.0±6.7 | 30.0±20 | 50.0 |
| Tamoxifeno (µM) | 9.0±3.3 | 25.0±8.1 | 7.0±2.4 | 0.4 |
| Cisplatino (µM) | 33.3±15 | 83.3±21 | 33.3±7.0 | 6.3 |
| Oxaliplatino (µM ) | 5.0±0.25 | 11.3±5.3 | 6.3±0.51 | 9.1 |
| Carboplatino (µM) | 36.4±7.1 | 3.4±0.4 | 35.8±9.9 | 105 |
| Mitomicina (ng/ml) | 156.0±15 | 10.0±3.0 | 35.0±9.0 | 345.0 |
| Estreptozotocina (µg/ml) | 180±33 | 50±21 | 60±19 | 100 |
| Etopósido (µg/ml) | 45.0±12.3 | 0.13±0.03 | 0.25±0.02 | 5.6 |
| Dacarbazina (µg/ml) | 4.2±2.3 | 2.2±1.3 | 16.5±3.9 | 8.6 |
Los valores de IC50 se expresan como media±SD (n=3), y se muestra la PPC clínica para su comparación
Actividad citotóxica de fármacos de platino de tercera generación en líneas celulares carcinoides pulmonares
Se comprobó la citotoxicidad de los nuevos fármacos basados en platino satraplatino y picoplatino utilizando las tres líneas celulares carcinoides in vitro. In vivo, el satraplatino se convierte rápidamente en JM149 y en el metabolito altamente activo JM118, que se incluyeron en este ensayo de quimiosensibilidad (Fig. 2). Los PPC alcanzables fueron 15,9 µM para picoplatino, 1,4 µM para satraplatino y 2,2 µM para JM118, respectivamente. Las células H835 se ensayaron como suspensión unicelular o como agregados globulares con un diámetro aproximado de 150-250 µM. Las pruebas de quimiosensibilidad mostraron que el picoplatino y el JM118 alcanzaron concentraciones IC50 inferiores a sus PPC en las células H727 y H835, respectivamente. Además, H727 demostró ser sensible a JM149. Las células H835 cultivadas como esferoides multicelulares fueron más resistentes al picoplatino (2,7 veces), JM216 (7,9 veces), JM149 (4,3 veces) y JM118 (8,7 veces).

Citotoxicidad de combinaciones de fármacos basados en platino con DCA en líneas celulares carcinoides pulmonares
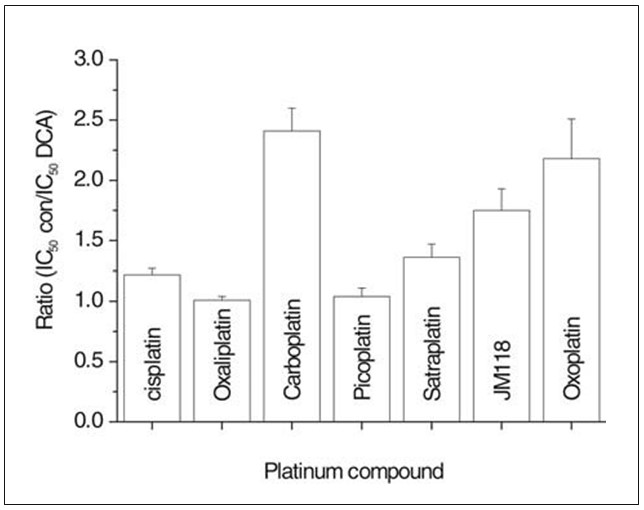
Además, se realizaron ensayos de quimiosensibilidad como los descritos anteriormente utilizando la línea celular resistente UMC-11 en ausencia o en presencia continua de 10 mM de DCA (Fig. 3). Esta concentración de DCA redujo la proliferación de las células UMC-11 en un 22,2±3,2% y disminuyó los valores de IC50 (factor de sensibilización: media±SD de IC50 del compuesto de platino en medio solo dividida por la IC50 del compuesto de platino respectivo en medio suplementado con 10 mM de DCA; IC50 del compuesto de platino en presencia de DCA) para carboplatino (2.41±0,19; 13,1±0,2 µM), satraplatino (1,36±0,11; 7,8±0,4 µM), metabolito JM118 (1,75±0,18; 1,22±0,05 µM) y oxoplatino (2,18±0,33; 4,8±0,14 µM). En cambio, el cisplatino (1,22±0,9; 25,3±0,75 µM), el oxaliplatino (1,01±0,03; 4,4±0,16 µM) y el picoplatino (1,04±0,02; 28,6±0,6 µM) mostraron una modulación baja o nula de su citotoxicidad por el DCA. El oxoplatino [cis, trans, cis diamino dihidroxido diclorido platino(IV)] se está investigando actualmente como fármaco oral de platino.
Discusión
El éxito del tratamiento de los tumores carcinoides malignos requiere un enfoque multimodal, que incluya la resección, la reducción del tumor mediante ligadura de la arteria hepática para las metástasis hepáticas y el tratamiento sistémico con fármacos citostáticos y/o citotóxicos [1-3, 8]. La octreotida y diferentes análogos de la somatostatina de acción prolongada produjeron tasas de respuesta bioquímica del orden del 30-70%, pero una reducción objetiva del tumor en menos del 10% de los pacientes [36]. La quimioterapia de agente único de los tumores carcinoides dio tasas de respuesta muy bajas que no superaron el 20% para la monoterapia con doxorrubicina [37]. Los ensayos clínicos que incluyeron estreptozotocina más ciclofosfamida o 5-FU no generaron tasas de respuesta significativamente mejores, que oscilaron entre el 26 y el 33% [18]. En resumen, los carcinoides pueden controlarse farmacológicamente mediante tratamiento con análogos de la somatostatina e interferón, así como con fármacos citotóxicos, como estreptozotocina, dacarbazina, 5-FU, ciclofosfamida, doxorrubicina durante un tiempo prolongado; sin embargo, los tumores finalmente progresan a un estado refractario [3, 16, 38, 39].
Aquí se probó la citotoxicidad de una amplia gama de terapéuticos utilizando las tres líneas celulares permanentes UMC-11, H727 y H835 derivadas de carcinoides broncopulmonares por Giaccone et al. [40]. H727 y H835 pueden considerarse principalmente células sensibles a fármacos con insensibilidad a taxol, 5-FU, cisplatino y tamoxifeno. Por el contrario, las células UMC-11 mostraron una marcada quimiorresistencia con la excepción de la sensibilidad a la dacarbazina, vinblastina, mitomicina, carboplatino y oxaliplatino. La comparación de los valores IC50 de los quimioterápicos obtenidos in vitro con los PPC alcanzables clínicamente proporciona una estimación aproximada de la efi cacia clínica esperada. Los valores IC50 in vivo de las células tumorales pueden reducirse bajo la aplicación prolongada de un fármaco o ser superiores si se tienen en cuenta las concentraciones tisulares más bajas y la menor accesibilidad de las células tumorales. Aunque las tres líneas celulares mostraron una fracción de fase S similar en las mediciones de distribución del ciclo celular, sus tiempos de duplicación difirieron y ascendieron a 20,8 y 35,7 h para las líneas quimiosensibles H727 y H835, respectivamente, y a 27,0 h para las células quimiorresistentes UMC-11. Según estos datos, la quimiorresistencia de las tres líneas celulares carcinoides no se debe a diferencias en su fracción de fase S o en sus tiempos de duplicación. Los resultados in vitro obtenidos para estreptozotocina, dacarbazina, cisplatino, etopósido, 5-FU, doxorrubicina y tamoxifeno concuerdan bien con la limitada actividad clínica (tasa de respuesta <30%) de estos fármacos en pacientes con carcinoides avanzados [16]. En un ensayo clínico con pacientes carcinoides se notificó que el carboplatino tenía una actividad insuficiente; sin embargo, no está claro si alguno de estos pacientes tenía carcinoides en el intestino anterior [41]. La elevada expresión de la proteína del grupo de complementación cruzada de reparación por escisión 1 (ERCC1), un componente clave del mecanismo de reparación del ADN dañado por aductos de platino, en los carcinoides típicos parecía estar relacionada con la resistencia al platino en estos pacientes [42].
Desde el desarrollo de regímenes quimioterápicos para carcinoides avanzados basados en estreptozotocina/dacarbazina, 5-FU, ciclofosfamida u otros, se han introducido varios fármacos nuevos que han demostrado poseer una actividad anticancerosa significativa en tumores relacionados, ya sea como agentes únicos o en combinación [3, 43, 44]. Estos agentes incluyen el oxaliplatino, un compuesto de platino muy activo, el paclitaxel, un taxano dirigido a la polimerización de los microtúbulos, los análogos del inhibidor de la topoisomerasa I camptotecina y el antimetabolito gemcitabina. El paclitaxel resultó ser menos citotóxico que la vinblastina y la gemcitabina, que eran activas contra las dos líneas celulares carcinoides sensibles. El paclitaxel se evaluó recientemente en un estudio clínico en el que participaron 14 pacientes con tumores carcinoides y nueve pacientes con tumores de células de los islotes, y arrojó una tasa de respuesta global del 8% que se asoció a una toxicidad hematológica significativa [45]. El compuesto original de gran actividad, la camptotecina (CPT), fue abandonado para su uso clínico debido a su elevada toxicidad local tras la aplicación intravenosa, pero actualmente se está reevaluando en nuevas formulaciones. Dos derivados establecidos, a saber, CPT-11 (irinotecan) y topotecan, se modificaron para obtener una mayor solubilidad en agua y demostraron mostrar actividad clínica en una amplia gama de tumores [46]. Las CPP alcanzables de aproximadamente 65 nM para topotecán y >70 nM para el metabolito activo de CPT-11, SN38, se encuentran en el mismo rango que el valor IC50 obtenido para CPT [32, 47]. Un informe sobre quimiorresistencia en cultivos primarios de carcinoides típicos halló una sensibilidad relativamente alta a 5-FU, doxorrubicina, etopósido y dacarbazina, pero una alta resistencia a cisplatino, gemcitabina, vinblastina y carboplatino [48]. Sin embargo, sólo seis de las 60 muestras tumorales analizadas eran carcinoides del intestino anterior y no se aplicaron todos los agentes a cada muestra tumoral. Por lo tanto, los carcinoides pulmonares pueden presentar un patrón de quimiosensibilidad distinto al de los tumores del intestino medio y posterior, como se observó en el presente estudio.
Nuestros resultados muestran que el oxaliplatino es citotóxico contra las tres líneas celulares carcinoides, incluidas las células UMC-11, que muestran una amplia resistencia al fármaco. Además, se ha descrito una respuesta clínica al cisplatino en un único paciente con carcinoide [49]. Los nuevos complejos de platino satraplatino y picoplatino no se han probado hasta ahora en pacientes carcinoides, pero mostraron una actividad clínica prometedora en ensayos de cáncer de pulmón [20, 50]. Las células UMC-11 son insensibles al picoplatino. JM118, el metabolito altamente activo del satraplatino, mostró una citotoxicidad significativa contra las tres líneas celulares carcinoides de pulmón. La sensibilidad a los nuevos compuestos de platino se reduce notablemente en los esferoides de células H835 en comparación con las suspensiones unicelulares y depende del tamaño molecular y la lipofilia del fármaco respectivo. Por lo tanto, el acceso limitado de los quimioterápicos a las células carcinoides y los niveles insuficientes de fármaco resultantes pueden estar asociados con la resistencia a los fármacos en los tumores carcinoides in vivo [49].
La resistencia generalizada a los fármacos citotóxicos puede atribuirse a una mayor supresión de la muerte apoptótica de las células tumorales a través de alteraciones de las características de las mitocondrias [51]. El metabolismo de la mayoría de los tumores sólidos comprende la glucólisis aeróbica (efecto Warburg), y en estas condiciones las mitocondrias no proporcionan factores proapoptóticos esenciales. El DCA es una pequeña molécula inhibidora de la piruvato deshidrogenasa cinasa disponible por vía oral que aumenta el flujo de piruvato hacia las mitocondrias y, por tanto, favorece la oxidación de la glucosa frente a la glucólisis [52]. Esto invierte la apoptosis mitocondrial suprimida en el cáncer y provoca la inhibición del crecimiento tumoral in vitro e in vivo en el cáncer de mama, próstata y endometrio [53]. Además de los efectos celulares inducidos por el DCA por sí solo, puede ser capaz de potenciar la muerte celular cuando se combina con fármacos citotóxicos. El DCA no tuvo ningún efecto aditivo en las dos líneas celulares de cáncer de pulmón no microcítico A549 y H719 con paclitaxel, etopósido o cisplatino. Sin embargo, el mitaplatino, un compuesto en el que se añadieron dos moléculas de DCA a las posiciones axiales de un centro de Pt(IV) de seis coordenadas, mostró una actividad prometedora [54, 55]. Nuestros resultados demuestran que el DCA inhibe el crecimiento de la línea celular quimiorresistente UMC-11 y sensibiliza las células al carboplatino, JM118 y oxoplatino a concentraciones que pueden alcanzarse in vivo [56]. Queda por dilucidar el mecanismo de esta selectividad del DCA por compuestos específicos de platino. En conclusión, los complejos de platino como el oxaliplatino, el carboplatino y el satraplatino pueden tener potencial para el tratamiento de los carcinoides pulmonares, y la sensibilización de las células tumorales a determinados fármacos de platino inducida por el DCA puede tener una aplicabilidad más amplia en la quimioterapia citotóxica.
Agradecimientos
Queremos dar las gracias al Dr. Z. Salama por proporcionar complejos de platino y por sus útiles discusiones. Este proyecto fue financiado por una subvención del Banco Nacional de Austria (nº 13345) al Dr. K. Geissler. El Dr. W. Fiebiger y el Dr. U. Olszewski PhD han contribuido a partes iguales a este estudio.
Conflicto de intereses
Los autores declaran que no tienen ningún conflicto de intereses relacionado con la publicación de este manuscrito.
REFERENCIAS
1 Öberg K (2003) Diagnóstico y tratamiento de los tumores carcinoides. Expert Rev Anticancer Ther 3:863-8772 Modlin IM, Kidd M, Latich I et al (2005) Estado actual de los carcinoides gastrointestinales. Gastroenterology 128:1717-1751
3 Pinchot SN, Holen K, Sippel RS, Chen H (2008) Carcinoid tumors. Oncologist 13:1255-1269
4 Zuetenhorst JM, Taal BG (2005) Metastatic carcinoid tumors: a clinical review. Oncologist 10:123-131
5 Granberg D, Oberg K (2005) Neuroendocrine tumours. Cancer Chemother Biol Response Modif 22:471-483
6 Capella C, Heitz PU, Hofler H et al (1995) Revised classification of neuroendocrine tumors of the lung, pancreas and gut. Virchows Arch 425:547-560
7 Warren WH, Gould VE, Faber LP et al (1985) Neuroendocrine neoplasms of the bronchopulmonary tract: a classification of the spectrum of carcinoid to small cell carcinoma and intervening variants. J Thorac Cardiovasc Surg 89:819-825
8 Plockinger U, Rindi G, Arnold R et al (2004) European Neuroendocrine Tumour Society: guidelines for the diagnosis and treatment of neuroendocrine gastrointestinal tumours. Una declaración de consenso en nombre de la Sociedad Europea de Tumores Neuroendocrinos (ENETS). Neuroendocrinología 80:394-424
9 Öberg K, Eriksson B (2005) Nuclear medicine in the detection, staging and treatment of gastrointestinal carcinoid tumours. Best Pract Res Clin Endocrinol Metab 19:265-276
10 Dousset B, Saint-Marc O, Pitre J et al (1996) Metastatic endocrine tumors: medical treatment, surgical resection and liver transplantation. World J Surg 20:908-915
11 Raderer M, Kurtaran A, Leimer M et al (2000) Value of peptide receptor scintigraphy using (123) I-vasoactive intestinal peptide and (111)In-DTPAD-Phe1-octreotide in 194 carcinoid patients: Experiencia de la Universidad de Viena, 1993 a 1998. J Clin Oncol 18:1331-1336
12 Smolle-Juttner FM, Popper H, Klemen H et al (1993) Clinical features and therapy of «typical» and «atypical» bronchial carcinoid tumors (grade 1 and grade 2 neuroendocrine carcinoma). Eur J Cardiothorac Surg 7:121-125
13 Marty-Ane CH, Costes V, Pujol JL et al (1995) Carcinoid tumors of the lung: do atypical features require aggressive management? Ann Thorac Surg 59:78-83
14 Moertel CG, Sauer WG, Dockerty MB, Baggenstoss AH (1961) Life history of the carcinoid tumor of the small intestine. Cancer 14:901-912
15 Goodwin JD (1975) Carcinoid tumors: an analysis of 2837 cases. Cancer 36:560-569
16 Bertino EM, Confer PD, Colonna JE et al (2009) Pulmonary neuroendocrine/carcinoid tumors: a review article. Cáncer 115:4434-4441
17 Moertel CG (1983) Treatment of the carcinoid tumor and the malignant carcinoid syndrome. J Clin Oncol 1:727-740
18 Sun W, Lipsitz S, Catalano P et al (2005) Phase II/III Study of doxorubicin with fluorouracil compared with streptozocin with fluorouracil or dacarbazine in the treatment of advanced carcinoid tumors: Estudio E1281 del Eastern Cooperative Oncology Group. J Clin Oncol 23:4897-4904
19 Dowell JE (2010) Cáncer de pulmón de células pequeñas: ¿estamos progresando? Am J Med Sci 339:68-76
20 Shah N, Dizon DS (2009) Agentes de platino de nueva generación para tumores sólidos. Future Oncol 5:33-42
21 Dhar S, Lippard SJ (2009) Mitaplatin, a potent fusion of cisplatin and the orphan drug dichloroacetate. Proc Natl Acad Sci U S A 106:22199-22204
22 Chong CD, Logothetis CJ, Savaraj N et al (1988) The correlation of vinblastine pharmacokinetics to toxicity in testicular cancer patients. J Clin Pharmacol 28:714-718
23 Rowinsky EK, Burke PJ, Karp JE et al (1989) Phase I and pharmacodynamic study of taxol in refractory acute leukemias. Cancer Res 49:4640-4647
24 Dennis MJ, Beijnen JH, Grochow LB, van Warderdam LJC (1997) An overview of the clinical pharmacology of topotecan. Semin Oncol 24:12-18S
25 Ho DH, Pazdur R, Covington W et al (1998) Comparison of 5-fluorouracil pharmacokinetics in patients receiving continuous 5-fluorouracil infusion and oral uracil plus N1-(2′-tetrahydrofuryl)-5-fluorouracil. Clin Cancer Res 4:2085-2088
26 Wihlm J, Limacher JM, Leveque D et al (1997) Pharmacokinetic profile of high-dose doxorubicin administered during a 6 h intravenous infusion in breast cancer patients. Bull Cancer 84:603-608
27 Touroutoglou N, Gravel D, Raber MN et al (1998) Clinical results of a pharmacodynamically-based strategy for higher dosing of gemcitabine in patients with solid tumors. Ann Oncol 9:1003-1008
28 Kivisto KT, Villikka K, Nyman L et al (1998) Tamoxifen and toremifene concentrations in plasma are greatly decreased by rifampicin. Clin Pharmacol Ther 64:648-654
29 Bonetti A, Franceschi T, Apostoli P et al (1995) Cisplatin pharmacokinetics using a five-day schedule during repeated courses of chemotherapy in germ cell tumors. Ther Drug Monit 17:25-32
30 Graham MA, Lockwood GF, Greenslade D et al (2000) Clinical pharmacokinetics of oxaliplatin: a critical review. Clin Cancer Res 6:1205-1218
31 Oguri S, Sakakibara T, Mase H et al (1988) Clinical pharmacokinetics of carboplatin. J Clin Pharmacol 28:208-215
32 Schilcher RB, Young JD, Ratanatharathorn V et al (1984) Clinical pharmacokinetics of highdose mitomycin C. Cancer Chemother Pharmacol 13:186-190
33 Adolphe AB, Glasofer ED, Troetel WM et al (1975) Fate of streptozotocin (NSC-85998) in patients with advanced cancer. Cancer Chemother Rep 9:547-556
34 Hande K, Messenger M, Wagner J et al (1999) Inter- and intrapatient variability in etoposide kinetics with oral and intravenous drug application. Clin Cancer Res 5:2742-2747
35 Chabot GG, Flaherty LE, Valdivieso M, Baker LH (1990) Alteration of DTIC pharmacokinetics after interleukin-2 administration in melanoma patients. Cancer Chemother Pharmacol 27:157-160
36 Kvols LK, Moertel CG, O’Connell MJ et al (1986) Treatment of the malignant carcinoid evaluation of a long-acting somatostatin analog. N Engl J Med 315:663-666
37 Engstrom PF, Lavin PT, Moertel CG et al (1984) Streptozotocin plus fluorouracil versus doxorubicin therapy for metastatic carcinoid tumor. J Clin Oncol 8:865-890
38 Vilar E, Salazar R, Pérez-García J et al (2007) Chemotherapy and role of the proliferation marker Ki-67 in digestive neuroendocrine tumors. Endocr Relat Cancer 14:221-23
39 García-Yuste M, Matilla JM, Cueto A et al (2007) Tumores carcinoides típicos y atípicos: análisis de la experiencia del Estudio Multicéntrico Español de Tumores Neuroendocrinos de Pulmón. Eur J Cardiothorac Surg 31:192-197
40 Giaccone G, Battey J, Gazdar AF et al (1992) Neuromedin B is present in lung cancer cell lines. Cancer Res 52:2732s-2736s
41 Saltz L, Lauwers G, Wiseberg J, Kelsen D (1993) A phase II trial of carboplatin in patients with advanced APUD tumors. Cancer 72:619-622
42 Skov BG, Holm B, Erreboe A et al (2010) ERCC1 and Ki67 in small cell lung carcinoma and other neuroendocrine tumors of the lung: distribution and impact on survival. J Thorac Oncol 5:453-459
43 Kelly K (2000) Nuevos agentes quimioterápicos para el cáncer de pulmón de células pequeñas. Chest 117:156-162S
44 Teicher BA (2008) Newer cytotoxic agents: attacking cancer broadly. Clin Cancer Res 14:1610-1617
45 Ansell SM, Pitot HC, Burch PA et al (2001) A phase II study of high-dose paclitaxel in patients with advanced neuroendocrine tumors. Cancer 91:1543-1548
46 Iyer L, Ratain MJ (1998) Clinical pharmacology of camptothecins. Cancer Chemother Pharmacol 42:S31-S43
47 Catimel G, Chabot GG, Guastalla JP et al (1995) Estudio de fase I y farmacocinético de irinotecán (CPT-11) administrado diariamente durante tres días consecutivos cada tres semanas en pacientes con tumores sólidos avanzados. Ann Oncol 6:133-140
48 Lyons JM 3rd, Abergel J, Thomson JL et al (2009) In vitro chemoresistance testing in well-differentiated carcinoid tumors. Ann Surg Oncol 16:649-655
49 Porter AT, Ostrowski MJ (1988) Successful treatment of malignant carcinoid tumour with intravenous cisplatinum. Eur J Surg Oncol 14:703-704
50 Olszewski U, Hamilton G (2010) ¿Aún está por llegar un fármaco anticanceroso mejor basado en el platino? Anticancer Agents Med Chem 10:293-301
51 Wasilewski M, Scorrano L (2009) The changing shape of mitochondrial apoptosis. Trends Endocrinol Metab 20:287-294
52 Michelakis ED, Webster L, Mackey JR (2008) Dichloroacetate (DCA) as a potential metabolictargeting therapy for cancer. Br J Cancer 99:989-994
53 Sun RC, Fadia M, Dahlstrom JE et al (2010) Reversal of the glycolytic phenotype by dichloroacetate inhibits metastatic breast cancer cell growth in vitro and in vivo. Breast Cancer Res Treat 120:253-260
54 Otterson GA, Wang L, Wu X et al (2008) Effect of dichloroacetate in combination with chemotherapy on human lung cancer cells. J Clin Oncol 26S:14637
55 Dhar S, Lippard SJ (2009) Mitaplatin, a potent fusion of cisplatin and the orphan drug dichloroacetate. Proc Natl Acad Sci U S A 106:22199-22204
56 Li T, Schultz I, Keys DA et al (2008) Quantitative evaluation of dichloroacetic acid kinetics in human: a physiologically based pharmacokinetic modeling investigation. Toxicología 245: 35-48