Wolfgang Fiebiger1, Ulrike Olszewski2, Ernst Ulsperger2, Klaus Geissler2, Gerhard Hamilton2,3
1 Afdeling Interne Geneeskunde I, Afdeling Oncologie, St. Poelten Ziekenhuis, St. Poelten, Oostenrijk
2 Ludwig Boltzmann Cluster of Translational Oncology, C/o Balderichgasse, 26/13, 1170 Wenen, Oostenrijk
e-mail: [email protected]
G. Hamilton
3 Afdeling Chirurgie, Medische Universiteit Wenen, Wenen, Oostenrijk
Ontvangen: 1 april 2010
Aanvaard: 6 juni 2010
Abstract
Inleiding: Chemotherapie voor gevorderde goed gedifferentieerde carcinoïden wordt gekenmerkt door lage responspercentages en korte responsduur. Deze studie had tot doel de in vitro activiteit van nieuwe op platina gebaseerde chemotherapeutische geneesmiddelen in combinatie met dichlooracetaat (DCA), een sensibilisator voor apoptose, tegen longcarcinoïde cellijnen te beoordelen.
Methoden: Drie permanente cellijnen (UMC-11, H727 en H835) werden blootgesteld aan 14 verschillende gevestigde cytotoxische geneesmiddelen en de nieuwe op platina gebaseerde verbindingen als satraplatin, JM118 en picoplatin in combinatie met DCA, en de levensvatbaarheid van de cellen werd gemeten met behulp van een tetrazolium gebaseerde kleurstoftest.
Resultaten: Met uitzondering van de zeer chemoresistente UMC- 11 lijn, waren de carcinoïde cellijnen (H727, H835) gevoelig voor de meeste chemotherapeutica in vitro. Van de op platina gebaseerde geneesmiddelen waren carboplatine en oxaliplatine het meest werkzaam. H835-cellen die als multicellulaire sferoïden groeiden, waren 2,7-8,7-maal zo resistent tegen picoplatine, satraplatine en de metaboliet daarvan in vergelijking met suspensies van afzonderlijke cellen. DCA (10 mM) remde de groei van UMC-11-cellen met 22% en maakte deze zeer resistente cellen 1,4-2,4-voudig gevoelig voor carboplatine, satraplatine en JM118.
Conclusie: De zeer resistente UMC-11 longcarcinoïde cellen zijn gevoelig voor carboplatine, oxaliplatine en de satraplatine metaboliet JM118, maar multicellulaire sferoïdale groei, zoals waargenomen in de H835 cellijn en longtumoren, lijkt de chemoresistentie duidelijk te verhogen. De activiteit van carboplatine en JM118 wordt aanzienlijk en specifiek verhoogd in combinatie met de apoptosesensibilisator DCA, die de mitochondriale ademhaling bevordert boven de aërobe glycolyse. Kortom, van de nieuwe platinamiddelen heeft satraplatine het potentieel voor de behandeling van longcarcinoïden en versterkt DCA de cytotoxiciteit van geselecteerde platinamiddelen.
Trefwoorden: Carcinoïd; Chemosensitiviteit; Geneesmiddelenresistentie; Platina-complex; Picoplatine; Satraplatine; Dichlooracetaat
INLEIDING
Carcinoïden zijn afgeleid van enterochromaffinecellen van het neuro-endocriene celsysteem dat wijd verspreid is in het lichaam [1-3]. Deze vrij zeldzame tumoren hebben een incidentie van 2,0-2,5 gevallen per 100.000 mensen voor klinisch opvallende carcinoïden [4]. De carcinoïden van het voordarmkanaal vertegenwoordigen 20% van alle carcinoïden en omvatten naast de maag- en duodenale carcinoïden ook de thymus en de long (die 2% van de primaire longkankers vertegenwoordigen) [ 5]. Op grond van hun histologische kenmerken worden deze heterogene tumoren geclassificeerd als goed gedifferentieerde neuro-endocriene tumoren met kleine cellen en regelmatige kernen (typische carcinoïden) of goed gedifferentieerde neuro-endocriene carcinomen met atypische kernen en necrotische gebieden (atypische carcinoïden) [6, 7]. Het “carcinoïd-syndroom”, dat wordt geïnduceerd door secretie van vasoactieve stoffen, komt voor bij minder dan 5% van de longcarcinoïden [8]. 13 tot 22% van de patiënten heeft verre uitzaaiingen op het moment van presentatie [4]. De primaire diagnostische procedures omvatten biochemische tests, met name analyse van serotonine en urine 5-hydroxyindoleazijnzuur (5-HIAA). De meest gevoelige techniek voor de lokalisatie van de tumoren is scintigrafie van de somatostatinereceptor, aangevuld met CT voor de visualisatie van levermetastasen en gelijktijdige biopsie voor histopathologische verificatie [9]. Aangezien meer dan 80% van de carcinoïde tumoren somatostatinereceptor type 2 tot expressie brengt, kan met 111indium-DTPA-octreotideals tracer het nut van een komende therapie met somatostatine-analoog worden voorspeld [10, 11].
Chirurgische genezing van longcarcinoïden kan worden bereikt door resectie, maar een fractie van de tumoren geeft binnen twee tot vier jaar na de primaire operatie aanleiding tot wijdverspreide metastasering [12]. In tegenstelling tot de meer indolente goed gedifferentieerde neuro-endocriene tumoren die metastasen vertonen in minder dan 15% van de gevallen en een vijfjaarsoverleving van meer dan 90%, zijn goed gedifferentieerde neuro-endocriene carcinomen agressiever, met metastasen in 30 tot 50% van de gevallen en een vijfjaarsoverleving tussen 40 en 60% [1, 2, 13]. Patiënten met kwaadaardige carcinoïden vertonen een vijfjaarsoverleving van ongeveer 20% met een mediane overleving van twee jaar in aanwezigheid van levermetastasen [14-16]. De medische behandeling van metastatische ziekte omvat somatostatine-analogen, α-interferonen en chemotherapie [1, 17].
Vanwege de zeldzaamheid van deze tumoren zijn de klinische studies meestal kleinschalig, met variabele inclusiecriteria en studieopzet [ 1, 16]. In principe kan chemotherapie worden overwogen voor patiënten met progressieve ziekte onder niet-cytotoxische therapie, mits deze gepaard gaat met aanzienlijke symptomen en een slechte prognose. Doxorubicine, 5-fluorouracil (5-FU), dacarbazine, streptozotocine, cyclofosfamide, cisplatine en etoposide zijn gebruikt als afzonderlijke middelen en in combinaties die slechts gedurende korte perioden een respons van minder dan 20% opleverden, en zijn daarom niet aanbevolen voor de klinische routine [1, 3, 16-18].
In de huidige studie hebben wij de in vitro activiteit van nieuwere chemotherapeutische geneesmiddelen, waaronder gemcitabine, camptothecine, oxaliplatine en paclitaxel, getest in vergelijking met cytotoxische geneesmiddelen die momenteel voor chemotherapie worden gebruikt, met behulp van de drie permanente longcarcinoïdcellijnen UMC11, H727 en H835. Longcarcinoïden zijn nauw verwant aan kleincellige longkanker (SCLC), die voornamelijk wordt behandeld met een combinatie van cisplatine en etoposide [3,19]. Derde-generatie geneesmiddelen op basis van platina, zoals satraplatine en picoplatine, worden momenteel in klinische trials onderzocht voor SCLC en zijn misschien ook werkzaam tegen longcarcinoïden [20]. De orale prodrug satraplatine [JM216; bisacetatoammine dichlorido cyclohexylamine platinum(IV)], de actieve metabolieten JM149 [cis-ammine dichlorido (cyclohexylamine) dihydroxidoplatinum(IV)] en JM118 [cis-ammine dichlorido cyclohexylamine platinum(II)], alsmede picoplatine [JM473, ZD-0473, AMD-473; cis-ammine dichlorido 2-methylpyridine platina(II)], werden onderzocht op hun cytotoxische werking in vitro met behulp van de drie longcarcinoïde cellijnen. De werkzaamheid van de platinacomplexen zal naar verwachting verder verbeteren in combinatie met dichlooracetaat (DCA), dat gericht is tegen pyruvaatdehydrogenase kinase. Daarom werd het additieve effect van deze verbinding op de cytotoxiciteit van de platina geneesmiddelen verder onderzocht [21].
Materialen en methoden
Chemicaliën en cellijnen
Gemcitabine werd verkregen van Eli Lilly (Londen, VK), dacarbazine van Medac (Hamburg, Duitsland), oxaliplatine van Sanofi (Parijs, Frankrijk), en alle andere geneesmiddelen waren afkomstig van Sigma-Aldrich (St. Louis, MO, VS). Satraplatine en zijn metabolieten JM149 en JM118 alsmede picoplatine werden op maat gemaakt door Chiracon (Luckenwalde, Duitsland). Natrium-DCA werd bereid als 1 M voorraadoplossing. National Cancer Institute (NCI) UMC-11, H727 en H835 longcarcinoïde cellijnen werden gekocht van de American Tissue Culture Collection (ATCC, Manassas, VA, USA). De cellen werden gekweekt in RPMI-1640-medium aangevuld met 10% serum van runderfoetussen en 4 mM glutamine (Seromed, Berlijn, Duitsland). UMC-11- en H727-cellen werden gesubcultiveerd door trypsinisatie (2,5% trypsine/EDTA-oplossing, Boehringer Mannheim, Duitsland), en H835-cellen die in suspensie groeiden, werden in stand gehouden door het medium te vervangen.
Cell cycle distribution and doubling time assays
Om de cell cycle distribution te analyseren werden aliquots van de celculturen gewassen met PBS, geresuspendeerd in 100 µl PBS en gefixeerd met 1 ml 70% ethanol bij -20°C gedurende 30 min. Vervolgens werden de cellen gecentrifugeerd, gewassen met PBS en gekleurd met een oplossing van 20 µg/ml propidiumjodide (PI) in 0,5% Triton X100/PBS aangevuld met 5 µg/ml RNAse A gedurende 24 uur bij kamertemperatuur. Histogrammen werden verkregen met een FACS Scan flowcytometriesysteem (Becton Dickinson, Mountain View, CA, USA), en de celcyclusverdeling werd berekend met Multicycle AV-software (Phoenix, San Diego, CA, USA). De verdubbelingstijden van de cellijnen werden bepaald door dagelijkse metingen van het aantal cellen van drie onafhankelijke culturen gedurende zes opeenvolgende dagen met een microcellenteller (Sysmex, Tokio, Japan). H835-celclusters werden gedispergeerd door trypsinebehandeling om afzonderlijke celsuspensies voor het tellen te verkrijgen.
Celproliferatietest
De cellen werden geoogst, geteld en verdeeld over microtiterplaten in 100 µl medium bij een dichtheid van 1×104 cellen per putje. Passende verdunningen van testverbindingen werden toegevoegd tot een totaal volume van 200 µl per putje en de platen werden gedurende vier dagen onder weefselkweekomstandigheden geïncubeerd. Voorraadoplossingen van de verbindingen werden bereid in 70% ethanol of dimethylsulfoxide en meer dan 100 keer verdund voor de tests. In alle tests werden oplosmiddelcontroles opgenomen. De dosis-respons curven werden verkregen door de celproliferatie te beoordelen bij tweevoudige verdunningen van het geneesmiddel in drievoud en werden gebruikt voor de berekening van de IC50-waarden. De celgroei werd gekwantificeerd met een aangepaste tetrazoliumkleurstoftest (MTT; EZ4U, Biomedica, Wenen, Oostenrijk) en door meting van de gereduceerde formazaankleurstof bij een golflengte van 450 nm (mediumcontrole ingesteld op 100% proliferatie).
Statistische analyse
Verschillen tussen twee onafhankelijke groepen werden bepaald met behulp van ANOVA en de Mann-Whitney U-test. p<0,05 werd beschouwd als statistisch significant. Alle berekeningen werden uitgevoerd met Statistica-software (Statsoft, Tulsa, OK, USA). De verdubbelingstijden van cellijnen werden geanalyseerd met behulp van een online calculator (Roth V. 2006, verkrijgbaar bij ).
Resultaten
Celcyclusverdeling en verdubbelingstijd van de drie longcarcinoïde cellijnen
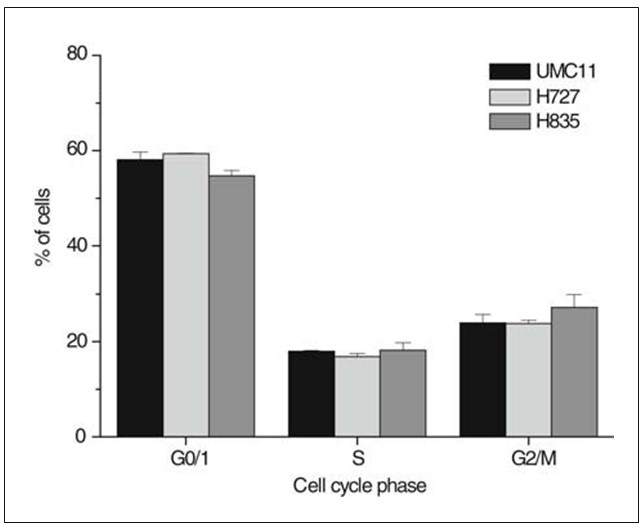
Percentages carcinoïde cellen in specifieke celcyclusfasen werden bepaald door PI-kleuring van gefixeerde cellen uit subconfluente culturen, flowcytometrische analyse en fitting van de resulterende histogrammen (Fig. 1). De cellijnen vertoonden een fractie S-fase cellen van meer dan 17% en G0/1-fracties van minder dan 54% van de totale celpopulatie. De S-fase fracties van de UMC-11, H727 en H835 carcinoïde cellijnen waren niet significant verschillend. De verdubbelingstijden van de cellijnen werden bepaald door dagelijkse telling van de cellen van zes onafhankelijke culturen en bleken respectievelijk 20,8 uur te bedragen voor H727, 27,0 uur voor UMC-11 en 35,7 uur voor H835.
Chemosensitiviteitstests met klinisch vastgestelde geneesmiddelen
De cellenwerden in vitro blootgesteld aan de afzonderlijke chemotherapeutische geneesmiddelen en de IC50-waarden werden berekend uit dosis-responsrelaties na kwantificering van de overlevende cellen door middel van MTT-tests. Alle tests werden gedurende vier dagen uitgevoerd, behalve de tests met dacarbazine gedurende zeven dagen, aangezien de actieve metaboliet (5-amino-imidazool-4-carboxamide) in vitro langzaam wordt gevormd. Tabel 1 toont de resultaten van de chemosensitiviteitstests voor 14 geneesmiddelen die tegen de drie carcinoïdecellijnen zijn getest. De IC50-waarden werden vergeleken met de volgende individuele haalbare piekplasmaconcentraties (PPC): vinblastine 8,5 ng/ml [22], taxol 3,5±1,4 µM [23], camptothecinederivaat topotecan (TPT) 65±20 nM [24], 5-FU 0,6 µM/l [25], doxorubicine 73,5±26.4 ng/ml [26], gemcitabine 50 µM [27], tamoxifen 0,4 µM [28], cisplatine 6,3 µM [29], oxaliplatine 9,1±1.25 µM [30], carboplatine 105 µM [31], mitomycine C 345±151 ng/ml [32], streptozotocine 100±10 µg/ml [33], etoposide 5,6±2,5 µg/ml [34] en dacarbazine 8,6±0,6 µg/ml [35]. UMC-11-cellen vertoonden een duidelijke chemoresistentie tegen de meeste geneesmiddelen, met uitzondering van vinblastine, camptothecine, oxaliplatine, carboplatine, mitomycine C en dacarbazine, waar de IC50-waarden voor de respectieve geneesmiddelen lager waren dan PPC. De andere twee permanente cellijnen H727 en H835 waren gevoelig voor respectievelijk 10/14 en 9/14 van de hier gebruikte geneesmiddelen. Vergeleken met de H835-cellijn was de H727-lijn, die p53 wildtype is, extra gevoelig voor dacarbazine. Alle drie de cellijnen leken een vergelijkbare gevoeligheid te hebben voor oxaliplatine en carboplatine, in tegenstelling tot hun hoge resistentie tegen cisplatine.
| Drug | Longcarcinoïdcelijn | Longcarcinoïd cellijn | Longcarcinoïde cellijn | Longcarcinoïde cellijn |
| UMC-11 (IC50) | H727 (IC50) | H835 (IC50) | PPC | |
| Vinblastine ( ng/ml) | 2.0±0.35 | 8.0±2.7 | 2.0±0.3 | 8.5 |
| Taxol (ng/ml) | 10.0±4.4 | 8.0±3.8 | 9.0±3.9 | 1.0 |
| Camptothecine (nM ) | 18.0±5.0 | 0.5±0.1 | 6.5±4.3 | (65) |
| 5-Fluorouracil (µM ) | 30.0±4.6 | 20.0±5.9 | 45.0±8.7 | 0.6 |
| Doxorubicine (nM) | 370.7±72.4 | 24.1±5.2 | 73.1± 2.4 | 73.5 |
| Gemcitabine (nM) | 833.3±103 | 30.0±6.7 | 30.0±20 | 50.0 |
| Tamoxifen (µM) | 9.0±3.3 | 25.0±8.1 | 7.0±2.4 | 0.4 |
| Cisplatine (µM) | 33.3±15 | 83.3±21 | 33.3±7.0 | 6.3 |
| Oxaliplatine (µM ) | 5.0±0.25 | 11.3±5.3 | 6.3±0.51 | 9.1 |
| Carboplatine (µM) | 36.4±7.1 | 3.4±0.4 | 35.8±9.9 | 105 |
| Mitomycine (ng/ml) | 156.0±15 | 10.0±3.0 | 35.0±9.0 | 345.0 |
| Streptozotocine (µg/ml) | 180±33 | 50±21 | 60±19 | 100 |
| Etoposide (µg/ml) | 45.0±12.3 | 0.13±0.03 | 0.25±0.02 | 5.6 |
| Dacarbazine (µg/ml) | 4.2±2.3 | 2.2±1.3 | 16.5±3.9 | 8.6 |
IC50-waarden zijn gegeven als gemiddelde±SD (n=3), en ter vergelijking worden klinische PPC getoond
Cytotoxische activiteit van platina geneesmiddelen van de derde generatie in longcarcinoïde cellijnen
De nieuwe platina geneesmiddelen satraplatine en picoplatine werden getest op cytotoxiciteit met de drie carcinoïde cellijnen in vitro. In vivo wordt satraplatine snel omgezet in JM149 en de zeer actieve metaboliet JM118, die in deze chemosensitiviteitstest werden opgenomen (fig. 2). De haalbare PPC’s waren respectievelijk 15,9 µM voor picoplatine, 1,4 µM voor satraplatine en 2,2 µM voor JM118. H835-cellen werden getest als een enkele celsuspensie of als bolvormige aggregaten met een diameter van ongeveer 150-250 µM. Uit de chemosensitiviteitstests bleek dat picoplatine en JM118 IC50-concentraties bereikten die lager waren dan hun PPC’s in respectievelijk H727- en H835-cellen. Bovendien bleek H727 gevoelig te zijn voor JM149. H835-cellen die als meercellige sferoïden waren gekweekt, waren resistenter tegen picoplatine (2,7-voudig), JM216 (7,9-voudig), JM149 (4,3-voudig) en JM118 (8,7-voudig).

Cytotoxiciteit van combinaties van op platina gebaseerde geneesmiddelen met DCA in longcarcinoïde cellijnen
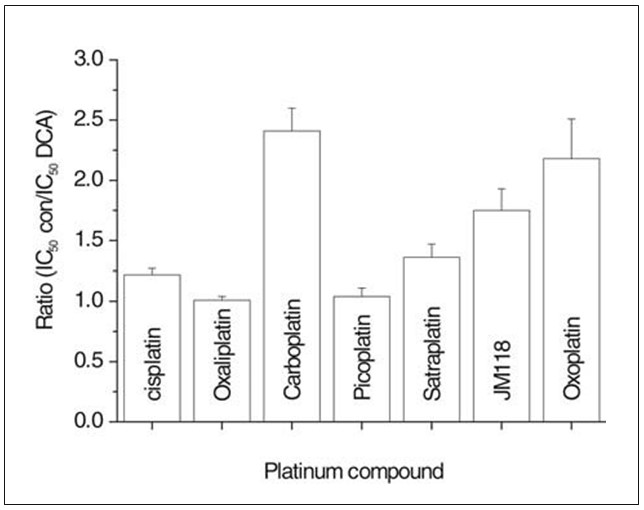
Chemosensitiviteitstests zoals hierboven beschreven werden bovendien uitgevoerd met de resistente UMC-11 cellijn in afwezigheid of in voortdurende aanwezigheid van 10 mM DCA (fig. 3). Deze concentratie van DCA verminderde de proliferatie van UMC-11 cellen met 22,2±3,2% en verlaagde IC50-waarden (sensibilisatiefactor: gemiddelde±SD van IC50 van platinaverbinding in medium alleen gedeeld door de IC50 van de respectieve platinaverbinding in medium aangevuld met 10 mM DCA; IC50 van platinaverbinding in aanwezigheid van DCA) voor carboplatine (2,41±0,19; 13,5 mM DCA).41±0,19; 13,1±0,2 µM), satraplatine (1,36±0,11; 7,8±0,4 µM), metaboliet JM118 (1,75±0,18; 1,22±0,05 µM) en oxoplatine (2,18±0,33; 4,8±0,14 µM). Cisplatine (1,22±0,9; 25,3±0,75 µM), oxaliplatine (1,01±0,03; 4,4±0,16 µM) en picoplatine (1,04±0,02; 28,6±0,6 µM) vertoonden daarentegen weinig of geen modulatie van hun cytotoxiciteit door DCA. Oxoplatine [cis, trans, cis diammine dihydroxido dichlorido platina(IV)] wordt momenteel onderzocht als oraal platinamedicijn.
Bespreking
Succesvolle behandeling van kwaadaardige carcinoïde tumoren vereist een multimodale aanpak, waaronder resectie, tumorreductie door leverarterie voor levermetastasen en systemische therapie met cytostatica en/of cytotoxische geneesmiddelen [1-3, 8]. Octreotide en verschillende langwerkende somatostatine-analogen leverden een biochemische respons op van 30-70%, maar objectieve tumorkrimp bij minder dan 10% van de patiënten [36]. Single-agent chemotherapie van carcinoïde tumoren gaf zeer lage responspercentages die niet hoger waren dan 20% voor doxorubicine monotherapie [37]. Klinische proeven met streptozotocine plus cyclofosfamide of 5-FU leverden geen significant betere respons op, variërend van 26 tot 33% [18]. Kortom, carcinoïden kunnen farmacologisch onder controle worden gehouden door behandeling met somatostatine-analogen en interferon, alsmede cytotoxische geneesmiddelen, zoals streptozotocine, dacarbazine, 5-FU, cyclofosfamide, doxorubicine gedurende langere tijd; uiteindelijk gaan de tumoren echter over in een refractaire toestand [3, 16, 38, 39].
De cytotoxiciteit van een breed scala van therapeutica werd hier getest met behulp van de drie permanente cellijnen UMC-11, H727 en H835, afgeleid van bronchopulmonale carcinoïden door Giaccone et al. [40]. H727 en H835 kunnen voornamelijk worden beschouwd als geneesmiddelengevoelige cellen met ongevoeligheid voor taxol, 5-FU, cisplatine en tamoxifen. De UMC-11 cellen daarentegen vertoonden een duidelijke chemoresistentie, met uitzondering van gevoeligheid voor dacarbazine, vinblastine, mitomycine, carboplatine en oxaliplatine. Vergelijking van de in vitro verkregen IC50-waarden van de chemotherapeutica met de klinisch haalbare PPC’s levert een ruwe schatting op van de verwachte klinische effectiviteit. De in vivo IC50-waarden van tumorcellen kunnen ofwel lager zijn bij langdurige toepassing van een geneesmiddel, ofwel hoger wanneer rekening wordt gehouden met lagere weefselconcentraties en verminderde toegankelijkheid van tumorcellen. Hoewel alle drie cellijnen een vergelijkbare S-fase-fractie vertoonden in de metingen van de celcyclusverdeling, verschilden hun verdubbeltijden en bedroegen zij respectievelijk 20,8 en 35,7 uur voor de chemosensitieve lijnen H727 en H835, en 27,0 uur voor de chemoresistente UMC-11 cellen. Volgens deze gegevens is de chemoresistentie van de drie carcinoïde cellijnen niet te wijten aan verschillen in hun S-fase fractie of verdubbelingstijden. De in vitro resultaten verkregen voor streptozotocine, dacarbazine, cisplatine, etoposide, 5-FU, doxorubicine en tamoxifen komen goed overeen met de beperkte klinische activiteit (<30% respons) van deze geneesmiddelen bij patiënten met gevorderde carcinoïden [16]. Carboplatine bleek onvoldoende werkzaam in een klinisch onderzoek met carcinoïde patiënten; het is echter niet duidelijk of een van deze patiënten carcinoïden in de voormaag had [41]. Hoge expressie van het excisieherstel kruiscomplementatie groep 1 (ERCC1) eiwit, een sleutelcomponent van het herstelmechanisme voor door platina adducten beschadigd DNA, in typische carcinoïden leek verband te houden met platina resistentie bij deze patiënten [42].
Sinds de ontwikkeling van chemotherapieregimes voor gevorderde carcinoïden op basis van streptozotocine/dacarbazine, 5-FU, cyclofosfamide of andere, zijn verscheidene nieuwe geneesmiddelen geïntroduceerd en is aangetoond dat zij een significante antikankeractiviteit bezitten bij verwante tumoren, hetzij als enkelvoudig middel, hetzij in combinatie [3, 43, 44]. Deze middelen omvatten oxaliplatine, een zeer actieve platinaverbinding, paclitaxel, een taxaan dat de polymerisatie van microtubuli aanpakt, analogen van de topoisomerase I-remmer camptothecine en de antimetaboliet gemcitabine. Paclitaxel bleek minder cytotoxisch dan vinblastine en gemcitabine, die actief waren tegen de twee gevoelige carcinoïdecellijnen. Paclitaxel werd onlangs geëvalueerd in een klinische studie met 14 patiënten met carcinoïde tumoren en negen patiënten met eilandjesceltumoren en leverde een algemene respons op van 8%, die gepaard ging met aanzienlijke hematologische toxiciteit [45]. De zeer actieve moederverbinding camptothecine (CPT) werd niet meer klinisch gebruikt vanwege de hoge lokale toxiciteit bij intraveneuze toepassing, maar wordt momenteel opnieuw geëvalueerd in nieuwe formuleringen. Twee gevestigde derivaten, namelijk CPT-11 (irinotecan) en topotecan, werden gewijzigd om een hogere oplosbaarheid in water te verkrijgen en er werd aangetoond dat zij klinische activiteit vertonen bij een groot aantal tumoren [46]. De bereikbare PPC’s van ongeveer 65 nM voor topotecan en >70 nM voor de actieve metaboliet van CPT-11, SN38, liggen in hetzelfde bereik als de IC50-waarde verkregen voor CPT [32, 47]. Een verslag van chemoresistentie in primaire culturen van typische carcinoïden vond een relatief hoge gevoeligheid voor 5-FU, doxorubicine, etoposide en dacarbazine, maar een hoge resistentie tegen cisplatine, gemcitabine, vinblastine en carboplatine [48]. Slechts zes van de 60 geteste tumormonsters waren echter voordarmcarcinoïden en niet elk middel werd op elk tumormonster toegepast. Daarom kunnen longcarcinoïden een ander chemosensitiviteitspatroon vertonen dan midden- en achterdarmtumoren, zoals in deze studie is gevonden.
Uit onze resultaten blijkt dat oxaliplatine cytotoxisch is tegen alle drie de carcinoïdcellijnen, inclusief UMC-11 cellen, die een brede resistentie tegen geneesmiddelen vertonen. Bovendien werd klinische respons op cisplatine gemeld voor één carcinoïde patiënt [49]. De nieuwe platinacomplexen satraplatine en picoplatine zijn tot dusver niet getest bij carcinoïdpatiënten, maar vertoonden veelbelovende klinische activiteit in longkankerproeven [20, 50]. UMC-11 cellen zijn ongevoelig voor picoplatine. JM118, de zeer actieve metaboliet van satraplatine, vertoonde significante cytotoxiciteit tegen alle drie de longcarcinoïde cellijnen. De gevoeligheid voor de nieuwe platinaverbindingen is duidelijk minder in sferoïden van H835-cellen dan in suspensies van afzonderlijke cellen en hangt af van de molecuulgrootte en de lipofiliteit van het desbetreffende geneesmiddel. Daarom kunnen de beperkte toegang van de chemotherapeutica tot carcinoïde cellen en de daaruit voortvloeiende ontoereikende geneesmiddelenniveaus in verband worden gebracht met geneesmiddelenresistentie in carcinoïde tumoren in vivo [49].
Brede resistentie tegen cytotoxische geneesmiddelen kan worden toegeschreven aan verhoogde onderdrukking van apoptotische tumorceldood via veranderingen in de kenmerken van mitochondriën [51]. Het metabolisme van de meeste vaste tumoren bestaat uit aërobe glycolyse (Warburg-effect), en onder deze omstandigheden slagen mitochondriën er niet in essentiële proapoptotische factoren te leveren. DCA is een oraal beschikbare kleine molecule remmer van het pyruvaat dehydrogenase kinase die de flux van pyruvaat naar de mitochondria verhoogt en daardoor glucose-oxidatie bevoordeelt boven glycolyse [52]. Dit keert de onderdrukte mitochondriale apoptose bij kanker om en resulteert in remming van de tumorgroei in vitro en in vivo voor borst-, prostaat- en endometriumkanker [53]. Naast de cellulaire effecten van DCA alleen kan het ook de celdood versterken wanneer het gecombineerd wordt met cytotoxische geneesmiddelen. DCA had geen additief effect bij de twee niet-kleincellige longkankercellijnen A549 en H719 met paclitaxel, etoposide of cisplatine. Mitaplatine, een verbinding waarbij twee DCA-moleculen werden toegevoegd aan de axiale posities van een zescoordinaat Pt(IV)-centrum, vertoonde echter veelbelovende activiteit [54, 55]. Onze resultaten tonen aan dat DCA de groei van de chemoresistente UMC-11-cellijn remt en de cellen gevoelig maakt voor carboplatine, JM118 en oxoplatine bij concentraties die in vivo kunnen worden bereikt [56]. Het mechanisme van deze selectiviteit van DCA voor specifieke platinaverbindingen moet nog worden opgehelderd. Geconcludeerd kan worden dat platinacomplexen zoals oxaliplatine, carboplatine en satraplatine potentieel hebben voor de behandeling van longcarcinoïden, en dat de door DCA geïnduceerde sensibilisering van de tumorcellen voor geselecteerde platina-medicijnen breder toepasbaar kan zijn in de cytotoxische chemotherapie.
Erkenning
Wij willen Dr. Z. Salama bedanken voor het verstrekken van platina complexen en nuttige discussies. Dit project werd ondersteund door een subsidie van de Oostenrijkse Nationale Bank (# 13345) aan Dr. K. Geissler. Dr. W. Fiebiger en Dr. U. Olszewski PhD hebben in gelijke mate bijgedragen aan deze studie.
Belangenverstrengeling
De auteurs verklaren dat zij geen belangenconflict hebben met betrekking tot de publicatie van dit manuscript.
VERWIJZINGEN
1 Öberg K (2003) Diagnose en behandeling van carcinoïde tumoren. Expert Rev Anticancer Ther 3:863-8772 Modlin IM, Kidd M, Latich I et al (2005) Current status of gastrointestinal carcinoids. Gastro-enterologie 128:1717-1751
3 Pinchot SN, Holen K, Sippel RS, Chen H (2008) Carcinoïde tumoren. Oncoloog 13:1255-1269
4 Zuetenhorst JM, Taal BG (2005) Metastatische carcinoïde tumoren: een klinisch overzicht. Oncoloog 10:123-131
5 Granberg D, Oberg K (2005) Neuro-endocriene tumoren. Cancer Chemother Biol Response Modif 22:471-483
6 Capella C, Heitz PU, Hofler H et al (1995) Revised classification of neuroendocrine tumors of the lung, pancreas and gut. Virchows Arch 425:547-560
7 Warren WH, Gould VE, Faber LP et al (1985) Neuro-endocrine neoplasms of the bronchopulmonary tract: a classification of the spectrum of carcinoid to small cell carcinoma and intervening variants. J Thorac Cardiovasc Surg 89:819-825
8 Plockinger U, Rindi G, Arnold R et al (2004) European Neuroendocrine Tumor Society: guidelines for the diagnosis and treatment of neuroendocrine gastrointestinal tumours. Een consensusverklaring namens de European Neuroendocrine Tumor Society (ENETS). Neuroendocrinologie 80:394-424
9 Öberg K, Eriksson B (2005) Nucleaire geneeskunde bij de detectie, stadiëring en behandeling van gastro-intestinale carcinoïde tumoren. Best Pract Res Clin Endocrinol Metab 19:265-276
10 Dousset B, Saint-Marc O, Pitre J et al (1996) Metastatische endocriene tumoren: medische behandeling, chirurgische resectie en levertransplantatie. World J Surg 20:908-915
11 Raderer M, Kurtaran A, Leimer M et al (2000) Value of peptide receptor scintigraphy using (123) I-vasoactive intestinal peptide and (111)In-DTPAD-Phe1-octreotide in 194 carcinoid patients: Universiteit van Wenen, 1993-1998. J Clin Oncol 18:1331-1336
12 Smolle-Juttner FM, Popper H, Klemen H et al (1993) Clinical features and therapy of “typical” and “atypical” bronchial carcinoid tumors (grade 1 and grade 2 neuroendocrine carcinoma). Eur J Cardiothorac Surg 7:121-125
13 Marty-Ane CH, Costes V, Pujol JL et al (1995) Carcinoïde tumoren van de long: vereisen atypische kenmerken een agressieve behandeling? Ann Thorac Surg 59:78-83
14 Moertel CG, Sauer WG, Dockerty MB, Baggenstoss AH (1961) Life history of the carcinoid tumor of the small intestine. Kanker 14:901-912
15 Goodwin JD (1975) Carcinoïde tumoren: een analyse van 2837 gevallen. Kanker 36:560-569
16 Bertino EM, Confer PD, Colonna JE et al (2009) Pulmonale neuro-endocriene/carcinoïde tumoren: een overzichtsartikel. Kanker 115:4434-4441
17 Moertel CG (1983) Treatment of the carcinoid tumor and the malignant carcinoid syndrome. J Clin Oncol 1:727-740
18 Sun W, Lipsitz S, Catalano P et al (2005) Phase II/III Study of doxorubicin with fluorouracil compared with streptozocin with fluorouracil or dacarbazine in the treatment of advanced carcinoid tumors: Eastern Cooperative Oncology Group Studie E1281. J Clin Oncol 23:4897-4904
19 Dowell JE (2010) Kleincellige longkanker: boeken we vooruitgang? Am J Med Sci 339:68-76
20 Shah N, Dizon DS (2009) Nieuwe generatie platinamiddelen voor vaste tumoren. Toekomstige Oncol 5:33-42
21 Dhar S, Lippard SJ (2009) Mitaplatine, een krachtige fusie van cisplatine en het weesgeneesmiddel dichlooracetaat. Proc Natl Acad Sci U S A 106:22199-22204
22 Chong CD, Logothetis CJ, Savaraj N et al (1988) The correlation of vinblastine pharmacokinetics to toxicity in testicular cancer patients. J Clin Pharmacol 28:714-718
23 Rowinsky EK, Burke PJ, Karp JE et al (1989) Phase I and pharmacodynamic study of taxol in refractory acute leukemias. Cancer Res 49:4640-4647
24 Dennis MJ, Beijnen JH, Grochow LB, van Warderdam LJC (1997) Een overzicht van de klinische farmacologie van topotecan. Semin Oncol 24:12-18S
25 Ho DH, Pazdur R, Covington W et al (1998) Comparison of 5-fluorouracil pharmacokinetics in patients receiving continuous 5-fluorouracil infusion and oral uracil plus N1-(2′-tetrahydrofuryl)-5-fluorouracil. Klinisch kankeronderzoek 4:2085-2088
26 Wihlm J, Limacher JM, Leveque D et al (1997) Pharmacokinetic profile of high-dose doxorubicin administered during a 6 h intravenous infusion in breast cancer patients. Bull Kanker 84:603-608
27 Touroutoglou N, Gravel D, Raber MN et al (1998) Clinical results of a pharmacodynamically-based strategy for higher dosing of gemcitabine in patients with solid tumors. Ann Oncol 9:1003-1008
28 Kivisto KT, Villikka K, Nyman L et al (1998) Tamoxifen- en toremifeenconcentraties in plasma worden sterk verlaagd door rifampicine. Clin Pharmacol Ther 64:648-654
29 Bonetti A, Franceschi T, Apostoli P et al (1995) Cisplatin pharmacokinetics using a five-day schedule during repeated courses of chemotherapy in germ cell tumors. Ther Drug Monit 17:25-32
30 Graham MA, Lockwood GF, Greenslade D et al (2000) Clinical pharmacokinetics of oxaliplatin: a critical review. Klinisch kankeronderzoek 6:1205-1218
31 Oguri S, Sakakibara T, Mase H et al (1988) Clinical pharmacokinetics of carboplatin. J Clin Pharmacol 28:208-215
32 Schilcher RB, Young JD, Ratanatharathorn V et al (1984) Clinical pharmacokinetics of highdose mitomycin C. Cancer Chemother Pharmacol 13:186-190
33 Adolphe AB, Glasofer ED, Troetel WM et al (1975) Fate of streptozotocin (NSC-85998) in patients with advanced cancer. Cancer Chemother Rep 9:547-556
34 Hande K, Messenger M, Wagner J et al (1999) Inter- and intrapatient variability in etoposide kinetics with oral and intravenous drug application. Clin Cancer Res 5:2742-2747
35 Chabot GG, Flaherty LE, Valdivieso M, Baker LH (1990) Alteration of DTIC pharmacokinetics after interleukin-2 administration in melanoma patients. Cancer Chemother Pharmacol 27:157-160
36 Kvols LK, Moertel CG, O’Connell MJ et al (1986) Treatment of the malignant carcinoid evaluation of a long-acting somatostatin analog. N Engl J Med 315:663-666
37 Engstrom PF, Lavin PT, Moertel CG et al (1984) Streptozotocin plus fluorouracil versus doxorubicine therapie voor gemetastaseerde carcinoïde tumor. J Clin Oncol 8:865-890
38 Vilar E, Salazar R, Pérez-García J et al (2007) Chemotherapie en de rol van de proliferatiemarker Ki-67 in digestieve neuro-endocriene tumoren. Endocr Relat Cancer 14:221-23
39 García-Yuste M, Matilla JM, Cueto A et al (2007) Typische en atypische carcinoïde tumoren: analyse van de ervaring van de Spaanse Multi-centric Study of Neuroendocrine Tumours of the Lung. Eur J Cardiothorac Surg 31:192-197
40 Giaccone G, Battey J, Gazdar AF et al (1992) Neuromedine B is aanwezig in longkankercellijnen. Cancer Res 52:2732s-2736s
41 Saltz L, Lauwers G, Wiseberg J, Kelsen D (1993) A phase II trial of carboplatin in patients with advanced APUD tumors. Kanker 72:619-622
42 Skov BG, Holm B, Erreboe A et al (2010) ERCC1 en Ki67 in kleincellig longcarcinoom en andere neuro-endocriene tumoren van de long: distributie en impact op overleving. J Thorac Oncol 5:453-459
43 Kelly K (2000) Nieuwe chemotherapiemiddelen voor kleincellige longkanker. Chest 117:156-162S
44 Teicher BA (2008) Nieuwere cytotoxische middelen: kanker breed aanpakken. Clin Cancer Res 14:1610-1617
45 Ansell SM, Pitot HC, Burch PA et al (2001) A phase II study of high-dose paclitaxel in patients with advanced neuroendocrine tumors. Kanker 91:1543-1548
46 Iyer L, Ratain MJ (1998) Clinical pharmacology of camptothecins. Cancer Chemother Pharmacol 42:S31-S43
47 Catimel G, Chabot GG, Guastalla JP et al (1995) Phase I and pharmacokinetic study of irinotecan (CPT-11) administered daily for three consecutive days every three weeks in patients with advanced solid tumors. Ann Oncol 6:133-140
48 Lyons JM 3rd, Abergel J, Thomson JL et al (2009) In vitro chemoresistentietests in goed gedifferentieerde carcinoïde tumoren. Ann Surg Oncol 16:649-655
49 Porter AT, Ostrowski MJ (1988) Succesvolle behandeling van kwaadaardige carcinoïde tumor met intraveneus cisplatina. Eur J Surg Oncol 14:703-704
50 Olszewski U, Hamilton G (2010) Komt er nog een beter antikankermedicijn op basis van platina? Antikankermiddelen Med Chem 10:293-301
51 Wasilewski M, Scorrano L (2009) The changing shape of mitochondrial apoptosis. Trends Endocrinol Metab 20:287-294
52 Michelakis ED, Webster L, Mackey JR (2008) Dichloroacetate (DCA) als potentiële metabolictargeting therapie voor kanker. Br J Cancer 99:989-994
53 Sun RC, Fadia M, Dahlstrom JE et al (2010) Reversal of the glycolytic phenotype by dichloroacetate inhibits metastatic breast cancer cell growth in vitro and in vivo. Breast Cancer Res Treat 120:253-260
54 Otterson GA, Wang L, Wu X et al (2008) Effect van dichlooracetaat in combinatie met chemotherapie op menselijke longkankercellen. J Clin Oncol 26S:14637
55 Dhar S, Lippard SJ (2009) Mitaplatin, een krachtige fusie van cisplatine en het weesgeneesmiddel dichlooracetaat. Proc Natl Acad Sci U S A 106:22199-22204
56 Li T, Schultz I, Keys DA et al (2008) Quantitative evaluation of dichloroacetic acid kinetics in human: a physiologically based pharmacokinetic modeling investigation. Toxicologie 245: 35-48