Вольфганг Фибигер1, Ульрике Ольшевски2, Эрнст Ульспергер2, Клаус Гайслер2, Герхард Гамильтон2,3
1 Отделение внутренней медицины I, отделение онкологии, больница Санкт-Поэльтен, Санкт-Поэльтен, Австрия
2 Ludwig Boltzmann Cluster of Translational Oncology, C/o Balderichgasse, 26/13, 1170 Vienna, Austria
e-mail: [email protected]
Гамильтон
3 Кафедра хирургии, Медицинский университет Вены, Вена, Австрия
Получено: 1 апреля 2010 г.
Принято: 6 июня 2010 г
Аннотация
Введение: Химиотерапия распространенных хорошо дифференцированных карциноидов характеризуется низкой частотой ответов и короткой продолжительностью ответов. Целью настоящего исследования была оценка in vitro активности новых химиотерапевтических препаратов на основе платины в комбинации с дихлорацетатом (DCA), сенсибилизатором апоптоза, против клеточных линий карциноида легкого.
Методы: Три постоянные клеточные линии (UMC-11, H727 и H835) подвергались воздействию 14 различных известных цитотоксических препаратов и новых соединений на основе платины, таких как сатраплатин, JM118 и пикоплатин в сочетании с DCA, а жизнеспособность клеток измерялась с помощью анализа на основе тетразолиевого красителя.
Результаты: За исключением высоко химиорезистентной линии UMC- 11, линии карциноидных клеток (H727, H835) были чувствительны к большинству химиотерапевтических препаратов in vitro. Среди препаратов на основе платины наибольшую эффективность показали карбоплатин и оксалиплатин. Клетки H835, растущие в виде многоклеточных сфероидов, были в 2,7-8,7 раза более устойчивы к пикоплатину, сатраплатину и его метаболитам по сравнению с суспензией одиночных клеток. DCA (10 мМ) подавлял рост клеток UMC- 11 на 22% и сенсибилизировал эти высокоустойчивые клетки к карбоплатину, сатраплатину и JM118 в 1,4-2,4 раза.
Выводы: Высокоустойчивые карциноидные клетки легких UMC-11 чувствительны к карбоплатину, оксалиплатину и метаболиту сатраплатина JM118, но многоклеточный сфероидный рост, наблюдаемый в клеточной линии H835 и легочных опухолях, по-видимому, заметно повышает химиорезистентность. Активность карбоплатина и JM118 значительно и специфически повышается в сочетании с сенсибилизатором апоптоза DCA, который стимулирует митохондриальное дыхание над аэробным гликолизом. Таким образом, среди новых препаратов платины сатраплатин имеет потенциал для лечения карциноидов легких, а DCA потенцирует цитотоксичность отдельных препаратов платины.
Ключевые слова: Карциноид; химиочувствительность; лекарственная устойчивость; платиновый комплекс; пикоплатин; сатраплатин; дихлорацетат
ВВЕДЕНИЕ
Карциноиды происходят из энтерохромаффинных клеток нейроэндокринной клеточной системы, которая широко распространена в организме [1-3]. Эти довольно редкие опухоли встречаются с частотой 2,0-2,5 случая на 100 000 человек для клинически заметных карциноидов [4]. Карциноиды передней кишки составляют 20% всех карциноидных опухолей и включают карциноиды тимика и легкого (составляющие 2% первичных раков легкого) в дополнение к карциноидам желудка и двенадцатиперстной кишки [5]. По своим гистологическим характеристикам эти гетерогенные опухоли классифицируются либо как хорошо дифференцированные нейроэндокринные опухоли с мелкими клетками и правильными ядрами (типичный карциноид), либо как хорошо дифференцированные нейроэндокринные карциномы с ядерной атипией и некротическими участками (атипичный карциноид) [6, 7]. Карциноидный синдром», который индуцируется секрецией вазоактивных веществ, встречается менее чем в 5% легочных карциноидов [8]. От 13 до 22% пациентов имеют отдаленные метастазы на момент презентации [4]. Первичные диагностические процедуры включают биохимическое тестирование, в частности анализ серотонина и мочевой 5-гидроксииндолуксусной кислоты (5-HIAA). Наиболее чувствительным методом локализации опухолей является сцинтиграфия рецепторов соматостатина, дополненная КТ для визуализации метастазов в печени и сопутствующей биопсией для гистопатологической верификации [9]. Поскольку более 80% карциноидных опухолей экспрессируют рецептор соматостатина 2-го типа, 111-индий-ДТПА-октреотидв качестве трассера может быть способен предсказать полезность предстоящей терапии аналогами соматостатина [10, 11].
Хирургическое излечение пациентов с карциноидом легкого может быть достигнуто путем резекции, однако часть опухолей дает распространенные метастазы в течение двух-четырех лет после первичной операции [12]. В отличие от более индолентных хорошо дифференцированных нейроэндокринных опухолей, дающих метастазы менее чем в 15% случаев и имеющих пятилетнюю выживаемость более 90%, хорошо дифференцированные нейроэндокринные карциномы более агрессивны, с метастазами в 30-50% случаев и пятилетней выживаемостью от 40 до 60% [1, 2, 13]. У пациентов со злокачественными карциноидами пятилетняя выживаемость составляет около 20% с медианой выживаемости два года при наличии метастазов в печени [14-16]. Медикаментозное лечение метастатической болезни включает аналоги соматостатина, α-интерфероны и химиотерапию [1, 17].
Клинические исследования обычно небольшие с различными критериями включения и дизайном исследования из-за редкости этих опухолей [1, 16]. В принципе, химиотерапия может быть рассмотрена для пациентов с прогрессирующим заболеванием при нецитотоксической терапии, при условии, что она связана со значительными симптомами и плохим прогнозом. Доксорубицин, 5-фторурацил (5-ФУ), дакарбазин, стрептозотоцин, циклофосфамид, цисплатин и этопозид использовались как отдельные агенты и в комбинациях, приводящих к частоте ответов менее 20% только в течение короткого периода времени, и поэтому не были рекомендованы для клинической рутинной практики [1, 3, 16-18].
В настоящем исследовании мы проверили in vitro активность новых химиотерапевтических препаратов, включая гемцитабин, камптотецин, оксалиплатин и паклитаксел, в сравнении с цитотоксическими препаратами, используемыми в настоящее время для химиотерапии, на трех постоянных клеточных линиях карциноида легкого UMC11, H727 и H835. Карциноиды легких тесно связаны с мелкоклеточным раком легких (МКРЛ), который в основном лечится комбинацией цисплатина и этопозида [3,19]. Препараты третьего поколения на основе платины, такие как сатраплатин и пикоплатин, в настоящее время исследуются в клинических испытаниях для лечения СКЛК и, возможно, также активны в отношении карциноидов легких [20]. Поэтому пероральное пролекарство сатраплатина [JM216; бисацетатоаммин дихлоридо циклогексиламин платина(IV)], его активные метаболиты JM149 [цис-аммин дихлоридо (циклогексиламин) дигидроксидоплатина(IV)] и JM118 [цис-аммин дихлоридо циклогексиламин платина(II)], а также пикоплатин [JM473, ZD-0473, AMD-473; цис-аммин дихлоридо 2-метилпиридиновая платина(II)], были изучены на их цитотоксическую эффективность in vitro с использованием трех клеточных линий карциноидных клеток легких. Ожидается, что эффективность платиновых комплексов будет еще больше повышена в комбинации с дихлорацетатом (DCA), который нацелен на киназу пируватдегидрогеназы. Таким образом, аддитивный эффект этого соединения на цитотоксичность препаратов платины был дополнительно исследован [21].
Материалы и методы
Химические вещества и клеточные линии
Гемцитабин был получен от Eli Lilly (Лондон, Великобритания), дакарбазин — от Medac (Гамбург, Германия), оксалиплатин — от Sanofi (Париж, Франция), а все остальные препараты — от Sigma-Aldrich (Сент-Луис, МО, США). Сатраплатин и его метаболиты JM149 и JM118, а также пикоплатин были синтезированы на заказ компанией Chiracon (Luckenwalde, Германия). Натрий DCA был приготовлен в виде 1 М исходного раствора. Линии легочных карциноидных клеток UMC-11, H727 и H835 Национального института рака (NCI) были приобретены в Американской коллекции культур тканей (ATCC, Манассас, штат Вирджиния, США). Клетки культивировали в среде RPMI-1640, дополненной 10% фетальной бычьей сывороткой и 4 мМ глутамина (Seromed, Берлин, Германия). Клетки UMC-11 и H727 субкультивировали путем трипсинизации (2,5% раствор трипсина/EDTA, Boehringer Mannheim, Германия), а клетки H835, растущие в суспензии, поддерживали путем замены среды.
Распределение клеточного цикла и анализ времени удвоения
Для анализа распределения клеточного цикла аликвоты клеточных культур промывали PBS, ресуспендировали в 100 мкл PBS и фиксировали 1 мл 70% этанола при -20°C в течение 30 мин. Затем клетки центрифугировали, промывали PBS и окрашивали раствором 20 мкг/мл йодистого пропидия (PI) в 0,5% Triton X100/PBS, дополненным 5 мкг/мл РНКазы А в течение 24 ч при комнатной температуре. Гистограммы получали с помощью системы проточной цитометрии FACS Scan (Becton Dickinson, Mountain View, CA, США), а распределение клеточного цикла рассчитывали с помощью программного обеспечения Multicycle AV (Phoenix, San Diego, CA, США). Время удвоения клеточных линий определяли путем ежедневного измерения количества клеток в трех независимых культурах в течение шести последовательных дней с помощью микроцеллконтрастного счетчика (Sysmex, Токио, Япония). Скопления клеток H835 рассеивали путем обработки трипсином для получения суспензии отдельных клеток для подсчета.
Анализ пролиферации клеток
Клетки собирали, подсчитывали и распределяли в микротитровальные планшеты в 100 мкл среды при плотности 1×104 клеток/лунку. Соответствующие разведения тестируемых соединений добавляли в общий объем 200 мкл/лунку, и планшеты инкубировали в условиях культуры ткани в течение четырех дней. Стоковые растворы соединений готовили в 70% этаноле или диметилсульфоксиде и разбавляли более чем в 100 раз для проведения анализов. Во все анализы были включены контрольные растворы. Кривые доза-ответ получали путем оценки пролиферации клеток при двукратном разведении препарата в трех экземплярах и использовали для расчета значений IC50. Рост клеток оценивали количественно с помощью модифицированного тетразолиевого красителя (МТТ; EZ4U, Biomedica, Вена, Австрия) и путем измерения восстановленного формазанового красителя при длине волны 450 нм (контроль среды установлен на 100% пролиферацию).
Статистический анализ
Различия между двумя независимыми группами определяли с помощью ANOVA и U-теста Манна-Уитни. p<0,05 считалось статистически значимым. Все расчеты проводились с использованием программного обеспечения Statistica (Statsoft, Tulsa, OK, USA). Время удвоения клеточных линий анализировали с помощью онлайн-калькулятора (Roth V. 2006, доступно на сайте ).
Результаты
Распределение клеточного цикла и время удвоения трех линий карциноидных клеток легких
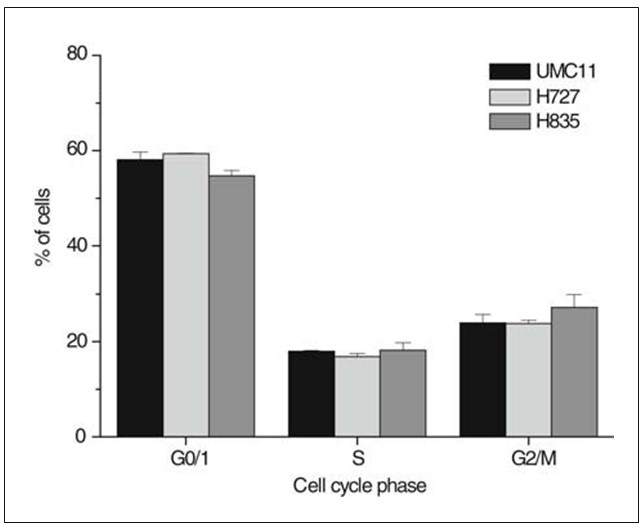
Процентное содержание карциноидных клеток в определенных фазах клеточного цикла определяли путем окрашивания PI фиксированных клеток, полученных из субконфлюентных культур, проточного цитометрического анализа и подгонки полученных гистограмм под кривые (рис. 1). В клеточных линиях доля клеток S-фазы превышала 17%, а доля G0/1 — менее 54% от общей популяции клеток, соответственно. Фракции S-фазы карциноидных клеточных линий UMC-11, H727 и H835 существенно не отличались. Время удвоения клеточных линий было определено путем ежедневного подсчета клеток из шести независимых культур и составило 20,8 ч для H727, 27,0 ч для UMC-11 и 35,7 ч для H835, соответственно.
Тесты на химиочувствительность с использованием клинически известных препаратов
Клетки подвергались воздействию отдельных химиотерапевтических препаратов in vitro, а значения IC50 рассчитывались по зависимости доза-ответ после количественной оценки выживших клеток с помощью МТТ-теста. Все тесты проводились в течение четырех дней, за исключением тестов с дакарбазином в течение семи дней, поскольку активный метаболит (5-аминоимидазол-4-карбоксамид) медленно образуется in vitro. В таблице 1 представлены результаты анализа химиочувствительности 14 препаратов, протестированных против трех линий карциноидных клеток. Значения IC50 сравнивались со следующими индивидуальными достижимыми пиковыми концентрациями в плазме (PPC): винбластин 8,5 нг/мл [22], таксол 3,5±1,4 мкМ [23], производное камптотецина топотекан (TPT) 65±20 нМ [24], 5-ФУ 0,6 мкМ/л [25], доксорубицин 73,5±26.4 нг/мл [26], гемцитабин 50 мкМ [27], тамоксифен 0,4 мкМ [28], цисплатин 6,3 мкМ [29], оксалиплатин 9,1±1.25 мкМ [30], карбоплатин 105 мкМ [31], митомицин С 345±151 нг/мл [32], стрептозотоцин 100±10 мкг/мл [33], этопозид 5,6±2,5 мкг/мл [34] и дакарбазин 8,6±0,6 мкг/мл [35]. Клетки UMC-11 проявили выраженную химиорезистентность против большинства препаратов, за исключением винбластина, камптотецина, оксалиплатина, карбоплатина, митомицина С и дакарбазина, где значения IC50 были ниже PPC для соответствующих препаратов. Две другие постоянные клеточные линии H727 и H835 были чувствительны к 10/14 и 9/14, соответственно, использованных здесь препаратов. По сравнению с клеточной линией H835, линия H727, которая является p53 дикого типа, была дополнительно чувствительна к дакарбазину. Все три клеточные линии имели сходную чувствительность к оксалиплатину и карбоплатину в отличие от высокой устойчивости к цисплатину.
| Лекарство | Карциноидная клеточная линия легкого | Карциноидная клеточная линия легкого | Линия клеток карциноида легкого | Карциноидная клеточная линия легких |
| UMC-11 (IC50) | H727 (IC50) | H835 (IC50) | PPC | |
| Винбластин (нг/мл) | 2.0±0.35 | 8.0±2.7 | 2.0±0.3 | 8.5 |
| Таксол (нг/мл) | 10.0±4.4 | 8.0±3.8 | 9.0±3.9 | 1.0 |
| Камптотецин (нМ ) | 18.0±5.0 | 0.5±0.1 | 6.5±4.3 | (65) |
| 5-Флуороурацил (мкМ ) | 30.0±4.6 | 20.0±5.9 | 45.0±8.7 | 0.6 |
| Доксорубицин (нМ) | 370.7±72.4 | 24.1±5.2 | 73.1± 2.4 | 73.5 |
| Гемцитабин (нМ) | 833.3±103 | 30.0±6.7 | 30.0±20 | 50.0 |
| Тамоксифен (мкМ) | 9.0±3.3 | 25.0±8.1 | 7.0±2.4 | 0.4 |
| Цисплатин (мкМ) | 33.3±15 | 83.3±21 | 33.3±7.0 | 6.3 |
| Оксалиплатин (мкМ ) | 5.0±0.25 | 11.3±5.3 | 6.3±0.51 | 9.1 |
| Карбоплатин (мкМ) | 36.4±7.1 | 3.4±0.4 | 35.8±9.9 | 105 |
| Митомицин (нг/мл) | 156.0±15 | 10.0±3.0 | 35.0±9.0 | 345.0 |
| Стрептозотоцин (мкг/мл) | 180±33 | 50±21 | 60±19 | 100 |
| Этопозид (мкг/мл) | 45.0±12.3 | 0.13±0.03 | 0.25±0.02 | 5.6 |
| Дакарбазин (мкг/мл) | 4.2±2.3 | 2.2±1.3 | 16.5±3.9 | 8.6 |
Значения IC50 приведены как среднее±SD (n=3), для сравнения показаны клинические PPC
Цитотоксическая активность препаратов платины третьего поколения в клеточных линиях карциноида легких
Новые препараты на основе платины сатраплатин и пикоплатин были протестированы на цитотоксичность с использованием трех клеточных линий карциноида in vitro. In vivo сатраплатин быстро преобразуется в JM149 и высокоактивный метаболит JM118, которые были включены в данный анализ химиочувствительности (рис. 2). Достижимые PPC составляли 15,9 мкМ для пикоплатина, 1,4 мкМ для сатраплатина и 2,2 мкМ для JM118, соответственно. Клетки H835 тестировались либо в виде суспензии отдельных клеток, либо в виде шаровидных агрегатов диаметром приблизительно 150-250 мкм. Тесты на химиочувствительность показали, что пикоплатин и JM118 достигли концентраций IC50 ниже их PPC в клетках H727 и H835, соответственно. Кроме того, H727 оказалась чувствительной к JM149. Клетки H835, выращенные в виде многоклеточных сфероидов, были более устойчивы к пикоплатину (в 2,7 раза), JM216 (в 7,9 раза), JM149 (в 4,3 раза) и JM118 (в 8,7 раза).

Цитотоксичность комбинаций препаратов на основе платины с DCA в клеточных линиях карциноидных клеток легких
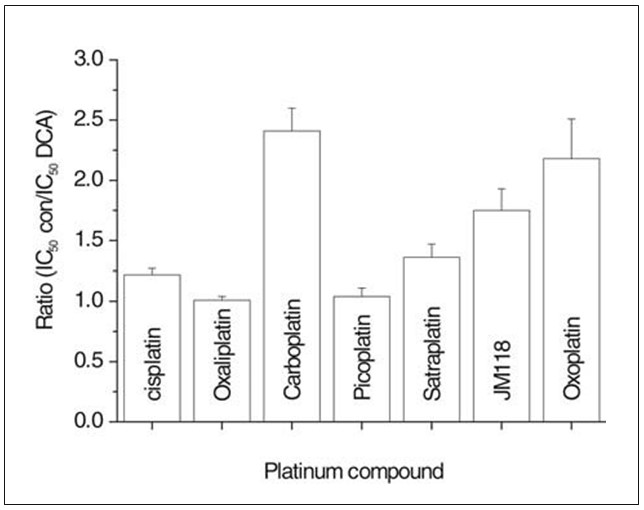
Анализы хемочувствительности, описанные выше, были дополнительно проведены с использованием устойчивой клеточной линии UMC-11 либо в отсутствии, либо в постоянном присутствии 10 мМ DCA (рис. 3). Эта концентрация DCA уменьшила пролиферацию клеток UMC-11 на 22,2±3,2% и снизила значения IC50 (коэффициент сенсибилизации: среднее ±SD значение IC50 платинового соединения только в среде, деленное на IC50 соответствующего платинового соединения в среде, дополненной 10 мМ DCA; IC50 платинового соединения в присутствии DCA) для карбоплатина (2.41±0,19; 13,1±0,2 мкМ), сатраплатина (1,36±0,11; 7,8±0,4 мкМ), метаболита JM118 (1,75±0,18; 1,22±0,05 мкМ) и оксоплатина (2,18±0,33; 4,8±0,14 мкМ). Напротив, цисплатин (1,22±0,9; 25,3±0,75 мкМ), оксалиплатин (1,01±0,03; 4,4±0,16 мкМ) и пикоплатин (1,04±0,02; 28,6±0,6 мкМ) показали низкую или отсутствующую модуляцию своей цитотоксичности под действием DCA. Оксоплатин [цис, транс, цис диаммин дигидроксидо дихлоридо платины(IV)] в настоящее время исследуется в качестве перорального препарата платины.
Обсуждение
Успешное лечение злокачественных карциноидных опухолей требует мультимодального подхода, включающего резекцию, уменьшение опухоли путем перевязки печеночной артерии при метастазах в печень и системную терапию с использованием цитостатических и/или цитотоксических препаратов [1-3, 8]. Октреотид и различные аналоги соматостатина длительного действия обеспечили частоту биохимического ответа в диапазоне 30-70%, но объективное уменьшение опухоли наблюдалось менее чем у 10% пациентов [36]. Одноагентная химиотерапия карциноидных опухолей дала очень низкие показатели ответа, которые не превышали 20% при монотерапии доксорубицином [37]. Клинические испытания, включающие стрептозотоцин плюс циклофосфамид или 5-ФУ, не дали значительно лучших показателей ответа — от 26 до 33% [18]. В целом, карциноиды можно фармакологически контролировать путем лечения аналогами соматостатина и интерфероном, а также цитотоксическими препаратами, такими как стрептозотоцин, дакарбазин, 5-ФУ, циклофосфамид, доксорубицин в течение длительного времени; однако в конечном итоге опухоли прогрессируют до рефрактерного состояния [3, 16, 38, 39].
Цитотоксичность широкого спектра терапевтических препаратов была протестирована здесь с использованием трех постоянных клеточных линий UMC-11, H727 и H835, полученных из бронхопульмональных карциноидов Giaccone et al. [40]. H727 и H835 можно рассматривать в основном как чувствительные к лекарственным препаратам клетки с нечувствительностью к таксолу, 5-FU, цисплатину и тамоксифену. Напротив, клетки UMC-11 демонстрировали выраженную химиорезистентность, за исключением чувствительности к дакарбазину, винбластину, митомицину, карбоплатину и оксалиплатину. Сравнение значений IC50 химиотерапевтических препаратов, полученных in vitro, с клинически достижимыми PPC дает приблизительную оценку ожидаемой клинической эффективности. Значения IC50 опухолевых клеток in vivo могут быть либо снижены при длительном применении препарата, либо повышены при учете более низких концентраций в тканях и снижении доступности опухолевых клеток. Хотя все три клеточные линии демонстрировали сходную долю S-фазы при измерении распределения клеточного цикла, их время удвоения отличалось и составило 20,8 и 35,7 ч для химиочувствительных линий H727 и H835, соответственно, и 27,0 ч для химиорезистентных клеток UMC-11. Согласно этим данным, химиорезистентность трех линий карциноидных клеток не связана с различиями в их фракции S-фазы или времени удвоения. Результаты in vitro, полученные для стрептозотоцина, дакарбазина, цисплатина, этопозида, 5-ФУ, доксорубицина и тамоксифена, хорошо согласуются с ограниченной клинической активностью (<30% ответа) этих препаратов у пациентов с распространенным карциноидом [16]. Карбоплатин, как сообщается, обладает недостаточной активностью в клиническом исследовании с участием пациентов с карциноидами; однако неясно, были ли у этих пациентов карциноиды передней кишки [41]. Высокая экспрессия белка 1 (ERCC1), ключевого компонента механизма восстановления ДНК, поврежденной аддуктами платины, в типичных карциноидах, по-видимому, связана с резистентностью к платине у этих пациентов [42].
С момента разработки схем химиотерапии карциноидов на основе стрептозотоцина/дакарбазина, 5-ФУ, циклофосфамида или других препаратов было введено несколько новых лекарственных средств, обладающих значительной противораковой активностью в отношении соответствующих опухолей, как в виде отдельных агентов, так и в комбинации [3, 43, 44]. Эти препараты включают оксалиплатин, высокоактивное соединение платины, паклитаксел, таксан, направленный на полимеризацию микротрубочек, аналоги ингибитора топоизомеразы I камптотецина и антиметаболит гемцитабин. Паклитаксел оказался менее цитотоксичным, чем винбластин и гемцитабин, которые были активны против двух чувствительных линий карциноидных клеток. Недавно паклитаксел был оценен в клиническом исследовании с участием 14 пациентов с карциноидными опухолями и девяти пациентов с опухолями островковых клеток и дал общий ответ в 8%, что было связано со значительной гематологической токсичностью [45]. Высокоактивное материнское соединение камптотецин (CPT) было прекращено для клинического использования из-за высокой местной токсичности при внутривенном применении, но в настоящее время его вновь изучают в новых препаратах. Два известных производных, а именно CPT-11 (иринотекан) и топотекан, были модифицированы для получения более высокой растворимости в воде и продемонстрировали клиническую активность при широком спектре опухолей [46]. Достижимые PPC приблизительно 65 нМ для топотекана и >70 нМ для активного метаболита CPT-11, SN38, находятся в том же диапазоне, что и значения IC50, полученные для CPT [32, 47]. В отчете о химиорезистентности в первичных культурах типичных карциноидов обнаружена относительно высокая чувствительность к 5-ФУ, доксорубицину, этопозиду и дакарбазину, но высокая устойчивость к цисплатину, гемцитабину, винбластину и карбоплатину [48]. Однако только шесть из 60 исследованных образцов опухолей были карциноидами передней кишки, и не каждый агент применялся к каждому образцу опухоли. Поэтому карциноиды легких могут проявлять химиочувствительность, отличную от опухолей средней и задней кишки, как это было обнаружено в настоящем исследовании.
Наши результаты показывают, что оксалиплатин цитотоксичен в отношении всех трех линий карциноидных клеток, включая клетки UMC-11, которые демонстрируют широкую лекарственную устойчивость. Кроме того, сообщалось о клиническом ответе на цисплатин у одного пациента с карциноидом [49]. Новые платиновые комплексы сатраплатин и пикоплатин до сих пор не были испытаны на карциноидных пациентах, но показали многообещающую клиническую активность в испытаниях рака легких [20, 50]. Клетки UMC-11 нечувствительны к пикоплатину. JM118, высокоактивный метаболит сатраплатина, показал значительную цитотоксичность против всех трех клеточных линий карциноида легкого. Чувствительность к новым соединениям платины заметно снижается в сфероидах клеток H835 по сравнению с суспензией отдельных клеток и зависит от размера молекулы и липофильности соответствующего препарата. Поэтому ограниченный доступ химиотерапевтических препаратов к карциноидным клеткам и, как следствие, недостаточный уровень лекарств может быть связан с лекарственной устойчивостью карциноидных опухолей in vivo [49].
Широкая резистентность к цитотоксическим препаратам может быть связана с повышенным подавлением апоптотической гибели опухолевых клеток через изменение характеристик митохондрий [51]. Метаболизм большинства солидных опухолей включает аэробный гликолиз (эффект Варбурга), и в этих условиях митохондрии не могут обеспечить необходимые проапоптотические факторы. DCA — это перорально доступный ингибитор киназы пируватдегидрогеназы, который увеличивает поток пирувата в митохондрии и тем самым способствует окислению глюкозы, а не гликолизу [52]. Это обращает вспять подавленный митохондриальный апоптоз при раке и приводит к торможению роста опухоли in vitro и in vivo при раке молочной железы, простаты и эндометрия [53]. В дополнение к клеточным эффектам, вызываемым только DCA, он может усиливать гибель клеток в сочетании с цитотоксическими препаратами. DCA не оказывал аддитивного эффекта на две клеточные линии немелкоклеточного рака легких A549 и H719 с паклитакселом, этопозидом или цисплатином. Однако митаплатин, соединение, в котором две молекулы DCA были присоединены к аксиальным позициям шестикоординатного Pt(IV) центра, показал многообещающую активность [54, 55]. Наши результаты показывают, что DCA ингибирует рост химиорезистентной клеточной линии UMC-11 и сенсибилизирует клетки к карбоплатину, JM118 и оксоплатину в концентрациях, которые могут быть достигнуты in vivo [56]. Механизм этой избирательности DCA для конкретных платиновых соединений еще предстоит выяснить. В заключение следует отметить, что комплексы платины, такие как оксалиплатин, карбоплатин и сатраплатин, могут иметь потенциал для лечения карциноидов легких, а сенсибилизация опухолевых клеток к отдельным препаратам платины, вызываемая DCA, может иметь более широкое применение в цитотоксической химиотерапии.
Благодарность
Мы хотим поблагодарить доктора З. Саламу за предоставление платиновых комплексов и полезные обсуждения. Этот проект был поддержан грантом Австрийского национального банка (№ 13345) для д-ра К. Гайслера. Д-р В. Фибигер и д-р У. Ольшевски PhD внесли равный вклад в данное исследование.
Конфликт интересов
Авторы заявляют, что у них нет конфликта интересов, связанного с публикацией данной рукописи.
ССЫЛКИ
1 Öberg K (2003) Диагностика и лечение карциноидных опухолей. Expert Rev Anticancer Ther 3:863-8772 Modlin IM, Kidd M, Latich I et al (2005) Current status of gastrointestinal carcinoids. Гастроэнтерология 128:1717-1751
3 Pinchot SN, Holen K, Sippel RS, Chen H (2008) Карциноидные опухоли. Онколог 13:1255-1269
4 Zuetenhorst JM, Taal BG (2005) Метастатические карциноидные опухоли: клинический обзор. Онколог 10:123-131
5 Granberg D, Oberg K (2005) Нейроэндокринные опухоли. Cancer Chemother Biol Response Modif 22:471-483
6 Capella C, Heitz PU, Hofler H et al (1995) Revised classification of neuroendocrine tumors of the lung, pancreas and gut. Virchows Arch 425:547-560
7 Warren WH, Gould VE, Faber LP et al (1985) Neuroendocrine neoplasms of the bronchopulmonary tract: a classification of the spectrum of carcinoid to small cell carcinoma and intervening variants. J Thorac Cardiovasc Surg 89:819-825
8 Plockinger U, Rindi G, Arnold R et al (2004) Европейское общество нейроэндокринных опухолей: руководство по диагностике и лечению нейроэндокринных опухолей желудочно-кишечного тракта. Консенсусное заявление от имени Европейского общества нейроэндокринных опухолей (ENETS). Нейроэндокринология 80:394-424
9 Öberg K, Eriksson B (2005) Ядерная медицина в выявлении, стадировании и лечении карциноидных опухолей желудочно-кишечного тракта. Best Pract Res Clin Endocrinol Metab 19:265-276
10 Dousset B, Saint-Marc O, Pitre J et al (1996) Метастатические эндокринные опухоли: медицинское лечение, хирургическая резекция и трансплантация печени. World J Surg 20:908-915
11 Raderer M, Kurtaran A, Leimer M et al (2000) Значение сцинтиграфии пептидных рецепторов с использованием (123) I-вазоактивного кишечного пептида и (111)In-DTPAD-Phe1-октреотида у 194 пациентов с карциноидами: Опыт Венского университета, 1993-1998 гг. J Clin Oncol 18:1331-1336
12 Smolle-Juttner FM, Popper H, Klemen H et al (1993) Клинические особенности и терапия «типичных» и «атипичных» бронхиальных карциноидных опухолей (нейроэндокринная карцинома 1 и 2 класса). Eur J Cardiothorac Surg 7:121-125
13 Marty-Ane CH, Costes V, Pujol JL et al (1995) Карциноидные опухоли легких: требуют ли атипичные особенности агрессивного лечения? Ann Thorac Surg 59:78-83
14 Moertel CG, Sauer WG, Dockerty MB, Baggenstoss AH (1961) Life history of the carcinoid tumor of the small intestine. Рак 14:901-912
15 Goodwin JD (1975) Карциноидные опухоли: анализ 2837 случаев. Рак 36:560-569
16 Bertino EM, Confer PD, Colonna JE et al (2009) Pulmonary neuroendocrine/carcinoid tumors: a review article. Рак 115:4434-4441
17 Moertel CG (1983) Лечение карциноидной опухоли и злокачественного карциноидного синдрома. J Clin Oncol 1:727-740
18 Sun W, Lipsitz S, Catalano P et al (2005) Phase II/III Study of doxorubicin with fluorouracil compared with streptozocin with fluorouracil or dacarbazine in the treatment of advanced carcinoid tumors: Eastern Cooperative Oncology Group Study E1281. J Clin Oncol 23:4897-4904
19 Dowell JE (2010) Мелкоклеточный рак легких: добиваемся ли мы прогресса? Am J Med Sci 339:68-76
20 Shah N, Dizon DS (2009) Платиновые агенты нового поколения для лечения солидных опухолей. Онкол будущего 5:33-42
21 Dhar S, Lippard SJ (2009) Митаплатин, мощное соединение цисплатина и сиротского препарата дихлорацетата. Proc Natl Acad Sci U S A 106:22199-22204
22 Chong CD, Logothetis CJ, Savaraj N et al (1988) Корреляция фармакокинетики винбластина с токсичностью у пациентов с раком яичек. J Clin Pharmacol 28:714-718
23 Rowinsky EK, Burke PJ, Karp JE et al (1989) Фаза I и фармакодинамическое исследование таксола при рефрактерных острых лейкозах. Cancer Res 49:4640-4647
24 Dennis MJ, Beijnen JH, Grochow LB, van Warderdam LJC (1997) An overview of the clinical pharmacology of topotecan. Semin Oncol 24:12-18S
25 Ho DH, Pazdur R, Covington W et al (1998) Сравнение фармакокинетики 5-фторурацила у пациентов, получающих непрерывную инфузию 5-фторурацила и пероральный урацил плюс N1-(2′-тетрагидрофурил)-5-фторурацил. Clin Cancer Res 4:2085-2088
26 Wihlm J, Limacher JM, Leveque D et al (1997) Фармакокинетический профиль высокодозного доксорубицина, вводимого в течение 6 ч внутривенной инфузии у больных раком молочной железы. Bull Cancer 84:603-608
27 Touroutoglou N, Gravel D, Raber MN et al (1998) Клинические результаты фармакодинамически обоснованной стратегии повышения дозировки гемцитабина у пациентов с солидными опухолями. Ann Oncol 9:1003-1008
28 Kivisto KT, Villikka K, Nyman L et al (1998) Концентрации тамоксифена и торемифена в плазме крови значительно снижаются под действием рифампицина. Clin Pharmacol Ther 64:648-654
29 Bonetti A, Franceschi T, Apostoli P et al (1995) Фармакокинетика цисплатина при использовании пятидневного графика во время повторных курсов химиотерапии при герминогенных опухолях. Ther Drug Monit 17:25-32
30 Graham MA, Lockwood GF, Greenslade D et al (2000) Clinical pharmacokinetics of oxaliplatin: a critical review. Clin Cancer Res 6:1205-1218
31 Oguri S, Sakakibara T, Mase H et al (1988) Clinical pharmacokinetics of carboplatin. J Clin Pharmacol 28:208-215
32 Schilcher RB, Young JD, Ratanatharathorn V et al (1984) Clinical pharmacokinetics of highdose mitomycin C. Cancer Chemother Pharmacol 13:186-190
33 Adolphe AB, Glasofer ED, Troetel WM et al (1975) Fate of streptozotocin (NSC-85998) in patients with advanced cancer. Cancer Chemother Rep 9:547-556
34 Hande K, Messenger M, Wagner J et al (1999) Inter- and intrapatient variability in etoposide kinetics with oral and intravenous drug application. Clin Cancer Res 5:2742-2747
35 Chabot GG, Flaherty LE, Valdivieso M, Baker LH (1990) Alteration of DTIC pharmacokinetics after interleukin-2 administration in melanoma patients. Cancer Chemother Pharmacol 27:157-160
36 Kvols LK, Moertel CG, O’Connell MJ et al (1986) Treatment of the malignant carcinoid evaluation of a long-acting somatostatin analog. N Engl J Med 315:663-666
37 Engstrom PF, Lavin PT, Moertel CG et al (1984) Streptozotocin plus fluorouracil versus doxorubicin therapy for metastatic carcinoid tumor. J Clin Oncol 8:865-890
38 Vilar E, Salazar R, Pérez-García J et al (2007) Химиотерапия и роль маркера пролиферации Ki-67 в пищеварительных нейроэндокринных опухолях. Endocr Relat Cancer 14:221-23
39 García-Yuste M, Matilla JM, Cueto A et al (2007) Типичные и атипичные карциноидные опухоли: анализ опыта Испанского многоцентрового исследования нейроэндокринных опухолей легких. Eur J Cardiothorac Surg 31:192-197
40 Giaccone G, Battey J, Gazdar AF et al (1992) Нейромедин B присутствует в клеточных линиях рака легких. Cancer Res 52:2732s-2736s
41 Saltz L, Lauwers G, Wiseberg J, Kelsen D (1993) A phase II trial of carboplatin in patients with advanced APUD tumors. Рак 72:619-622
42 Skov BG, Holm B, Erreboe A et al (2010) ERCC1 и Ki67 в мелкоклеточной карциноме легких и других нейроэндокринных опухолях легких: распределение и влияние на выживаемость. J Thorac Oncol 5:453-459
43 Kelly K (2000) Новые химиотерапевтические средства для лечения мелкоклеточного рака легкого. Chest 117:156-162S
44 Teicher BA (2008) Newer cytotoxic agents: attacking cancer broadly. Clin Cancer Res 14:1610-1617
45 Ansell SM, Pitot HC, Burch PA et al (2001) Исследование II фазы высокой дозы паклитаксела у пациентов с распространенными нейроэндокринными опухолями. Рак 91:1543-1548
46 Iyer L, Ratain MJ (1998) Клиническая фармакология камптотецинов. Cancer Chemother Pharmacol 42:S31-S43
47 Catimel G, Chabot GG, Guastalla JP et al (1995) Фаза I и фармакокинетическое исследование иринотекана (CPT-11), применяемого ежедневно в течение трех дней подряд каждые три недели у пациентов с распространенными солидными опухолями. Ann Oncol 6:133-140
48 Lyons JM 3rd, Abergel J, Thomson JL et al (2009) In vitro тестирование химиорезистентности в хорошо дифференцированных карциноидных опухолях. Ann Surg Oncol 16:649-655
49 Porter AT, Ostrowski MJ (1988) Успешное лечение злокачественной карциноидной опухоли с помощью внутривенного цисплатина. Eur J Surg Oncol 14:703-704
50 Olszewski U, Hamilton G (2010) Лучший противораковый препарат на основе платины еще впереди? Anticancer Agents Med Chem 10:293-301
51 Wasilewski M, Scorrano L (2009) The changing shape of mitochondrial apoptosis. Trends Endocrinol Metab 20:287-294
52 Michelakis ED, Webster L, Mackey JR (2008) Дихлорацетат (DCA) как потенциальная метаболическая терапия рака. Br J Cancer 99:989-994
53 Sun RC, Fadia M, Dahlstrom JE et al (2010) Реверсия гликолитического фенотипа с помощью дихлорацетата подавляет рост метастатических клеток рака молочной железы in vitro и in vivo. Breast Cancer Res Treat 120:253-260
54 Otterson GA, Wang L, Wu X et al (2008) Влияние дихлорацетата в сочетании с химиотерапией на клетки рака легких человека. J Clin Oncol 26S:14637
55 Dhar S, Lippard SJ (2009) Mitaplatin, мощный синтез цисплатина и сиротского препарата дихлорацетата. Proc Natl Acad Sci U S A 106:22199-22204
56 Li T, Schultz I, Keys DA et al (2008) Количественная оценка кинетики дихлоруксусной кислоты у человека: исследование на основе физиологического фармакокинетического моделирования. Токсикология 245: 35-48