Akbar Khan, MD; Denis Marier, ND; Eric Marsden, ND; Douglas Andrews, ND; Isaac Eliaz, MD
Akbar Khan, MD, ist medizinischer Direktor von Medicor Cancer Centres, Inc, in Toronto, Ontario, Kanada. Denis Marier, ND, ist der Direktor der Canadian Clinic for Integrative Medicine in Windsor, Ontario. Eric Marsden, ND, ist Direktor des Marsden Center of Naturopathic Excellence in Maple, Ontario. Douglas Andrews, ND, ist angestellter naturheilkundlicher Arzt bei Medicor Cancer Centres, Inc. Isaac Eliaz, MD, ist Direktor der Amitabha Medical Clinic in Santa Rosa, Kalifornien.
Korrespondierender Autor: Akbar Khan, MD E-mail Adresse: [email protected]
Zusammenfassung
Orales Dichloracetat-Natrium (DCA) wird derzeit als Einzelwirkstoff und als Adjuvans zur Behandlung verschiedener Krebsarten untersucht. Einer der Faktoren, die den klinischen Einsatz von DCA bei kontinuierlicher oraler Verabreichung einschränken, ist eine dosisabhängige, reversible Neurotoxizität, einschließlich peripherer Neuropathie und Enzephalopathie. Die intravenöse (IV) Verabreichung hat eine Reihe potenzieller Vorteile, darunter (1) gepulste Dosierung, um höhere Konzentrationen zu erreichen, als dies bei oraler Verabreichung möglich ist, (2) eine längere Auswaschphase, um das Potenzial für Neurotoxizität zu verringern, und (3) eine Umgehung des Verdauungssystems, was besonders für Krebspatienten im fortgeschrittenen Stadium von Bedeutung ist. Für hochdosiertes DCA (bis zu 100 mg/kg/Dosis) lagen Daten vor, die seine Sicherheit sowohl bei gesunden Freiwilligen als auch bei schwerkranken Patienten bestätigten, so dass die Autoren mit der Off-Label-Behandlung von Krebspatienten beginnen konnten. Bei mehreren ihrer Patienten, die mit IV DCA behandelt wurden, beobachteten die Autoren klinische, hämatologische oder radiologische Reaktionen. In diesem Artikel werden drei Fälle von Patienten mit rezidivierenden Krebserkrankungen vorgestellt, bei denen alle konventionellen Therapien versagt hatten: (1) ein 79-jähriger männlicher Patient mit Dickdarmkrebs, der Lebermetastasen hatte, (2) ein 43-jähriger männlicher Patient mit Angiosarkom, der Pankreas- und Knochenmetastasen hatte, und (3) ein 10-jähriger männlicher Patient mit neuroendokrinem Pankreaskarzinom, der Lebermetastasen hatte. (Altern Ther Health Med. 2014;20(suppl 2):21-28.)
Orales Natriumdichloracetat (DCA) ist ein Medikament, das derzeit als Einzelwirkstoff und als Zusatztherapie bei Krebs untersucht wird.1 Derzeit läuft an der University of Alberta eine Phase-I-Studie mit oralem DCA bei rezidivierenden oder metastasierenden soliden Tumoren, und an der Stanford University werden zwei Studien mit oralem DCA bei Kopf- und Halskrebs durchgeführt.
DCA wurde von Stacpoole2-5 ausgiebig für die Behandlung der kongenitalen Laktatazidose untersucht, zu der eine Gruppe von vererbten mitochondrialen Erkrankungen gehört. Das Sicherheitsprofil für die Anwendung von oralem DCA beim Menschen wurde durch diese Arbeiten ermittelt. Das Medikament hat sich als relativ sicher erwiesen und weist keine hämatologischen, kardialen, pulmonalen oder renalen Toxizitäten auf.6 Die Haupttoxizität ist neurologisch, vor allem die periphere Neuropathie, und dieser Zustand ist reversibel.7 Es wurde ein DCA-induziertes Delirium beobachtet, das nach Absetzen des Medikaments rasch reversibel ist.8 Bei einem kleinen Prozentsatz der Patienten kann eine asymptomatische, aber reversible Erhöhung der Leberenzyme auftreten.9
Im Januar 2007 veröffentlichten Bonnet et al10 eine bahnbrechende Arbeit, in der sie nachwiesen, dass DCA bei der Behandlung von Brust-, Lungen- und Gehirnkrebs beim Menschen in vitro und in vivo (bei Ratten) über neuartige Stoffwechselwege wirksam ist, die eine Hemmung der mitochondrialen Pyruvatdehydrogenase-Kinase beinhalten. Die Forscher berichteten, dass DCA in Krebszellen selektiv Apoptose auslöst, indem es das mitochondriale Membranpotenzial reduziert, die aerobe Glykolyse (Warburg-Effekt) blockiert und mitochondriale Kalium-Ionen-Kanäle aktiviert. In der Folge wurde DCA weiter untersucht und es wurde festgestellt, dass es eine krebshemmende Wirkung auf mehrere Krebsarten hat, darunter Dickdarmkrebs,11 Prostatakrebs,12 Eierstockkrebs,13 Neuroblastom,14 Lungenkarzinom,15 Gebärmutterhalskrebs,16 Endometriumkrebs,17 Cholangiokarzinom,18 Sarkom19 und T-Zell-Lymphom.20 Es wurden
auch andere Wirkmechanismen von DCA gegen Krebszellen vorgeschlagen. Zu diesen Methoden gehören (1) die Hemmung der Angiogenese,21 (2) die Veränderung der Expression des Hypoxie-induzierbaren Faktors 1-α (HIF1-α),21 und (3) die Veränderung der pH-Regulatoren vakuoläre H+-ATPase (V-ATPase) und Monocarboxylat-Transporter 1 (MCT1) und anderer Regulatoren des Zellüberlebens, wie dem p53-regulierten Modulator der Apoptose (PUMA), dem Glukose-Transporter 1 (GLUT1), dem B-Zell-Lymphom-2-Protein (BCL2) und dem zellulären Tumorantigen p53 (p53).20 Einige Studien kamen jedoch zu anderen Ergebnissen und zeigten eine verminderte Apoptose bei bestimmten Krebszelllinien unter hypoxischen Bedingungen.22,23
In vitro wurde auch gezeigt, dass DCA die Zytotoxizität ausgewählter Platinverbindungen erhöht, was auf ein Potenzial für die klinische Anwendung bei platinresistentem kleinzelligem Lungenkrebs, Ewing-Sarkom und Eierstockkrebs hindeutet.24 In einer anderen In-vitro-Studie wurde eine signifikante, synergistische antiproliferative Wirkung bei Gebärmutterhalskrebs-Zelllinien mit einer Kombination aus DCA und Cisplatin festgestellt.25 Die Literatur zeigt deutlich das Potenzial für weitere Forschung und Entwicklung von DCA.
Auf der Grundlage der ursprünglichen Arbeit von Bonnet et al.10 begann einer der jetzigen Autoren 2007 mit der Anwendung von oralem DCA als Off-Label-Behandlung für Krebspatienten, die eine schlechte Prognose hatten oder auf herkömmliche Krebstherapien nicht angesprochen hatten. Die periphere Neuropathie26 erwies sich als der Hauptfaktor, der den klinischen Nutzen einschränkte. Dieser Autor entwickelte in Zusammenarbeit mit einem anderen Autor, einem Arzt für Naturheilkunde, ein DCA-Protokoll zur Behandlung der Neuropathie. Das Ergebnis dieser Arbeit war eine orale DCA-Kur, die die natürlichen neuroprotektiven Medikamente Acetyl-L-Carnitin,27-30 R-α-Liponsäure,31-34 und Benfotiamin enthielt.35-37 Die klinische Beobachtung von mehr als 300 Patienten mit fortgeschrittener Krebserkrankung, die mit dieser Therapie behandelt wurden, ergab, dass 60 bis 70 % einen messbaren Nutzen von DCA hatten. Das ungefähre Neuropathierisiko betrug 20 % bei einer DCA-Dosis von 20 bis 25 mg/kg/Tag in einem Zyklus von zwei Wochen mit und einer Woche ohne DCA in Verbindung mit den drei natürlichen Ergänzungsmitteln.
Die intravenöse (IV) Verabreichung hat eine Reihe von therapeutischen Vorteilen, darunter (1) höhere Blutspiegel, da mit einer gepulsten IV-Dosierung eine höhere Konzentration erreicht werden kann als mit einer oralen Dosierung, (2) eine längere Auswaschphase, um das Potenzial für Neurotoxizität zu verringern, und (3) eine Umgehung des Verdauungssystems, was besonders für Krebspatienten im fortgeschrittenen Stadium von Bedeutung ist. Es liegen Daten über hochdosiertes, intravenös verabreichtes DCA mit einer Dosis von bis zu 100 mg/kg/Dosis vor, die seine Sicherheit sowohl bei gesunden Freiwilligen38 als auch bei schwerkranken Patienten bestätigt haben.39 Die Autoren Eliaz und Khan entwickelten ein IV-DCA-Behandlungsprotokoll und setzten es in die klinische Praxis um. Khan hatte bereits seit 2007 Erfahrung mit der intravenösen DCA-Behandlung von Patienten mit vollständigem Darmverschluss. Allerdings war es bei Khans früherem Einsatz von IV-DCA aus dem Jahr 2007 nicht möglich, langfristige Reaktionen zu bewerten, da die Behandlung bei Patienten im Endstadium mit einer Prognose von 4 bis 6 Wochen Lebenserwartung erfolgte.
In diesem Artikel werden drei Fälle vorgestellt, die die Auswirkungen der IV-DCA-Behandlung veranschaulichen. Alle Patienten und/oder Betreuer der Patienten gaben ihr Einverständnis zur Veröffentlichung ihrer Fälle. Diese Patienten hatten eine sehr schlechte Prognose und/oder hatten auf die konventionelle Therapie nicht angesprochen. Alle Patienten profitierten erheblich von der DCA-Therapie, mit minimalen Nebenwirkungen, ohne Myelosuppression und ohne Organtoxizität. Die Patienten in diesen Fallstudien wurden in Zusammenarbeit mit den drei Autoren, die Ärzte für Naturheilkunde sind, behandelt. Sie entwickelten individuelle Protokolle, die natürliche Hilfsmittel wie die Behandlung mit intravenöser Ascorbinsäure/Vitamin C (IVC) und natürliche neuroprotektive Wirkstoffe enthielten.
FALL 1: KOLONKREBS
Ein 79-jähriger Mann suchte wegen eines metastasierten Kolonkarzinoms eine Therapie. Die ursprüngliche Diagnose lautete T3N1M0 sigmoides Adenokarzinom, das mäßig differenziert war. Zu den Komorbiditäten gehörten Angina pectoris, Myokardinfarkt, vierfacher koronarer Bypass, Bluthochdruck, Hypercholesterinämie und Divertikulose. Er wurde zunächst mit einer Hemikolektomie links und einer Kolostomie behandelt, gefolgt von einer Chemotherapie mit 5-Fluorouracil (5-FU) und Irinotecan über einen Zeitraum von ca. 6 Monaten und der anschließenden Aufhebung der Kolostomie.
Der Patient blieb etwa 3 Jahre lang krankheitsfrei. Zu diesem Zeitpunkt begann das karzinoembryonale Antigen (CEA) anzusteigen, und eine Computertomographie (CT) zeigte neue Leber- und Lungenmetastasen. Er wurde erneut mit einer 5-FU- und Irinotecan-Chemotherapie über drei Zyklen behandelt, die unwirksam war und durch extreme Müdigkeit und Unwohlsein erschwert wurde. Die Chemotherapie wurde abgesetzt, und der Patient wurde an die Palliativmedizin überwiesen.
Die Patientin entschied sich für eine naturheilkundliche Behandlung in der Klinik eines Autors, die im Dezember 2010 begann. Die Therapie umfasste homöopathische Mittel und IVC in einer Dosis von 75 g zweimal pro Woche, woraufhin sie an Energie und Gewicht zunahm. Die damaligen Medikamente und Ergänzungsmittel waren Pantoprazol, Alfuzosin, Metoprolol, Ramipril, Simvastatin, Amlodipin, Clopidogrel, Vitamin D, Vitamin-B-Komplex, Acidophilus und α-Liponsäure. Der Patient setzte die Behandlung bis 2011 mit guter Symptomkontrolle fort; sein CEA-Wert stieg jedoch weiter an. Eine CT-Untersuchung im November 2011 zeigte eine ausgedehnte, diffuse, metastatische Lebererkrankung und zahlreiche vergrößerte Lungenknoten, die mit einem intervallartigen Fortschreiten der Erkrankung einhergingen. Der Patient entschied sich daraufhin für die versuchsweise Verabreichung von IV DCA. Am 19. Dezember 2011 wurden die Ausgangsblutwerte, einschließlich CEA und Leberenzyme, bestimmt. Die erste Dosis von 3000 mg (41 mg/kg) IV DCA wurde am 22. Dezember 2011 verabreicht, zusammen mit 50 g IVC. Ein CEA-Test sollte vier Wochen später durchgeführt werden, wurde aber fälschlicherweise einen Tag nach der Infusion zusammen mit der Messung der Leberenzyme wiederholt. Es wurde ein rascher Rückgang der Leberenzyme und des CEA festgestellt. (Siehe Abbildung 1 und Abbildung 2.)
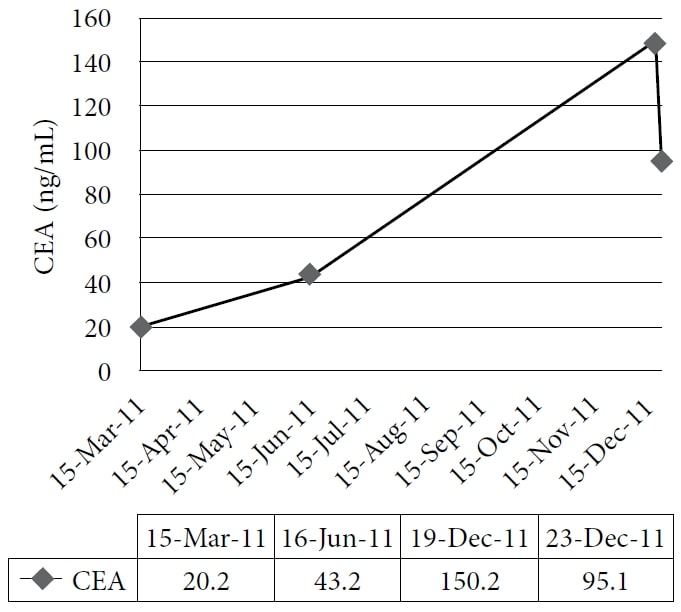
Abbildung zeigt den allmählichen Anstieg des carcinoembryonalen Antigens (CEA) während der naturheilkundlichen Behandlung und seinen starken Rückgang nach Verabreichung von intravenösem Dichloracetat-Natrium (DCA).
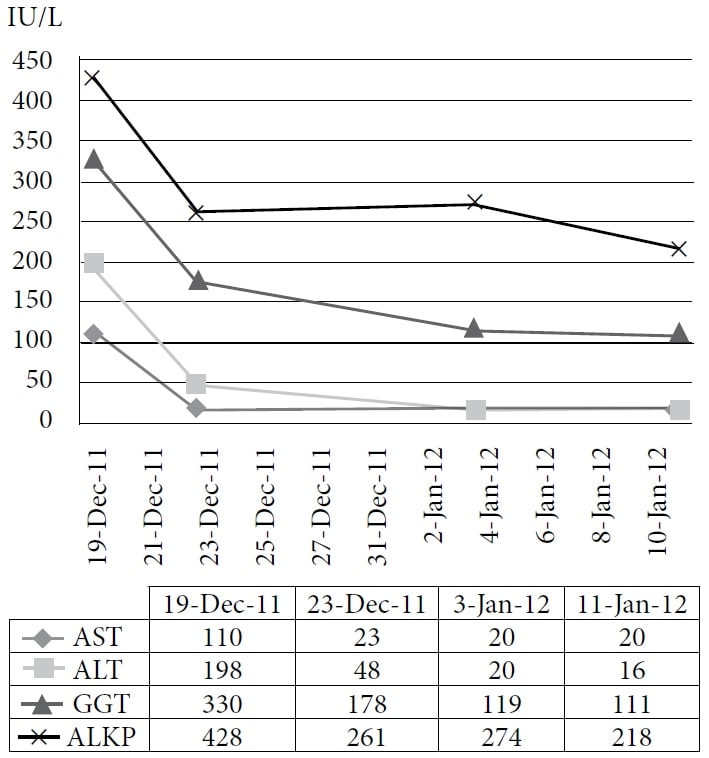
: AST = Aspartat-Aminotransferase; ALT = Alanin-Aminotransferase; GGT = γ-Glutamyl-Transpeptidase; ALKP = alkalische Phosphatase.
Die Abbildung zeigt den sofortigen starken Abfall und den kontinuierlichen Rückgang der Leberenzyme nach Verabreichung von intravenösem DCA.
Die zweite DCA-Infusion wurde 6 Tage später mit einer Dosis von 3500 mg (48 mg/kg) zusammen mit 35 g IVC verabreicht. Nach der Infusion stellte der Patient neue Symptome fest: Schüttelfrost, Schweißausbrüche und Müdigkeit. Eine dritte DCA-Infusion mit einer Dosis von 3700 mg (50 mg/kg) und 50 g IVC wurde 8 Tage nach der zweiten Dosis verabreicht, und die anschließenden Bluttests zeigten weitere Verbesserungen (Abbildung 2).
Allerdings bemerkte der Patient nach der Infusion erneut eine kurze Phase der Müdigkeit und des Unwohlseins und entschied sich gegen den Rat seiner Ärzte, die Behandlung aufgrund dieser Nebenwirkungen abzubrechen. Einen Monat nach der DCA-Behandlung wurde eine erneute Ultraschalluntersuchung des Abdomens durchgeführt. In dem Bericht hieß es: „Unter Berücksichtigung der Unterschiede bei den bildgebenden Verfahren hat sich das Erscheinungsbild der Lebermetastasen gegenüber der vorherigen CT des Abdomens vom 10. November 2011 nicht wesentlich verändert.“ Die Lungenmetastasen wurden nicht untersucht, da keine respiratorischen Symptome vorlagen.
FALL 2: ANGIOSARKOM
Ein 43-jähriger Mann suchte wegen eines metastasierten Angiosarkoms des rechten Oberschenkels eine Therapie. Der Patient hatte in der Vorgeschichte ein Osteosarkom des rechten Schienbeins, das 1995 im Alter von 27 Jahren diagnostiziert und mit einer Resektion und einer Tumorprothesenrekonstruktion behandelt worden war, gefolgt von einer Chemotherapie mit Doxorubicin und Cisplatin. Dieser Krebs galt als geheilt.
Im Jahr 2007, im Alter von 39 Jahren, suchte er seinen Arzt wegen Schmerzen und Schwellungen oberhalb des rechten Knies auf. Nach einer Magnetresonanztomographie (MRT) und einer Biopsie wurde die Diagnose Angiosarkom gestellt. Man ging davon aus, dass es sich bei diesem Krebs um ein mögliches sekundäres Malignom handelte, das durch die vorherige Chemotherapie verursacht worden war. Der Patient erhielt eine Chemotherapie mit Doxorubicin und Ifosfamid, die jedoch wegen einer Infektion und einer anschließenden Nierenschädigung infolge einer Antibiotikabehandlung mit Vancomycin verkürzt wurde. Er unterzog sich dann 2008 einer Tumorresektion und Rekonstruktion.
Im Jahr 2009, ein Jahr nach dieser Operation, entwickelten sich bei ihm Lungenmetastasen, die durch eine Lungenkeilresektion operativ entfernt wurden. In der Folge entwickelten sich weitere Lungenmetastasen, für die sich der Patient zwischen 2009 und 2011 zwei weiteren Lungenresektionen unterzog. Im August 2011 wurde eine Metastase im linken Iliakalflügel festgestellt, die durch Exzision und Strahlentherapie behandelt wurde. Im Oktober 2011 wurde bei einer CT-Untersuchung eine neue Pankreasschwanzmetastase mit einer Größe von 6,1 × 5,7 cm diagnostiziert, die sofort mit Strahlentherapie behandelt wurde. Eine vergrößerte Lungenmetastase im linken Oberlappen mit einer Größe von 12 mm wurde ebenfalls im CT-Scan festgestellt.
Im November 2011 wandte sich der Patient an einen der Autoren, einen Arzt für Naturheilkunde. Die Patientin wurde mit IV Viscum album (Mistelextrakt) und IVC behandelt. Die Dosierung wurde auf 300 mg Viscum album und 75 g IVC dreimal pro Woche erhöht. Außerdem erhielt er Nahrungsergänzungsmittel, darunter Vitamin D, modifiziertes Zitruspektin, Verdauungsenzyme, Omega-3-Fettsäuren, Bioperin und Artemisinin.
Im Januar 2012 wurden bei einer weiteren CT-Untersuchung trotz aggressiver naturheilkundlicher Therapie neue, kleine Wirbelsäulenmetastasen festgestellt. Die Bauchspeicheldrüsenschwanzmasse hatte sich 2 Monate nach der Radiatio auf 7,6 × 5,6 cm vergrößert. Es wurden mehrere neue, kleine Lungenknoten gefunden. Es wurden neue lytische Knochenmetastasen in C3, T9, L2 und im Manubrium festgestellt.
Aufgrund des Fortschreitens der Krankheit entschied sich der Patient im Februar 2012 für eine IV-DCA-Therapie. Die Ausgangswerte der Blutuntersuchung zeigten eine Anämie (Hämoglobin 101 g/L), eine leichte Niereninsuffizienz (Harnstoff 12,6 mmol/L und Kreatinin 195 µmol/L) und eine leichte Erhöhung der γ-Glutamyltranspeptidase (GGT) (77 U/L). Seine alkalische Phosphatase (ALKP) war normal. Vor Beginn der DCA-Behandlung wurde eine Kernspintomographie der Wirbelsäule als Ausgangssituation durchgeführt.
Die intravenöse DCA-Behandlung wurde mit einer Dosis von 3000 mg (47 mg/kg) wöchentlich begonnen und über einen Zeitraum von zwei Wochen auf 5000 mg (47 mg/kg) zweimal wöchentlich eskaliert. Es wurden keine Nebenwirkungen beobachtet. Gleichzeitig mit dem Beginn der DCA-Behandlung erhielt der Patient auch eine stereotaktische Strahlentherapie der Wirbelsäule. Nach zweimonatiger intravenöser DCA-Behandlung in Kombination mit den laufenden naturheilkundlichen Behandlungen zeigte ein CT-Scan die Stabilität aller Lungenmetastasen und die Schrumpfung der Pankreasmetastase von 7,6 × 5,6 cm auf 5,9 × 5,2 cm. In T12 wurde ein subtiles neues luzentes Areal festgestellt, während die Luzenz aller anderen Knochenmetastasen leicht zunahm. Eine Technetium-Knochenszintigraphie im April 2012 zeigte keine entsprechende Aktivität in einem der auf dem CT sichtbaren luzenten Bereiche. Eine erneute MRT der Wirbelsäule bestätigte ein gemischtes Ansprechen, wobei das größte Wachstum der Knochenmetastasen eine Zunahme von 1 bis 2 mm war.
Nach einer insgesamt viermonatigen IV-DCA-Therapie zeigte ein MRT die Stabilität fast aller Wirbelsäulenmetastasen, von denen zwei als leicht vergrößert gemeldet wurden, wobei keine Maße angegeben wurden. Es wurden keine neuen Wirbelsäulenmetastasen festgestellt. Ein CT-Scan einen Monat später, nach 5 Monaten DCA-Therapie, zeigte, dass alle Lungenknoten stabil waren, und die Bauchspeicheldrüsenmasse verringerte sich weiter von 5,9 × 5,2 cm auf 4,4 × 4,4 cm. Es waren keine neuen intrathorakalen oder intra-abdominalen Metastasen aufgetreten. Viele der vorhandenen Knochenmetastasen wiesen eine leichte Zunahme der Leuchtkraft auf. Der ALKP-Wert blieb normal, und es war keine Verschlechterung der Zellzahlen oder der Nierenfunktion eingetreten. Obwohl er die intravenöse DCA-Therapie fortsetzte, begann der Patient mit der Suche nach aggressiveren Behandlungsmöglichkeiten, mit dem Ziel, eine vollständige Remission zu erreichen. Abgesehen von der spinalen stereotaktischen Strahlentherapie wurde gleichzeitig mit der IV DCA keine konventionelle Therapie durchgeführt.
Der Patient blieb bis September 2012 klinisch stabil, als er die Behandlung mit intravenösem DCA nach acht Monaten abbrach, um sich in einer Privatklinik in Deutschland einer niedrig dosierten Chemotherapie mit Ganzkörperhyperthermie und Insulinpotenzierung zu unterziehen.
FALL 3: NEUROENDOKRINES PANKREASKARZINOM
Ein 10-jähriger Mann mit einem metastasierten neuroendokrinen Pankreaskarzinom wurde von seinen Eltern aus Portugal zur DCA-Behandlung in die Klinik eines Autors in Kanada gebracht, nachdem eine konventionelle Chemotherapie versagt hatte. Er suchte zunächst seinen Arzt in Portugal wegen Müdigkeit und Appetitlosigkeit auf. Die Diagnose wurde mittels Ultraschall und Biopsie gestellt, die eine Bauchspeicheldrüsenmasse mit Metastasen in den Bauchhöhlen und ausgedehnten Lebermetastasen, die das gesamte Leberparenchym befallen, ergab. Die Somatostatinrezeptor-Szintigraphie zeigte eine Pankreasläsion mit hoher Aufnahme, aber eine geringe Aufnahme in allen Leberläsionen. Auf der Grundlage einer multidisziplinären Fallbesprechung mit dem pädiatrischen Onkologenteam des regionalen Krebszentrums in Lissabon, Portugal, wurden 6 Zyklen Cisplatin und Etoposid als Erstbehandlung ausgewählt. Eine CT-Untersuchung nach 2 Zyklen Chemotherapie zeigte eine Verkleinerung der Metastasen und des Primärtumors. Nach dem fünften Zyklus stellte der Onkologe anhand neuer CT-Scans und Blutmarker ein nachlassendes Ansprechen fest, und die Patientin begann sich klinisch zu verschlechtern mit Gewichtsverlust, Übelkeit und Erbrechen. Das Transplantationsteam schloss die Möglichkeit einer hochdosierten Chemotherapie und einer Lebertransplantation aus. Nach einer Gesamtbehandlung mit Cisplatin (600 mg/m2) und Etoposid (1800 mg/m2) wurde die Therapie abgebrochen.
Der Patient kam 2 Monate später zur Beurteilung der DCA-Therapie nach Kanada. Zu diesem Zeitpunkt nahm er unter anderem Metoclopramid, Ondansetron, Fluconazol, Loperamid, Esomeprazol, Naltrexon (4,5 mg) vor dem Schlafengehen und Paracetamol (Acetaminophen). DCA in einer Dosis von 2500 mg intravenös (74 mg/kg) und Octreotid in einer Dosis von 100 µg intravenös wurden zweimal pro Woche in der Klinik verabreicht. Octreotid wurde in der Hoffnung auf eine verstärkte Wirkung nur auf den Haupttumor der Bauchspeicheldrüse hinzugefügt, der bei einem vorherigen Somatostatinrezeptor-Scan eine hohe Aufnahme gezeigt hatte. Die Therapie wurde innerhalb von 2 Wochen nach dem letzten CT-Scan begonnen. Gleichzeitig wurde eine unterstützende IV-Behandlung durchgeführt, die aus 250 mg R-α-Liponsäure, Aminosäuren, IVC, Kalzium, Magnesium, Vitamin-B-Komplex und Multitrace-Mineralien (ohne Kupfer) bestand. Nach zwei Infusionen wurde die IVC von 5 auf 20 g erhöht, nachdem die Sicherheit durch einen normalen Serum-Glucose-6-Phosphat-Dehydrogenase (G6PD)-Spiegel bestätigt worden war. Octreotid wurde auf 100 µg täglich als Infusion erhöht.
1 Tag nach den Infusionen traten bei dem Patienten vorübergehend verstärkte Bauchschmerzen und neue Schmerzen in der linken Schulterspitze auf. Er berichtete auch über einen Anstieg seines Energielevels. Nach jeder Infusion kam es weiterhin zu einer vorübergehenden Eskalation der Schmerzen, die nach Absetzen von Naltrexon mit oralem Morphium gut in den Griff zu bekommen waren. Er wurde 2 Wochen lang zweimal pro Woche in der Praxis behandelt. Neue Bluttests nach vier Infusionsbehandlungen ergaben einen Rückgang der Alanin-Aminotransferase (ALT), eine stabile Aspartat-Aminotransferase (AST) und GGT, einen starken Anstieg der Milchsäure-Dehydrogenase (LDH) und einen Rückgang des Hämoglobins (Tabelle 1). Anschließend wurde er in die Obhut seiner Ärzte in Portugal entlassen, die die IV-DCA-Therapie zusammen mit einer unterstützenden IVC und IV-α-Liponsäure ohne Komplikationen fortsetzten.
| Name | Vor DCA | Nach 4 Dosen | Nach 12 Dosen | Einheiten |
| Hämoglobin | 91 | 71 | 81 | g/L |
| Weiße Blutkörperchen | 5.7 | 8.2 | 8.2 | ×109/L |
| Blutplättchen | 227 | 171 | 171 | ×109/L |
| Alkalische Phosphatase | 188 | 206 | 122 | U/L |
| LDH | 988 | 1784 | 1449 | U/L |
| GGT | 169 | 171 | 76 | U/L |
| AST | 54 | 55 | 70 | U/L |
| ALT | 23 | 15 | 15 | U/L |
: LDH = Milchsäuredehydrogenase; GGT = γ-Glutamyltranspeptidase; AST = Aspartat-Aminotransferase; ALT = Alanin-Aminotransferase.
Ein CT-Scan nach insgesamt 6 Wochen Therapie zeigte eine Schrumpfung der größten Lebermetastase um 2 cm (Abbildungen 3A und 3B). Die zweitgrößte Metastase schrumpfte ebenfalls um fast 2 cm (Abbildungen 4A und 4B).
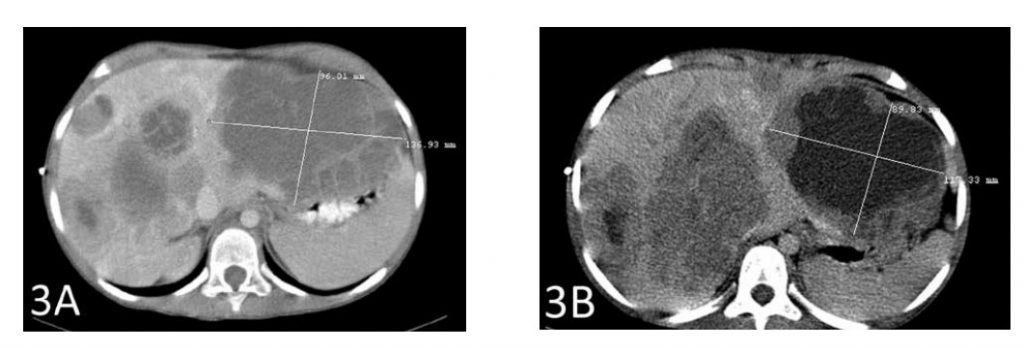
3A zeigt die größte Metastase vor Beginn der Therapie mit IV DCA. Abbildung 3B zeigt die Schrumpfung dieses Tumors um 2 cm nach der Therapie
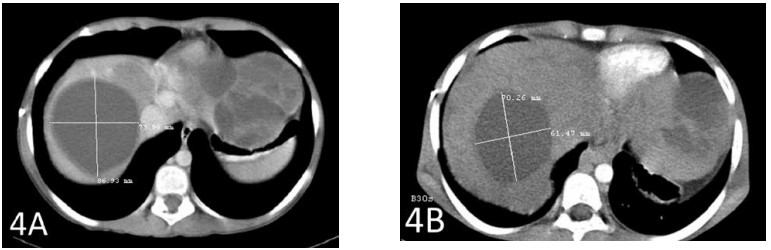
4A zeigt die zweitgrößte Metastase vor Beginn der Therapie mit IV DCA. Abbildung 4B zeigt die Schrumpfung dieses Tumors um fast 2 cm.
Ein neuer Somatostatin-Scan (Gallium-68-Positronen-Emissions-Tomographie), der eine Woche nach dem CT-Scan durchgeführt wurde, zeigte „keine Hinweise auf Tumorläsionen mit erhöhter Expression der Somatostatinrezeptoren 2, 3 oder 5“ Aufgrund dieses Ergebnisses wurde die Octreotid-Infusion abgesetzt und die DCA-Therapie beibehalten. Der Patient blieb klinisch stabil, ohne dass die Therapie für weitere 3 Monate geändert wurde. Zu diesem Zeitpunkt beantragte er die Beendigung der Therapie, da sein persönliches Ziel darin bestand, einen funktionellen Status der ECOG-Stufe 0 (voll aktiv und ohne Einschränkung der körperlichen Fähigkeiten) zu erreichen, und dieses Ziel als unerreichbar galt.
DISKUSSION
Es wurden drei Fälle einer IV-DCA-Therapie bei Patienten mit fortgeschrittenem Krebs vorgestellt, bei denen die Autoren ein günstiges klinisches, biochemisches oder radiologisches Ansprechen beobachteten.
Fall 1 veranschaulicht das biochemische Ansprechen eines metastasierten Kolonkarzinoms auf IV DCA in Kombination mit hochdosierter IVC. Zuvor war der CEA-Wert des Patienten stetig angestiegen, während er nur 10 Monate lang IVC erhielt. Daher kann der Rückgang des CEA-Wertes auf die DCA-Therapie zurückgeführt werden. Da in der Literatur von einer möglichen CEA-Reduktion um mehr als 50 % innerhalb von 10 Stunden nach einer Lebermetastasektomie berichtet wird,40 ist ein starker Rückgang des CEA am ersten Tag nach einer anderen Therapie plausibel, wenn der Krebs schnell angesprochen hat, und sollte nicht als falsches Ergebnis angesehen werden. Darüber hinaus steht der schnelle Rückgang der Leberenzyme im Einklang mit einer geringeren Leberschädigung infolge des Absterbens von Krebszellen oder der Wachstumshemmung.
Bei der Ultraschalluntersuchung nach der DCA-Behandlung wurde keine Veränderung der Tumorgröße festgestellt; allerdings lag unmittelbar vor Beginn der DCA-Behandlung kein Ausgangsbild vor, und die Vergleichs-CT-Untersuchung wurde zwei Monate vor Beginn der Therapie durchgeführt. Daher können keine Schlussfolgerungen darüber gezogen werden, ob eine Verkleinerung des Tumors stattgefunden hat. Aufgrund der zeitlichen Begrenzung der Aufnahmen und des Vergleichs zwischen CT und Ultraschall konnten die Autoren zumindest eine Tumorstabilität feststellen. Über die Dauerhaftigkeit des Ansprechens können keine Aussagen gemacht werden, da der Patient die Therapie sehr früh abbrach. Die Autoren kamen zu dem Schluss, dass IV DCA beim Menschen gegen das Kolonadenokarzinom wirksam zu sein scheint.
Fall 2 veranschaulicht ein teilweises Ansprechen eines metastasierten Angiosarkoms auf IV DCA in Kombination mit natürlichen Therapien. Trotz vorbestehender Anämie und chronischem Nierenversagen war eine wirksame Behandlung möglich, da DCA weder myelosuppressiv noch nephrotoxisch ist. Bei diesem Patienten konnte eine große Metastase in der Bauchspeicheldrüse, die auf eine vorherige Strahlentherapie nicht angesprochen hatte, verkleinert werden. Eine Verkleinerung um mehr als 30 % entspricht der Definition eines partiellen Ansprechens nach den Response Evaluation Criteria in Solid Tumors (RECIST). Das Ergebnis war Stabilität bei den multiplen Lungenmetastasen und nahezu vollständige Stabilität bei den vorhandenen Knochenmetastasen. Das Ansprechen der Knochenmetastasen könnte auf die gleichzeitige stereotaktische Strahlentherapie der Wirbelsäule zurückzuführen sein, das Ansprechen der anderen Metastasen jedoch nicht. Während der anfänglichen 5-monatigen DCA-Therapie traten winzige, neue Knochenmetastasen auf. Während der DCA-Therapie traten keine neuen intrathorakalen oder intraabdominalen Metastasen auf, während Lungen- und Bauchspeicheldrüsenmetastasen bereits vor dieser Therapie gewachsen waren. Bei der Patientin traten keine nennenswerten behandlungsbedingten Nebenwirkungen auf.
Aufgrund der Heterogenität des Tumors ist mit einem gemischten Ansprechen zu rechnen. Eine weitere mögliche Erklärung für das bessere Ansprechen der Bauchspeicheldrüsenmetastasen im Vergleich zu den Lungenmetastasen besteht darin, dass DCA bei vorgestrahlten Tumoren eine größere Wirksamkeit hat. Über dieses Ergebnis wurde bereits berichtet.41 Ein teilweises Ansprechen ist angesichts der schlechten Prognose des Patienten ermutigend, insbesondere weil die Behandlung gut verträglich war und keine hämatologischen, renalen oder neurologischen Toxizitäten auftraten. Mit sanfteren, nicht toxischen Therapien kann ein partielles Ansprechen durchaus akzeptabel sein und muss nicht aufgegeben werden. Die Autoren kamen zu dem Schluss, dass IV DCA beim Menschen gegen Angiosarkome wirksam zu sein scheint.
Fall 3 veranschaulicht die Tumorverkleinerung mit IV DCA in Kombination mit hochdosierter IVC. Dieses Ergebnis wird gemäß der RECIST-Definition als stabile Erkrankung eingestuft, da die Tumorverkleinerung weniger als 30 % betrug. Es wurden nur minimale Nebenwirkungen beobachtet. Ausgehend von den Octreotid-Scans vor und nach der Behandlung kann die Schrumpfung der großen Lebermetastasen nicht auf die Octreotid-Therapie zurückgeführt werden; in keinem der Scans wurden Octreotid-Rezeptoren in den Lebermetastasen nachgewiesen. Darüber hinaus unterstreicht das Verschwinden der Octreotid-Rezeptoren aus dem Bauchspeicheldrüsentumor das Fehlen eines Nutzens der Octreotid-Therapie. Somit kann das Ansprechen auf die Verabreichung von DCA in Kombination mit natürlichen Arzneimitteln zurückgeführt werden. Ein vorübergehendes Aufflackern von tumorbedingten Schmerzen wird manchmal bei der Verabreichung von DCA beobachtet und kann ein Zeichen für eine Tumorreaktion mit daraus resultierender Entzündung sein. Ein plötzlicher Anstieg der LDH im Serum des Patienten steht im Einklang mit diesem Effekt. Aufgrund der kurzen Dauer der Untersuchung kann keine Aussage über die Dauerhaftigkeit der Reaktion getroffen werden. Die Autoren kamen zu dem Schluss, dass IV DCA beim Menschen gegen neuroendokrine Pankreaskarzinome wirksam zu sein scheint.
Die vorgestellten Fälle zeigen, dass IV DCA eine vielversprechende Krebstherapie ist. Alle Patienten profitierten in erheblichem Maße von ihren Therapien, mit minimalen subjektiven Nebenwirkungen und ohne hämatologische, renale oder neurologische Toxizitäten trotz des fortgeschrittenen Stadiums der Erkrankung in allen Fällen. Behandlungen wie hochdosierte IVC, die mit DCA kombiniert wurden, wirkten sich unterstützend auf die Lebensqualität aus und hatten möglicherweise eine synergistische Wirkung mit dem intravenösen DCA. Es war jedoch klar, dass diese Behandlungen allein nicht für das Ansprechen des Tumors verantwortlich waren. Interessant ist, dass alle Patienten in dieser Fallserie IVC mit IV DCA erhielten. Es wird vermutet, dass IVC eine krebshemmende Wirkung durch Immunmodulation42,43 oder durch Induktion von Autophagie über die Erzeugung vonH2O2und ATP-Verarmung ausüben kann.44-46 IVC wirkt nachweislich als Adjuvans bei anderen Krebstherapien, z. B. Gemcitabin beim Pankreaskarzinom.47-49 Daher könnte IVC eine wichtige Rolle als Adjuvans zu IV DCA bei der Behandlung fortgeschrittener Krebserkrankungen spielen.
Derzeit laufen vier klinische Studien, die sich mit der Rolle von oralem DCA in der Krebstherapie befassen, aber es gibt keine Studien, die sich mit der intravenösen Verabreichung befassen. Da DCA nicht urheberrechtlich geschützt ist, ist es für die Forscher schwierig, die für die Durchführung von Studien am Menschen erforderlichen Mittel aufzubringen. Es ist zu hoffen, dass diese Fälle, die die Vorteile der DCA-Infusion veranschaulichen, zu formelleren klinischen Untersuchungen anregen werden. Weitere In-vitro- und In-vivo-Forschungen sind erforderlich, um die Wirkmechanismen von DCA und die Besonderheiten von Tumortyp und Mikroumgebung, die günstig auf dieses Medikament ansprechen, zu definieren. Klinische Studien mit Patienten, deren Tumore bereits bekanntermaßen gut auf DCA ansprechen, sind gerechtfertigt, um den Nutzen des Medikaments besser beurteilen und das Behandlungsschema optimieren zu können. DCA hat sich in Kombination mit einigen herkömmlichen Chemotherapeutika als vielversprechend erwiesen, ein Nutzen, der ebenfalls weiter erforscht werden sollte.
SCHLUSSFOLGERUNG
Auf der Grundlage der Literatur und der klinischen Erfahrung der Autoren ist die Off-Label-Infusion von DCA eine vielversprechende Behandlungsoption für Patienten, die die Risiken und Vorteile des Medikaments vollständig verstehen und akzeptieren, insbesondere für Patienten, denen keine konventionellen Behandlungsmöglichkeiten zur Verfügung stehen. Diese Fallstudien zeigen, dass DCA das Potenzial hat, das Leben zu verlängern, ohne die Lebensqualität der Patienten durch lähmende Nebenwirkungen zu mindern oder die physiologischen Funktionen zu beeinträchtigen, selbst bei sehr fortgeschrittener Krankheit. In den vorgestellten Fällen war die IV-DCA-Therapie von begrenzter Dauer, so dass es schwierig ist, den Grad des Überlebensvorteils abzuschätzen. Ausgehend von den Erfahrungen der Autoren mit der chronischen Anwendung von oralem DCA, wobei der 48-jährige Mann mit Glioblastom, der seit sechs Jahren stabil mit oralem DCA und ohne konventionelle Therapie überlebt, der längste Überlebende ist, sind die Autoren jedoch der Ansicht, dass das Medikament das Potenzial für eine langfristige Stabilisierung und/oder Rückbildung sowie eine erhebliche Verlängerung des Überlebens bietet. Angesichts seiner Erschwinglichkeit und geringen Toxizität verdient DCA weitere Untersuchungen.
DANKSAGUNG
Die Autoren bedanken sich bei Dr. Humaira Khan für ihre Hilfe und bei den Patienten für ihre Unterstützung und ihr Einverständnis, ihre Fälle zu veröffentlichen.
OFFENLEGUNGSERKLÄRUNG DER AUTOREN
Die Autoren haben in ihren jeweiligen Kliniken individualisierte, integrative, ergänzende Protokolle für Krebspatienten gegen eine Gebühr, einschließlich der Kosten für eines oder mehrere der in dieser Publikation aufgeführten Medikamente, verabreicht. Die Kliniken befinden sich im Besitz der Autoren und/oder ihrer Familienangehörigen. Die Autoren haben keine weiteren Zuschüsse oder finanzielle Unterstützung für diese Studie erhalten.
REFERENZEN
1 1. suchergebnisse für „Dichloracetat-Krebs“. ClinicalTrials.gov-Website. http:// clinicaltrials.gov/ct2/results?term=dichloroacetate+cancer. Accessed July 22, 2014.
2 Stacpoole PW, Harman EM, Curry SH, Baumgartner TG, Misbin RI. Behandlung der Laktatazidose mit Dichloracetat. N Engl J Med. 1983;309(7):390-396.
3 Stacpoole PW, Lorenz AC, Thomas RG, Harman EM. Dichloracetat bei der Behandlung der Laktatazidose. Ann Intern Med. 1988;108(1):58-63.
4StacpoolePW, Wright EC, Baumgartner TG, et al. A controlled clinical trial of dichloroacetate for treatment of lactic acidosis in adults: the DichloroacetateLactic Acidosis Study Group. N Engl J Med. 1992;327(22):1564-1569.
5 Stacpoole PW, Kurtz TL, Han Z, Langaee T. Role of dichloroacetate in the treatment of genetic mitochondrial diseases. Adv Drug Deliv Rev. 2008;60(13- 14):1478-1487.
6 Stacpoole PW, Kerr DS, Barnes C, et al. Kontrollierte klinische Studie von Dichloracetat zur Behandlung der kongenitalen Laktatazidose bei Kindern. Pediatrics. 2006;117(5):1519-1531.
7 Kaufmann P, Engelstad K, Wei Y, et al. Dichloracetat verursacht toxische Neuropathie bei MELAS: eine randomisierte, kontrollierte klinische Studie. Neurology. 2006;66(3):324-330.
8 Brandsma D, Dorlo TP, Haanen JH, Beijnen JH, Boogerd W. Severe encephalopathy and polyneuropathy induced by dichloroacetate. J Neurol. 2010;257(12):2099-2100.
9 Stacpoole PW, Gilbert LR, Neiberger RE, et al. Evaluation of long-term treatment of children with congenital lactic acidosis with dichloroacetate. Pediatrics. 2008;121(5):e1223-e1228.
10 Bonnet S, Archer SL, Allalunis-Turner J, et al. Eine Mitochondrien-K+-Kanal-Achse ist bei Krebs unterdrückt und ihre Normalisierung fördert die Apoptose und hemmt das Krebswachstum. Krebszelle. 2007;11(1):37-51.
11 Madhok BM, Yeluri S, Perry SL, Hughes TA, Jayne DG. Dichloracetat induziert Apoptose und Zellzyklus-Stillstand in Darmkrebszellen. Br J Cancer. 2010;102(12):1746-1752.
12 Cao W, Yacoub S, Shiverick KT, et al. Dichloracetat (DCA) sensibilisiert sowohl Wildtyp- als auch überexprimierende Bcl-2-Prostatakrebszellen in vitro für Strahlung. Prostate. 2008;68(11):1223-1231.
13 Saed GM, Fletcher NM, Jiang ZL, Abu-Soud HM, Diamond MP. Dichloracetat induziert Apoptose von epithelialen Eierstockkrebszellen durch einen Mechanismus, der die Modulation von oxidativem Stress einschließt. Reprod Sci. 2011;18(12):1253-1261.
14 Vella S, Conti M, Tasso R, Cancedda R, Pagano A. Dichloracetat hemmt das Wachstum von Neuroblastomen, indem es spezifisch gegen bösartige undifferenzierte Zellen wirkt. Int J Cancer. 2012;130(7):1484-1493.
15 Fiebiger W, Olszewski U, Ulsperger E, Geissler K, Hamilton G. In vitro cytotoxicity of novel platinum-based drugs and dichloroacetate against lung carcinoid cell lines. Clin Transl Oncol. 2011;13(1):43-49.
16 Liu D, Liu S, Jing X, Li X, Li W, Huang Y. Nekrose von Gebärmutterhalskrebs durch Dichloracetat, das aus elektrogesponnenen Polylactidmatten freigesetzt wird. Biomaterials. 2012;33(17):4362-4369.
17 Wong JY, Huggins GS, Debidda M, Munshi NC, De Vivo I. Dichloracetat induziert Apoptose in Endometriumkrebszellen. Gynecol Oncol. 2008;109(3):394- 402.
18IshiguroT, Ishiguro R, Ishiguro M, Iwai S. Die gleichzeitige Behandlung von Dichloracetat, Omeprazol und Tamoxifen zeigt eine synergistische antiproliferative Wirkung auf bösartige Tumore: In-vivo-Experimente und ein Fallbericht. Hepatogastroenterology. 2012;59(116):994-996.
19 Sorokina LV, Pyatchanina TV, Didenko GV, Kaplia AA, Khyzhnyak SV. Der Einfluss von Natriumdichloracetat auf die oxidativen Prozesse im Sarkom 37. Exp Oncol. 2011;33(4):216-221.
20 Kumar A, Kant S, Singh SM. Neue molekulare Mechanismen der Antitumorwirkung von Dichloracetat gegen T-Zell-Lymphome: Auswirkungen eines veränderten Glukosestoffwechsels, der pH-Homöostase und der Regulierung des Zellüberlebens. Chem Biol Interact. 2012;199(1):29-37.
21 Sutendra G, Dromparis P, Kinnaird A, et al. Mitochondriale Aktivierung durch Hemmung von PDKII unterdrückt HIF1a-Signalisierung und Angiogenese bei Krebs. Oncogene. 2013;32(13):1638-1650.
22 Shahrzad S, Lacombe K, Adamcic U, Minhas K, Coomber BL. Natriumdichloracetat (DCA) reduziert die Apoptose bei Hypoxie in kolorektalen Tumoren. Cancer Lett. 2010;297(1):75-83.
23 Anderson KM, Jajeh J, Guinan P, Rubenstein M. In vitro effects of dichloroacetate and CO2 on hypoxic HeLa cells. Anticancer Res. 2009;29(11):4579-4588.
24. Olszewski U, Poulsen TT, Ulsperger E, Poulsen HS, Geissler K, Hamilton G. In vitro-Zytotoxizität von Kombinationen von Dichloracetat mit krebsbekämpfenden Platinverbindungen. Clin Pharmacol. 2010;2:177-183.
25 Xie J, Wang BS, Yu DH, et al. Dichloracetat verlagert den Stoffwechsel von der Glykolyse zur Glukoseoxidation und zeigt eine synergistische Wachstumshemmung mit Cisplatin in HeLa-Zellen. Int J Oncol. 2011;38(2):409-417.
26 Beobachtungsdaten des Medicor-Krebszentrums zur DCA-Behandlung. Medicor Cancer Centres Website. http://medicorcancer.com/dca_therapy/dca-therapy-datajuly-2009/. Aktualisiert am 1. Juli 2009. Abgerufen am 22. Juli 2014.
27 De Grandis D. Acetyl-L-Carnitin zur Behandlung der durch Chemotherapie verursachten peripheren Neuropathie: eine kurze Übersicht. CNS Drugs. 2007;21(suppl 1):39-43.
28 Maestri A, De Pasquale Ceratti A, Cundari S, Zanna C, Cortesi E, Crino L. A pilot study on the effect of acetyl-L-carnitine in paclitaxel- and cisplatin-induced peripheral neuropathy. Tumori. 2005;91(2):135-138.
29EvansJD, Jacobs TF, Evans EW. Die Rolle von Acetyl-L-Carnitin bei der Behandlung der diabetischen peripheren Neuropathie. Ann Pharmacother. 2008;42(11):1686-1691.
30 Di Cesare Mannelli L, Ghelardini C, Toscano A, Pacini A, Bartolini A. Das Neuropathie-Schutzmittel Acetyl-L-Carnitin aktiviert die Proteinkinase C-gamma und MAPKs in einem Rattenmodell für neuropathische Schmerzen. Neuroscience. 2010;165(4):1345-1352.
31 Mijnhout GS, Kollen BJ, Alkhalaf A, Kleefstra N, Bilo HJ. Alpha-Liponsäure für symptomatische periphere Neuropathie bei Patienten mit Diabetes: eine Meta-Analyse randomisierter kontrollierter Studien. Int J Endocrinol. 2012;2012:456279.
32 Vallianou N, Evangelopoulos A, Koutalas P. Alpha-lipoic acid and diabetic neuropathy. Rev Diabet Stud. 2009;6(4):230-236.
33 Liu F, Zhang Y, Yang M, et al. Curative effect of alpha-lipoic acid on peripheral neuropathy in type 2 diabetes: a clinical study [in Chinese]. Zhonghua Yi Xue Za Zhi. 2007;87(38):2706-2709.
34 Ziegler D, Hanefeld M, Ruhnau KJ, et al. Treatment of symptomatic diabetic peripheral neuropathy with the antioxidant alpha-lipoic acid: a 3-week multicentre randomized controlled trial (ALADIN Study). Diabetologia. 1995;38(12):1425-1433.
35 Winkler G, Kempler P. Pathomechanismus der diabetischen Neuropathie: Hintergrund der pathogeneseorientierten Therapie [in ungarisch]. Orv Hetil. 2010;151(24):971- 981.
36 Ang CD, Alviar MJ, Dans AL, et al. Vitamin B zur Behandlung der peripheren Neuropathie. Cochrane Database Syst Rev. 2008;(3):CD004573.
37 Winkler G, Pal B, Nagybeganyi E, Ory I, Porochnavec M, Kempler P. Effectiveness of different benfotiamine dosages regimens in the treatment of painful diabetic neuropathy. Arzneimittelforschung. 1999;49(3):220-224.
38 Savasi I, Evans MK, Heigenhauser GJ, Spriet LL. Der Stoffwechsel der Skelettmuskulatur wird durch DCA-Infusion und Hyperoxie nach Beginn einer intensiven aeroben Belastung nicht beeinträchtigt. Am J Physiol Endocrinol Metab. 2002;283(1):E108-E115.
39 Shangraw RE, Lohan-Mannion D, Hayes A, Moriarty RM, Fu R, Robinson ST. Dichloracetat stabilisiert den intraoperativen Säure-Basen-Haushalt bei Lebertransplantationen. Liver Transpl. 2008;14(7):989-998.
40. Lokich J, Ellenberg S, Gerson B, Knox WE, Zamcheck N. Plasma-Clearance von karzinoembryonalem Antigen nach Lebermetastatektomie. J Clin Oncol. 1984;2(5):462-465.
41 Khan A. Use of oral dichloroacetate for palliation of leg pain arising from metastatic poorly differentiated carcinoma: a case report. J Palliat Med. 2011;14(8):973-977.
42 See D, Mason S, Roshan R. Increased tumor necrosis factor alpha (TNF-alpha) and natural killer cell (NK) function using an integrative approach in late stage cancers. Immunol Invest. 2002;31(2):137-153.
43 Mikirova N, Casciari J, Rogers A, Taylor P. Wirkung von hochdosiertem intravenösem Vitamin C auf Entzündungen bei Krebspatienten. J Transl Med. September 2012;10:189.
44 Chen P, Yu J, Chalmers B, et al. Pharmakologisches Ascorbat induziert Zytotoxizität in Prostatakrebszellen durch ATP-Verarmung und Induktion von Autophagie. Anticancer Drugs. 2012;23(4):437-444.
45 Chen P, Stone J, Sullivan G, Drisko JA, Chen Q. Anti-cancer effect of pharmacologic ascorbate and its interaction with supplementary parenteral glutathione in preclinical cancer models. Free Radic Biol Med. 2011;51(3):681- 687.
46 Deubzer B, Mayer F, Kuci Z, et al. H(2)O(2)-vermittelte Zytotoxizität pharmakologischer Ascorbatkonzentrationen auf Neuroblastomzellen: mögliche Rolle von Laktat und Ferritin. Cell Physiol Biochem. 2010;25(6):767-774.
47 Welsh JL, Wagner BA, van’t Erve TJ, et al. Pharmacological ascorbate with gemcitabine for the control of metastatic and node-positive pancreatic cancer (PACMAN): results from a phase I clinical trial. Cancer Chemother Pharmacol. 2013;71(3):765-775.
48 Monti DA, Mitchell E, Bazzan AJ, et al. Phase I evaluation of intravenous ascorbic acid in combination with gemcitabine and erlotinib in patients with metastatic pancreatic cancer. PloS One. 2012;7(1):e29794.
49 Cullen JJ, Spitz DR, Buettner GR. Kommentar zu „Pharmacologic ascorbate synergizes with gemcitabine in preclinical models of pancreatic cancer“ (Pharmakologisches Ascorbat synergiert mit Gemcitabin in präklinischen Modellen von Bauchspeicheldrüsenkrebs), d.h. wir sagen nur, gebt C eine Chance. Free Radic Biol Med. 2011;50(12):1726-1727.
Ähnliche Inhalte: