Akbar Khan, MD ; Denis Marier, ND ; Eric Marsden, ND ; Douglas Andrews, ND ; Isaac Eliaz, MD
Akbar Khan, MD, est le directeur médical de Medicor Cancer Centres, Inc, à Toronto, Ontario, Canada. Denis Marier, ND, est le directeur de la Canadian Clinic for Integrative Medicine à Windsor, en Ontario. Eric Marsden, ND, est le directeur du Marsden Center of Naturopathic Excellence à Maple, en Ontario. Douglas Andrews, ND, est un médecin naturopathe employé par Medicor Cancer Centres, Inc. Isaac Eliaz, MD, est le directeur de l’Amitabha Medical Clinic, à Santa Rosa, en Californie.
Auteur correspondant : Akbar Khan, MD Adresse électronique : [email protected]
Résumé
Le dichloroacétate de sodium (DCA) par voie orale fait actuellement l’objet d’études en tant qu’agent unique et adjuvant pour le traitement de divers cancers. L’un des facteurs limitant son utilisation clinique dans un régime oral continu est une neurotoxicité réversible liée à la dose, notamment une neuropathie périphérique et une encéphalopathie. La voie intraveineuse (IV) présente un certain nombre d’avantages potentiels, notamment (1) un dosage pulsé permettant d’atteindre des concentrations plus élevées qu’avec l’utilisation orale, (2) une période d’élimination plus longue pour réduire le potentiel de neurotoxicité, et (3) une dérivation du système digestif, ce qui est particulièrement important pour les patients atteints de cancer à un stade avancé. Les données disponibles sur le DCA IV à forte dose (jusqu’à 100 mg/kg/dose) ont confirmé son innocuité, tant chez les volontaires sains que chez les patients gravement malades, ce qui a permis aux auteurs d’entreprendre le traitement non autorisé de patients cancéreux. Chez plusieurs de leurs patients traités par DCA IV, les auteurs ont observé des réponses cliniques, hématologiques ou radiologiques. Cet article présente 3 cas de patients atteints de cancers récurrents et pour lesquels toutes les thérapies conventionnelles ont échoué : (1) un homme de 79 ans atteint d’un cancer du côlon avec des métastases hépatiques, (2) un homme de 43 ans atteint d’un angiosarcome avec des métastases pancréatiques et osseuses, et (3) un homme de 10 ans atteint d’un carcinome neuroendocrine pancréatique avec des métastases hépatiques. (Altern Ther Health Med. 2014;20(suppl 2):21-28.)
Le dichloroacétate (DCA) de sodium par voie orale est un médicament qui fait actuellement l’objet d’études en tant qu’agent unique et traitement d’appoint du cancer.1 Au moment de la rédaction de ce document, un essai de phase I en cours sur le DCA par voie orale pour les tumeurs solides récurrentes ou métastatiques se déroule à l’Université de l’Alberta et 2 essais sur le DCA par voie orale pour les cancers de la tête et du cou se déroulent à l’Université de Stanford.
Le DCA a été largement étudié par Stacpoole2-5 pour le traitement de l’acidose lactique congénitale, qui comprend un groupe de maladies mitochondriales héréditaires. Le profil de sécurité de l’utilisation du DCA oral chez l’homme a été établi grâce à ces travaux. Le médicament s’est avéré relativement sûr, sans toxicité hématologique, cardiaque, pulmonaire ou rénale.6 La principale toxicité est neurologique, principalement une neuropathie périphérique, et cet état est réversible.7 On a observé un délire induit par le DCA, rapidement réversible à l’arrêt du traitement.8 Une élévation asymptomatique mais réversible des enzymes hépatiques peut se produire chez un petit pourcentage de patients.9
En janvier 2007, Bonnet et al10 ont publié un article révolutionnaire qui démontrait que le DCA était efficace pour traiter les cancers du sein, du poumon et du cerveau chez l’homme in vitro et in vivo (chez le rat) par de nouvelles voies métaboliques qui impliquent l’inhibition de la pyruvate déshydrogénase kinase mitochondriale. Les chercheurs ont signalé que le DCA déclenchait l’apoptose de manière sélective dans les cellules cancéreuses en réduisant le potentiel de la membrane mitochondriale, en bloquant la glycolyse aérobie (effet Warburg) et en activant les canaux mitochondriaux potassium-ion. Par la suite, le DCA a fait l’objet d’études plus approfondies et s’est avéré avoir une activité anticancéreuse pour de multiples types de cancer, notamment les cancers du côlon,11 de la prostate,12 des ovaires,13 du neuroblastome,14 du poumoncarcinoïde,15 du col de l’utérus,16 de l’endomètre,17 du cholangiocarcinome,18 du sarcome19 et des lymphomes T.20
D’autres mécanismes d’action du DCA contre les cellules cancéreuses ont également été proposés. Ces méthodes comprennent (1) l’inhibition de l’angiogenèse,21 (2) l’altération de l’expression du facteur 1-α inductible par l’hypoxie (HIF1-α),21 et (3) l’altération des régulateurs du pH que sont la H+-ATPase de type vacuolaire (V-ATPase) et le transporteur monocarboxylate 1 (MCT1) et d’autres régulateurs de la survie cellulaire, tels que le modulateur d’apoptose régulé par p53 (PUMA), le transporteur de glucose 1 (GLUT1), la protéine du lymphome à cellules B 2 (BCL2) et l’antigène tumoral cellulaire p53 (p53).20 Cependant, certaines études ont obtenu des résultats différents, montrant une diminution de l’apoptose dans certaines lignées de cellules cancéreuses dans des conditions hypoxiques.22,23
Il a également été démontré in vitro que le DCA augmente la cytotoxicité de certains composés du platine, ce qui suggère un potentiel d’application clinique dans le cancer du poumon à petites cellules résistant au platine, le sarcome d’Ewing et le cancer de l’ovaire.24 Une autre étude in vitro a révélé des effets antiprolifératifs significatifs et synergiques sur des lignées cellulaires de cancer du col de l’utérus avec une combinaison de DCA et de cisplatine.25 L’ensemble de la littérature montre clairement le potentiel de recherche et de développement du DCA.
Sur la base des travaux originaux de Bonnet etal10, l’un des auteurs actuels a commencé à utiliser le DCA par voie orale en 2007 comme traitement non autorisé pour les patients atteints de cancer dont le pronostic était mauvais ou qui n’avaient pas répondu aux traitements anticancéreux conventionnels. On a observé que la neuropathie périphérique26 était le principal facteur limitant l’utilité clinique. Cet auteur a mis au point un protocole DCA pour traiter la neuropathie en collaboration avec un autre des auteurs, un médecin naturopathe. Ce travail a abouti à un régime de DCA oral qui comprenait les médicaments neuroprotecteurs naturels que sont l’acétyl-L-carnitine,27-30 l’acide R-α-lipoïque,31-34 et la benfotiamine.35-37 L’observation clinique de plus de 300 patients atteints d’un cancer avancé et traités avec ce régime a révélé que 60 à 70 % d’entre eux présentaient des bénéfices mesurables du DCA. Le risque approximatif de neuropathie était de 20 %, avec une dose de 20 à 25 mg/kg/jour de DCA, selon un cycle de deux semaines de traitement et une semaine de repos, en association avec les trois suppléments naturels.
La voie intraveineuse (IV) présente un certain nombre d’avantages thérapeutiques, notamment (1) des taux sanguins plus élevés parce que l’administration par voie IV pulsée permet d’atteindre une concentration plus élevée qu’avec une dose orale, (2) une période d’élimination plus longue pour réduire le potentiel de neurotoxicité et (3) le contournement du système digestif, ce qui est particulièrement important pour les patients atteints de cancer à un stade avancé. Des données étaient disponibles sur le DCA IV à forte dose, jusqu’à 100 mg/kg/dose, qui ont confirmé son innocuité, à la fois chez des volontaires sains38 et chez des patients gravement malades.39 Les auteurs Eliaz et Khan ont élaboré un protocole de traitement par DCA IV et l’ont transposé dans la pratique clinique. Khan avait une expérience préalable, débutant en 2007, avec le DCA IV, l’utilisant pour traiter des patients présentant une obstruction intestinale complète. Cependant, il n’a pas été possible, lors de l’utilisation antérieure du DCA IV par Khan remontant à 2007, d’évaluer les réponses à long terme, car le traitement a eu lieu chez des patients en phase terminale dont le pronostic vital était de 4 à 6 semaines.
Cet article présente 3 cas illustrant les effets du traitement par DCA IV. Tous les patients et/ou les tuteurs des patients ont donné leur consentement pour la publication de leurs cas. Ces patients avaient un très mauvais pronostic et/ou n’avaient pas répondu au traitement conventionnel. Tous les patients ont tiré des bénéfices significatifs du traitement par DCA, avec des effets secondaires minimes, sans myélosuppression et sans toxicité pour les organes. Les patients de ces études de cas ont été traités en coopération avec les trois auteurs, qui sont des médecins naturopathes. Ils ont développé des protocoles individuels incluant des adjuvants naturels, tels que le traitement par acide ascorbique/vitamine C IV (IVC) et des agents neuroprotecteurs naturels.
CAS 1 : CANCER DES COLONS
Un homme de 79 ans a demandé un traitement pour un cancer du côlon métastatique, avec un diagnostic initial d’adénocarcinome sigmoïde T3N1M0 modérément différencié. Il avait des antécédents d’angine, d’infarctus du myocarde, de quadruple pontage coronarien, d’hypertension, d’hypercholestérolémie et de diverticulose. Il a été initialement traité par une hémicolectomie gauche et une colostomie, suivies d’une chimiothérapie au 5-fluorouracile (5-FU) et à l’irinotécan pendant environ 6 mois, puis d’une colostomie réversible.
Le patient est resté indemne pendant environ 3 ans, date à laquelle l’antigène carcinoembryonnaire (ACE) a commencé à augmenter, et une tomodensitométrie (TDM) a révélé de nouvelles métastases hépatiques et pulmonaires. Il a de nouveau été traité par chimiothérapie au 5-FU et à l’irinotécan pendant 3 cycles, qui se sont avérés inefficaces et compliqués par une fatigue et un malaise extrêmes. La chimiothérapie a été interrompue et le patient a été orienté vers les soins palliatifs.
La patiente a choisi de suivre un traitement naturopathique à la clinique d’un des auteurs, à partir de décembre 2010. Le traitement comprenait des remèdes homéopathiques et de l’IVC à une dose de 75 g deux fois par semaine, avec une augmentation subséquente du niveau d’énergie et une prise de poids. Les médicaments et les suppléments à l’époque étaient le pantoprazole, l’alfuzosine, le métoprolol, le ramipril, la simvastatine, l’amlodipine, le clopidogrel, la vitamine D, le complexe de vitamine B, l’acidophile et l’acide α-lipoïque. Le patient a poursuivi le traitement jusqu’en 2011 avec un bon contrôle des symptômes ; cependant, son CEA a continué à augmenter. Une tomodensitométrie en novembre 2011 a démontré une maladie hépatique étendue, diffuse et métastatique, ainsi que de nombreux nodules pulmonaires grossissants compatibles avec une progression de la maladie par intervalles. Le patient a alors choisi d’entreprendre une cure d’essai de DCA IV. Les tests sanguins de base ont été obtenus, y compris le CEA et les enzymes hépatiques, le 19 décembre 2011. La première dose de 3000 mg (41 mg/kg) de DCA IV a été administrée le 22 décembre 2011, ainsi que 50 g d’IVC. Un test CEA devait être réalisé 4 semaines plus tard mais a été répété par erreur 1 jour après la perfusion, en même temps que la mesure des enzymes hépatiques. Une réduction rapide des enzymes hépatiques et du CEA a été constatée. (Voir Figure 1 et Figure 2.)
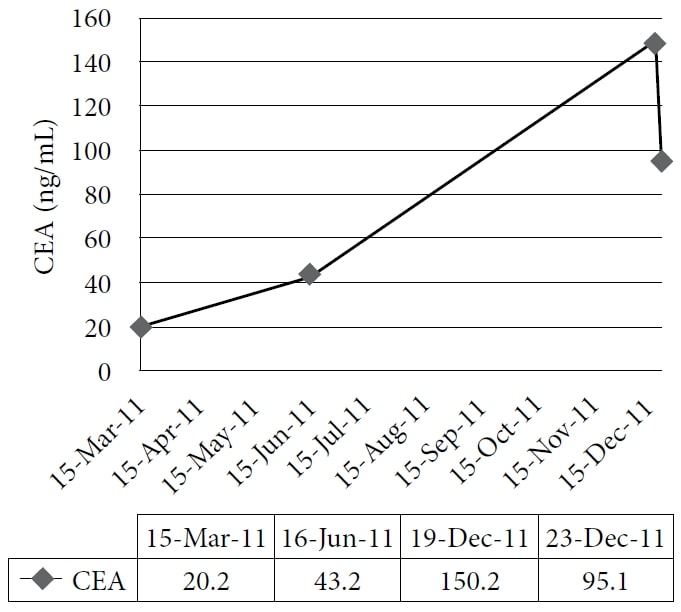
La figure montre l’augmentation progressive de l’antigène carcinoembryonnaire (ACE) pendant le traitement naturopathique et sa forte diminution après l’administration de dichloroacétate de sodium (DCA) par voie intraveineuse.
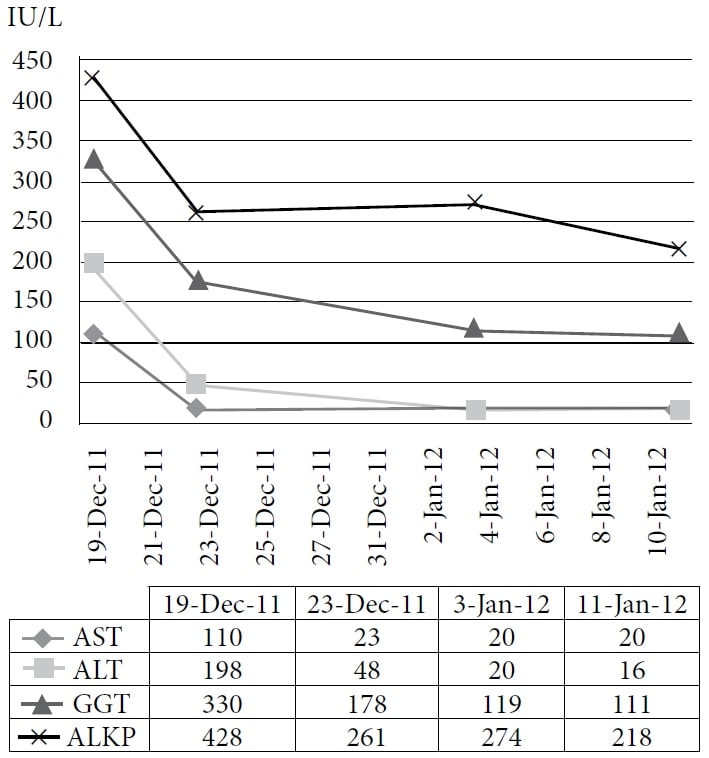
Abréviations : AST = aspartate aminotransférase ; ALT = alanine aminotransférase ; GGT = γ-glutamyl transpeptidase ; ALKP = phosphatase alcaline.
La figure montre la forte baisse immédiate et la diminution continue des enzymes hépatiques avec l’administration de DCA IV.
La deuxième perfusion de DCA a été administrée 6 jours plus tard à une dose de 3500 mg (48 mg/kg) en même temps que 35 g d’IVC. Après la perfusion, le patient a noté de nouveaux symptômes : frissons, sueurs et fatigue. Une troisième perfusion de DCA à la dose de 3700 mg (50 mg/kg) et 50 g d’IVC ont été administrés 8 jours après la deuxième dose, et les analyses sanguines ultérieures ont montré de nouvelles améliorations (Figure 2).
Cependant, le patient a de nouveau noté une brève période de fatigue et de malaise après la perfusion et, contre l’avis de ses médecins, a décidé d’arrêter le traitement en raison de ces effets secondaires. Une nouvelle échographie abdominale a été réalisée 1 mois après le traitement par DCA. Le rapport indiquait : « En tenant compte des différences dans les modalités d’imagerie, l’apparence des métastases hépatiques n’a pas changé de manière significative par rapport au précédent scanner de l’abdomen du 10 novembre 2011. » Les métastases pulmonaires n’ont pas été évaluées, car aucun symptôme respiratoire n’était évident.
CAS 2 : ANGIOSARCOME
Un homme de 43 ans a demandé un traitement pour un angiosarcome métastatique du fémur droit. Le patient avait des antécédents d’ostéosarcome du tibia droit, diagnostiqué à l’âge de 27 ans en 1995 et traité par résection et reconstruction de la tumeur par prothèse, suivie d’une chimiothérapie à la doxorubicine et au cisplatine. Ce cancer a été considéré comme guéri.
À l’âge de 39 ans, en 2007, il a consulté son médecin pour une douleur et un gonflement au-dessus du genou droit. Après une imagerie par résonance magnétique (IRM) et une biopsie, un diagnostic d’angiosarcome a été posé. Ce cancer a été considéré comme une tumeur maligne secondaire potentielle causée par une chimiothérapie antérieure. Le patient a reçu une chimiothérapie à base de doxorubicine et d’ifosfamide, mais le traitement prévu a été écourté en raison d’une infection et de lésions rénales consécutives à un traitement antibiotique à la vancomycine. Il a ensuite subi une résection de la tumeur et une reconstruction en 2008.
En 2009, un an après cette chirurgie, il a développé des métastases pulmonaires qui ont été enlevées chirurgicalement par résection du bord du poumon. D’autres métastases pulmonaires se sont ensuite développées, pour lesquelles le patient a subi 2 résections pulmonaires supplémentaires entre 2009 et 2011. En août 2011, une métastase de l’aile iliaque gauche a été identifiée et a été traitée par excision et radiothérapie. En octobre 2011, une nouvelle métastase de la queue du pancréas mesurant 6,1 × 5,7 cm a été diagnostiquée à la suite d’un scanner et a été traitée immédiatement par radiothérapie. Une métastase pulmonaire élargie, dans le lobe supérieur gauche, mesurant 12 mm a également été mise en évidence au scanner.
En novembre 2011, le patient a consulté l’un des auteurs, un médecin naturopathe. Le patient a été traité par Viscum album (extrait de gui) et IVC en IV. Les doses ont été augmentées à 300 mg de viscum album et 75 g d’IVC 3 fois par semaine. Il a également reçu des suppléments, notamment de la vitamine D, de la pectine d’agrumes modifiée, des enzymes digestives, des acides gras oméga-3, de la biopérine et de l’artémisinine.
En janvier 2012, un autre scanner a révélé de nouvelles petites métastases vertébrales malgré un traitement naturopathique agressif. La masse de la queue du pancréas s’était agrandie à 7,6 × 5,6 cm deux mois après la radiothérapie. De multiples nouveaux petits nodules pulmonaires ont été découverts. De nouvelles métastases osseuses lytiques ont été observées sur C3, T9, L2 et le manubrium.
En raison de la progression de la maladie, le patient a choisi de commencer une thérapie IV DCA en février 2012. Les résultats des analyses sanguines de base étaient significatifs : anémie (hémoglobine 101 g/L), insuffisance rénale légère (urée 12,6 mmol/L et créatinine 195 µmol/L) et légère élévation de la γ-glutamyl transpeptidase (GGT) (77 U/L). Sa phosphatase alcaline (ALKP) était normale. Avant le début du DCA, une IRM de la colonne vertébrale a été réalisée comme référence.
Le DCA IV a été commencé à une dose de 3000 mg (47 mg/kg) par semaine et augmenté sur une période de 2 semaines à 5000 mg (47 mg/kg) deux fois par semaine. Aucun effet secondaire n’a été observé. En même temps que le début du DCA, le patient a également reçu une radiothérapie stéréotaxique de la colonne vertébrale. Après deux mois de DCA IV, en association avec les traitements naturopathiques en cours, un scanner a révélé la stabilité de toutes les métastases pulmonaires et le rétrécissement de la métastase pancréatique de 7,6 × 5,6 cm à 5,9 × 5,2 cm. Une nouvelle zone de lucidité subtile a été observée à T12, avec une légère augmentation de la lucidité de toutes les autres métastases osseuses. Une scintigraphie osseuse au technétium réalisée en avril 2012 n’a montré aucune activité correspondante dans aucune des zones de lucidité observées sur le scanner. Une nouvelle IRM de la colonne vertébrale a confirmé une réponse mitigée, la plus grande croissance des métastases osseuses étant une augmentation de 1 à 2 mm.
Après un total de 4 mois de traitement par DCA IV, une IRM a démontré la stabilité de presque toutes les métastases de la colonne vertébrale, dont 2 ont été signalées comme étant légèrement plus grandes, sans précision de mesure. Aucune nouvelle métastase vertébrale n’a été notée. Un mois plus tard, après 5 mois de traitement par DCA IV, un scanner a montré que tous les nodules pulmonaires étaient stables, et que la masse pancréatique avait encore diminué de taille, passant de 5,9 × 5,2 cm à 4,4 × 4,4 cm. Aucune nouvelle métastase intrathoracique ou intra-abdominale n’était apparue. De nombreuses métastases osseuses existantes présentaient une légère augmentation de la lucidité. L’ALKP est restée normale, et aucune détérioration de la numération cellulaire ou de la fonction rénale n’est survenue. Bien qu’il ait poursuivi le traitement par DCA IV, le patient a commencé à rechercher des options thérapeutiques plus agressives, dans le but d’obtenir une rémission complète. À part la radiothérapie stéréotaxique spinale, aucun traitement conventionnel concomitant n’avait été administré en même temps que le DCA IV.
Le patient est resté cliniquement stable jusqu’en septembre 2012, date à laquelle il a interrompu le traitement par DCA IV après 8 mois de thérapie pour se rendre dans une clinique privée en Allemagne pour une chimiothérapie à faible dose, avec hyperthermie totale du corps et potentialisation de l’insuline.
CAS 3 : CARCINOME PANCRÉATIQUE NEUROENDOCRINE
Un garçon de 10 ans atteint d’un carcinome pancréatique neuroendocrinien métastatique a été amené du Portugal par ses parents à la clinique de l’un des auteurs au Canada pour un traitement par DCA après l’échec de la chimiothérapie conventionnelle. Il a d’abord consulté son médecin au Portugal pour des problèmes de fatigue et d’anorexie. Le diagnostic a été établi par échographie et biopsie, qui ont révélé une masse pancréatique avec des métastases dans les ganglions abdominaux et des métastases hépatiques étendues occupant tout le parenchyme hépatique. La scintigraphie des récepteurs de la somatostatine a mis en évidence une lésion pancréatique à forte captation, mais a montré une faible captation dans toutes les lésions hépatiques. Sur la base d’une discussion de cas multidisciplinaire avec l’équipe d’oncologie pédiatrique du centre régional de cancérologie de Lisbonne, au Portugal, 6 cycles de cisplatine et d’étoposide ont été choisis comme traitement primaire. Un scanner après deux cycles de chimiothérapie a montré une réduction des métastases et de la tumeur primaire. Au cinquième cycle, l’oncologue a noté une diminution de la réponse sur la base de nouvelles tomographies et de marqueurs sanguins, et le patient a commencé à se détériorer cliniquement avec une perte de poids, des nausées et des vomissements. L’équipe de transplantation a écarté la possibilité d’une chimiothérapie à forte dose et d’une transplantation hépatique. Le traitement a été abandonné après un traitement total de cisplatine à 600 mg/m2 et d’étoposide à 1800 mg/m2.
Le patient est arrivé au Canada pour une évaluation concernant la thérapie DCA 2 mois plus tard. Les médicaments qu’il prenait alors comprenaient du métoclopramide, de l’ondansétron, du fluconazole, du lopéramide, de l’ésoméprazole, de la naltrexone (4,5 mg) au coucher et du paracétamol (acétaminophène). Le DCA à une dose de 2500 mg IV (74 mg/kg) et l’octréotide à une dose de 100 µg IV ont été initiés deux fois par semaine en clinique. L’octréotide a été ajouté dans l’espoir d’une action renforcée contre la tumeur pancréatique principale uniquement ; il avait montré une forte captation sur une scintigraphie antérieure des récepteurs de la somatostatine. Le traitement a été commencé dans les deux semaines suivant la dernière tomodensitométrie. Un traitement de soutien par voie intraveineuse a été administré simultanément et se composait d’acide R-α-lipoïque à 250 mg, d’acides aminés, d’IVC, de calcium, de magnésium, de complexe de vitamines B et de minéraux multitraces, sans cuivre. Après 2 perfusions, l’IVC a été augmenté de 5 à 20 g après que la sécurité ait été confirmée par un taux sérique normal de glucose-6-phosphate déshydrogénase (G6PD). L’octréotide a été augmenté à 100 µg par voie IV par jour.
Le patient a ressenti une augmentation transitoire de la douleur abdominale et une nouvelle douleur à l’extrémité de son épaule gauche un jour après les perfusions. Il a également signalé une augmentation de son niveau d’énergie. Il a continué à ressentir une escalade temporaire de la douleur après chaque perfusion, qui a été bien gérée avec de la morphine orale, après avoir arrêté la naltrexone. Il a été traité deux fois par semaine pendant deux semaines au cabinet. De nouvelles analyses sanguines après 4 traitements IV ont révélé une réduction de l’alanine aminotransférase (ALT), une stabilité de l’aspartate aminotransférase (AST) et de la GGT, une forte augmentation de l’acide lactique déshydrogénase (LDH) et une baisse de l’hémoglobine (tableau 1). Il a ensuite été remis aux soins de ses médecins au Portugal, qui ont poursuivi le traitement par DCA IV ainsi que le soutien par IVC et l’acide α-lipoïque IV, sans complications.
| Nom | Avant DCA | Après 4 doses | Après 12 doses | Unités |
| Hémoglobine | 91 | 71 | 81 | g/L |
| Globules blancs | 5.7 | 8.2 | 8.2 | ×109/L |
| Plaquettes | 227 | 171 | 171 | ×109/L |
| Phosphatase alcaline | 188 | 206 | 122 | U/L |
| LDH | 988 | 1784 | 1449 | U/L |
| GGT | 169 | 171 | 76 | U/L |
| AST | 54 | 55 | 70 | U/L |
| ALT | 23 | 15 | 15 | U/L |
Abréviations : LDH = acide lactique déshydrogénase ; GGT = γ-glutamyl transpeptidase ; AST = aspartate aminotransférase ; ALT = alanine aminotransférase.
Un scanner après un total de 6 semaines de traitement a montré un rétrécissement de la plus grande métastase hépatique de 2 cm (Figures 3A et 3B). La deuxième plus grande métastase a également rétréci de près de 2 cm (Figures 4A et 4B).
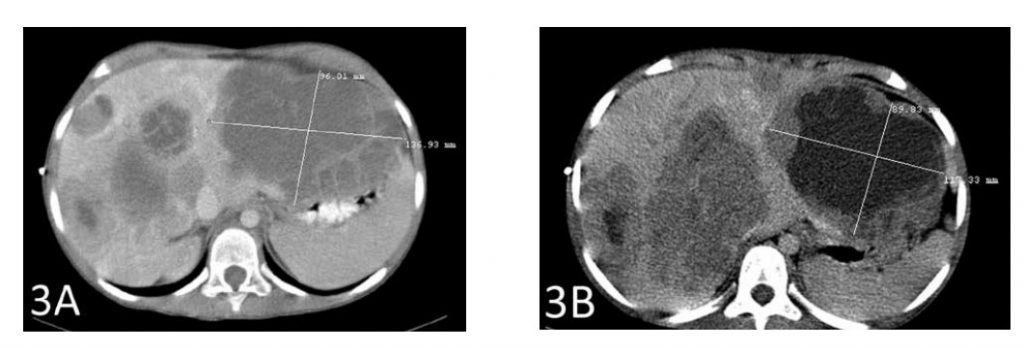
La figure 3A montre la plus grande métastase avant le début du traitement par DCA IV. La figure 3B montre le rétrécissement de cette tumeur de 2 cm après le traitement
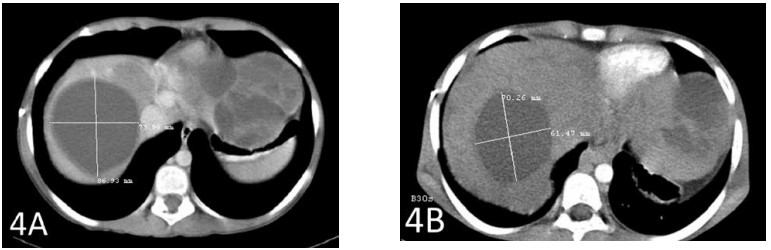
La figure 4A montre la deuxième plus grande métastase avant le début du traitement par DCA IV. La figure 4B montre le rétrécissement de cette tumeur de près de 2 cm.
Une nouvelle scintigraphie à la somatostatine (tomographie par émission de positons au gallium 68) réalisée une semaine après la tomodensitométrie n’a montré « aucun signe de lésions tumorales avec une expression accrue des récepteurs 2, 3 ou 5 de la somatostatine » Sur la base de ce résultat, l’octréotide IV a été interrompu et le traitement par DCA a été maintenu. Le patient est resté cliniquement stable, sans changement de traitement, pendant trois mois supplémentaires. À ce moment-là, il a demandé l’arrêt du traitement parce que son objectif personnel était d’atteindre un statut fonctionnel de niveau ECOG 0 (pleinement actif et sans restriction des capacités physiques), et que cet objectif était considéré comme irréalisable.
DISCUSSION
Nous avons présenté trois cas de traitement par DCA IV chez des patients atteints d’un cancer avancé, dans lesquels les auteurs ont observé des réponses cliniques, biochimiques ou radiologiques favorables.
Le cas 1 illustre la réponse biochimique d’un cancer du côlon métastatique à un DCA IV, associé à une dose élevée d’IVC. Auparavant, le CEA du patient avait augmenté de façon constante alors qu’il n’utilisait l’IVC que depuis 10 mois. Par conséquent, la diminution du CEA peut être attribuée au traitement par DCA. Étant donné que la littérature fait état d’un potentiel de réduction de l’ACE de plus de 50 % dans les 10 heures suivant une métastatectomiehépatique40, une forte baisse de l’ACE un jour après tout autre traitement est plausible si le cancer a répondu rapidement et ne doit pas être considérée comme un résultat erroné. En outre, la baisse rapide des enzymes hépatiques est cohérente avec une réduction des lésions hépatiques résultant de la mort des cellules cancéreuses ou de l’inhibition de la croissance.
L’échographie réalisée après le traitement au DCA n’a signalé aucun changement dans la taille des tumeurs ; cependant, aucun examen de référence n’était disponible immédiatement avant le début du traitement au DCA, et le scanner de comparaison a été réalisé deux mois avant le début du traitement. Ainsi, aucune conclusion ne peut être tirée quant à l’existence d’une réduction de la taille de la tumeur. Dans les limites de la durée des scans et de la comparaison entre le CT et l’échographie, les auteurs ont au moins observé une stabilité de la tumeur. Aucune conclusion ne peut être tirée sur la durabilité de la réponse car le patient a interrompu le traitement très tôt. Les auteurs ont conclu que le DCA IV semble avoir une activité chez l’homme contre l’adénocarcinome du côlon.
Le cas 2 illustre une réponse partielle d’un angiosarcome métastatique au DCA IV en combinaison avec des thérapies naturelles. Malgré une anémie préexistante et une insuffisance rénale chronique, un traitement efficace a été possible car le DCA n’est pas myélosuppressif ni néphrotoxique. Ce patient a bénéficié d’une réduction d’une importante métastase pancréatique, qui n’avait pas répondu à une radiothérapie antérieure. Une réduction de plus de 30 % de la taille correspond à la définition d’une réponse partielle selon les critères d’évaluation de la réponse dans les tumeurs solides (RECIST). Le résultat est une stabilité dans les multiples métastases pulmonaires et une stabilité presque complète dans les métastases osseuses existantes. La réponse des métastases osseuses pourrait être attribuable à la radiothérapie stéréotaxique spinale concomitante, mais pas la réponse des autres métastases. De minuscules nouvelles métastases osseuses sont apparues au cours du traitement initial de 5 mois par DCA. Aucune nouvelle métastase intrathoracique ou intra-abdominale n’est apparue pendant le traitement par DCA, alors que les métastases pulmonaires et pancréatiques s’étaient développées avant ce traitement. Le patient n’a ressenti aucun effet secondaire significatif lié au traitement.
On peut s’attendre à des réponses mitigées en raison de l’hétérogénéité des tumeurs. Une autre explication possible de la réponse améliorée de la métastase pancréatique par rapport aux métastases pulmonaires est que le DCA peut avoir une plus grande efficacité dans les tumeurs préradiées. Ce résultat a été rapporté précédemment.41 Une réponse partielle est encourageante étant donné le mauvais pronostic du patient, en particulier parce que le traitement a été bien toléré, sans toxicité hématologique, rénale ou neurologique. Avec des thérapies plus douces et non toxiques, une réponse partielle peut être tout à fait acceptable et ne doit pas être abandonnée. Les auteurs ont conclu que le DCA IV semble avoir une activité chez l’homme contre l’angiosarcome.
Le cas 3 illustre la réduction de la tumeur avec le DCA IV lorsqu’il est associé à une dose élevée de IVC. Ce résultat est classé comme une maladie stable selon la définition RECIST car la réduction tumorale était inférieure à 30%. Des effets secondaires minimes ont été observés. D’après les scintigraphies à l’octréotide réalisées avant et après le traitement, le rétrécissement des grandes métastases hépatiques ne peut pas être attribué au traitement à l’octréotide ; aucune des scintigraphies n’a révélé la présence de récepteurs à l’octréotide dans les métastases hépatiques. De plus, la disparition des récepteurs d’octréotide de la tumeur pancréatique souligne encore plus l’absence de bénéfice lié au traitement par octréotide. Ainsi, la réponse peut être attribuée à l’administration de DCA, associée à des médicaments naturels. Une flambée temporaire de la douleur liée à la tumeur est parfois notée avec le DCA IV et peut être un signe de réponse tumorale avec l’inflammation qui en résulte. Une augmentation soudaine du taux de LDH sérique du patient est cohérente avec cet effet. En raison de la courte durée de l’évaluation, aucune conclusion ne peut être tirée quant à la durabilité de la réponse. Les auteurs ont conclu que le DCA IV semble avoir une activité chez l’homme contre le carcinome pancréatique neuroendocrine.
Les cas présentés indiquent que le DCA IV est un traitement anticancéreux prometteur. Tous les patients ont tiré des bénéfices significatifs de leur traitement, avec des effets secondaires subjectifs minimes et aucune toxicité hématologique, rénale ou neurologique, malgré le stade avancé de la maladie dans tous les cas. Les traitements tels que le IVC à forte dose associé au DCA ont apporté un soutien en termes de qualité de vie et ont pu avoir un effet synergique avec le DCA IV. Cependant, il était clair que ces traitements seuls n’expliquaient pas les réponses tumorales. Il est intéressant de noter que tous les patients de cette série de cas ont utilisé l’IVC avec le DCA IV. On pense que l’IVC peut exercer un effet anticancéreux par immunomodulation42,43 ou par induction de l’autophagie médiée par la génération de H2O2 et la déplétion de l’ATP.44-46 Il a été démontré que l’IVC agit comme un adjuvant dans d’autres thérapies anticancéreuses, comme la gemcitabine dans le carcinome du pancréas.47-49 Par conséquent, l’IVC pourrait avoir un rôle important comme adjuvant au DCA IV dans le traitement des cancers avancés.
A ce jour, 4 essais cliniques actifs étudient le rôle du DCA oral dans le traitement du cancer, mais aucun essai n’étudie actuellement la voie d’administration IV. En raison du statut non exclusif du DCA, il est difficile pour les chercheurs de réunir les fonds nécessaires à la réalisation d’essais sur l’homme. On espère que ces cas illustrant les avantages du DCA IV encourageront des investigations cliniques plus formelles. D’autres recherches in vitro et in vivo sont nécessaires pour aider à définir les mécanismes d’action du DCA et les spécificités du type de tumeur et du microenvironnement qui répondent favorablement à ce médicament. Des essais cliniques avec des patients dont les tumeurs sont déjà connues pour répondre favorablement au DCA sont justifiés pour mieux évaluer les bénéfices du médicament et optimiser le schéma thérapeutique. Le DCA s’est révélé prometteur en combinaison avec certains agents chimiothérapeutiques conventionnels, un avantage qui devrait également être exploré davantage.
CONCLUSION
D’après la littérature et l’expérience clinique des auteurs, le DCA IV hors indication est une option thérapeutique prometteuse pour les patients qui comprennent et acceptent pleinement ses risques et ses avantages, en particulier ceux qui n’ont aucune option thérapeutique conventionnelle à leur disposition. Ces études de cas montrent que le DCA a le potentiel de prolonger la vie sans réduire la qualité de vie des patients par des effets secondaires débilitants ni compromettre les fonctions physiologiques, même pour les maladies à un stade très avancé. Dans les cas présentés, le traitement par DCA IV était de durée limitée, ce qui rend difficile l’estimation du degré de bénéfice en termes de survie. Cependant, sur la base de l’expérience des auteurs en matière d’utilisation chronique du DCA oral, le plus long survivant actuel étant un homme de 48 ans atteint d’un glioblastome qui est resté stable pendant 6 ans sous DCA oral sans traitement conventionnel, les auteurs pensent que le médicament offre un potentiel de stabilisation et/ou de régression à long terme ainsi qu’une amélioration substantielle de la survie. Étant donné son caractère abordable et sa faible toxicité, le DCA mérite d’être étudié plus avant.
REMERCIEMENTS
Les auteurs souhaitent remercier le Dr Humaira Khan pour son aide et également les patients pour leur soutien et leur consentement à la publication de leurs cas.
DÉCLARATION DES AUTEURS
Dans leurs cliniques respectives, les auteurs ont administré des protocoles individualisés, intégratifs et adjuvants à des patients atteints de cancer contre rémunération, y compris le coût d’un ou plusieurs des médicaments mentionnés dans cette publication. Les cliniques sont la propriété des auteurs et/ou des membres de leur famille. Les auteurs n’ont reçu aucune autre subvention ou soutien financier pour cette étude.
RÉFÉRENCES
1 1. résultats de la recherche « Dichloroacetate cancer ». Site Web ClinicalTrials.gov. http:// clinicaltrials.gov/ct2/results?term=dichloroacetate+cancer. Consulté le 22 juillet 2014.
2 Stacpoole PW, Harman EM, Curry SH, Baumgartner TG, Misbin RI. Traitement de l’acidose lactique avec le dichloroacétate. N Engl J Med. 1983;309(7):390-396.
3 Stacpoole PW, Lorenz AC, Thomas RG, Harman EM. Le dichloroacétate dans le traitement de l’acidose lactique. Ann Intern Med. 1988;108(1):58-63.
4StacpoolePW, Wright EC, Baumgartner TG, et al. A controlled clinical trial of dichloroacetate for treatment of lactic acidosis in adults : the DichloroacetateLactic Acidosis Study Group. N Engl J Med. 1992;327(22):1564-1569.
5 Stacpoole PW, Kurtz TL, Han Z, Langaee T. Role of dichloroacetate in the treatment of genetic mitochondrial diseases. Adv Drug Deliv Rev. 2008;60(13- 14):1478-1487.
6 Stacpoole PW, Kerr DS, Barnes C, et al. Controlled clinical trial of dichloroacetate for treatment of congenital lactic acidosis in children. Pediatrics. 2006;117(5):1519-1531.
7 Kaufmann P, Engelstad K, Wei Y, et al. Dichloroacetate causes toxic neuropathy in MELAS : a randomized, controlled clinical trial. Neurology. 2006;66(3):324-330.
8 Brandsma D, Dorlo TP, Haanen JH, Beijnen JH, Boogerd W. Encéphalopathie et polyneuropathie sévères induites par le dichloroacétate. J Neurol. 2010;257(12):2099-2100.
9 Stacpoole PW, Gilbert LR, Neiberger RE, et al. Evaluation du traitement à long terme d’enfants atteints d’acidose lactique congénitale par le dichloroacétate. Pediatrics. 2008;121(5):e1223-e1228.
10 Bonnet S, Archer SL, Allalunis-Turner J, et al. A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth. Cancer Cell. 2007;11(1):37-51.
11 Madhok BM, Yeluri S, Perry SL, Hughes TA, Jayne DG. Le dichloroacétate induit l’apoptose et l’arrêt du cycle cellulaire dans les cellules cancéreuses colorectales. Br J Cancer. 2010;102(12):1746-1752.
12 Cao W, Yacoub S, Shiverick KT, et al. Le dichloroacétate (DCA) sensibilise in vitro les cellules cancéreuses de la prostate de type sauvage et sur-exprimant Bcl-2 aux radiations. Prostate. 2008;68(11):1223-1231.
13 Saed GM, Fletcher NM, Jiang ZL, Abu-Soud HM, Diamond MP. Le dichloroacétate induit l’apoptose des cellules cancéreuses épithéliales ovariennes par un mécanisme impliquant la modulation du stress oxydatif. Reprod Sci. 2011;18(12):1253-1261.
14 Vella S, Conti M, Tasso R, Cancedda R, Pagano A. Le dichloroacétate inhibe la croissance des neuroblastomes en agissant spécifiquement contre les cellules indifférenciées malignes. Int J Cancer. 2012;130(7):1484-1493.
15 Fiebiger W, Olszewski U, Ulsperger E, Geissler K, Hamilton G. Cytotoxicité in vitro de nouveaux médicaments à base de platine et du dichloroacétate contre des lignées de cellules carcinoïdes pulmonaires. Clin Transl Oncol. 2011;13(1):43-49.
16 Liu D, Liu S, Jing X, Li X, Li W, Huang Y. Nécrose du carcinome cervical par le dichloroacétate libéré par les tapis de polylactide électrospun. Biomatériaux. 2012;33(17):4362-4369.
17 Wong JY, Huggins GS, Debidda M, Munshi NC, De Vivo I. Le dichloroacétate induit l’apoptose dans les cellules cancéreuses de l’endomètre. Gynecol Oncol. 2008;109(3):394- 402.
18IshiguroT, Ishiguro R, Ishiguro M, Iwai S. Le co-traitement du dichloroacétate, de l’oméprazole et du tamoxifène présente un effet antiprolifératif synergique sur les tumeurs malignes : expériences in vivo et rapport de cas. Hépatogastroentérologie. 2012;59(116):994-996.
19 Sorokina LV, Pyatchanina TV, Didenko GV, Kaplia AA, Khyzhnyak SV. L’influence du dichloroacétate de sodium sur les processus oxydatifs dans le sarcome 37. Exp Oncol. 2011;33(4):216-221.
20 Kumar A, Kant S, Singh SM. Nouveaux mécanismes moléculaires de l’action antitumorale du dichloroacétate contre le lymphome à cellules T : implication de l’altération du métabolisme du glucose, de l’homéostasie du pH et de la régulation de la survie cellulaire. Chem Biol Interact. 2012;199(1):29-37.
21 Sutendra G, Dromparis P, Kinnaird A, et al. L’activation mitochondriale par l’inhibition de PDKII supprime la signalisation HIF1a et l’angiogenèse dans le cancer. Oncogene. 2013;32(13):1638-1650.
22 Shahrzad S, Lacombe K, Adamcic U, Minhas K, Coomber BL. Le dichloroacétate (DCA) de sodium réduit l’apoptose dans l’hypoxie des tumeurs colorectales. Cancer Lett. 2010;297(1):75-83.
23 Anderson KM, Jajeh J, Guinan P, Rubenstein M. In vitro effects of dichloroacetate and CO2 on hypoxic HeLa cells. Anticancer Res. 2009;29(11):4579-4588.
24. Olszewski U, Poulsen TT, Ulsperger E, Poulsen HS, Geissler K, Hamilton G. Cytotoxicité in vitro des combinaisons de dichloroacétate avec des composés de platine anticancéreux. Clin Pharmacol. 2010;2:177-183.
25 Xie J, Wang BS, Yu DH, et al. Le dichloroacétate fait passer le métabolisme de la glycolyse à l’oxydation du glucose et présente une inhibition synergique de la croissance avec le cisplatine dans les cellules HeLa. Int J Oncol. 2011;38(2):409-417.
26 Données observationnelles sur le traitement DCA du Centre de cancer Medicor. Site Web des centres anticancéreux Medicor. http://medicorcancer.com/dca_therapy/dca-therapy-datajuly-2009/. Mis à jour le 1er juillet 2009. Consulté le 22 juillet 2014.
27 De Grandis D. Acetyl-L-carnitine for the treatment of chemotherapy-induced peripheral neuropathy : a short review. CNS Drugs. 2007;21(suppl 1):39-43.
28 Maestri A, De Pasquale Ceratti A, Cundari S, Zanna C, Cortesi E, Crino L. Une étude pilote sur l’effet de l’acétyl-L-carnitine dans la neuropathie périphérique induite par le paclitaxel et le cisplatine. Tumori. 2005;91(2):135-138.
29EvansJD, Jacobs TF, Evans EW. Role of acetyl-L-carnitine in the treatment of diabetic peripheral neuropathy. Ann Pharmacother. 2008;42(11):1686-1691.
30 Di Cesare Mannelli L, Ghelardini C, Toscano A, Pacini A, Bartolini A. L’agent neuroprotecteur acétyl-L-carnitine active la protéine kinase C-gamma et les MAPK dans un modèle de douleur neuropathique chez le rat. Neuroscience. 2010;165(4):1345-1352.
31 Mijnhout GS, Kollen BJ, Alkhalaf A, Kleefstra N, Bilo HJ. L’acide alpha-lipoïque pour la neuropathie périphérique symptomatique chez les patients diabétiques : une méta-analyse d’essais contrôlés randomisés. Int J Endocrinol. 2012;2012:456279.
32 Vallianou N, Evangelopoulos A, Koutalas P. Alpha-lipoic acid and diabetic neuropathy. Rev Diabet Stud. 2009;6(4):230-236.
33 Liu F, Zhang Y, Yang M, et al. Curative effect of alpha-lipoic acid on peripheral neuropathy in type 2 diabetes : a clinical study [en chinois]. Zhonghua Yi Xue Za Zhi. 2007;87(38):2706-2709.
34 Ziegler D, Hanefeld M, Ruhnau KJ, et al. Treatment of symptomatic diabetic peripheral neuropathy with the antioxidant alpha-lipoic acid : a 3-week multicentre randomized controlled trial (ALADIN Study). Diabetologia. 1995;38(12):1425-1433.
35 Winkler G, Kempler P. Pathomechanism of diabetic neuropathy : background of the pathogenesis-oriented therapy [en hongrois]. Orv Hetil. 2010;151(24):971- 981.
36 Ang CD, Alviar MJ, Dans AL, et al. Vitamine B pour le traitement de la neuropathie périphérique. Cochrane Database Syst Rev. 2008 ;(3):CD004573.
37 Winkler G, Pal B, Nagybeganyi E, Ory I, Porochnavec M, Kempler P. Effectiveness of different benfotiamine dosimens in the treatment of painful diabetic neuropathy. Arzneimittelforschung. 1999;49(3):220-224.
38 Savasi I, Evans MK, Heigenhauser GJ, Spriet LL. Skeletal muscle metabolism is unaffected by DCA infusion and hyperoxia after onset of intense aerobic exercise. Am J Physiol Endocrinol Metab. 2002;283(1):E108-E115.
39 Shangraw RE, Lohan-Mannion D, Hayes A, Moriarty RM, Fu R, Robinson ST. Le dichloroacétate stabilise l’équilibre acido-basique peropératoire pendant la transplantation du foie. Liver Transpl. 2008;14(7):989-998.
40. Lokich J, Ellenberg S, Gerson B, Knox WE, Zamcheck N. Plasma clearance of carcinoembryonic antigen following hepatic metastatectomy. J Clin Oncol. 1984;2(5):462-465.
41 Khan A. Use of oral dichloroacetate for palliation of leg pain arising from metastatic poorly differentiated carcinoma : a case report. J Palliat Med. 2011;14(8):973-977.
42 See D, Mason S, Roshan R. Augmentation du facteur de nécrose tumorale alpha (TNF-alpha) et de la fonction des cellules tueuses naturelles (NK) grâce à une approche intégrative dans les cancers de stade avancé. Immunol Invest. 2002;31(2):137-153.
43 Mikirova N, Casciari J, Rogers A, Taylor P. Effect of high-dose intravenous vitamin C on inflammation in cancer patients. J Transl Med. Septembre 2012;10:189.
44 Chen P, Yu J, Chalmers B, et al. L’ascorbate pharmacologique induit la cytotoxicité des cellules cancéreuses de la prostate par l’épuisement de l’ATP et l’induction de l’autophagie. Médicaments anticancéreux. 2012;23(4):437-444.
45 Chen P, Stone J, Sullivan G, Drisko JA, Chen Q. Effet anticancéreux de l’ascorbate pharmacologique et son interaction avec le glutathion parentéral supplémentaire dans des modèles de cancer précliniques. Free Radic Biol Med. 2011;51(3):681- 687.
46 Deubzer B, Mayer F, Kuci Z, et al. H(2)O(2)-mediated cytotoxicity of pharmacologic ascorbate concentrations to neuroblastoma cells : potential role of lactate and ferritin. Cell Physiol Biochem. 2010;25(6):767-774.
47 Welsh JL, Wagner BA, van’t Erve TJ, et al. Ascorbate pharmacologique avec gemcitabine pour le contrôle du cancer du pancréas métastatique et ganglionnaire (PACMAN) : résultats d’un essai clinique de phase I. Cancer Chemother Pharmacol. 2013;71(3):765-775.
48 Monti DA, Mitchell E, Bazzan AJ, et al. Évaluation de phase I de l’acide ascorbique intraveineux en association avec la gemcitabine et l’erlotinib chez les patients atteints de cancer du pancréas métastatique. PloS One. 2012;7(1):e29794.
49 Cullen JJ, Spitz DR, Buettner GR. Comment on « Pharmacologic ascorbate synergizes with gemcitabine in preclinical models of pancreatic cancer » ie, all we are saying is, give C a chance. Free Radic Biol Med. 2011;50(12):1726-1727.
Contenu connexe :