Akbar Khan, MD; Denis Marier, ND; Eric Marsden, ND; Douglas Andrews, ND; Isaac Eliaz, MD
Akbar Khan, MD, is medisch directeur van Medicor Cancer Centres, Inc, in Toronto, Ontario, Canada. Denis Marier, ND, is directeur van Canadian Clinic for Integrative Medicine in Windsor, Ontario. Eric Marsden, ND, is directeur van Marsden Center of Naturopathic Excellence in Maple, Ontario. Douglas Andrews, ND, is natuurgeneeskundig medewerker bij Medicor Cancer Centres, Inc. Isaac Eliaz, MD, is directeur van Amitabha Medical Clinic, in Santa Rosa, Californië.
Corresponderende auteur: Akbar Khan, MD E-mailadres: [email protected]
Abstract
Oraal dichlooracetaat-natrium (DCA) wordt momenteel onderzocht als enkelvoudig middel en als adjuvans voor de behandeling van verschillende kankers. Een van de factoren die het klinisch gebruik in een continu oraal regime beperken is een dosisgerelateerde, reversibele neurotoxiciteit, waaronder perifere neuropathie en encefalopathie. De intraveneuze (IV) route heeft een aantal potentiële voordelen, waaronder (1) gepulseerde dosering om hogere concentraties te bereiken dan haalbaar is bij oraal gebruik, (2) een langere uitwasperiode om de kans op neurotoxiciteit te verminderen, en (3) een omzeiling van het spijsverteringsstelsel, wat vooral belangrijk is voor kankerpatiënten in een gevorderd stadium. Er waren gegevens beschikbaar over IV DCA in hoge dosis (tot 100 mg/kg/dosis) die de veiligheid ervan bevestigden, zowel bij gezonde vrijwilligers als bij ernstig zieke patiënten, waardoor de auteurs konden beginnen met offlabel behandeling van kankerpatiënten. Bij verschillende van hun patiënten behandeld met IV DCA hebben de auteurs klinische, hematologische of radiologische reacties waargenomen. Dit artikel presenteert 3 gevallen van patiënten met terugkerende kankers en bij wie alle conventionele therapieën hadden gefaald: (1) een 79-jarige mannelijke patiënt met darmkanker met levermetastasen, (2) een 43-jarige mannelijke patiënt met angiosarcoom met pancreas- en botmetastasen, en (3) een 10-jarige mannelijke patiënt met pancreas neuro-endocrien carcinoom met levermetastasen. (Altern Ther Health Med. 2014;20(suppl 2):21-28.)
Oraal natriumdichlooracetaat (DCA) is een geneesmiddel dat momenteel wordt onderzocht als enkelvoudig middel en als aanvullende behandeling bij kanker.1 Op het moment van schrijven loopt er een fase I-proef met oraal DCA voor terugkerende of gemetastaseerde vaste tumoren aan de Universiteit van Alberta en twee proeven met oraal DCA voor hoofd-halskanker aan de Stanford University.
DCA is uitgebreid onderzocht door Stacpoole2-5 voor de behandeling van congenitale melkziekte, een groep van erfelijke mitochondriale ziekten. Het veiligheidsprofiel voor het gebruik van oraal DCA bij mensen is door dit onderzoek vastgesteld. Het middel is relatief veilig gebleken, zonder hematologische, cardiale, pulmonale of renale toxiciteit.6 De belangrijkste toxiciteit is neurologisch, voornamelijk perifere neuropathie, en deze aandoening is omkeerbaar.7 Een door DCA veroorzaakt delirium is waargenomen en is snel omkeerbaar bij staken van het middel.8 Een asymptomatische maar omkeerbare verhoging van leverenzymen kan voorkomen bij een klein percentage van de patiënten.9
In januari 2007 publiceerden Bonnet et al10 een baanbrekend artikel dat aantoonde dat DCA effectief was bij de behandeling van borst-, long- en hersenkanker bij mensen in vitro en in vivo (bij ratten) via nieuwe metabolische routes die betrekking hebben op remming van mitochondriaal pyruvaatdehydrogenase kinase. De onderzoekers meldden dat DCA selectief apoptose veroorzaakte in kankercellen door het mitochondriale membraanpotentieel te verlagen, aërobe glycolyse te blokkeren (Warburg-effect) en mitochondriale kalium-ionkanalen te activeren. Vervolgens is DCA verder bestudeerd en is gebleken dat het werkzaam is tegen verschillende soorten kanker, waaronder colon,11 prostaat,12 eierstok,13 neuroblastoom,14 longcarcinoïde,15 baarmoederhals,16 endometrium,17 cholangiocarcinoom,18 sarcoom19 en T-cel-lymfoom.20
Er zijn ook andere werkingsmechanismen van DCA tegen kankercellen voorgesteld. Deze omvatten (1) remming van angiogenese,21 (2) wijziging van de expressie van hypoxie-induceerbare factor 1-α (HIF1-α),21 en (3) wijziging van de pH-regulatoren vacuolair-type H+-ATPase(V-ATPase) en monocarboxylaattransporter 1 (MCT1) en andere regulatoren van celoverleving, zoals p53-upregulated modulator of apoptosis (PUMA), glucose transporter 1 (GLUT1), B-cell lymphoma 2 (BCL2) proteïne, en cellulair tumorantigen p53 (p53).20 Sommige studies hebben echter andere resultaten opgeleverd, waarbij een verminderde apoptose in bepaalde kankercellijnen onder hypoxische omstandigheden werd aangetoond.22,23
In vitro is ook aangetoond dat DCA de cytotoxiciteit van geselecteerde platinaverbindingen verhoogt, wat wijst op een potentieel voor klinische toepassing bij platina-resistente kleincellige longkanker, sarcoom van Ewing en eierstokkanker.24 In een ander in vitro-onderzoek werden significante, synergetische, antiproliferatieve effecten gevonden met een combinatie van DCA en cisplatine bij cellijnen van baarmoederhalskanker.25 Uit de literatuur blijkt duidelijk een potentieel voor verder onderzoek en ontwikkeling van DCA.
Op basis van oorspronkelijk werk van Bonnet et al.10 begon een van de huidige auteurs in 2007 oraal DCA te gebruiken als off-label behandeling voor kankerpatiënten met een slechte prognose of die niet hadden gereageerd op conventionele kankertherapieën. Perifere neuropathie26 bleek de belangrijkste factor te zijn die de klinische bruikbaarheid beperkte. Deze auteur ontwikkelde in samenwerking met een andere auteur, een natuurgeneeskundige, een DCA-protocol om de neuropathie aan te pakken. Dit werk resulteerde in een oraal DCA-regime dat de natuurlijke neuroprotectieve geneesmiddelen acetyl-L-carnitine,27-30 R-α-liponzuur,31-34 en benfotiamine bevatte.35-37 Klinische observatie van meer dan 300 patiënten met gevorderde kanker die met dit regime werden behandeld, toonde aan dat 60% tot 70% meetbare voordelen van DCA vertoonde. Het risico op neuropathie bedroeg ongeveer 20%, met een dosis DCA van 20 tot 25 mg/kg/dag in een cyclus van 2 weken op 1 week af, in combinatie met de 3 natuurlijke supplementen.
De intraveneuze (IV) route heeft een aantal therapeutische voordelen, waaronder (1) hogere bloedspiegels omdat met een gepulseerde IV-dosering een hogere concentratie kan worden bereikt dan met een orale dosis, (2) een langere uitwasperiode om de kans op neurotoxiciteit te verminderen, en (3) een omzeiling van het spijsverteringsstelsel, wat vooral belangrijk is voor kankerpatiënten in een gevorderd stadium. Er waren gegevens beschikbaar over hoge dosis, IV DCA tot 100 mg/kg/dosis die de veiligheid ervan hebben bevestigd, zowel bij gezonde vrijwilligers38 als bij ernstig zieke patiënten.39 Auteurs Eliaz en Khan ontwikkelden een IV-DCA behandelingsprotocol en vertaalden dit naar de klinische praktijk. Khan had vanaf 2007 al ervaring met IV DCA en gebruikte het om patiënten met volledige darmobstructie te behandelen. Bij Khan’s eerdere gebruik van IV DCA uit 2007 was het echter niet mogelijk om reacties op lange termijn te beoordelen, omdat de behandeling plaatsvond bij patiënten in het eindstadium met een prognose van 4 tot 6 weken levensverwachting.
Dit artikel presenteert 3 gevallen die de effecten van IV-DCA behandeling illustreren. Alle patiënten en/of voogden van patiënten gaven toestemming voor publicatie van hun gevallen. Deze patiënten hadden een zeer slechte prognose en/of hadden niet gereageerd op conventionele therapie. Alle patiënten hadden duidelijk baat bij de DCA-therapie, met minimale bijwerkingen, geen myelosuppressie en geen orgaantoxiciteit. De patiënten in deze casestudies werden behandeld in samenwerking met de 3 auteurs, die natuurgeneeskundige artsen zijn. Zij ontwikkelden individuele protocollen met natuurlijke hulpstoffen, zoals behandeling met IV ascorbinezuur/vitamine C (IVC) en natuurlijke neuroprotectieve middelen.
CASE 1: DARMKANKER
Een 79-jarige man zocht therapie voor uitgezaaide darmkanker, met een oorspronkelijke diagnose van T3N1M0 sigmoïd adenocarcinoom dat matig gedifferentieerd was. Comorbiditeiten waren angina, myocardinfarct, viervoudige coronaire bypass, hypertensie, hypercholesterolemie en diverticulose. Hij werd aanvankelijk behandeld met een linker hemicolectomie en colostomie, gevolgd door 5-fluorouracil (5-FU) en irinotecan chemotherapie gedurende ongeveer 6 maanden, en daaropvolgende omkering van de colostomie.
De patiënt bleef ongeveer 3 jaar ziektevrij, waarna het carcino-embryonaal antigeen (CEA) begon toe te nemen en een computertomografie (CT-scan) nieuwe lever- en longmetastasen liet zien. Hij werd opnieuw behandeld met 5-FU en irinotecan chemotherapie gedurende 3 cycli, die ineffectief waren en werden bemoeilijkt door extreme vermoeidheid en malaise. De chemotherapie werd gestaakt en de patiënt werd doorverwezen naar de palliatieve zorg.
De patiënt koos voor een natuurgeneeskundige behandeling in de kliniek van een van de auteurs, die in december 2010 begon. De therapie omvatte homeopathische middelen en IVC in een dosis van 75 g tweemaal per week, met als gevolg een verhoogd energieniveau en gewichtstoename. De medicijnen en supplementen waren toen pantoprazol, alfuzosine, metoprolol, ramipril, simvastatine, amlodipine, clopidogrel, vitamine D, vitamine B-complex, acidophilus en α-liponzuur. De patiënt zette de behandeling in 2011 voort met goede symptoombestrijding; zijn CEA bleef echter toenemen. Een CT-scan in november 2011 toonde uitgebreide, diffuse, metastatische leverziekte, en talrijke vergrote longknobbels die consistent waren met interval ziekteprogressie. De patiënt koos toen voor een proefkuur met IV DCA. Op 19 december 2011 werden bloedonderzoeken gedaan, waaronder CEA en leverenzymen. De eerste dosis van 3000 mg (41 mg/kg) IV DCA werd toegediend op 22 december 2011, samen met 50 g IVC. Een CEA-test zou 4 weken later worden uitgevoerd, maar werd per vergissing herhaald 1 dag na het infuus, samen met de meting van leverenzymen. Er werd een snelle vermindering van leverenzymen en CEA geconstateerd. (Zie figuur 1 en figuur 2.)
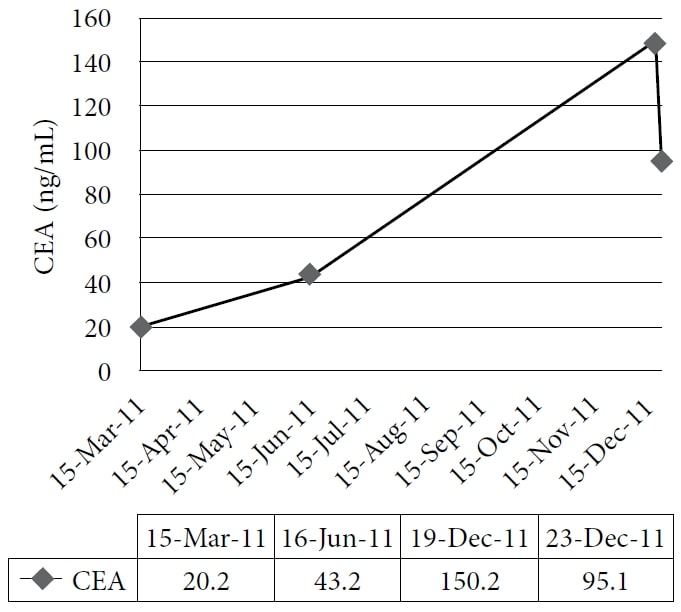
De figuur toont de geleidelijke toename van carcino-embryonaal antigeen (CEA) tijdens de natuurgeneeskundige behandeling en de scherpe daling ervan na toediening van intraveneus dichlooracetaat-natrium (DCA).
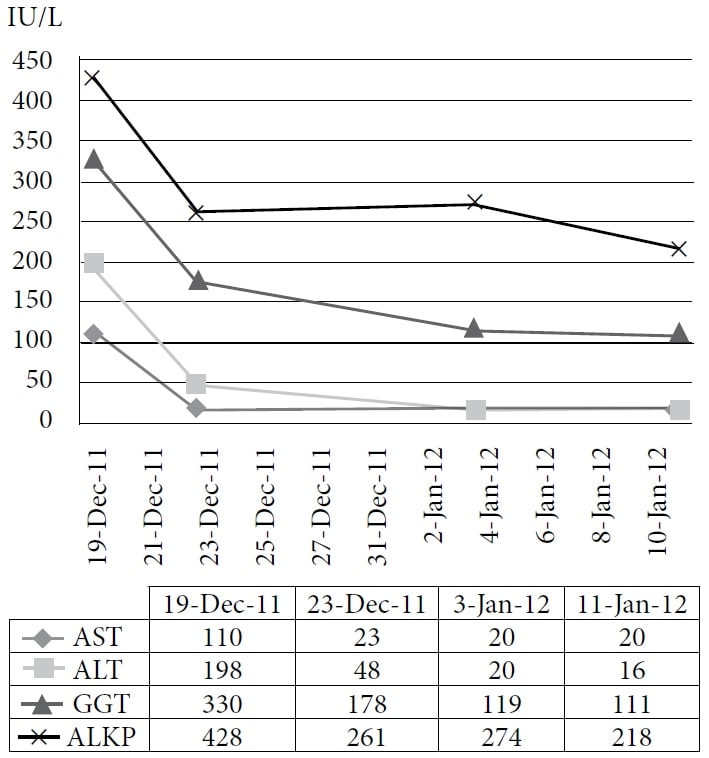
Afkortingen: AST = aspartaat aminotransferase; ALT = alanine aminotransferase; GGT = γ-glutamyltranspeptidase; ALKP = alkalische fosfatase.
De figuur toont de onmiddellijke scherpe daling en de voortdurende afname van leverenzymen bij toediening van IV DCA.
Het tweede DCA-infuus werd 6 dagen later toegediend in een dosis van 3500 mg (48 mg/kg) samen met 35 g IVC. Na het infuus vertoonde de patiënt nieuwe symptomen: koude rillingen, zweten en vermoeidheid. Een derde DCA-infuus in een dosis van 3700 mg (50 mg/kg) en 50 g IVC werd 8 dagen na de tweede dosis toegediend, waarbij latere bloedtests verdere verbeteringen lieten zien (figuur 2).
De patiënt merkte echter opnieuw een korte periode van vermoeidheid en malaise op na het infuus, en tegen het advies van zijn artsen in, besloot hij op grond van die bijwerkingen de behandeling te staken. Een maand na de DCA-behandeling werd een nieuwe buikechografie gemaakt. In het rapport stond: “Rekening houdend met verschillen in beeldvormingsmodaliteiten, is het uiterlijk van de levermetastasen niet significant veranderd ten opzichte van de vorige CT van de buik van 10 november 2011.” Longmetastasen werden niet geëvalueerd, omdat er geen ademhalingssymptomen waren.
GEVAL 2: ANGIOSARCOOM
Een 43-jarige man zocht een behandeling voor een uitgezaaid angiosarcoom van het rechter dijbeen. De patiënt had een geschiedenis van osteosarcoom van de rechter tibia, gediagnosticeerd op 27-jarige leeftijd in 1995 en behandeld met resectie en tumor-prothese reconstructie, gevolgd door doxorubicine en cisplatine chemotherapie. Deze kanker werd als genezen beschouwd.
Op 39-jarige leeftijd in 2007 raadpleegde hij zijn arts met pijn en zwelling boven de rechterknie. Na MRI en een biopsie werd de diagnose angiosarcoom gesteld. Deze kanker werd beschouwd als een mogelijke secundaire maligniteit veroorzaakt door de voorafgaande chemotherapie. De patiënt kreeg doxorubicine en ifosfamide chemotherapie, maar de voorgenomen kuur werd ingekort vanwege infectie en daaropvolgende nierschade als gevolg van antibiotische behandeling met vancomycine. Vervolgens onderging hij in 2008 een tumorresectie en reconstructie.
In 2009, een jaar na die operatie, ontwikkelde hij longmetastasen die operatief werden verwijderd met een longrandresectie. Vervolgens ontwikkelden zich verdere longmetastasen, waarvoor de patiënt tussen 2009 en 2011 nog 2 longresecties onderging. In augustus 2011 werd een metastase in de linker bekkenvleugel geïdentificeerd en behandeld met excisie en radiotherapie. In oktober 2011 werd een nieuwe pancreas-staart metastase van 6,1 × 5,7 cm gediagnosticeerd als resultaat van een CT-scan en werd onmiddellijk behandeld met radiotherapie. Een vergrote longmetastase in de linkerbovenkamer van 12 mm was ook zichtbaar op de CT-scan.
In november 2011 raadpleegde de patiënt een van de auteurs, een natuurgeneeskundig arts. De patiënt werd behandeld met IV Viscum album (maretak extract) en IVC. De doses werden opgevoerd tot 300 mg viscum album en 75 g IVC 3 keer per week. Hij kreeg ook supplementen, waaronder vitamine D, gemodificeerde citruspectine, spijsverteringsenzymen, omega-3 vetzuren, bioperine en artemisinine.
In januari 2012 toonde een nieuwe CT-scan nieuwe, kleine uitzaaiingen in de wervelkolom, ondanks agressieve natuurgeneeskundige therapie. De pancreasstaartmassa was vergroot tot 7,6 × 5,6 cm bij 2 maanden postradiotherapie. Er werden meerdere nieuwe, kleine longknobbels gevonden. Er werden nieuwe lytische botmetastasen gezien op C3, T9, L2 en het manubrium.
Op basis van de progressie van de ziekte koos de patiënt ervoor om in februari 2012 te beginnen met IV DCA-therapie. De resultaten van de baseline bloedtests waren significant voor anemie (hemoglobine 101 g/L), licht nierfalen (ureum 12,6 mmol/L en creatinine 195 µmol/L), en lichte γ-glutamyl transpeptidase (GGT) verhoging (77 U/L). Zijn alkalische fosfatase (ALKP) was normaal. Voorafgaand aan de start van de DCA werd een MRI van de wervelkolom uitgevoerd als baseline.
IV DCA werd gestart met een dosis van 3000 mg (47 mg/kg) per week en in een periode van 2 weken opgevoerd tot 5000 mg (47 mg/kg) tweemaal per week. Er werden geen bijwerkingen waargenomen. Gelijktijdig met het begin van de DCA kreeg de patiënt ook stereotactische radiotherapie voor de wervelkolom. Na 2 maanden IV DCA, in combinatie met de lopende natuurgeneeskundige behandelingen, toonde een CT-scan stabiliteit in alle longmetastasen en krimp van de pancreasmetastase van 7,6 × 5,6 cm tot 5,9 × 5,2 cm. Er werd een subtiel nieuw gebied van lucency gezien op T12, met een lichte toename in lucency van alle andere botmetastasen. Een technetium botscan in april 2012 toonde geen overeenkomstige activiteit in een van de gebieden van lucency gezien op de CT. Een nieuwe MRI van de wervelkolom bevestigde een gemengde respons, met als grootste botmetastische groei een toename van 1 tot 2 mm.
Na in totaal 4 maanden IV DCA-therapie toonde een MRI stabiliteit voor bijna alle wervelkolommetastasen, waarvan er 2 werden gerapporteerd als iets groter, zonder specifieke meting. Er werden geen nieuwe wervelmetastasen geconstateerd. Een CT-scan een maand later, na 5 maanden IV DCA, toonde aan dat alle longknobbels stabiel waren, en dat de pancreasmassa verder in omvang was afgenomen van 5,9 × 5,2 cm tot 4,4 × 4,4 cm. Er waren geen nieuwe intrathoracale of intra-abdominale metastasen opgetreden. Veel van de bestaande botmetastasen vertoonden een lichte toename van de helderheid. ALKP bleef normaal, en er was geen verslechtering van het celgetal of de nierfunctie opgetreden. Hoewel hij de IV DCA-therapie voortzette, begon de patiënt een zoektocht naar agressievere behandelingsmogelijkheden, met als doel volledige remissie te bereiken. Behalve spinale stereotactische radiotherapie was er geen gelijktijdige conventionele therapie gegeven tegelijk met de IV DCA.
De patiënt bleef klinisch stabiel tot september 2012, toen hij de behandeling met IV DCA na 8 maanden onderbrak om naar een privékliniek in Duitsland te gaan voor laaggedoseerde chemotherapie, met totale lichaamshyperthermie en insulinepotentiëring.
CASUS 3: NEURO-ENDOCRIEN PANCREASCARCINOOM
Een 10-jarige man met metastatisch, neuro-endocrien pancreascarcinoom werd door zijn ouders vanuit Portugal naar de kliniek van één van de auteurs in Canada gebracht voor behandeling met DCA, nadat conventionele chemotherapie was mislukt. Hij ging aanvankelijk naar zijn arts in Portugal met vermoeidheid en anorexia. De diagnose werd gesteld door echografie en biopsie, waarbij een pancreasmassa met abdominale-knoopmetastasen en uitgebreide levermetastasen die het gehele leverparenchym besloegen, werden gevonden. Somatostatinereceptorscintigrafie toonde een pancreaslaesie met hoge uptake, maar een lage uptake in alle leverlaesies. Op basis van een multidisciplinaire casusbespreking met het kinderoncologieteam van het regionale kankercentrum in Lissabon, Portugal, werden 6 cycli cisplatine en etoposide gekozen als primaire behandeling. Een CT-scan na 2 cycli chemotherapie toonde een vermindering van de metastasen en de primaire tumor. Bij de vijfde cyclus constateerde de oncoloog een afnemende respons op basis van nieuwe CT-scans en bloedmarkers, en de patiënt begon klinisch te verslechteren met gewichtsverlies, misselijkheid en braken. De mogelijkheid van hoge dosis chemotherapie en levertransplantatie werd door het transplantatieteam uitgesloten. De therapie werd gestaakt na een totale behandeling met cisplatine van 600 mg/m2 en etoposide van 1800 mg/m2.
De patiënt kwam 2 maanden later in Canada aan voor beoordeling van de DCA-therapie. Zijn medicatie bestond toen uit metoclopramide, ondansetron, fluconazol, loperamide, esomeprazol, naltrexon (4,5 mg) voor het slapen gaan en paracetamol (acetaminofen). DCA in een dosis van 2500 mg IV (74 mg/kg) en octreotide in een dosis van 100 µg IV werden tweemaal per week in de kliniek gestart. Octreotide werd toegevoegd in de hoop op een versterkte werking tegen alleen de belangrijkste pancreastumor; het had een hoge opname laten zien op een eerdere scan van de somatostatinereceptor. De therapie werd binnen 2 weken na de laatste CT-scan gestart. Gelijktijdig werd ondersteunende IV-behandeling gegeven, bestaande uit R-α-liponzuur van 250 mg, aminozuren, IVC, calcium, magnesium, vitamine B-complex en multitrace mineralen, zonder koper. Na 2 infusies werd het IVC verhoogd van 5 tot 20 g nadat de veiligheid was bevestigd door een normale serum-glucose-6-fosfaat dehydrogenase (G6PD)-spiegel. Octreotide werd verhoogd tot 100 µg per IV per dag.
De patiënt ervoer voorbijgaande toegenomen buikpijn en nieuwe pijn in zijn linkerschouderpunt 1 dag na de infusies. Hij meldde ook een toename van zijn energieniveau. Hij bleef een tijdelijke escalatie van pijn ervaren na elk infuus, die goed werd beheerd met orale morfine, na het staken van naltrexon. Hij werd twee keer per week behandeld gedurende 2 weken in de kantooromgeving. Nieuw bloedonderzoek na 4 IV-behandelingen toonde een verlaging van de alanine aminotransferase (ALT), stabiele aspartaat aminotransferase (AST) en GGT, een grote stijging van melkzuurdehydrogenase (LDH), en een daling van het hemoglobine (tabel 1). Hij werd vervolgens ontslagen naar de zorg van zijn artsen in Portugal, die de IV DCA-therapie voortzetten samen met ondersteunende IVC en IV α-liponzuur, zonder complicaties.
| Naam | Pre-DCA | Na 4 doses | Na 12 doses | Eenheden |
| Hemoglobine | 91 | 71 | 81 | g/L |
| Witte bloedcellen | 5.7 | 8.2 | 8.2 | ×109/L |
| Bloedplaatjes | 227 | 171 | 171 | ×109/L |
| Alkalische fosfatase | 188 | 206 | 122 | U/L |
| LDH | 988 | 1784 | 1449 | U/L |
| GGT | 169 | 171 | 76 | U/L |
| AST | 54 | 55 | 70 | U/L |
| ALT | 23 | 15 | 15 | U/L |
Afkortingen: LDH = melkzuurdehydrogenase; GGT = γ-glutamyltranspeptidase; AST = aspartaataminotransferase; ALT = alanineaminotransferase.
Een CT-scan na in totaal 6 weken therapie toonde een krimp van de grootste levermetastase met 2 cm (figuren 3A en 3B). De op één na grootste metastase kromp eveneens met bijna 2 cm (figuren 4A en 4B).
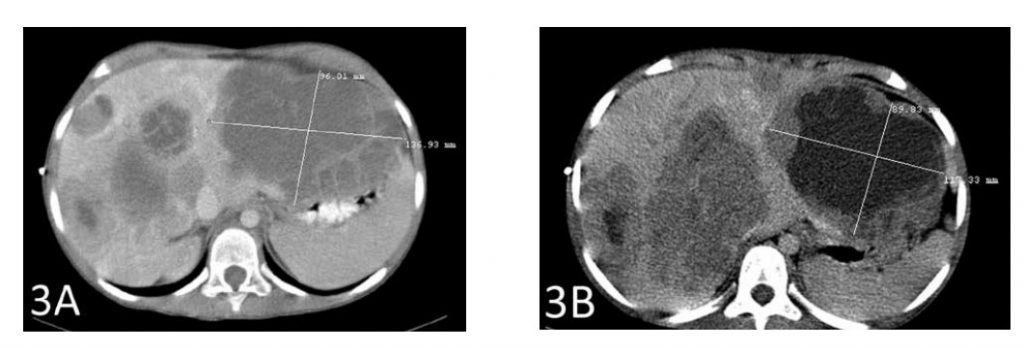
Figuur 3A toont de grootste metastase vóór het begin van de therapie met IV DCA. Figuur 3B toont de krimp van die tumor met 2 cm na de therapie
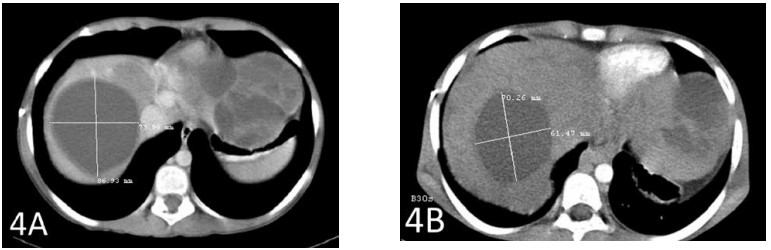
Figuur 4A toont de op één na grootste metastase vóór het begin van de therapie met IV DCA. Figuur 4B toont de krimp van die tumor met bijna 2 cm.
Een nieuwe somatostatinescan (gallium 68 positronemissietomografie) die een week na de CT-scan werd uitgevoerd, toonde “geen aanwijzingen voor tumorlaesies met verhoogde expressie van somatostatinereceptoren 2, 3 of 5” Op grond van deze bevinding werd de IV octreotide gestaakt, en werd de DCA-therapie voortgezet. De patiënt bleef klinisch stabiel zonder veranderingen in de therapie gedurende nog eens 3 maanden. Op dat moment verzocht hij de therapie te stoppen omdat zijn persoonlijke doel was een functionele status van ECOG-niveau 0 (volledig actief zonder fysieke beperkingen) te bereiken, en men dacht dat dit doel niet haalbaar was.
DISCUSSIE
Er zijn drie gevallen gepresenteerd van IV DCA-therapie voor patiënten met gevorderde kanker waarbij de auteurs gunstige klinische, biochemische of radiologische reacties hebben waargenomen.
Casus 1 illustreert de biochemische respons van uitgezaaide darmkanker op IV DCA, gecombineerd met een hoge dosis IVC. Eerder was de CEA van de patiënt gestaag gestegen terwijl hij slechts 10 maanden IVC had gebruikt. Daarom kan de daling van CEA worden toegeschreven aan de DCA-therapie. Omdat de literatuur melding maakt van een potentiële CEA-daling van meer dan 50% binnen 10 uur na een levermetastatectomie,40 is een grote daling van CEA op 1 dag na een andere therapie aannemelijk als de kanker snel heeft gereageerd en moet deze niet als een foutief resultaat worden beschouwd. Bovendien is de snelle daling van leverenzymen consistent met verminderde leverschade als gevolg van de dood van kankercellen of groeiremming.
De echografie na de behandeling met DCA meldde geen verandering in de tumorgrootte; er was echter geen uitgangsscan beschikbaar onmiddellijk vóór het begin van de DCA-behandeling, en de vergelijkende CT-scan werd 2 maanden vóór het begin van de therapie gemaakt. Er kunnen dus geen conclusies worden getrokken over de vraag of de tumorgrootte is afgenomen. Binnen de beperkingen van de tijdstippen van de scans en van een vergelijking tussen CT en echografie, hebben de auteurs op zijn minst tumorstabiliteit waargenomen. Er kunnen geen conclusies worden getrokken over de duurzaamheid van de respons omdat de patiënt de therapie zeer vroeg stopte. De auteurs concludeerden dat IV DCA bij mensen werkzaam lijkt te zijn tegen colon adenocarcinoom.
Casus 2 illustreert een gedeeltelijke respons van gemetastaseerd angiosarcoom op IV DCA in combinatie met natuurlijke therapieën. Ondanks reeds bestaande bloedarmoede en chronisch nierfalen was een effectieve behandeling mogelijk omdat DCA niet myelosuppressief of nefrotoxisch is. Bij deze patiënt werd een grote pancreasmetastase, die niet had gereageerd op eerdere radiotherapie, verkleind. Een afname van meer dan 30% in omvang voldoet aan de definitie van een gedeeltelijke respons volgens de Response Evaluation Criteria in Solid Tumors (RECIST). Stabiliteit in de meervoudige longmetastasen en bijna volledige stabiliteit in de bestaande botmetastasen was het resultaat. De respons van de botmetastasen kon worden toegeschreven aan gelijktijdige stereotactische spinale radiotherapie, maar de respons van de andere metastasen niet. Kleine, nieuwe botmetastasen verschenen tijdens de eerste kuur van 5 maanden DCA-therapie. Er verschenen geen nieuwe intrathoracale of intra-abdominale metastasen tijdens de DCA-therapie, terwijl de long- en pancreasmetastasen vóór die therapie waren gegroeid. De patiënt ondervond geen significante behandelingsgerelateerde bijwerkingen.
Gemengde reacties kunnen worden verwacht wegens tumorheterogeniteit. Een andere mogelijke verklaring voor de verbeterde respons van de pancreasmetastasen in vergelijking met de longmetastasen is dat DCA mogelijk een grotere werkzaamheid heeft in vooraf bestraalde tumoren. Dit resultaat is eerder gerapporteerd.41 Een gedeeltelijke respons is bemoedigend gezien de slechte prognose van de patiënt, vooral omdat de behandeling goed werd verdragen zonder hematologische, renale of neurologische toxiciteit. Met mildere, niet-toxische therapieën kan een gedeeltelijke respons volledig aanvaardbaar zijn en hoeft deze niet te worden opgegeven. De auteurs concludeerden dat IV DCA bij mensen werkzaam lijkt te zijn tegen angiosarcomen.
Casus 3 illustreert tumorreductie met IV DCA in combinatie met hoge dosis IVC. Dit resultaat is geclassificeerd als stabiele ziekte volgens de RECIST-definitie omdat de tumor minder dan 30% was afgenomen. Er werden minimale bijwerkingen waargenomen. Op basis van de octreotidescans voor en na de behandeling kan de afname van grote levermetastasen niet worden toegeschreven aan de octreotidetherapie; geen van beide scans toonde octreotidereceptoren in de levermetastasen. Bovendien benadrukt het verdwijnen van octreotidereceptoren uit de pancreastumor het gebrek aan voordeel van octreotidetherapie. De respons kan dus worden toegeschreven aan de toediening van DCA, gecombineerd met natuurlijke geneesmiddelen. Een tijdelijke opflakkering van tumorgerelateerde pijn wordt soms opgemerkt met IV DCA en kan een teken zijn van tumorrespons met daaruit voortvloeiende ontsteking. Een plotselinge stijging van het serum LDH van de patiënt is in overeenstemming met dit effect. Vanwege de korte duur van de beoordeling kan geen conclusie worden getrokken over de duurzaamheid van de respons. De auteurs concluderen dat IV DCA bij mensen werkzaam lijkt te zijn tegen neuro-endocrien pancreascarcinoom.
De gepresenteerde gevallen wijzen erop dat IV DCA een veelbelovende kankertherapie is. Alle patiënten hadden duidelijk baat bij hun behandeling, met minimale subjectieve bijwerkingen en geen hematologische, renale of neurologische toxiciteit, ondanks het gevorderde ziektestadium in alle gevallen. Behandelingen zoals hoge dosis IVC die werden gecombineerd met DCA waren ondersteunend in termen van levenskwaliteit en kunnen een synergetisch effect hebben gehad met de IV DCA. Het was echter duidelijk dat deze behandelingen alleen niet verantwoordelijk waren voor de tumorrespons. Het is interessant op te merken dat alle patiënten in deze casereeks IVC met IV DCA gebruikten. Aangenomen wordt dat IVC een antikankereffect kan uitoefenen door immunomodulatie42,43 of door inductie van autofagie gemedieerd door generatie van H2O2 en ATP depletie.44-46 IVC is aangetoond als adjuvans bij andere kankertherapieën, zoals gemcitabine bij pancreascarcinoom.47-49 Daarom kan IVC een belangrijke rol spelen als adjuvans voor IV DCA bij de behandeling van gevorderde kankers.
Op dit moment wordt in 4 actieve klinische onderzoeken de rol van oraal DCA als kankertherapie onderzocht, maar in geen enkel onderzoek wordt momenteel de route van intraveneuze toediening onderzocht. Omdat DCA geen eigendomsrecht heeft, is het voor onderzoekers moeilijk om op grote schaal fondsen te werven voor de uitvoering van proeven op mensen. Gehoopt wordt dat deze gevallen, die de voordelen van IV DCA illustreren, meer formele klinische onderzoeken zullen aanmoedigen. Verder in vitro en in vivo onderzoek is nodig om de werkingsmechanismen van DCA en de specifieke kenmerken van het tumortype en de micro-omgeving die gunstig reageren op dit geneesmiddel te helpen definiëren. Klinische proeven met patiënten van wie bekend is dat hun tumoren gunstig reageren op DCA zijn gerechtvaardigd om de voordelen van het geneesmiddel beter te beoordelen en het behandelingsregime te optimaliseren. DCA is veelbelovend gebleken in combinatie met sommige conventionele chemotherapeutische middelen, een voordeel dat ook verder moet worden onderzocht.
CONCLUSIE
Op basis van de literatuur en de klinische ervaring van de auteurs is off-label IV DCA een veelbelovende behandelingsoptie voor patiënten die de risico’s en voordelen ervan volledig begrijpen en aanvaarden, in het bijzonder voor patiënten die geen conventionele behandelingsmogelijkheden hebben. Deze casestudies tonen aan dat DCA het leven kan verlengen zonder de levenskwaliteit van patiënten te verminderen met invaliderende bijwerkingen of de fysiologische functie in gevaar te brengen, zelfs bij ziekte in een zeer vergevorderd stadium. In de gepresenteerde gevallen was de IV DCA-therapie van beperkte duur, waardoor het moeilijk is om de mate van overlevingsvoordeel in te schatten. Echter, gebaseerd op de ervaring van de auteurs met chronisch gebruik van orale DCA, met als langste overlevende een 48-jarige man met glioblastoom die al 6 jaar stabiel is op orale DCA zonder conventionele therapie, geloven de auteurs dat het medicijn mogelijkheden biedt voor stabilisatie en/of regressie op lange termijn, evenals een aanzienlijke verbetering van de overleving. Gezien de betaalbaarheid en lage toxiciteit verdient DCA verder onderzoek.
DANKBETUIGINGEN
De auteurs willen Dr Humaira Khan bedanken voor haar hulp en ook de patiënten voor hun steun en toestemming om hun gevallen te publiceren.
AUTEURSVERKLARING
Binnen hun respectieve klinieken dienden de auteurs geïndividualiseerde, integratieve, aanvullende protocollen toe aan patiënten met kanker tegen betaling, inclusief kosten voor 1 of meer van de in deze publicatie vermelde geneesmiddelen. De klinieken zijn eigendom van de auteurs en/of hun familieleden. De auteurs ontvingen geen andere subsidies of financiële steun voor deze studie.
VERWIJZINGEN
1 1. “Dichloroacetate cancer” zoekresultaten. Website van ClinicalTrials.gov. http:// clinicaltrials.gov/ct2/results?term=dichloroacetate+cancer. Geraadpleegd op 22 juli 2014.
2 Stacpoole PW, Harman EM, Curry SH, Baumgartner TG, Misbin RI. Behandeling van lactische acidose met dichlooracetaat. N Engl J Med. 1983;309(7):390-396.
3 Stacpoole PW, Lorenz AC, Thomas RG, Harman EM. Dichloroacetate in the treatment of lactic acidosis. Ann Intern Med. 1988;108(1):58-63.
4StacpoolePW, Wright EC, Baumgartner TG, et al. A controlled clinical trial of dichloroacetate for treatment of lactic acidosis in adults: the DichloroacetateLactic Acidosis Study Group. N Engl J Med. 1992;327(22):1564-1569.
5 Stacpoole PW, Kurtz TL, Han Z, Langaee T. Role of dichloroacetate in the treatment of genetic mitochondrial diseases. Adv Drug Deliv Rev. 2008;60(13- 14):1478-1487.
6 Stacpoole PW, Kerr DS, Barnes C, et al. Controlled clinical trial of dichloroacetate for treatment of congenital lactic acidosis in children. Pediatrics. 2006;117(5):1519-1531.
7 Kaufmann P, Engelstad K, Wei Y, et al. Dichloroacetate causes toxic neuropathy in MELAS: a randomized, controlled clinical trial. Neurology. 2006;66(3):324-330.
8 Brandsma D, Dorlo TP, Haanen JH, Beijnen JH, Boogerd W. Severe encephalopathy and polyneuropathy induced by dichloroacetate. J Neurol. 2010;257(12):2099-2100.
9 Stacpoole PW, Gilbert LR, Neiberger RE, et al. Evaluation of long-term treatment of children with congenital lactic acidosis with dichloroacetate. Pediatrics. 2008;121(5):e1223-e1228.
10 Bonnet S, Archer SL, Allalunis-Turner J, et al. A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth. Cancer Cell. 2007;11(1):37-51.
11 Madhok BM, Yeluri S, Perry SL, Hughes TA, Jayne DG. Dichloroacetate induceert apoptose en celcyclusstilstand in colorectale kankercellen. Br J Cancer. 2010;102(12):1746-1752.
12 Cao W, Yacoub S, Shiverick KT, et al. Dichloroacetate (DCA) sensitizes both wild-type and over expressing Bcl-2 prostate cancer cells in vitro to radiation. Prostate. 2008;68(11):1223-1231.
13 Saed GM, Fletcher NM, Jiang ZL, Abu-Soud HM, Diamond MP. Dichloroacetate induceert apoptose van epitheliale ovariumkankercellen via een mechanisme waarbij oxidatieve stress wordt gemoduleerd. Reprod Sci. 2011;18(12):1253-1261.
14 Vella S, Conti M, Tasso R, Cancedda R, Pagano A. Dichloroacetate inhibits neuroblastoma growth by specifically acting against malignant undifferentiated cells. Int J Cancer. 2012;130(7):1484-1493.
15 Fiebiger W, Olszewski U, Ulsperger E, Geissler K, Hamilton G. In vitro cytotoxicity of novel platinum-based drugs and dichloroacetate against lung carcinoid cell lines. Clin Transl Oncol. 2011;13(1):43-49.
16 Liu D, Liu S, Jing X, Li X, Li W, Huang Y. Necrose of cervical carcinoma by dichloroacetate released from electrospun polylactide mats. Biomaterials. 2012;33(17):4362-4369.
17 Wong JY, Huggins GS, Debidda M, Munshi NC, De Vivo I. Dichloroacetate induceert apoptose in endometriumkankercellen. Gynecol Oncol. 2008;109(3):394- 402.
18IshiguroT, Ishiguro R, Ishiguro M, Iwai S. Co-treatment of dichloroacetate, omeprazole and tamoxifen exhibited synergistically antiproliferative effect on malignant tumors: in vivo experiments and a case report. Hepatogastroenterologie. 2012;59(116):994-996.
19 Sorokina LV, Pyatchanina TV, Didenko GV, Kaplia AA, Khyzhnyak SV. De invloed van natriumdichlooracetaat op de oxidatieve processen in sarcoom 37. Exp Oncol. 2011;33(4):216-221.
20 Kumar A, Kant S, Singh SM. Novel molecular mechanisms of antitumor action of dichloroacetate against T cell lymphoma: implication of altered glucose metabolism, pH homeostasis and cell survival regulation. Chem Biol Interact. 2012;199(1):29-37.
21 Sutendra G, Dromparis P, Kinnaird A, et al. Mitochondrial activation by inhibition of PDKII suppresses HIF1a signaling and angiogenesis in cancer. Oncogene. 2013;32(13):1638-1650.
22 Shahrzad S, Lacombe K, Adamcic U, Minhas K, Coomber BL. Natriumdichlooracetaat (DCA) vermindert apoptose in colorectale tumorhypoxie. Cancer Lett. 2010;297(1):75-83.
23 Anderson KM, Jajeh J, Guinan P, Rubenstein M. In vitro effects of dichloroacetate and CO2 on hypoxic HeLa cells. Anticancer Res. 2009;29(11):4579-4588.
24. Olszewski U, Poulsen TT, Ulsperger E, Poulsen HS, Geissler K, Hamilton G. In vitro cytotoxicity of combinations of dichloroacetate with anticancer platinum compounds. Clin Pharmacol. 2010;2:177-183.
25 Xie J, Wang BS, Yu DH, et al. Dichloroacetate shifts the metabolism from glycolysis to glucose oxidation and exhibits synergistic growth inhibition with cisplatin in HeLa cells. Int J Oncol. 2011;38(2):409-417.
26 De observationele DCA-behandelingsgegevens van Medicor Kankercentra. Website Medicor Kankercentra. http://medicorcancer.com/dca_therapy/dca-therapy-datajuly-2009/. Bijgewerkt op 1 juli 2009. Geraadpleegd op 22 juli 2014.
27 De Grandis D. Acetyl-L-carnitine voor de behandeling van chemotherapie-geïnduceerde perifere neuropathie: een kort overzicht. CNS Drugs. 2007;21(suppl 1):39-43.
28 Maestri A, De Pasquale Ceratti A, Cundari S, Zanna C, Cortesi E, Crino L. A pilot study on the effect of acetyl-L-carnitine in paclitaxel- and cisplatin-induced peripheral neuropathy. Tumori. 2005;91(2):135-138.
29EvansJD, Jacobs TF, Evans EW. Role of acetyl-L-carnitine in the treatment of diabetic peripheral neuropathy. Ann Pharmacother. 2008;42(11):1686-1691.
30 Di Cesare Mannelli L, Ghelardini C, Toscano A, Pacini A, Bartolini A. The neuropathy-protective agent acetyl-L-carnitine activates protein kinase C-gamma and MAPKs in a rat model of neuropathic pain. Neuroscience. 2010;165(4):1345-1352.
31 Mijnhout GS, Kollen BJ, Alkhalaf A, Kleefstra N, Bilo HJ. Alfa liponzuur voor symptomatische perifere neuropathie bij patiënten met diabetes: een meta-analyse van gerandomiseerde gecontroleerde onderzoeken. Int J Endocrinol. 2012;2012:456279.
32 Vallianou N, Evangelopoulos A, Koutalas P. Alpha-liponzuur en diabetische neuropathie. Rev Diabet Stud. 2009;6(4):230-236.
33 Liu F, Zhang Y, Yang M, et al. Curatief effect van alfa-liponzuur op perifere neuropathie bij diabetes type 2: een klinische studie [in het Chinees]. Zhonghua Yi Xue Za Zhi. 2007;87(38):2706-2709.
34 Ziegler D, Hanefeld M, Ruhnau KJ, et al. Treatment of symptomatic diabetic peripheral neuropathy with the antioxidant alpha-lipoic acid: a 3-week multicentre randomized controlled trial (ALADIN Study). Diabetologia. 1995;38(12):1425-1433.
35 Winkler G, Kempler P. Pathomechanisme van diabetische neuropathie: achtergrond van de op pathogenese gerichte therapie [in het Hongaars]. Orv Hetil. 2010;151(24):971- 981.
36 Ang CD, Alviar MJ, Dans AL, et al. Vitamine B voor de behandeling van perifere neuropathie. Cochrane Database Syst Rev. 2008;(3):CD004573.
37 Winkler G, Pal B, Nagybeganyi E, Ory I, Porochnavec M, Kempler P. Effectiveness of different benfotiamine dose regimens in the treatment of painful diabetic neuropathy. Arzneimittelforschung. 1999;49(3):220-224.
38 Savasi I, Evans MK, Heigenhauser GJ, Spriet LL. Skeletal muscle metabolism is unaffected by DCA infusion and hyperoxia after onset of intense aerobic exercise. Am J Physiol Endocrinol Metab. 2002;283(1):E108-E115.
39 Shangraw RE, Lohan-Mannion D, Hayes A, Moriarty RM, Fu R, Robinson ST. Dichloroacetate stabilizes the intraoperative acid-base balance during liver transplantation. Liver Transpl. 2008;14(7):989-998.
40. Lokich J, Ellenberg S, Gerson B, Knox WE, Zamcheck N. Plasma clearance of carcinoembryonic antigen following hepatic metastatectomy. J Clin Oncol. 1984;2(5):462-465.
41 Khan A. Use of oral dichloroacetate for palliation of leg pain arising from metastatic poorly differentiated carcinoma: a case report. J Palliat Med. 2011;14(8):973-977.
42 See D, Mason S, Roshan R. Increased tumor necrosis factor alpha (TNF-alpha) and natural killer cell (NK) function using an integrative approach in late stage cancers. Immunol Invest. 2002;31(2):137-153.
43 Mikirova N, Casciari J, Rogers A, Taylor P. Effect of high-dose intravenous vitamin C on inflammation in cancer patients. J Transl Med. September 2012;10:189.
44 Chen P, Yu J, Chalmers B, et al. Pharmacological ascorbate induces cytotoxicity in prostate cancer cells through ATP depletion and induction of autophagy. Anticancer Drugs. 2012;23(4):437-444.
45 Chen P, Stone J, Sullivan G, Drisko JA, Chen Q. Anti-cancer effect of pharmacologic ascorbate and its interaction with supplementary parenteral glutathione in preclinical cancer models. Free Radic Biol Med. 2011;51(3):681- 687.
46 Deubzer B, Mayer F, Kuci Z, et al. H(2)O(2)-mediated cytotoxicity of pharmacologic ascorbate concentrations to neuroblastoma cells: potential role of lactate and ferritin. Cell Physiol Biochem. 2010;25(6):767-774.
47 Welsh JL, Wagner BA, van’t Erve TJ, et al. Pharmacological ascorbate with gemcitabine for the control of metastatic and node-positive pancreatic cancer (PACMAN): results from a phase I clinical trial. Cancer Chemother Pharmacol. 2013;71(3):765-775.
48 Monti DA, Mitchell E, Bazzan AJ, et al. Phase I evaluation of intravenous ascorbic acid in combination with gemcitabine and erlotinib in patients with metastatic pancreatic cancer. PloS One. 2012;7(1):e29794.
49 Cullen JJ, Spitz DR, Buettner GR. Comment on “Pharmacologic ascorbate synergizes with gemcitabine in preclinical models of pancreatic cancer” ie, all we are saying is, give C a chance. Free Radic Biol Med. 2011;50(12):1726-1727.
Gerelateerde inhoud: