Akbar Khan, MD; Denis Marier, ND; Eric Marsden, ND; Douglas Andrews, ND; Isaac Eliaz, MD
Akbar Khan, MD, è il direttore medico di Medicor Cancer Centres, Inc, a Toronto, Ontario, Canada. Denis Marier, ND, è direttore della Canadian Clinic for Integrative Medicine di Windsor, Ontario. Eric Marsden, ND, è direttore del Marsden Center of Naturopathic Excellence di Maple, Ontario. Douglas Andrews, ND, è medico naturopata presso Medicor Cancer Centres, Inc. Isaac Eliaz, MD, è direttore della Amitabha Medical Clinic, a Santa Rosa, California.
Autore corrispondente: Akbar Khan, MD Indirizzo e-mail: [email protected]
Abstract
Il dicloroacetato di sodio (DCA) orale è attualmente in fase di studio come agente singolo e come adiuvante per il trattamento di vari tipi di cancro. Uno dei fattori che ne limitano l’uso clinico in regime orale continuo è la neurotossicità reversibile legata alla dose, che comprende neuropatia periferica ed encefalopatia. La via endovenosa (IV) presenta una serie di potenziali vantaggi, tra cui (1) il dosaggio pulsato per raggiungere concentrazioni più elevate rispetto a quelle ottenibili con l’uso orale, (2) un periodo di washout più lungo per ridurre il potenziale di neurotossicità e (3) l’aggiramento dell’apparato digerente, particolarmente significativo per i pazienti oncologici in fase avanzata. Erano disponibili dati sul DCA per via endovenosa ad alte dosi (fino a 100 mg/kg/dose) che ne hanno confermato la sicurezza, sia in volontari sani che in pazienti gravemente malati, consentendo agli autori di iniziare il trattamento offlabel dei pazienti oncologici. In molti dei loro pazienti trattati con DCA per via endovenosa, gli autori hanno osservato risposte cliniche, ematologiche o radiologiche. Questo articolo presenta 3 casi di pazienti con tumori ricorrenti e per i quali tutte le terapie convenzionali erano fallite: (1) un paziente maschio di 79 anni con cancro al colon che aveva metastasi al fegato, (2) un paziente maschio di 43 anni con angiosarcoma che aveva metastasi al pancreas e alle ossa e (3) un paziente maschio di 10 anni con carcinoma neuroendocrino pancreatico che aveva metastasi al fegato. (Altern Ther Health Med. 2014;20(suppl 2):21-28)
Il dicloroacetato di sodio (DCA) orale è un farmaco attualmente in fase di studio come agente singolo e come trattamento aggiuntivo del cancro.1 Al momento in cui scriviamo, presso l’Università di Alberta è in corso uno studio di fase I sul DCA orale per i tumori solidi ricorrenti o metastatici e presso l’Università di Stanford sono in corso due studi sul DCA orale per i tumori della testa e del collo.
Il DCA è stato ampiamente studiato da Stacpoole2-5 per il trattamento dell’acidosi lattica congenita, che comprende un gruppo di malattie mitocondriali ereditarie. Il profilo di sicurezza per l’uso del DCA orale nell’uomo è stato stabilito grazie a questo lavoro. Il farmaco è risultato relativamente sicuro, senza tossicità ematologica, cardiaca, polmonare o renale.6 La principale tossicità è di tipo neurologico, principalmente la neuropatia periferica, e questa condizione è reversibile.7 È stato osservato un delirio indotto dal DCA, che è rapidamente reversibile con l’interruzione del farmaco.8 In una piccola percentuale di pazienti può verificarsi un innalzamento asintomatico ma reversibile degli enzimi epatici.9
Nel gennaio 2007, Bonnet et al10 hanno pubblicato un lavoro innovativo che ha dimostrato l’efficacia del DCA nel trattamento dei tumori umani della mammella, del polmone e del cervello in vitro e in vivo (nei ratti) attraverso nuove vie metaboliche che coinvolgono l’inibizione della piruvato deidrogenasi mitocondriale chinasi. I ricercatori hanno riferito che il DCA ha innescato l’apoptosi in modo selettivo nelle cellule tumorali riducendo il potenziale di membrana mitocondriale, bloccando la glicolisi aerobica (effetto Warburg) e attivando i canali mitocondriali degli ioni potassio. Successivamente, il DCA è stato ulteriormente studiato ed è risultato avere un’attività antitumorale per diversi tipi di cancro, compresi i tumori del colon,11 della prostata,12 dell’ovaio,13 del neuroblastoma,14 del carcinoma polmonare,15 della cervice uterina,16 dell’endometrio,17 del colangiocarcinoma,18 del sarcoma19 e del linfoma a cellule T.20
Sono stati proposti anche altri meccanismi di azione del DCA contro le cellule tumorali. Questi metodi includono (1) l’inibizione dell’angiogenesi,21 (2) l’alterazione dell’espressione dell’hypoxia-inducible factor 1-α (HIF1-α),21 e (3) l’alterazione dei regolatori del pH della vacuolar-type H+-ATPase(V-ATPase) e del monocarboxylate transporter 1 (MCT1) e di altri regolatori della sopravvivenza cellulare, come il modulatore dell’apoptosi p53-upregolato (PUMA), il trasportatore del glucosio 1 (GLUT1), la proteina del linfoma a cellule B 2 (BCL2) e l’antigene tumorale cellulare p53 (p53).20 Tuttavia, alcuni studi hanno ottenuto risultati diversi, mostrando una diminuzione dell’apoptosi in alcune linee cellulari tumorali in condizioni di ipossia.22,23
È stato inoltre dimostrato in vitro che il DCA aumenta la citotossicità di alcuni composti del platino, suggerendo un potenziale per l’applicazione clinica nel carcinoma polmonare a piccole cellule resistente al platino, nel sarcoma di Ewing e nel carcinoma ovarico.24 Un altro studio in vitro ha riscontrato effetti antiproliferativi significativi e sinergici utilizzando linee cellulari di carcinoma della cervice uterina con una combinazione di DCA e cisplatino.25 L’insieme della letteratura mostra chiaramente il potenziale per ulteriori ricerche e sviluppi del DCA.
Sulla base del lavoro originale di Bonnet et al,10 uno degli attuali autori ha iniziato a utilizzare il DCA orale nel 2007 come trattamento off-label per i pazienti oncologici con prognosi infausta o che non avevano risposto alle terapie oncologiche convenzionali. La neuropatia periferica26 è stata osservata come il principale fattore che limita l’utilità clinica. Questo autore ha sviluppato un protocollo DCA per affrontare la neuropatia in collaborazione con un altro degli autori, un medico naturopata. Questo lavoro ha portato a un regime di DCA per via orale che includeva i farmaci naturali neuroprotettivi acetil-L-carnitina,27-30 acido R-α-lipoico,31-34 e benfotiamina.35-37 L’osservazione clinica di oltre 300 pazienti affetti da cancro avanzato trattati con questo regime ha rivelato che il 60%-70% ha mostrato benefici misurabili dal DCA. Il rischio approssimativo di neuropatia era del 20%, con una dose di DCA da 20 a 25 mg/kg/die, con un ciclo di 2 settimane di assunzione e 1 settimana di sospensione, in combinazione con i 3 integratori naturali.
La via endovenosa (IV) presenta una serie di vantaggi terapeutici, tra cui (1) livelli ematici più elevati perché il dosaggio endovenoso pulsato può raggiungere una concentrazione più alta rispetto a quella ottenibile con un dosaggio orale, (2) un periodo di washout più lungo per ridurre il potenziale di neurotossicità e (3) l’aggiramento dell’apparato digerente, particolarmente significativo per i pazienti oncologici in fase avanzata. Erano disponibili dati sulla somministrazione di DCA per via endovenosa ad alte dosi, fino a 100 mg/kg/dose, che ne hanno confermato la sicurezza, sia in volontari sani38 che in pazienti gravemente malati.39 Gli autori Eliaz e Khan hanno sviluppato un protocollo di trattamento con DCA per via endovenosa e lo hanno tradotto nella pratica clinica. Khan aveva già avuto esperienze precedenti, a partire dal 2007, con il DCA per via endovenosa, utilizzandolo per trattare pazienti con ostruzione intestinale completa. Tuttavia, nell’uso precedente di Khan del DCA per via endovenosa, risalente al 2007, non era possibile valutare le risposte a lungo termine perché il trattamento avveniva in pazienti in fase terminale con una prognosi di 4-6 settimane di aspettativa di vita.
Questo articolo presenta 3 casi che illustrano gli effetti del trattamento con DCA per via endovenosa. Tutti i pazienti e/o i loro tutori hanno dato il consenso alla pubblicazione dei loro casi. Questi pazienti avevano una prognosi molto sfavorevole e/o non avevano risposto alla terapia convenzionale. Tutti i pazienti hanno tratto benefici significativi dalla terapia con DCA, con effetti collaterali minimi, nessuna mielosoppressione e nessuna tossicità d’organo. I pazienti di questi casi di studio sono stati trattati in collaborazione con i 3 autori, che sono medici naturopati. Hanno sviluppato protocolli individuali che includevano coadiuvanti naturali, come il trattamento con acido ascorbico/vitamina C per via endovenosa (IVC) e agenti neuroprotettivi naturali.
CASO 1: CANCRO DEL COLON
Un uomo di 79 anni ha richiesto una terapia per un cancro al colon metastatico, con una diagnosi originale di adenocarcinoma sigmoideo T3N1M0 moderatamente differenziato. Le comorbidità includevano un’anamnesi di angina, infarto miocardico, quadruplo bypass coronarico, ipertensione, ipercolesterolemia e diverticolosi. Il paziente è stato inizialmente trattato con emicolectomia sinistra e colostomia, seguita da chemioterapia con 5-fluorouracile (5-FU) e irinotecan per circa 6 mesi e successiva inversione della colostomia.
Il paziente è rimasto libero da malattia per circa 3 anni, quando l’antigene carcinoembrionale (CEA) ha iniziato ad aumentare e una tomografia computerizzata (TC) ha mostrato nuove metastasi epatiche e polmonari. Il paziente è stato nuovamente trattato con chemioterapia a base di 5-FU e irinotecan per 3 cicli, che si sono rivelati inefficaci e complicati da estrema stanchezza e malessere. La chemioterapia è stata interrotta e il paziente è stato indirizzato alle cure palliative.
La paziente ha scelto di intraprendere un trattamento naturopatico presso la clinica di un autore, a partire da dicembre 2010. La terapia comprendeva rimedi omeopatici e IVC alla dose di 75 g due volte alla settimana, con un conseguente aumento del livello di energia e del peso. I farmaci e gli integratori in quel momento erano pantoprazolo, alfuzosina, metoprololo, ramipril, simvastatina, amlodipina, clopidogrel, vitamina D, complesso vitaminico B, acidophilus e acido α-lipoico. Il paziente ha continuato il trattamento fino al 2011 con un buon controllo dei sintomi; tuttavia, il suo CEA ha continuato ad aumentare. Una TAC effettuata nel novembre 2011 ha dimostrato una malattia epatica metastatica estesa e diffusa e numerosi noduli polmonari in espansione, coerenti con una progressione della malattia a intervalli. Il paziente ha quindi scelto di intraprendere un ciclo di prova di DCA per via endovenosa. Il 19 dicembre 2011 sono stati eseguiti gli esami del sangue di base, tra cui il CEA e gli enzimi epatici. La prima dose di 3000 mg (41 mg/kg) di DCA per via endovenosa è stata somministrata il 22 dicembre 2011, insieme a 50 g di IVC. Un test CEA era stato programmato per essere eseguito 4 settimane dopo, ma è stato erroneamente ripetuto 1 giorno dopo l’infusione, insieme alla misurazione degli enzimi epatici. È stata notata una rapida riduzione degli enzimi epatici e del CEA. (Vedi Figura 1 e Figura 2)
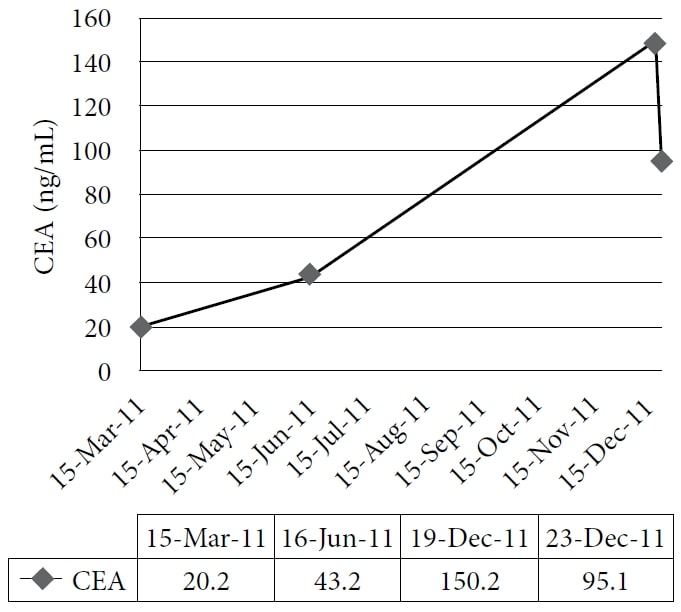
La figura mostra il graduale aumento dell’antigene carcinoembrionale (CEA) durante il trattamento naturopatico e la sua netta diminuzione dopo la somministrazione di dicloroacetato di sodio (DCA) per via endovenosa.
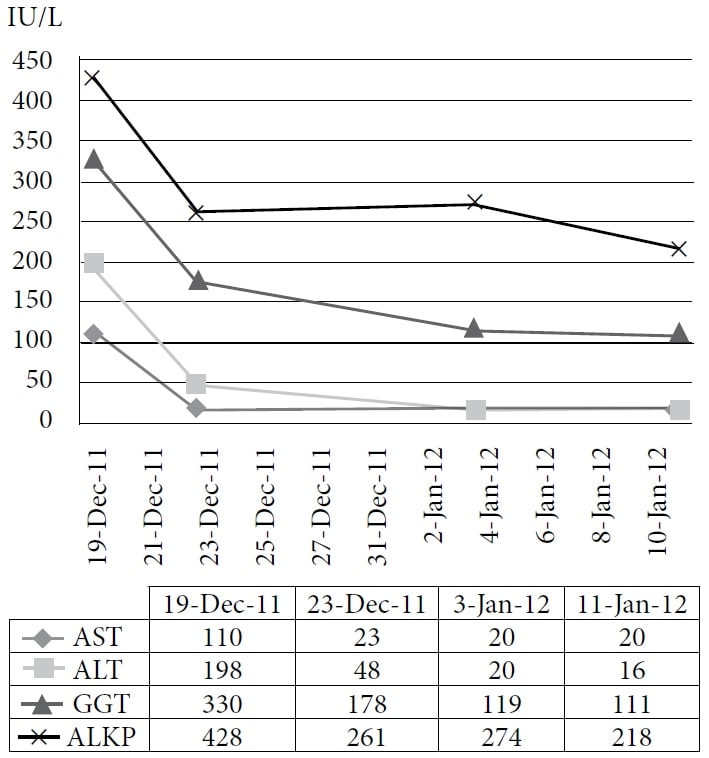
Abbreviazioni: AST = aspartato aminotransferasi; ALT = alanina aminotransferasi; GGT = γ-glutamil transpeptidasi; ALKP = fosfatasi alcalina.
La figura mostra l’immediato brusco calo e la continua diminuzione degli enzimi epatici con la somministrazione di DCA per via endovenosa.
La seconda infusione di DCA è stata somministrata 6 giorni dopo alla dose di 3500 mg (48 mg/kg) insieme a 35 g di IVC. Dopo l’infusione, il paziente ha notato nuovi sintomi: brividi, sudorazione e affaticamento. Una terza infusione di DCA alla dose di 3700 mg (50 mg/kg) e 50 g di IVC è stata somministrata 8 giorni dopo la seconda dose, con successivi esami del sangue che hanno mostrato ulteriori miglioramenti (Figura 2).
Tuttavia, il paziente ha nuovamente notato un breve periodo di affaticamento e malessere dopo l’infusione e, contro il parere dei medici, ha deciso di interrompere il trattamento a causa di questi effetti collaterali. Una nuova ecografia addominale è stata eseguita 1 mese dopo il trattamento con DCA. Nel referto si legge: “Tenendo conto delle differenze tra le modalità di imaging, l’aspetto delle metastasi epatiche non è cambiato in modo significativo rispetto alla precedente TC dell’addome del 10 novembre 2011” Le metastasi polmonari non sono state valutate perché non erano evidenti sintomi respiratori.
CASO 2: ANGIOSARCOMA
Un uomo di 43 anni ha richiesto una terapia per un angiosarcoma metastatico del femore destro. Il paziente aveva un’anamnesi di osteosarcoma della tibia destra, diagnosticato all’età di 27 anni nel 1995 e trattato con resezione e ricostruzione della protesi tumorale, seguita da chemioterapia con doxorubicina e cisplatino. Questo tumore è stato considerato guarito.
All’età di 39 anni, nel 2007, ha consultato il suo medico con dolore e gonfiore sopra il ginocchio destro. Dopo una risonanza magnetica (RM) e una biopsia, è stata fatta una diagnosi di angiosarcoma. Si riteneva che questo tumore fosse una potenziale malignità secondaria causata dalla precedente chemioterapia. Il paziente è stato sottoposto a chemioterapia con doxorubicina e ifosfamide, ma il decorso previsto è stato abbreviato a causa di un’infezione e di un conseguente danno renale, dovuto al trattamento antibiotico con vancomicina. Nel 2008 è stato quindi sottoposto a resezione e ricostruzione del tumore.
Nel 2009, 1 anno dopo l’intervento, ha sviluppato metastasi polmonari che sono state rimosse chirurgicamente con resezione del bordo polmonare. Successivamente si sono sviluppate altre metastasi polmonari, per le quali il paziente è stato sottoposto ad altre 2 resezioni polmonari tra il 2009 e il 2011. Nell’agosto 2011 è stata identificata una metastasi all’ala sinistra, trattata con escissione e radioterapia. Nell’ottobre 2011, a seguito di una TAC, è stata diagnosticata una nuova metastasi alla coda del pancreas di 6,1 × 5,7 cm, trattata immediatamente con radioterapia. La TAC ha evidenziato anche una metastasi polmonare ingrandita di 12 mm nel lobo superiore sinistro.
Nel novembre 2011, la paziente ha consultato uno degli autori, un medico naturopata. Il paziente è stato trattato con Viscum album (estratto di vischio) e IVC per via endovenosa. Le dosi sono state aumentate a 300 mg di viscum album e 75 g di IVC 3 volte a settimana. Ha ricevuto anche integratori, tra cui vitamina D, pectina di agrumi modificata, enzimi digestivi, acidi grassi omega-3, bioperina e artemisinina.
Nel gennaio 2012, un’altra TAC ha rivelato nuove piccole metastasi alla colonna vertebrale, nonostante la terapia naturopatica aggressiva. La massa della coda del pancreas si era ingrandita a 7,6 × 5,6 cm a 2 mesi dalla radioterapia. Sono stati riscontrati numerosi nuovi piccoli noduli polmonari. Sono state riscontrate nuove metastasi ossee litiche che hanno coinvolto C3, T9, L2 e il manubrio.
In base alla progressione della malattia, la paziente ha deciso di iniziare la terapia con DCA per via endovenosa nel febbraio 2012. I risultati degli esami del sangue al basale erano significativi per anemia (emoglobina 101 g/L), lieve insufficienza renale (urea 12,6 mmol/L e creatinina 195 µmol/L) e lieve elevazione della γ-glutamil transpeptidasi (GGT) (77 U/L). La fosfatasi alcalina (ALKP) era normale. Prima dell’inizio del DCA, è stata eseguita una risonanza magnetica della colonna vertebrale come base.
Il DCA per via endovenosa è stato iniziato con una dose di 3000 mg (47 mg/kg) alla settimana, aumentata in un periodo di 2 settimane a 5000 mg (47 mg/kg) due volte alla settimana. Non sono stati osservati effetti collaterali. In concomitanza con l’inizio del DCA, il paziente ha ricevuto anche una radioterapia stereotassica alla colonna vertebrale. Dopo 2 mesi di DCA per via endovenosa, in combinazione con i trattamenti naturopatici in corso, una TAC ha rivelato la stabilità di tutte le metastasi polmonari e la contrazione della metastasi pancreatica da 7,6 × 5,6 cm a 5,9 × 5,2 cm. È stata osservata una nuova sottile area di lucentezza in T12, con un lieve aumento della lucentezza di tutte le altre metastasi ossee. Una scansione ossea con tecnezio effettuata nell’aprile 2012 non ha mostrato attività corrispondente in nessuna delle aree di lucentezza osservate alla TC. Una nuova risonanza magnetica della colonna vertebrale ha confermato una risposta mista, con un aumento della metastasi ossea di 1-2 mm.
Dopo un totale di 4 mesi di terapia con DCA per via endovenosa, una risonanza magnetica ha dimostrato la stabilità di quasi tutte le metastasi della colonna vertebrale, 2 delle quali sono state segnalate come leggermente più grandi, senza specificarne la misura. Non sono state rilevate nuove metastasi alla colonna vertebrale. Un mese dopo, dopo 5 mesi di DCA per via endovenosa, la TC ha mostrato la stabilità di tutti i noduli polmonari e l’ulteriore riduzione delle dimensioni della massa pancreatica da 5,9 × 5,2 cm a 4,4 × 4,4 cm. Non si sono verificate nuove metastasi intratoraciche o intra-addominali. Molte delle metastasi ossee esistenti mostravano un leggero aumento della lucentezza. L’ALKP è rimasto normale e non si è verificato alcun deterioramento della conta cellulare o della funzione renale. Pur continuando la terapia con DCA per via endovenosa, il paziente ha iniziato a cercare opzioni terapeutiche più aggressive, con l’obiettivo di ottenere una remissione completa. Oltre alla radioterapia stereotassica spinale, non era stata somministrata alcuna terapia convenzionale concomitante al DCA endovenoso.
Il paziente è rimasto clinicamente stabile fino a settembre 2012, quando ha interrotto il trattamento con DCA endovena dopo 8 mesi di terapia per recarsi in una clinica privata in Germania per sottoporsi a chemioterapia a basso dosaggio, con ipertermia totale del corpo e potenziamento insulinico.
CASO 3: CARCINOMA PANCREATICO NEUROENDOCRINO
Un maschio di 10 anni con carcinoma pancreatico neuroendocrino metastatico è stato portato dai genitori dal Portogallo alla clinica di un autore in Canada per il trattamento con DCA dopo aver fallito la chemioterapia convenzionale. Inizialmente si era recato dal suo medico in Portogallo per affaticamento e anoressia. La diagnosi è stata effettuata mediante ecografia e biopsia, che hanno rivelato una massa pancreatica con metastasi ai linfonodi addominali e metastasi epatiche estese che occupavano l’intero parenchima epatico. La scintigrafia del recettore della somatostatina ha evidenziato una lesione pancreatica ad alta captazione, ma ha mostrato una bassa captazione in tutte le lesioni epatiche. Sulla base di una discussione multidisciplinare del caso con l’équipe di oncologia pediatrica del centro oncologico regionale di Lisbona, Portogallo, sono stati scelti 6 cicli di cisplatino ed etoposide come trattamento primario. Una TAC dopo 2 cicli di chemioterapia ha dimostrato una riduzione delle metastasi e del tumore primario. Al quinto ciclo, l’oncologo ha notato una risposta in diminuzione sulla base di nuove TAC e marcatori ematici e la paziente ha iniziato a peggiorare clinicamente con perdita di peso, nausea e vomito. L’équipe del trapianto ha escluso la possibilità di una chemioterapia ad alte dosi e di un trapianto di fegato. La terapia è stata abbandonata dopo un trattamento totale di cisplatino a 600 mg/m2 ed etoposide a 1800 mg/m2.
Il paziente è arrivato in Canada per la valutazione della terapia con DCA 2 mesi dopo. I suoi farmaci all’epoca comprendevano metoclopramide, ondansetron, fluconazolo, loperamide, esomeprazolo, naltrexone (4,5 mg) al momento di coricarsi e paracetamolo (acetaminofene). Il DCA alla dose di 2500 mg IV (74 mg/kg) e l’octreotide alla dose di 100 µg IV sono stati iniziati due volte a settimana in ambulatorio. L’octreotide è stato aggiunto con la speranza di potenziare l’azione solo contro il tumore pancreatico principale, che aveva mostrato un’elevata captazione in una precedente scansione del recettore della somatostatina. La terapia è stata iniziata entro 2 settimane dall’ultima TAC. In concomitanza è stato somministrato un trattamento endovenoso di supporto che consisteva in acido R-α-lipoico a 250 mg, aminoacidi, IVC, calcio, magnesio, complesso vitaminico B e minerali multitraccia, senza rame. Dopo 2 infusioni, l’IVC è stata aumentata da 5 a 20 g dopo che la sicurezza è stata confermata da un livello normale di glucosio-6-fosfato deidrogenasi (G6PD) nel siero. L’Octreotide è stato aumentato a 100 µg per via endovenosa al giorno.
Il paziente ha avvertito un aumento transitorio del dolore addominale e un nuovo dolore alla punta della spalla sinistra 1 giorno dopo le infusioni. Ha anche riferito un aumento del livello di energia. Ha continuato a sperimentare una temporanea escalation del dolore dopo ogni infusione, che è stata gestita bene con morfina orale, dopo aver sospeso il naltrexone. È stato trattato due volte a settimana per 2 settimane in ufficio. I nuovi esami del sangue dopo 4 trattamenti endovenosi hanno rivelato una riduzione dell’alanina aminotransferasi (ALT), un’aspartato aminotransferasi (AST) e una GGT stabili, un forte aumento della deidrogenasi dell’acido lattico (LDH) e un calo dell’emoglobina (Tabella 1). È stato quindi dimesso dai suoi medici in Portogallo, che hanno continuato la terapia con DCA per via endovenosa, insieme a IVC di supporto e acido α-lipoico per via endovenosa, senza complicazioni.
| Nome | Pre-DCA | Dopo 4 dosi | Dopo 12 dosi | Unità |
| Emoglobina | 91 | 71 | 81 | g/L |
| Globuli bianchi | 5.7 | 8.2 | 8.2 | ×109/L |
| Piastrine | 227 | 171 | 171 | ×109/L |
| Fosfatasi alcalina | 188 | 206 | 122 | U/L |
| LDH | 988 | 1784 | 1449 | U/L |
| GGT | 169 | 171 | 76 | U/L |
| AST | 54 | 55 | 70 | U/L |
| ALT | 23 | 15 | 15 | U/L |
Abbreviazioni: LDH = acido lattico deidrogenasi; GGT = γ-glutamil transpeptidasi; AST = aspartato aminotransferasi; ALT = alanina aminotransferasi.
Una TC dopo un totale di 6 settimane di terapia ha mostrato una riduzione di 2 cm della metastasi epatica più grande (Figure 3A e 3B). Anche la seconda metastasi più grande si è ridotta di quasi 2 cm (Figure 4A e 4B).
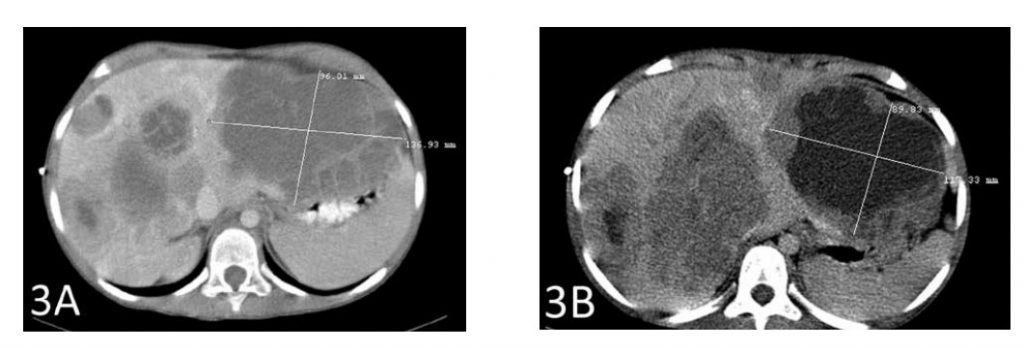
La Figura 3A mostra la metastasi più grande prima dell’inizio della terapia con DCA IV. La Figura 3B mostra la riduzione di 2 cm del tumore dopo la terapia
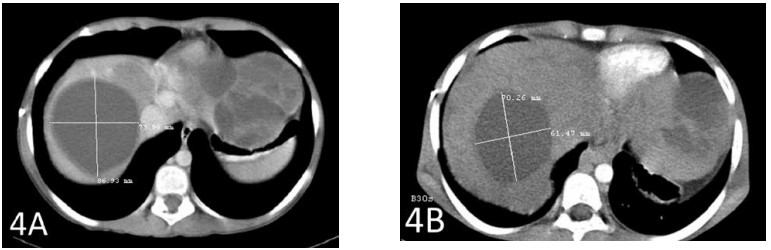
La Figura 4A mostra la seconda metastasi più grande prima dell’inizio della terapia con DCA IV. La Figura 4B mostra la riduzione del tumore di quasi 2 cm.
Una nuova scansione della somatostatina (tomografia a emissione di positroni con gallio 68) eseguita una settimana dopo la TAC non ha mostrato “alcuna evidenza di lesioni tumorali con aumentata espressione dei recettori della somatostatina 2, 3 o 5” Sulla base di questo risultato, l’octreotide per via endovenosa è stato sospeso e la terapia con DCA è stata mantenuta. Il paziente è rimasto clinicamente stabile senza cambiamenti nella terapia per altri 3 mesi. A quel punto, ha chiesto di interrompere la terapia perché il suo obiettivo personale era quello di raggiungere uno stato funzionale di livello ECOG 0 (completamente attivo senza limitazioni nelle abilità fisiche), obiettivo che si riteneva irraggiungibile.
DISCUSSIONE
Sono stati presentati tre casi di terapia con DCA per via endovenosa in pazienti con cancro avanzato in cui gli autori hanno osservato risposte cliniche, biochimiche o radiologiche favorevoli.
Il caso 1 illustra la risposta biochimica di un carcinoma metastatico del colon alla terapia DCA per via endovenosa, combinata con IVC ad alte dosi. In precedenza, il CEA del paziente era aumentato costantemente mentre utilizzava solo l’IVC per 10 mesi. Pertanto, la diminuzione del CEA può essere attribuita alla terapia con DCA. Poiché la letteratura riporta una potenziale riduzione del CEA di oltre il 50% entro 10 ore dalla metastatectomia epatica,40 un’ampia diminuzione del CEA a 1 giorno da qualsiasi altra terapia è plausibile se il tumore ha risposto rapidamente e non deve essere considerato un risultato errato. Inoltre, il rapido calo degli enzimi epatici è coerente con una riduzione del danno epatico derivante dalla morte delle cellule tumorali o dall’inibizione della crescita.
L’ecografia successiva al trattamento con DCA non ha riportato alcun cambiamento nelle dimensioni del tumore; tuttavia, non era disponibile alcuna scansione di base immediatamente prima dell’inizio del trattamento con DCA e la TAC di confronto è stata eseguita 2 mesi prima dell’inizio della terapia. Pertanto, non è possibile trarre conclusioni sull’eventuale riduzione delle dimensioni del tumore. Nei limiti dei tempi delle scansioni e del confronto TC-ultrasuoni, gli autori hanno almeno osservato la stabilità del tumore. Non è possibile trarre conclusioni sulla durata della risposta perché il paziente ha interrotto la terapia molto presto. Gli autori concludono che il DCA per via endovenosa sembra avere attività nell’uomo contro l’adenocarcinoma del colon.
Il caso 2 illustra una risposta parziale di un angiosarcoma metastatico al DCA per via endovenosa in combinazione con terapie naturali. Nonostante l’anemia preesistente e l’insufficienza renale cronica, è stato possibile effettuare un trattamento efficace poiché il DCA non è mielosoppressivo né nefrotossico. Questo paziente ha sperimentato la riduzione di una grande metastasi pancreatica, che non aveva risposto alla precedente radioterapia. Una riduzione di oltre il 30% delle dimensioni corrisponde alla definizione di risposta parziale secondo i criteri RECIST (Response Evaluation Criteria in Solid Tumors). Il risultato è stato la stabilità delle metastasi polmonari multiple e la quasi completa stabilità delle metastasi ossee esistenti. La risposta delle metastasi ossee potrebbe essere attribuita alla radioterapia stereotassica spinale concomitante, ma la risposta delle altre metastasi no. Durante i 5 mesi iniziali di terapia con DCA sono comparse nuove metastasi ossee. Non sono comparse nuove metastasi intratoraciche o intra-addominali durante la terapia con DCA, mentre le metastasi polmonari e pancreatiche erano cresciute prima di tale terapia. La paziente non ha manifestato effetti collaterali significativi legati al trattamento.
Si possono prevedere risposte miste a causa dell’eterogeneità del tumore. Un’altra possibile spiegazione della maggiore risposta delle metastasi pancreatiche rispetto a quelle polmonari è che il DCA potrebbe avere una maggiore efficacia nei tumori preradicati. Questo risultato è stato riportato in precedenza.41 Una risposta parziale è incoraggiante data la prognosi infausta del paziente, soprattutto perché il trattamento è stato ben tollerato senza tossicità ematologica, renale o neurologica. Con terapie più delicate e non tossiche, una risposta parziale può essere del tutto accettabile e non deve essere abbandonata. Gli autori hanno concluso che il DCA per via endovenosa sembra avere un’attività nell’uomo contro l’angiosarcoma.
Il caso 3 illustra la riduzione del tumore con DCA per via endovenosa in combinazione con IVC ad alte dosi. Questo risultato è stato classificato come malattia stabile secondo la definizione RECIST perché la riduzione del tumore era inferiore al 30%. Sono stati osservati effetti collaterali minimi. Sulla base delle scansioni di octreotide prima e dopo il trattamento, la riduzione delle grandi metastasi epatiche non può essere attribuita alla terapia con octreotide; nessuna delle due scansioni ha mostrato recettori di octreotide nelle metastasi epatiche. Inoltre, la scomparsa dei recettori dell’octreotide dal tumore pancreatico sottolinea ulteriormente la mancanza di benefici legati alla terapia con octreotide. Pertanto, la risposta può essere attribuita alla somministrazione di DCA, in combinazione con farmaci naturali. Con la somministrazione di DCA per via endovenosa si nota talvolta una temporanea riacutizzazione del dolore correlato al tumore, che può essere un segno della risposta del tumore con conseguente infiammazione. Un aumento improvviso della LDH sierica del paziente è coerente con questo effetto. A causa della breve durata della valutazione, non è possibile trarre conclusioni sulla durata della risposta. Gli autori hanno concluso che il DCA per via endovenosa sembra avere un’attività nell’uomo contro il carcinoma pancreatico neuroendocrino.
I casi presentati indicano che il DCA per via endovenosa è una terapia oncologica promettente. Tutti i pazienti hanno tratto benefici significativi dalla terapia, con effetti collaterali soggettivi minimi e nessuna tossicità ematologica, renale o neurologica, nonostante lo stadio avanzato della malattia. Trattamenti come l’IVC ad alte dosi, combinati con il DCA, sono stati di supporto in termini di qualità di vita e potrebbero aver avuto un effetto sinergico con il DCA endovenoso. Tuttavia, è chiaro che questi trattamenti da soli non sono stati in grado di spiegare le risposte tumorali. È interessante notare che tutti i pazienti di questa serie di casi hanno utilizzato l’IVC con il DCA endovenoso. Si ritiene che l’IVC possa esercitare un effetto antitumorale attraverso l’immunomodulazione42,43 o l’induzione dell’autofagia mediata dalla generazione di H2O2 e dalla deplezione di ATP.44-46 È stato dimostrato che l’IVC agisce come coadiuvante in altre terapie antitumorali, come la gemcitabina nel carcinoma del pancreas.47-49 Pertanto, l’IVC potrebbe avere un ruolo significativo come coadiuvante del DCA endovenoso nel trattamento dei tumori avanzati.
Al momento della stesura del presente documento, 4 studi clinici attivi stanno studiando il ruolo del DCA orale come terapia antitumorale, ma nessuno studio sta attualmente studiando la via di somministrazione endovenosa. A causa dello status non proprietario del DCA, è difficile per i ricercatori raccogliere i fondi necessari per condurre studi sull’uomo. Si spera che questi casi che illustrano i benefici del DCA per via endovenosa incoraggino indagini cliniche più formali. Sono necessarie ulteriori ricerche in vitro e in vivo per definire i meccanismi d’azione del DCA e le specificità del tipo di tumore e del microambiente che rispondono favorevolmente a questo farmaco. Per valutare meglio i benefici del farmaco e ottimizzare il regime di trattamento, sono necessari studi clinici su pazienti con tumori già noti per rispondere favorevolmente al DCA. Il DCA si è dimostrato promettente in combinazione con alcuni agenti chemioterapici convenzionali, un beneficio che dovrebbe essere ulteriormente esplorato.
CONCLUSIONE
Sulla base della letteratura e dell’esperienza clinica degli autori, il DCA per via endovenosa off-label è un’opzione terapeutica promettente per i pazienti che ne comprendono e accettano pienamente i rischi e i benefici, in particolare per quelli che non hanno a disposizione opzioni terapeutiche convenzionali. Questi casi di studio dimostrano che il DCA ha il potenziale di prolungare la vita senza ridurre la qualità della vita dei pazienti con effetti collaterali debilitanti o compromettere la funzione fisiologica, anche in caso di malattia in fase molto avanzata. Nei casi presentati, la terapia con DCA per via endovenosa è stata di durata limitata, rendendo difficile stimare il grado di beneficio in termini di sopravvivenza. Tuttavia, sulla base dell’esperienza degli autori nell’uso cronico di DCA orale, con il più lungo sopravvissuto attuale che è un uomo di 48 anni con glioblastoma stabile da 6 anni con DCA orale senza terapia convenzionale, gli autori ritengono che il farmaco offra un potenziale di stabilizzazione e/o regressione a lungo termine, nonché un sostanziale miglioramento della sopravvivenza. Data la sua economicità e bassa tossicità, il DCA merita ulteriori indagini.
RICONOSCIMENTI
Gli autori desiderano ringraziare la dottoressa Humaira Khan per la sua assistenza e i pazienti per il loro sostegno e il consenso alla pubblicazione dei loro casi.
DICHIARAZIONE DI DIVULGAZIONE DELL’AUTORE
All’interno delle rispettive cliniche, gli autori hanno somministrato protocolli integrativi personalizzati a pazienti affetti da cancro a pagamento, compreso il costo di uno o più dei farmaci elencati in questa pubblicazione. Le cliniche sono di proprietà degli autori e/o dei loro familiari. Gli autori non hanno ricevuto altre sovvenzioni o sostegno finanziario per questo studio.
RIFERIMENTI
1 1. risultati della ricerca “Dichloroacetate cancer”. Sito web ClinicalTrials.gov. http:// clinicaltrials.gov/ct2/results?term=dicloroacetato+cancro. Consultato il 22 luglio 2014.
2 Stacpoole PW, Harman EM, Curry SH, Baumgartner TG, Misbin RI. Trattamento dell’acidosi lattica con dicloroacetato. N Engl J Med. 1983;309(7):390-396.
3 Stacpoole PW, Lorenz AC, Thomas RG, Harman EM. Il dicloroacetato nel trattamento dell’acidosi lattica. Ann Intern Med. 1988;108(1):58-63.
4StacpoolePW, Wright EC, Baumgartner TG, et al. A controlled clinical trial of dichloroacetate for treatment of lactic acidosis in adults: the DichloroacetateLactic Acidosis Study Group. N Engl J Med. 1992;327(22):1564-1569.
5 Stacpoole PW, Kurtz TL, Han Z, Langaee T. Role of dichloroacetate in the treatment of genetic mitochondrial diseases. Adv Drug Deliv Rev. 2008;60(13- 14):1478-1487.
6 Stacpoole PW, Kerr DS, Barnes C, et al. Studio clinico controllato di dicloroacetato per il trattamento dell’acidosi lattica congenita nei bambini. Pediatria. 2006;117(5):1519-1531.
7 Kaufmann P, Engelstad K, Wei Y, et al. Il dicloroacetato causa neuropatia tossica nel MELAS: uno studio clinico randomizzato e controllato. Neurologia. 2006;66(3):324-330.
8 Brandsma D, Dorlo TP, Haanen JH, Beijnen JH, Boogerd W. Grave encefalopatia e polineuropatia indotta dal dicloroacetato. J Neurol. 2010;257(12):2099-2100.
9 Stacpoole PW, Gilbert LR, Neiberger RE, et al. Valutazione del trattamento a lungo termine di bambini con acidosi lattica congenita con dicloroacetato. Pediatria. 2008;121(5):e1223-e1228.
10 Bonnet S, Archer SL, Allalunis-Turner J, et al. Un asse mitocondriale-K+ channel è soppresso nel cancro e la sua normalizzazione promuove l’apoptosi e inibisce la crescita del cancro. Cancer Cell. 2007;11(1):37-51.
11 Madhok BM, Yeluri S, Perry SL, Hughes TA, Jayne DG. Il dicloroacetato induce apoptosi e arresto del ciclo cellulare nelle cellule di cancro del colon-retto. Br J Cancer. 2010;102(12):1746-1752.
12 Cao W, Yacoub S, Shiverick KT, et al. Il dicloroacetato (DCA) sensibilizza in vitro alle radiazioni sia le cellule di cancro alla prostata wild-type che quelle che esprimono Bcl-2. Prostata. 2008;68(11):1223-1231.
13 Saed GM, Fletcher NM, Jiang ZL, Abu-Soud HM, Diamond MP. Il dicloroacetato induce l’apoptosi delle cellule epiteliali di cancro ovarico attraverso un meccanismo che coinvolge la modulazione dello stress ossidativo. Reprod Sci. 2011;18(12):1253-1261.
14 Vella S, Conti M, Tasso R, Cancedda R, Pagano A. Il dicloroacetato inibisce la crescita del neuroblastoma agendo specificamente contro le cellule indifferenziate maligne. Int J Cancer. 2012;130(7):1484-1493.
15 Fiebiger W, Olszewski U, Ulsperger E, Geissler K, Hamilton G. Citotossicità in vitro di nuovi farmaci a base di platino e dicloroacetato contro linee cellulari di carcinoide polmonare. Clin Transl Oncol. 2011;13(1):43-49.
16 Liu D, Liu S, Jing X, Li X, Li W, Huang Y. Necrosi del carcinoma cervicale da parte del dicloroacetato rilasciato da tappeti di polilattide elettrofilati. Biomateriali. 2012;33(17):4362-4369.
17 Wong JY, Huggins GS, Debidda M, Munshi NC, De Vivo I. Il dicloroacetato induce apoptosi nelle cellule del cancro endometriale. Gynecol Oncol. 2008;109(3):394- 402.
18IshiguroT, Ishiguro R, Ishiguro M, Iwai S. Il co-trattamento di dicloroacetato, omeprazolo e tamoxifene ha mostrato un effetto antiproliferativo sinergico sui tumori maligni: esperimenti in vivo e un case report. Epatogastroenterologia. 2012;59(116):994-996.
19 Sorokina LV, Pyatchanina TV, Didenko GV, Kaplia AA, Khyzhnyak SV. Influenza del dicloroacetato di sodio sui processi ossidativi nel sarcoma 37. Exp Oncol. 2011;33(4):216-221.
20 Kumar A, Kant S, Singh SM. Nuovi meccanismi molecolari dell’azione antitumorale del dicloroacetato contro il linfoma a cellule T: implicazione dell’alterazione del metabolismo del glucosio, dell’omeostasi del pH e della regolazione della sopravvivenza cellulare. Chem Biol Interact. 2012;199(1):29-37.
21 Sutendra G, Dromparis P, Kinnaird A, et al. L’attivazione mitocondriale tramite l’inibizione di PDKII sopprime la segnalazione di HIF1a e l’angiogenesi nel cancro. Oncogene. 2013;32(13):1638-1650.
22 Shahrzad S, Lacombe K, Adamcic U, Minhas K, Coomber BL. Il dicloroacetato di sodio (DCA) riduce l’apoptosi nell’ipossia del tumore colorettale. Cancer Lett. 2010;297(1):75-83.
23 Anderson KM, Jajeh J, Guinan P, Rubenstein M. Effetti in vitro del dicloroacetato e della CO2 sulle cellule HeLa ipossiche. Anticancer Res. 2009;29(11):4579-4588.
24. Olszewski U, Poulsen TT, Ulsperger E, Poulsen HS, Geissler K, Hamilton G. Citotossicità in vitro di combinazioni di dicloroacetato con composti di platino antitumorali. Clin Pharmacol. 2010;2:177-183.
25 Xie J, Wang BS, Yu DH, et al. Il dicloroacetato sposta il metabolismo dalla glicolisi all’ossidazione del glucosio e mostra un’inibizione sinergica della crescita con il cisplatino nelle cellule HeLa. Int J Oncol. 2011;38(2):409-417.
26 Dati osservazionali sul trattamento DCA del Medicor Cancer Centre. Sito web di Medicor Cancer Centres. http://medicorcancer.com/dca_therapy/dca-therapy-datajuly-2009/. Aggiornato al 1° luglio 2009. Consultato il 22 luglio 2014.
27 De Grandis D. Acetil-L-carnitina per il trattamento della neuropatia periferica indotta da chemioterapia: una breve rassegna. Farmaci del SNC. 2007;21(suppl 1):39-43.
28 Maestri A, De Pasquale Ceratti A, Cundari S, Zanna C, Cortesi E, Crino L. Uno studio pilota sull’effetto dell’acetil-L-carnitina nella neuropatia periferica indotta da paclitaxel e cisplatino. Tumori. 2005;91(2):135-138.
29EvansJD, Jacobs TF, Evans EW. Ruolo dell’acetil-L-carnitina nel trattamento della neuropatia periferica diabetica. Ann Pharmacother. 2008;42(11):1686-1691.
30 Di Cesare Mannelli L, Ghelardini C, Toscano A, Pacini A, Bartolini A. L’agente neuroprotettivo acetil-L-carnitina attiva la protein-chinasi C-gamma e le MAPK in un modello di dolore neuropatico nel ratto. Neuroscienze. 2010;165(4):1345-1352.
31 Mijnhout GS, Kollen BJ, Alkhalaf A, Kleefstra N, Bilo HJ. L’acido alfa-lipoico per la neuropatia periferica sintomatica nei pazienti con diabete: una meta-analisi di studi controllati randomizzati. Int J Endocrinol. 2012;2012:456279.
32 Vallianou N, Evangelopoulos A, Koutalas P. Acido alfa-lipoico e neuropatia diabetica. Rev Diabet Stud. 2009;6(4):230-236.
33 Liu F, Zhang Y, Yang M, et al. Effetto curativo dell’acido alfa-lipoico sulla neuropatia periferica nel diabete di tipo 2: uno studio clinico [in cinese]. Zhonghua Yi Xue Za Zhi. 2007;87(38):2706-2709.
34 Ziegler D, Hanefeld M, Ruhnau KJ, et al. Trattamento della neuropatia periferica diabetica sintomatica con l’antiossidante acido alfa-lipoico: uno studio multicentrico randomizzato e controllato di 3 settimane (Studio ALADIN). Diabetologia. 1995;38(12):1425-1433.
35 Winkler G, Kempler P. Il meccanismo della neuropatia diabetica: retroscena della terapia orientata alla patogenesi [in ungherese]. Orv Hetil. 2010;151(24):971- 981.
36 Ang CD, Alviar MJ, Dans AL, et al. Vitamina B per il trattamento della neuropatia periferica. Cochrane Database Syst Rev. 2008;(3):CD004573.
37 Winkler G, Pal B, Nagybeganyi E, Ory I, Porochnavec M, Kempler P. Efficacia di diversi regimi di dosaggio di benfotiamina nel trattamento della neuropatia diabetica dolorosa. Arzneimittelforschung. 1999;49(3):220-224.
38 Savasi I, Evans MK, Heigenhauser GJ, Spriet LL. Il metabolismo del muscolo scheletrico non è influenzato dall’infusione di DCA e dall’iperossia dopo l’inizio di un intenso esercizio aerobico. Am J Physiol Endocrinol Metab. 2002;283(1):E108-E115.
39 Shangraw RE, Lohan-Mannion D, Hayes A, Moriarty RM, Fu R, Robinson ST. Il dicloroacetato stabilizza l’equilibrio acido-base intraoperatorio durante il trapianto di fegato. Liver Transpl. 2008;14(7):989-998.
40. Lokich J, Ellenberg S, Gerson B, Knox WE, Zamcheck N. Eliminazione plasmatica dell’antigene carcinoembrionale dopo metastatectomia epatica. J Clin Oncol. 1984;2(5):462-465.
41 Khan A. Uso del dicloroacetato orale per la palliazione del dolore alla gamba derivante da un carcinoma metastatico scarsamente differenziato: un case report. J Palliat Med. 2011;14(8):973-977.
42 See D, Mason S, Roshan R. Incremento del fattore di necrosi tumorale alfa (TNF-alfa) e della funzione delle cellule natural killer (NK) mediante un approccio integrativo nei tumori in fase avanzata. Immunol Invest. 2002;31(2):137-153.
43 Mikirova N, Casciari J, Rogers A, Taylor P. Effetto della vitamina C endovenosa ad alte dosi sull’infiammazione nei pazienti oncologici. J Transl Med. Settembre 2012; 10:189.
44 Chen P, Yu J, Chalmers B, et al. L’ascorbato farmacologico induce citotossicità nelle cellule di cancro alla prostata attraverso la deplezione di ATP e l’induzione dell’autofagia. Anticancer Drugs. 2012;23(4):437-444.
45 Chen P, Stone J, Sullivan G, Drisko JA, Chen Q. Effetto antitumorale dell’ascorbato farmacologico e sua interazione con il glutatione parenterale supplementare in modelli preclinici di cancro. Free Radic Biol Med. 2011;51(3):681- 687.
46 Deubzer B, Mayer F, Kuci Z, et al. Citotossicità H(2)O(2) mediata da concentrazioni farmacologiche di ascorbato sulle cellule di neuroblastoma: ruolo potenziale di lattato e ferritina. Cell Physiol Biochem. 2010;25(6):767-774.
47 Welsh JL, Wagner BA, van’t Erve TJ, et al. Ascorbato farmacologico con gemcitabina per il controllo del carcinoma pancreatico metastatico e nodo-positivo (PACMAN): risultati di uno studio clinico di fase I. Cancer Chemother Pharmacol. 2013;71(3):765-775.
48 Monti DA, Mitchell E, Bazzan AJ, et al. Valutazione di fase I dell’acido ascorbico per via endovenosa in combinazione con gemcitabina ed erlotinib in pazienti con carcinoma pancreatico metastatico. PloS One. 2012;7(1):e29794.
49 Cullen JJ, Spitz DR, Buettner GR. Comment on “Pharmacologic ascorbate synergizes with gemcitabine in preclinical models of pancreatic cancer” ie, all we are saying is, give C a chance. Free Radic Biol Med. 2011;50(12):1726-1727.
Contenuti correlati: