Ellappan Babu, Ph. D, Sabarish Ramachandran, Ph. D, Veena Coothan-Kandaswamy, Ph. D., Selvakumar Elangovan, Ph. D, Puttur D. Prasad, Ph. D, Vadivel Ganapathy, Ph. D , en Muthusamy Thangaraju, Ph. D.
Afdeling Biochemie en Moleculaire Biologie, Medical College of Georgia, Georgia Health Sciences University, Augusta, Georgia, USA
Gebruikers mogen de inhoud van deze documenten bekijken, afdrukken, kopiëren, downloaden en text- en datamining gebruiken voor academisch onderzoek, onder voorbehoud van de volledige gebruiksvoorwaarden:
http://www.nature.com/authors/editorial_policies/license.html#terms
Correspondentie: M. Thangaraju, Ph. D., Department of Biochemistry and Molecular Biology, Medical College of Georgia, Augusta, GA 30912, USA. [email protected].
Belangenverstrengeling: De auteurs verklaren dat er geen concurrerende financiële belangen zijn met betrekking tot het werk beschreven in dit manuscript.
Gepubliceerd in definitieve vorm als: Oncogene. 2011 September 22; 30(38): 4026-4037. doi:10.1038/onc.2011.113.
Trefwoorden: SLC5A8; dichlooracetaat; antikankermedicijn; Warburg-effect; pyruvaatdehydrogenase kinase; mitochondriale oxidatie bij kanker
Abstract
Bij het publiek en wetenschappers is er toenemende belangstelling voor dichlooracetaat als potentieel geneesmiddel tegen kanker. Er bestaat geloofwaardig bewijs voor de antitumoractiviteit van deze verbinding, maar er zijn hoge concentraties nodig voor een significant therapeutisch effect. Helaas veroorzaken deze hoge concentraties schadelijke bijwerkingen voor het zenuwstelsel, waardoor het gebruik ervan voor de behandeling van kanker wordt uitgesloten. De mechanistische basis van de antitumoractiviteit van de verbinding is haar vermogen om het pyruvaat dehydrogenase complex te activeren door remming van pyruvaat dehydrogenase kinase. Aangezien de verbinding de kinase remt bij micromolaire concentraties, is niet bekend waarom therapeutisch onbetaalbaar hoge doses nodig zijn voor onderdrukking van tumorgroei. Wij veronderstelden dat een gebrek aan effectieve mechanismen voor het binnendringen van dichlooracetaat in tumorcellen aan dit fenomeen ten grondslag kan liggen. Hier tonen wij aan dat SLC5A8 zeer effectief en met hoge affiniteit dichlooracetaat transporteert. Deze transporter komt tot expressie in normale cellen, maar de expressie wordt in tumorcellen via epigenetische mechanismen onderdrukt. Het ontbreken van de transporter maakt tumorcellen resistent tegen de antitumoractiviteit van dichlooracetaat. Als de transporter echter ectopisch tot expressie komt in tumorcellen, worden de cellen gevoelig voor het geneesmiddel bij lage concentraties. Dit is duidelijk bij borstkankercellen, darmkankercellen en prostaatkankercellen. Normale cellen, die de transporter constitutief tot expressie brengen, worden echter niet beïnvloed door de verbinding, hetgeen wijst op de tumorcelselectieve therapeutische activiteit. Het mechanisme van de antitumoractiviteit van de verbinding is nog steeds haar vermogen om pyruvaatdehydrogenase kinase te remmen en de mitochondriale oxidatie van pyruvaat te forceren. Aangezien bij het uitschakelen van SLC5A8 in tumoren DNA-methylering een rol speelt en de expressie ervan kan worden geïnduceerd door behandeling met DNA-methyleringsremmers, suggereren onze bevindingen dat een combinatie van dichlooracetaat met een DNA-methyleringsremmer een middel zou zijn om de doses dichlooracetaat te verlagen om de schadelijke effecten van hoge doses te voorkomen, maar zonder de antitumoractiviteit in gevaar te brengen.
INLEIDING
Dichlooracetaat wordt momenteel gebruikt voor de behandeling van congenitale melkziekte (Stacpoole et al., 2003, 2008). De therapeutische werkzaamheid van dit geneesmiddel is te danken aan zijn vermogen om het pyruvaat dehydrogenase complex (PDC) in de mitochondriale matrix te activeren. Het enzymcomplex is echter niet het directe doelwit van het geneesmiddel. Dichlooracetaat is een remmer van pyruvaatdehydrogenase kinase (PDK), dat de E1α-subeenheid van PDC fosforyleert en het complex inactiveert (Stacpoole et al. 2003, 2008). Door PDK te remmen, voorkomt dichlooracetaat de fosforylering van E1α en houdt het PDC dus in actieve vorm. De door het geneesmiddel veroorzaakte activering van PDC vergemakkelijkt het mitochondriale metabolisme van pyruvaat. Aangezien cytosolisch pyruvaat ofwel in de mitochondriën kan worden getransporteerd en gemetaboliseerd, ofwel in het cytoplasma door lactaatdehydrogenase kan worden omgezet in lactaat, verschuift de activering van PDC door dichlooracetaat en het daaruit voortvloeiende metabolisme van pyruvaat in de mitochondriën het evenwicht tussen pyruvaat en lactaat in de richting van pyruvaat. Dit bevordert de omzetting van lactaat in pyruvaat, waardoor het lactaatgehalte daalt.
De laatste jaren is er veel belangstelling voor dichlooracetaat als potentieel geneesmiddel tegen kanker (Michelakis et al., 2008). Het idee dat dit middel tumorcellen kan doden heeft een rationele basis. Tumorcellen halen het grootste deel van hun energie uit aerobe glycolyse in plaats van uit mitochondriale oxidatie. Deze metabole verschuiving in tumorcellen werd voor het eerst herkend door Warburg (Warburg, 1956) en is daarom bekend geworden als het Warburg-effect (Gatenby en Gillies, 2004; Kim en Dang, 2006; Chen et al., 2007; Brahimi-Horn et al., 2007; Vander Heiden et al., 2009; Ganapathy et al., 2009; Mathupala et al., 2010). Aangezien aërobe glycolyse, waarbij glucose wordt omgezet in lactaat, slechts 2 ATP oplevert, terwijl mitochondriale oxidatie van pyruvaat uit glycolyse 30 ATP oplevert, lijkt het raadselachtig dat tumorcellen de voorkeur geven aan de minder efficiënte metabole route om energie te verkrijgen. Tumorcellen lijden echter niet aan een tekort aan ATP; in feite genereren zij meer energie dan normale cellen om hun toegenomen groei en proliferatie te ondersteunen. Dit wordt bereikt door de glycolyse meerdere malen te activeren. Weliswaar genereert mitochondriale oxidatie meer ATP dan cytoplasmatische glycolyse, maar tegelijkertijd produceert mitochondriale oxidatie reactieve zuurstofspecies, die schadelijk kunnen blijken voor de cellen. Blijkbaar herkennen tumorcellen dit negatieve aspect van mitochondriale oxidatie en kiezen zij daarom voor glycolyse als primaire bron van ATP. Glycolyse vereist geen zuurstof en genereert geen reactieve zuurstofspecies. Bovendien kunnen tumorcellen, omdat zij hun energie voornamelijk via glycolyse genereren, prolifereren in anerobe omstandigheden, die vaak voorkomen in vaste tumoren. De onderdrukking van de mitochondriale functie in tumoren is echter omkeerbaar. Een van de mechanismen waarmee tumorcellen mitochondriale oxidatie onderdrukken, is het induceren van PDK, waardoor PDC wordt geïnactiveerd (Semenza, 2010). Daarom kan oxidatie van pyruvaat in mitichondria worden geïnduceerd in tumorcellen door de kanker-geassocieerde onderdrukking van PDC-activiteit ongedaan te maken. Dichlooracetaat doet precies dat, door de PDK te remmen. Ondanks deze rationele basis voor dichlooracetaat als potentieel geneesmiddel tegen kanker, bestaat er in de literatuur aanzienlijke controverse over het klinisch nut van deze verbinding voor de behandeling van kanker bij de mens. Hoewel de studie van Bonnet et al. (2007) de antitumorwerking van dichlooracetaat in vitro en in vivo bij dieren heeft aangetoond, heeft een recente studie van Stockwin et al. (2010) aangetoond dat zeer hoge concentraties dichlooracetaat nodig zijn om celdood in tumorcellen te induceren en dat de verbinding bij deze concentraties geen tumorcelselectiviteit heeft.
Dichlooracetaat is geïoniseerd en kan het plasmamembraan niet passeren door diffusie. Dit doet de vraag rijzen hoe deze verbinding in de cellen komt en toegang krijgt tot PDK in de mitochondriale matrix. Voor zover wij weten is er slechts één rapport over het transport van dichlooracetaat in zoogdiercellen, waaruit blijkt dat monocarboxylaattransporters in hepatocyten en Ehrlich Lettre tumorcellen de cellulaire toegang van deze verbinding bemiddelen (Jackson en Halestrap, 1996). Aangezien de monocarboxylaattransporters electroneutraal zijn, is het mogelijk dat de meeste cellen, waaronder tumorcellen die deze transporters tot expressie brengen, niet in staat zijn dit geneesmiddel te concentreren. Onlangs hebben wij en anderen een nieuwe transporteur voor monocarboxylaten geïdentificeerd, die een soortgelijke substraatselectiviteit heeft als de monocarboxylaattransporteurs, maar Na+-gekoppeld en elektroneutraal is (Coady et al., 2004; Miyauchi et al., 2004). Deze transporter, bekend als natriumgekoppelde monocarboxylaattransporter (SMCT1) of SLC5A8 volgens de nomenclatuur van de Human Genome Organization, heeft het vermogen om zijn substraten te concentreren tegen een concentratiegradiënt vanwege de betrokkenheid van transmembraan Na+ gradiënt en membraanpotentiaal als drijvende krachten. SLC5A8 transporteert acetaat, propionaat, butyraat, lactaat, pyruvaat, 3- broomopyruvaat, nicotinaat, β-hydroxybutyraat en pyroglutamaat (Miyauchi et al., 2004, 2010; Gopal et al., 2004, 2005; Martin et al., 2006; Thangaraju et al., 2006, 2008, 2009a). Wij vroegen ons af of deze zeer energiegekoppelde transporter dichlooracetaat als substraat zou accepteren. Deze vraag is van direct belang voor de antitumoractiviteit van dit geneesmiddel, omdat tumorcellen deze transporter door epigenetische mechanismen het zwijgen opleggen (Ganapathy et al., 2005, 2008, 2009; Gupta et al., 2006). Daarom ondernamen wij de huidige studie om twee vragen te beantwoorden: (a) Transporteert SLC5A8 dichlooracetaat? (b) Is de antitumoractiviteit van het geneesmiddel afhankelijk van de expressie van de transporter in tumorcellen? De resultaten van de studie tonen aan dat SLC5A8 verplicht is voor de antitumoractiviteit van dichlooracetaat.
Resultaten
SLC5A8 transporteert dichlooracetaat op een Na+-gekoppelde wijze
Het transport van acetaat en zijn chloorderivaten door de menselijke SLC5A8 werd bestudeerd met behulp van het X. laevis oocyten expressiesysteem. De menselijke transporter werd heterologisch tot expressie gebracht in oöcyten door injectie van SLC5A8 cRNA. De transportfunctie werd elektrofysiologisch gecontroleerd met de twee-micro-elektrode voltage-clamp techniek. SLC5A8 functioneert als een Na+-gekoppelde transporter voor monocarboxylaten met een Na+: monocarboxylaat stoichiometrie van 2:1. Het transportproces is derhalve electrogenic, geassocieerd met de overdracht van één netto positieve lading in de cellen per transportcyclus. De resulterende depolarisatie van het membraan kan worden gevolgd als een inwaartse stroom onder spanning-clamp condities. Zoals te zien is in Fig. 1A, induceert blootstelling van SLC5A8-expresserende oöcyten aan acetaat (1 mM) opwaartse stromen wanneer deze worden gecontroleerd in aanwezigheid van Na+ in het perfusiemedium (129 ± 9 nA; n = 3 oöcyten). Deze stromen werden echter niet waargenomen in afwezigheid van Na+. Deze gegevens tonen aan dat SLC5A8 op een Na+-gekoppelde manier acetaattransport medieert. Uit verzadigingskinetiek bleek dat de Michaelis-constante (Kt) voor het transportproces 1,6 ± 0,1 mM bedroeg. Na vaststelling van de functionele activiteit van de gekloonde menselijke SLC5A8 met acetaat als positieve controle, onderzochten we het transport van dichlooracetaat. Blootstelling van SLC5A8- expresserende oöcyten aan dichlooracetaat (0,25 mM) induceerde duidelijke inwaartse stromen in aanwezigheid van Na+ (153 ± 28 nA; n = 5 oöcyten) (Fig. 2A). Dergelijke stromen werden niet waargenomen in afwezigheid van Na+. Het transportproces was verzadigbaar met een Kt van 36 ± 7 μM (fig. 2B). De affiniteit van dichlooracetaat voor de transporter is dus ~45 maal hoger dan die van acetaat. De door dichlooracetaat (0,25 mM) geïnduceerde stromen namen toe naarmate de concentratie Na+ in het perfusiemedium steeg (fig. 2C). Het verband was sigmoïdaal, wat wijst op betrokkenheid van meer dan één Na+ in het activeringsproces. Analyse van de gegevens volgens de Hill-vergelijking leverde een waarde op van 2,1 ± 0,2 voor de Hill-coëfficiënt. Uit deze gegevens blijkt dat de stoichiometrie van Na+: dichloroaceaat voor het transportproces 2:1 is.
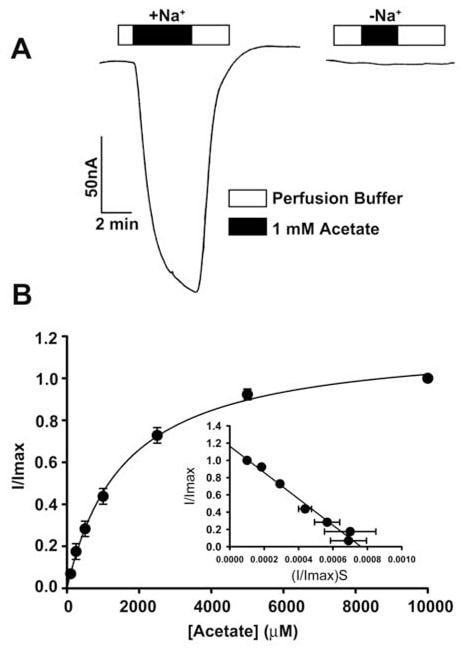
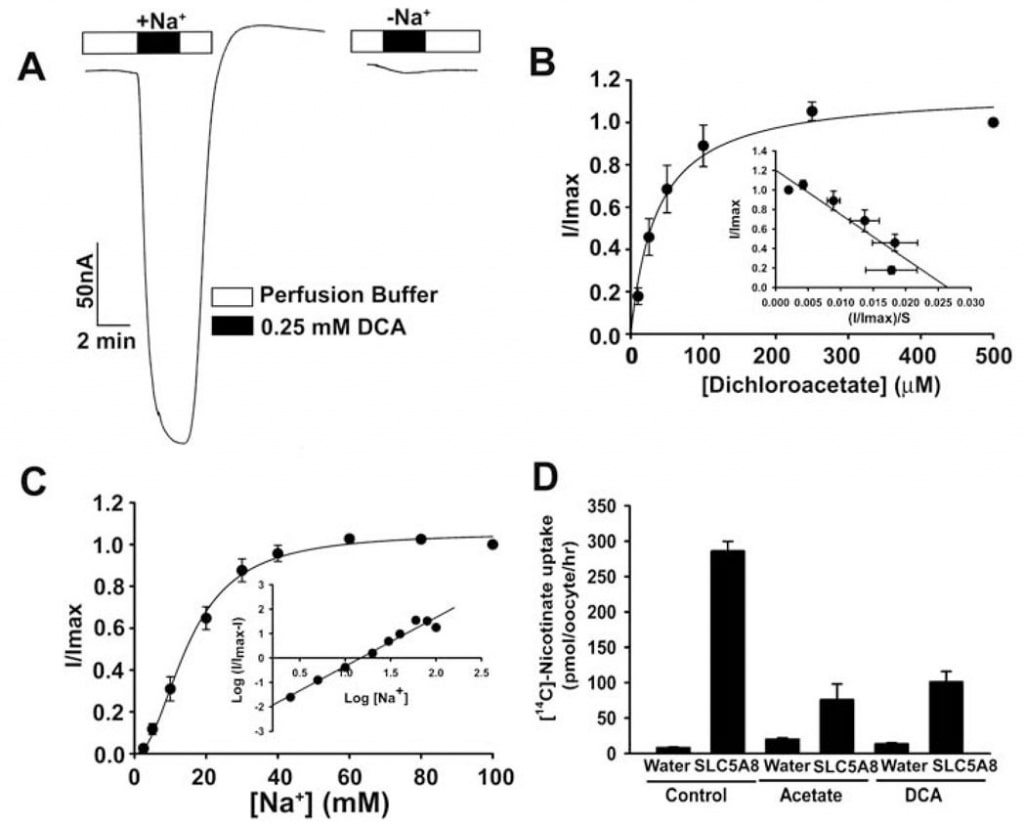
We gebruikten ook een alternatieve methode om het transport van dichlooracetaat via SLC5A8 te beoordelen. Deze methode gebruikte [14C]-nicotinaat als substraat voor SLC5A8. In water geïnjecteerde oöcyten brachten de transporter niet tot expressie en werden daarom als controle gebruikt. De opname van [14C]-nicotinaat (50 μM) was 60-maal hoger in oöcyten met SLC5A8-expressie dan in oöcyten met waterinjectie (fig. 2D). De SLC5A8-specifieke opname van nicotinaat werd >80% geremd in aanwezigheid van acetaat (0,25 mM) of dichlooracetaat (0,25 mM), hetgeen erop wijst dat acetaat en dichlooracetaat met nicotinaat concurreren om opname via SLC5A8.
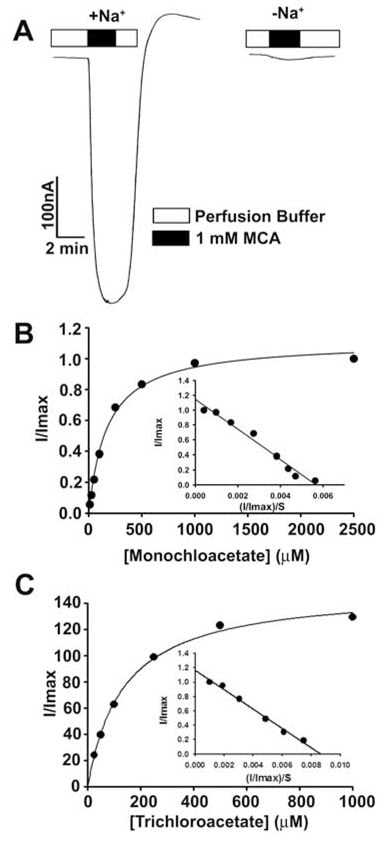
Deze bevindingen toonden aan dat dichlooracetaat een substraat met hoge affiniteit is voor humaan SLC5A8. Vervolgens bestudeerden wij ter vergelijking het transport van monochlooraceaat en trichlooracetaat (fig. 3). Beide verbindingen werden via SLC5A8 getransporteerd op een Na+-gekoppelde en verzadigde manier. De Kt was 177 ± 16μM voor monochlooracetaat en 134 ± 11 μM voor trichlooracetaat.
Dichlooracetaat-geïnduceerde apoptose in kankercellen vereist SLC5A8
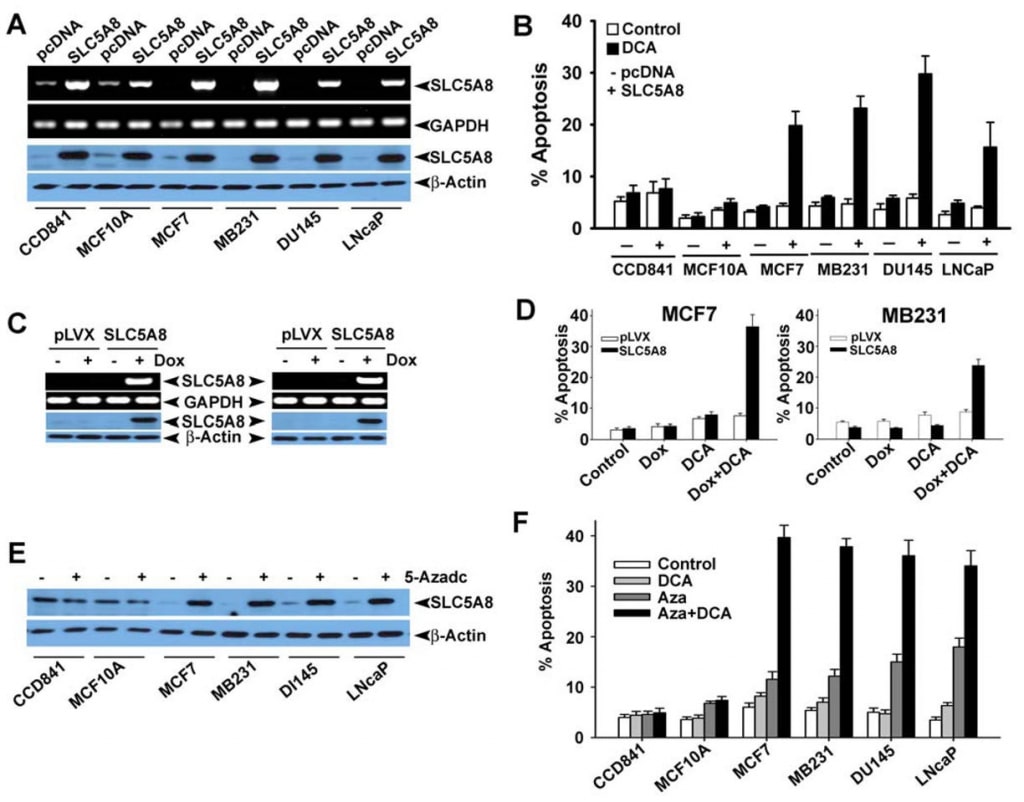
Hoewel verschillende studies hebben aangetoond dat dichlooracetaat apoptose induceert in verschillende kankercellijnen (Bonnet et al., 2007; Wong et al., 2008; Cao et al., 2008), kon een recent onderzoek deze bevindingen niet bevestigen (Stockwin et al., 2010). Het onderzoek van Bonnet et al. (2007) toonde aan dat dichlooracetaat in een concentratie van 0,5 mM in staat was metabolische veranderingen te induceren, specifiek in kankercellen en niet in normale cellen. Deze veranderingen omvatten depolarisatie van de mitochondriale membraan, onderdrukking van glycolyse, versterking van mitochondriale oxidatie, productie van reactieve zuurstofspecies, inductie van het plasmamembraan kaliumkanaal Kv1.5, en afgifte van pro-apoptotische factoren uit mitochondriën. Wong et al. (2008) toonden vervolgens aan dat dichlooracetaat apoptose veroorzaakt in endometriumkankercellen, en Cao et al. (2008) toonden aan dat de verbinding prostaatkankercellen gevoelig maakt voor bestraling. De studies van Stockwin et al. (2010) toonden daarentegen aan dat, hoewel dichlooracetaat in staat was mitochondriale depolarisatie en het genereren van reactieve zuurstofspecies te induceren, deze veranderingen zich zowel in kankercellen als in normale cellen voordeden. Bovendien was een zeer hoge concentratie van de verbinding (≥25 mM) nodig om apoptose te induceren. Op grond van de bevindingen van onze huidige studie dat SLC5A8 de energiegekoppelde actieve opname van dichlooracetaat in de cellen medieert en het feit dat kankercellen de transporter uitschakelen, vroegen wij ons af of de afwezigheid van de transporter in kankercellen de reden was voor het ontbreken van waarneembare apoptose bij lage concentraties van de verbinding, zoals waargenomen door Stockwin et al. (2010). Wij onderzochten deze vraag met behulp van drie verschillende menselijke cellijnen voor darmkanker (HCT116, SW620 en HT29). Deze drie cellijnen brengen SLC5A8 niet tot expressie (Thangaraju et al., 2008).
Wij bevestigden ook de afwezigheid van SLC5A8-expressie in menselijke colon- en borstkankercellijnen op eiwitniveau (Fig. 4A en B). Wij brachten SLC5A8 tot expressie in HCT116, SW620 en HT29-cellijnen door transfectie van een zoogdierexpressieconstruct en bevestigden de expressie door RT-PCR en Western blot analyse (Fig. 4C). Cellen getransfecteerd met lege vector dienden als controle. Vervolgens werden de controle- en SLC5A8-expressiecellen gedurende 48 uur blootgesteld aan dichlooracetaat (1 mM) en werd apoptose gecontroleerd (Fig. 4D-F). De resultaten waren interessant. In controlecellen, die de transporter niet tot expressie brachten, had dichlooracetaat geen significant effect. Onder identieke omstandigheden ondergingen SLC5A8-expressiecellen echter in duidelijke mate apoptose. Dit verschijnsel werd gezien in alle drie de cellijnen van darmkanker. Monochlooracetaat gedroeg zich ook vergelijkbaar met dichlooracetaat in HCT116- en SW620-cellen, maar niet in HT29-cellen, waar het vermogen van monochlooracetaat om apoptose te induceren aanzienlijk geringer was dan dat van dichlooracetaat. Acetaat en trichlooracetaat hadden geen merkbaar effect. Wij gebruikten butyraat als positieve controle in deze experimenten op basis van ons eerdere verslag dat de inductie van apoptose door butyraat in darmkankercellijnen verplicht afhankelijk is van de expressie van SLC5A8 (Thangaraju et al., 2008).
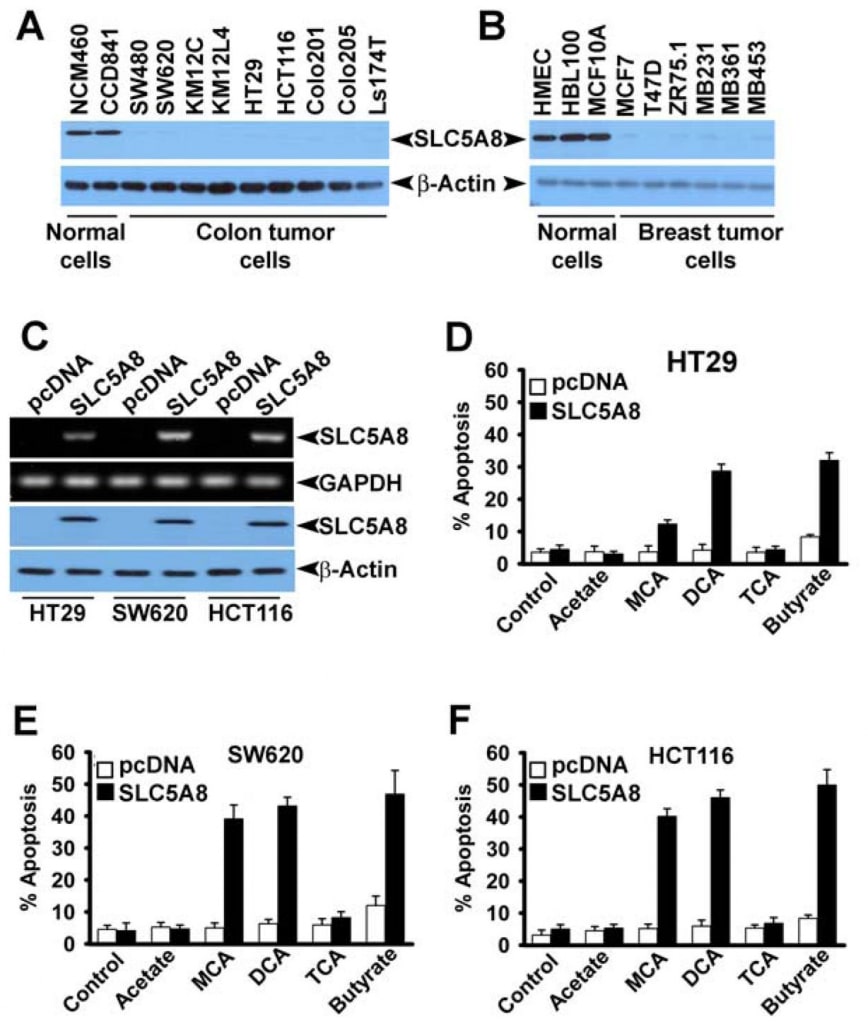
Vervolgens wilden wij nagaan of dichlooracetaat-geïnduceerde apoptose tumorcelselectiviteit vertoont en ook of het effect wordt gezien in kankercellijnen van andere weefseloorsprong dan het colon. Daartoe selecteerden wij CCD841 en MCF10A als representatieve normale cellijnen (CCD841, colon; MCF10A, mammarepitheel) en vier menselijke kankercellijnen: MCF7 (een oestrogeenreceptor-positieve borstkankercellijn), MB231 (een oestrogeenreceptornegatieve borstkankercellijn), DU145 (een androgeenongevoelige prostaatkankercellijn) en LNCaP (een androgeengevoelige prostaatkankercellijn). Zoals eerder gemeld (Thangaraju et al., 2006, 2008), drukten de normale cellijnen CCD841 en MCF10A detecteerbare niveaus van SLC5A8 uit, zowel op mRNA- als op eiwitniveau (fig. 5A). Daarentegen bracht geen van de vier hier onderzochte kankercellijnen de transporter tot expressie. De expressie werd duidelijk in kankercellijnen na transfectie van een zoogdierexpressieconstruct. In normale cellen namen de expressieniveaus toe na transfectie. Met deze cellijnen vergeleken wij het vermogen van dichlooracetaat om apoptose te induceren tussen normale en kankercellijnen (fig. 5B). Wij vonden geen significant verschil in apoptose in normale cellijnen met en zonder behandeling met dichlooracetaat (1 mM). Ook de verhoogde niveaus van SLC5A8-expressie hadden geen effect op de mate van apoptose. Daarentegen kon dichlooracetaat wel duidelijke apoptose induceren in de vier kankercellijnen, maar alleen als de cellen de transporter tot expressie brachten. Zonder expressie van de transporter ondergingen de kankercellijnen geen apoptose bij behandeling met dichlooracetaat. Deze resultaten tonen aan dat dichlooracetaat zelfs bij concentraties vanaf 1 mM op kankercelselectieve wijze apoptose kan veroorzaken, maar alleen als SLC5A8 tot expressie komt. Deze waarnemingen werden ook bevestigd met lenti-virusgemedieerde stabiele expressie van SLC5A8 (doxycylin-induceerbaar) in twee borstkankercellijnen, MCF7 en MB231 (fig. 5C, D). Het is duidelijk vastgesteld dat de uitschakeling van SLC5A8 samenhangt met DNA-methylering en dat behandeling van kankercellen met DNAdemethylerende middelen de expressie van SLC5A8 weer op gang brengt. Daarom behandelden wij normale en kankercellijnen met 5′-aza-2-deoxycytidine (5-Azadc), een DNA-demethylerende stof, en de heractivering van SLC5A8 werd bevestigd door immunoblottinganalyse (fig. 5E). behandeling met 5-Azadc veranderde de SLC5A8-eiwitexpressie niet in normale colon- en mammarepitheelcellen, terwijl het de SLC5A8-expressie in alle kankercellijnen opnieuw activeerde. Bovendien induceerde behandeling van deze cellen met 5-Azadc zelf significante apoptose; behandeling van deze cellen met dichlooracetaat (1 mM) versterkte de door 5-Azadc geïnduceerde apoptose echter aanzienlijk (fig. 5F).
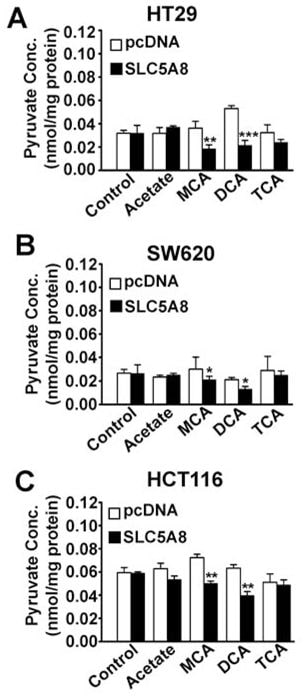
Effect van dichlooracetaat op intracellulaire niveaus van pyruvaat
Wat is het mechanisme dat verantwoordelijk is voor de inductie van apoptose door SLC5A8/dichlooracetaat in kankercellen? SLC5A8 is een actieve transporteur voor dichlooracetaat met een Kt van 36 ± 7μM. Daarom zal de verbinding in kankercellen worden geconcentreerd als de transporteur tot expressie komt. Dit zou verklaren waarom SLC5A8 verplicht is voor lage concentraties dichlooracetaat om apoptose in deze cellen te induceren. Als de transporteur niet tot expressie komt, accumuleren de cellen de verbinding wellicht niet tot niveaus die voldoende zijn om apoptose te veroorzaken. Hoe werkt dichlooracetaat, eenmaal geaccumuleerd in de kankercellen, om apoptose te veroorzaken? Het enige bekende werkingsmechanisme van dichlooracetaat is zijn vermogen om PDC te activeren door remming van PDK (Stacpoole et al., 1998, 2003, 2008). Dit zou leiden tot stimulering van mitochondriale oxidatie, generatie van reactieve zuurstofsoorten, depolarisatie van de mitochondriale membraanpotentiaal en inductie van apoptose. Activering van PDC door dichlooracetaat in intacte cellen zou de intracellulaire pyruvaatniveaus doen dalen. Op grond hiervan stelden wij de hypothese dat dichlooracetaat het pyruvaatgehalte in kankercellen zou verlagen en dat dit effect afhankelijk zou zijn van SLC5A8-expressie. Wij hebben deze hypothese getest in drie verschillende kankercellijnen (HT29, SW620 en HCT116) met en zonder exogene expressie van SLC5A8 (fig. 6). De expressie van de transporter op zich had geen effect op de intracellulaire pyruvaatniveaus. Dichlooracetaat kon de pyruvaatniveaus in alle drie de kankercellijnen aanzienlijk verlagen, maar alleen wanneer de transporter tot expressie werd gebracht. Interessant is dat monochlooracetaat ook een soortgelijk effect had, wederom alleen in aanwezigheid van SLC5A8; trichlooracetaat en acetaat daarentegen konden het pyruvaatgehalte niet beïnvloeden.
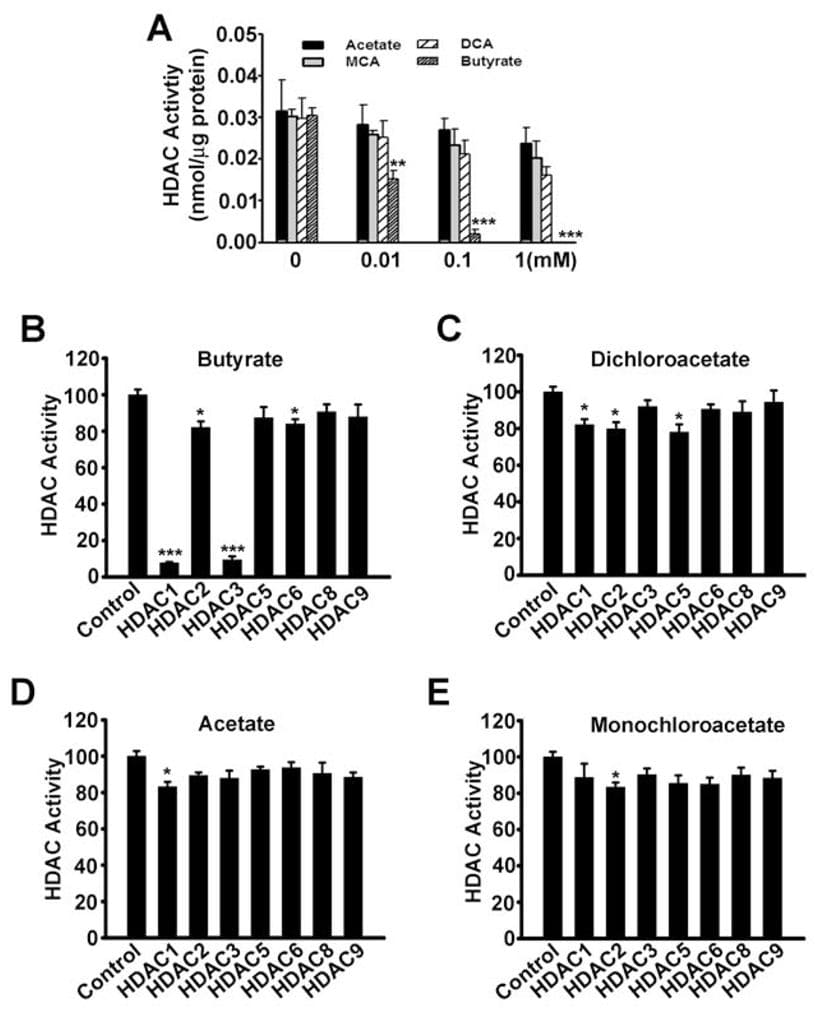
Tot nu toe was het enige mechanisme waardoor SLC5A8 als tumorsuppressor functioneert het vermogen om butyraat en pyruvaat, remmers van histon-deacetylases, in de cellen te concentreren. In deze studie hebben wij aangetoond dat dichlooracetaat ook apoptose in kankercellen induceert en dat dit effect afhankelijk is van de expressie van SLC5A8. Deze bevindingen zijn vergelijkbaar met die bij butyraat en pyruvaat. Daarom vroegen wij ons af of er enige betrokkenheid is van remming van histon-deacetylases bij de door dichlooracetaat geïnduceerde apoptose in kankercellen. Dit leek echter onwaarschijnlijk omdat acetaat geen remmer is van histon-deacetylases (Thangaraju et al., 2006). Wij konden echter niet uitsluiten dat dichlooracetaat als remmer van histon-deacetylases functioneert. Daarom onderzochten wij de invloed van acetaat, monochlooracetaat, dichlooracetaat en butyraat op de activiteit van histon-deacetylases. Eerst gebruikten wij lysaten van SW620-cellen als bron van histon-deacetylases (fig. 7A). Butyraat werd gebruikt als positieve controle in deze experimenten. Zoals verwacht remde butyraat de activiteit van histon-deacetylases. Onder identieke omstandigheden was dichlooracetaat ten minste 100 maal minder krachtig dan butyraat bij het remmen van histon-deacetylases. Vervolgens gebruikten wij recombinante menselijke histon-deacetylase-isovormen om te bepalen of specifieke isovormen van het enzym door dichlooracetaat konden worden geremd. Uit eerdere studies is gebleken dat butyraat een specifieke remmer is van de histon-deacetylase-isovormen HDAC1 en HDAC3 (Thangaraju et al., 2009b). In de huidige studie vonden wij hetzelfde met butyraat (Fig. 7B). Dichlooracetaat remde ook de isovormen HDAC1, HDAC2 en HDAC5 in significante mate, maar de werkzaamheid was zeer gering (~20% remming bij een concentratie van 1 mM) (fig. 7C). Acetaat (fig. 7D) en monochlooracetaat (fig. 7E) hadden op geen van de in de studie onderzochte isovormen enig effect.
Bespreking
Sinds de publicatie van het artikel in Cancer Cell door Bonnet et al. (2007) waaruit bleek dat dichlooracetaat in vitro apoptose bevordert bij kankercellijnen en in vivo de groei van kanker bij xenograften in muizen remt, is de publieke belangstelling voor het potentiële nut van deze verbinding als geneesmiddel tegen kanker gestaag toegenomen. Dichloroaetate is in gebruik geweest als geneesmiddel voor de behandeling van congenische melkziekte en daarom zijn details van de farmacokinetiek en het toxiciteitsprofiel van het geneesmiddel uitgewerkt (Stacpoole at al., 1998). De recente bevindingen dat het middel ook nuttig kan zijn bij de behandeling van kanker hebben veel kankerpatiënten ertoe aangezet dit niet-goedgekeurde middel te gebruiken zonder aanbeveling van hun arts (Pearson, 2007). Interessant is dat er geen gecontroleerde klinische proeven zijn geweest om de therapeutische werkzaamheid van dichlooracetaat als geneesmiddel tegen kanker te documenteren. Aangezien de structuur van dichlooracetaat niet kan worden gepatenteerd, waren farmaceutische bedrijven blijkbaar niet geïnteresseerd in de ontwikkeling van het geneesmiddel voor kankertherapie via klinische proeven, wat de hoofdonderzoeker van de oorspronkelijke publicatie in Cancer Cell ertoe aanzette fondsen te werven voor zijn eigen kleine klinische proeven (Pearson, 2007). De resultaten van de klinische proef zijn onlangs gepubliceerd (Machelakis et al., 2010), waaruit blijkt dat het geneesmiddel effectief is bij patiënten met gliobastoma. Hoewel het middel in vivo effectief was bij de behandeling van glioblastoom, moesten helaas hoge concentraties van het middel worden gebruikt voor therapeutische werkzaamheid, hetgeen resulteerde in perifere neuropathie. Dit was de enige ongewenste bijwerking die het gebruik van hogere doses van het geneesmiddel voor een grotere therapeutische werkzaamheid beperkte. Er waren geen aanwijzingen voor hematologische, lever-, nier- of harttoxiciteit. Verschillende studies hebben neurologische complicaties gedocumenteerd bij hoge doses dichlooracetaat bij dieren en mensen (Calcutt et al., 2009; Wiemer en Sachdev, 2009; Brandsma et al., 2010). De neurologische complicaties treden alleen op bij zeer hoge doses dichlooracetaat: 12.5 mg/kg/dag gedurende 3 maanden (Bonnet et al., 2007) of 15 mg/kg/dag gedurende 4 weken (Brandsma et al., 2010). De noodzaak van hoge doses dichlooracetaat om therapeutisch effectief te zijn in vivo komt overeen met de meeste recent gepubliceerde in vitro gegevens waaruit blijkt dat concentraties van 10 mM of hoger nodig zijn om apoptose te veroorzaken in kankercellijnen (Stockwin et al., 2010; Madhok et al., 2010; Xiao et al., 2010; Heshe et al., 2010; Sun et al., 2010).
Er zijn overtuigende aanwijzingen dat dichlooracetaat het metabolisch fenotype van kankercellen kan omkeren en hun dood kan bevorderen, maar het antitumoreffect wordt alleen gezien bij zeer hoge concentraties, zowel in vitro als in vivo. Aangezien bij deze therapeutisch effectieve concentraties neurologische toxiciteit optreedt, is het nut van de verbinding als antikankermedicijn bij de mens beperkt. Interessant is dat het enige moleculaire doelwit voor de antitumoractiviteit van dichlooracetaat PDK is, dat door de verbinding wordt geremd bij micromolaire concentraties (remmingsconstante, 50-100 μM) (Whitehouse et al., 1974; Cooper et al., 1974). Hoe komt het dan dat in vitro hoge millimolaire concentraties dichlooracetaat nodig zijn om kankercellen te doden? Deze vraag moet worden beantwoord om het potentieel van deze verbinding als geneesmiddel tegen kanker te benutten. Onze huidige studies geven een bevredigend antwoord op deze belangrijke vraag. Kankercellen brengen geen enkel transportsysteem tot expressie dat de verbinding doeltreffend van het extracellulaire medium naar zijn intracellulaire doelwit kan overbrengen. Monocarboxylaattransporters die tot expressie komen in kankercellen transporteren dichlooracetaat met een Kt van 0,6 mM (Jackson en Halestrap, 1996). Dit is een transportproces met lage affiniteit. Bovendien zijn monocarboxylaattransporters niet zeer concentratief. Bovendien genereren tumorcellen grote hoeveelheden lactaat, dat ook een substraat is voor monocarboxylaattransporters met een affiniteit die vergelijkbaar is met die van dichlooracetaat, waardoor concurrentie ontstaat voor het transportproces. De huidige studies tonen aan dat SLC5A8 dichlooracetaat transporteert met een affiniteit die aanzienlijk groter is dan die van de monocarboxylaattransporters (Kt: 36 μM versus 600 μM). Nog belangrijker is het feit dat SLC5A8 veel doeltreffender is dan de monocarboxylaattransporters bij het transport van dichlooracetaat vanwege de energievoorziening van eerstgenoemde door een transmembrane elektrochemische Na+ gradiënt. Het is interessant op te merken dat de affiniteit voor de transporteur drastisch verandert door de chlorering van de tweede koolstof in acetaat (Kt: 1572 ± 101 μM voor acetaat; 177 ± 16 μM voor monochlooracetaat; 36 ± 7 μM voor dichlooracetaat; 134 ± 11 μM voor trichlooracetaat). Onze bevindingen leiden tot de conclusie dat tumorcellen resistent zijn tegen door dichlooracetaat geïnduceerde apoptose, omdat deze cellen geen effectieve transportsystemen voor het geneesmiddel bezitten. Dit is de meest waarschijnlijke reden waarom zeer hoge concentraties van de verbinding nodig zijn om celdood in tumorcellen te induceren. Het is ook mogelijk dat de bij deze hoge concentraties waargenomen celdood in tumorcellen niet te wijten is aan activering van PDC, omdat soortgelijke effecten ook in normale cellen worden gezien (Stockwin et al., 2010).
In de huidige studie hebben we aangetoond dat, als SLC5A8 tot expressie komt in tumorcellen, dichlooracetaat celdood induceert bij een relatief lagere concentratie (1 mM) op een tumorcelselectieve manier. Onder identieke omstandigheden worden normale cellen (CCD841 en MCF10A) niet aangetast. De weerstand van normale cellen tegen dichlooracetaat is niet te wijten aan de afwezigheid van een transportsysteem voor het geneesmiddel. Normale cellen brengen SLC5A8 constitutief tot expressie, en wij hebben aangetoond dat de cellen geen apoptose ondergaan met of zonder extra expressie van de transporter. Dit bevestigt het tumorcelspecifieke effect van dichlooracetaat. Onze studies hebben ook aangetoond dat de werkzaamheid van dichlooracetaat als inducer van apoptose niet alleen wordt waargenomen bij darmkankercellijnen, maar ook bij borstkankercellijnen en prostaatkankercellijnen. Het mechanisme van de door dichlooracetaat veroorzaakte celdood in kankercellen is voornamelijk te wijten aan de activering van de mitochondriale oxidatie van pyruvaat. Dit wordt ondersteund door de bevinding dat de intracellulaire pyruvaatniveaus in kankercellen op een SLC5A8-afhankelijke wijze afnemen als reactie op de behandeling met dichlooracetaat, hetgeen suggereert dat de geconcentreerde opname van het geneesmiddel in kankercellen, gemedieerd door het exogeen tot expressie gebrachte SLC5A8, verantwoordelijk is voor dit effect. Dichlooracetaat remt geen histon-deacetylases, hetgeen remming van histon-deacetylases uitsluit als mogelijk mechanisme van apoptose in tumorcellen geïnduceerd door de verbinding.
De bevindingen dat dichlooracetaat bij lage concentraties selectief celdood in tumorcellen induceert, maar alleen als SLC5A8 tot expressie komt, hebben klinische en therapeutische betekenis. Het vermogen van dichlooracetaat om PDC te activeren via remming van PDK in kankercellen biedt een mechanistisch rationele basis voor de antitumoractiviteit van de verbinding. Kankercellen zijn echter resistent tegen het geneesmiddel vanwege het ontbreken van een effectieve transporteur voor het geneesmiddel, waardoor hoge concentraties van de verbinding nodig zijn om celdood te induceren, hetgeen helaas schadelijke bijwerkingen veroorzaakt zoals neuropathie. In deze studie hebben wij aangetoond dat SLC5A8 dient als actieve transporteur voor dichlooracetaat. Maar aangezien de expressie van de transporteur in tumorcellen verstomd is, hoe kunnen de huidige bevindingen dan relevant zijn voor het potentiële therapeutische gebruik van het geneesmiddel? De uitschakeling van SLC5A8 in kankercellen gebeurt via epigenetische mechanismen waarbij DNA-methylering betrokken is; behandeling van kankercellen met 5′-azacytidine, een remmer van DNA-methylering, activeert de expressie van het gen opnieuw (Li et al., 2003; Ueno et al., 2004; Hong et al., 2005; Porra et al., 2005; Thangaraju et al., 2006; Park et al., 2007, 2008). DNA-methylering speelt een cruciale rol bij het stilleggen van tumorsuppressorgenen in diverse vormen van kanker, en DNA-methyleringsremmers zijn veelbelovend als geneesmiddelen tegen kanker (Baylin, 2005). Twee verbindingen met een remmende werking op DNA-methylering worden klinisch gebruikt voor de behandeling van hematologische maligniteiten. Dit zijn 5′-aza-2′-deoxycytidine, ook bekend als decitabine (handelsnaam Dacogen) en 5′-azacytidine (handelsnaam Vidaza). In vitro studies hebben aangetoond dat behandeling van verschillende kankercellijnen met deze stoffen de expressie van SLC5A8 opnieuw activeert. Wij speculeren dat hetzelfde verschijnsel zich ook in vivo zal voordoen. Daarom zal een combinatie van een DNA-methyleringsremmer en dichlooracetaat waarschijnlijk effectief zijn voor de behandeling van kanker, omdat de DNA-methyleringsremmer de expressie van SLC5A8 in tumoren zou induceren, waardoor dichlooracetaat effectief in tumorcellen zou worden getransporteerd om de antitumoractiviteit ervan uit te lokken. Deze wijze van behandeling zou de concentratie van dichlooracetaat die nodig is voor in vivo werkzaamheid als antikankermiddel aanzienlijk verminderen, waardoor tumorselectiviteit mogelijk wordt en ook de schadelijke bijwerkingen zoals neuropathie worden vermeden. De bevindingen van deze studie vormen een rationele basis voor een dergelijke combinatietherapie.
Materialen en methoden
Materialen
[ 14C]-nicotinaat werd gekocht van American Radiolabeled Chemicals (St. Louis, MO). Acetaat en zijn chloorderivaten werden verkregen van Sigma (St. Louis, MO). SLC5A8 werd oorspronkelijk gekloond uit de menselijke darm (Miyauchi et al., 2004).
X. laevis oöcyte expressiesysteem
Capped cRNA van menselijk SLC5A8 cDNA (gekloond in pGH19, een X. laevis oöcyte expressievector) werd gesynthetiseerd met behulp van de mMESSAGE-mMACHINE kit (Ambion, Austin, TX). Rijpe oöcyten van X. laevis werden geïsoleerd door behandeling met collagenase A (1,6 mg/ml), handmatig ontbladerd en gehandhaafd bij 18 °C in gemodificeerd Barth’s medium, aangevuld met 25 ug/ml gentamicine. Oöcyten werden geïnjecteerd met 50 ng cRNA. Watergeïnjecteerde oöcyten dienden als controle. Elektrofysiologische studies werden uitgevoerd met de twee-micro-elektrode voltage-clamp methode. Oöcyten werden geperifuseerd met een NaCl-bevattende buffer (100 mM NaCl, 2 mM KCl, 1 mM MgCl2, 1 mM CaCl2, 10 mM Hepes, pH 7,5), gevolgd door dezelfde buffer met acetaat of zijn chloorderivaten. De membraanpotentiaal werd geklemd op -50 mV. De verschillen tussen de steady-state stromen gemeten in aan- en afwezigheid van substraten werden beschouwd als de substraat-geïnduceerde stromen. Bij de analyse van de verzadigingskinetiek van de substraat-geïnduceerde stromen werd de kinetische parameter Kt (d.w.z. de substraatconcentratie die nodig is voor de inductie van de halfmaximale stroom) berekend door de Michaelis-Menten-vergelijking te passen op de waarden van de substraat-geïnduceerde stromen. De Na+-activeringskinetiek van substraat-geïnduceerde stromen werd geanalyseerd door de substraat-specifieke stromen te meten in aanwezigheid van toenemende concentraties Na+. De gegevens voor de Na+-afhankelijke stromingen werden geanalyseerd volgens de Hill-vergelijking om de Hill-coëfficiënt te bepalen (het aantal Na+-ionen dat betrokken is bij het activeringsproces). Aangezien de expressieniveaus per oöcyt sterk verschilden, werden de kinetische analyses uitgevoerd door de expressieniveaus te normaliseren. Dit werd gedaan door de maximaal geïnduceerde SLC5A8-specifieke stroom in elk kinetisch experiment in individuele oöcyten te nemen als 1. Elk experiment werd herhaald met 3 of 4 verschillende oöcyten. De activiteit van de heterologisch tot expressie gebrachte SLC5A8 in oöcyten werd ook gecontroleerd door [14C]-nicotinaatopname. De concentratie nicotinaat in deze experimenten was 50 μM en de incubatietijd was 1 uur.
Het protocol voor het gebruik van kikkers in deze experimenten werd goedgekeurd door de Institutional Animal Care and Use Committee.
Ectopische expressie van SLC5A8 in gekweekte cellijnen
Cellen werden uitgezaaid in 35-mm kweekschalen en gekweekt in afwezigheid van pyruvaat. De cellen werden getransfecteerd met pcDNA of menselijk SLC5A8 cDNA met behulp van Fugene 6 en Opti-MEM. pEGFP-N1 werd gebruikt voor co-transfectie om de transfectie-efficiëntie te bepalen. Na 24 uur werden de cellen behandeld met of zonder acetaat of zijn chloorderivaten (1 mM) gedurende 24 uur. Voor FACS-analyse werden de cellen gefixeerd in 50% ethanol, behandeld met 0,1% natriumcitraat, 1 mg/ml RNase A en 50 μg/ml propidiumjodide, en vervolgens onderworpen aan fluorescentie-geactiveerde celsortering (FACS; FACS Caliber, Becton Dickinson) analyse.
Generation of SLC5A8-expressing stable cell lines
We genereerden SLC5A8-expressing stable clones in twee cellijnen, MCF7en MDA-MB231, om SLC5A8 conditioneel tot expressie te brengen door SLC5A8 cDNA onder controle van de Tet-afhankelijke promotor (Tet-On Advanced, Clontech) te plaatsen. Het systeem wordt geleverd met twee elementen, de regulatorvector (pLVX-Tet-On Advanced) en de responsvector (pLVX-Tight-Puro). Kort gezegd werd recombinant lentivirus geproduceerd door co-transfectie in 293FT-cellen van de regulatorvector (pLVX-Tet-On Advanced) en drie andere helpervectoren, pLP-1, pLP-2 en pVSVG (Invitrogen) met behulp van Lipofectamine 2000-transfectiereagens. Lenti-viraal supernatant werd 72 uur na transfectie geoogst en gefilterd door 0,45 μm membraan. MCF7- en MDA-MB231-cellen werden gedurende 24 uur geïnfecteerd met lentivirus in medium met 8 μg/ml polybrene en nog eens 48 uur gekweekt. Cellen werden geselecteerd met G418 (2 mg/ml) en de expressie van rTet R-eiwit werd gecontroleerd met Western blot. SLC5A8 werd gesubloneerd in pLVX-Tight-Puro en SLC5A8 pLVX-Tight-Puro werd getransduceerd in MCF7- en MDA-MB231-cellen die het rTetR-eiwit tot expressie brachten met dezelfde procedure als hierboven beschreven. De cellen werden geselecteerd met 2 ug/ml puromycine en gehandhaafd in medium met Tetvrij FBS, 0,25 ug/ml puromycine en 250 ug/ml G418. De inductie van SLC5A8-mRNA bij toevoeging van doxycycline werd bevestigd door RT-PCR.
Re-activering van SLC5A8-expressie door DNA-demethylerende stof
De cellenwerden uitgezaaid in schaaltjes van 10 cm bij een zeer lage dichtheid (0,5 ×106 cellen/schaaltje) en gekweekt in een medium zonder natriumpyruvaat. Na 24 uur werden de cellen behandeld met 5′-Azadc (2 μg/ml) gedurende 72 uur. Het medium werd elke 24 uur vervangen door vers medium met 5′-Azadc. Na de behandeling met 5′-Azadc werden de cellen behandeld met DCA (1 mM) gedurende 48 uur. Na de behandeling werden de cellen geoogst en verwerkt voor eiwitextractie en FACS-analyse.
Omgekeerde transcriptie-PCR
RNA van normale en kankercellijnen werd gebruikt voor semi-kwantitatieve RT-PCR. RNA (2 μg) werd met het GeneAmp PCR-systeem (Roche) omgerekend naar cDNA. De PCR-primers voor specifieke genen werden ontworpen op basis van de in GenBank beschikbare nucleotidesequenties. Omgekeerde transcriptie-PCR (RT-PCR) werd tweemaal herhaald met elk RNA-monster. GAPDH (Glyceraldehyde-3-fosfaat dehydrogenase) werd gebruikt als interne controle.
Western blot analyse
Vijftig microgram eiwit werd gefractioneerd door SDS-PAGE, en de gefractioneerde eiwitten werden overgebracht op een nitrocellulosemembraan (Whatman GmbH). Membranen werden geblokkeerd met 5% vetvrije droge melk en vervolgens blootgesteld aan anti-SLC5A8 primair antilichaam (Cat. # ARP44110, Aviva System Biology) bij 4 °C gedurende een nacht, gevolgd door behandeling met geschikte secundaire antilichamen. Eiwitten werden gevisualiseerd met ECL SuperSignal Western System (GE Healthcare).
Analyse van apoptose
Cellen werden gefixeerd in 50% ethanol, behandeld met 0,1% natriumcitraat, 1 mg/mL RNase A en 50 μg/mL propidiumjodide, en onderworpen aan fluorescentie-geactiveerde celsortering (FACS, Becton Dickinson) analyse.
Meting van HDAC-activiteit
Een in de handel verkrijgbare kit (Biovision, Mountain View, CA) werd gebruikt om de HDAC-activiteit te bepalen. Wanneer het cellysaat van de darmkankercellijn SW620 werd gebruikt als bron van HDAC-activiteit, werd 100 μg eiwit in het lysaat toegevoegd aan de enzymtest in aanwezigheid of afwezigheid van acetaat of chloorderivaten daarvan (1 mM). De activiteit van recombinante menselijke HDAC-isovormen werd ook gemeten met dezelfde kit. De recombinante HDAC-isovormen werden gekocht bij Cayman Chemical Company.
Meting van intracellulaire niveaus van pyruvaat
Cellen werden uitgezaaid in 35-mm kweekschalen en gekweekt in afwezigheid van pyruvaat. Cellen werden getransfecteerd met pcDNA of menselijk SLC5A8 cDNA met behulp van Fugene 6 en Opti-MEM. Na 24 uur werden de cellen behandeld met of zonder acetaat of zijn chloorderivaten (1 mM) gedurende 24 uur. Cellysaten werden vervolgens gebruikt voor het meten van pyruvaat met behulp van een commercieel verkrijgbare kit (Biovision, Mountain View, CA).
Dankbetuigingen
Het hier beschreven werk wordt gedeeltelijk ondersteund door de National Institutes of Health subsidie CA131402.
VERWIJZINGEN
1 Baylin SB. DNA-methylering en gene silencing in kanker. Nat Clin Pract Oncol. 2005; 2:S4-S11. [PubMed: 16341240]
2 Bonnet S, Archer SL, Allalunis-Turner J, Haromy A, Beaulieu C, Thompson R, et al. A mitochondriaK + channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth. Cancer Cell. 2007; 11:37-51. [PubMed: 17222789]
2Brahimi-HornMC, Chiche J, Pouyssegur J. Hypoxia signaling controls metabolic demand. Curr Opin Cell Biol. 2007; 19:223-229. [PubMed: 17303407]
2BrandsmaD, Dorlo TP, Haanen JH, Beijnen JH, Boogerd W. Severe encephalopathy and polyneuropathy induced by dichloroacetate. J Neurol. 2010 In press.
2CalcuttNA, Lopez VL, Bautista AD, Mizisin LM, Torres BR, Shroads AL, et al. Peripheral neuropathy in rats exposed to dichloroacetate. J Neuropathol Exp Neurol. 2009; 68:985-993. [PubMed: 19680144]
3CaoW, Yacoub S, Shiverick KT, Namiki K, Sakai Y, Porvasnik S, et al. Dichloroacetate (DCA) sensitizes both wild type and over expressing Bcl-2 prostate cancer cells in vitro to radiation. Prostate. 2008; 68:1223-1231. [PubMed: 18465755]
4ChenZ, Lu W, Garcia-Prieto C, Huang P. The Warburg effect and its cancer therapeutic implications. J Bioenerg Biomembr. 2007; 39:267-274. [PubMed: 17551814]
5CoadyMJ, Chang MH, Charron FM, Plata C, Wallendorff B, Sah JF, et al. The tumor suppressor gene SLC5A8 expresses a Na+-monocarboxylate cotransporter. J Physiol. 2004; 557:719-731. [PubMed: 15090606]
6CooperRH, Randle PJ, Denton RM. Regulation of heart muscle pyruvate dehydrogenase kinase. Biochem J. 1974; 143:625-641. [PubMed: 4462746]
7GanapathyV, Gopal E, Miyauchi S, Prasad PD. Biological functions of SLC5A8, a candidate tumor suppressor. Biochem Soc Trans. 2005; 33:237-240. [PubMed: 15667316]
8GanapathyV, Thangaraju M, Gopal E, Itagaki S, Miyauchi S, Prasad PD. Sodium-coupled monocarboxylate transporters in normale weefsels en in kanker. AAPS J. 2008; 10:193-199. [PubMed: 18446519]
9GanapathyV, Thangaraju M, Prasad PD. Nutrient transporters in kanker: Relevance to Warburg hypothesis and beyond. Pharmacol Ther. 2009; 121:29-40. [PubMed: 18992769]
10GatenbyRA, Gillies RJ. Waarom hebben kankers een hoge aerobe glycolyse? Nat Rev Cancer. 2004; 4:891- 899. [PubMed: 15516961]
11GopalE, Fei YJ, Sugawara M, Miyauchi S, Zhuang L, Martin PM, et al. Expression of Slc5a8 in kidney and its role in Na+-coupled transport of lactate. J Biol Chem. 2004; 279:44522-44532. [PubMed: 15322102]
12GopalE, Fei YJ, Miyauchi S, Zhuang L, Prasad PD, Ganapathy V. Sodium-coupled and electrogenic transport of B-complex vitamin nicotinic acid by Slc5a8, a member of the Na+/glucose cotransporter gene family. Biochem J. 2005; 388:309-316. [PubMed: 15651982]
13GuptaN, Martin PM, Prasad PD, Ganapathy V. SLC5A8 (SMCT1) -mediated transport of butyrate forms the basis for the tumor suppressive function of the transporter. Life Sci. 2006; 78:2419- 2425. [PubMed: 16375929]
14HesheD, Hoogestraat S, Brauckmann C, Karst U, Boos J, Lanvers-Kaminsky C. Dichloroacetate metabolically targeted therapy defeats cytotoxicity of standard anticancer drugs. Cancer Chemother Pharmacol. 2010 In press.
15HongC, Maunakea A, Jun P, Bollen AW, Hodgson JG, Goldenberg DD, et al. Shared epigenetic mechanisms in human and mouse gliomas inactivate expression of the growth suppressor SLC5A8. Cancer Res. 2005; 65:3617-3623. [PubMed: 15867356]
16JacksonVN, Halestrap AP. The kinetics, substrate, and inhibitor specificity of the monocarboxylate (lactate) transporter of rat liver cells determined using the fluorescent intracellular pH indicator, 2′, 7′-bis (carboxyethyl)-5(6)-carboxyfluorescein. J Biol Chem. 1996; 271:861-868. [PubMed: 8557697]
17KimJW, Dang CV. Cancer’s molecular sweet tooth and the Warburg effect. Cancer Res. 2006; 66:8927-8930. [PubMed: 16982728]
19LiH, Myeroff L, Smiraglia D, Romero MF, Pretlow TP, Kasturi L, et al. SLC5A8, a sodium transporter, is a tumor suppressor gene silenced by methylation in human colon aberrant crypt foci and cancers. Proc Natl Acad Sci USA. 2003; 100:8412-8417. [PubMed: 12829793]
20MadhokBM, Yeluri S, Perry SL, Hughes TA, Jayne DG. Dichloroacetate induceert apoptose en celcyclusstilstand in colorectale kankercellen. Br J Cancer. 2010; 102:1746-1752. [PubMed: 20485289]
21MartinPM, Gopal E, Ananth S, Zhuang L, Itagaki S, Prasad BM, et al. Identity of SMCT1 (SLC5A8) as a neuron-specific Na+-coupled transporter for active uptake of L-lactate and ketone bodies in the brain. J Neurochem. 2006; 98:279-288. [PubMed: 16805814]
22MathupalaSP, KOYH, Pedersen PL. De centrale rol van mitochondriën bij kanker: Warburg and beyond and encouraging prospects for effective therapies. Biochim Biophys Acta. 2010; 1797:1225-1230. [PubMed: 20381449]
23MichelakisED, Webster L, Mackey JR. Dichloroacetate (DCA) als een potentiële metabool-gerichte therapie voor kanker. Br J Cancer. 2008; 99:989-994. [PubMed: 18766181]
24MichelakisED, Sutendra G, Dromparis P, Webster L, Haromy A, Niven E, et al. Metabolic modulation of glioblastoma with dichloroacetate. Sci Transl Med. 2010; 2:31-34.
25MiyauchiS, Gopal E, Fei YJ, Ganapathy V. Functional identification of SLC5A8, a tumor suppressor downregulated in colon cancer, as a Na+-coupled transporter for short-chain fatty acids. J Biol Chem. 2004; 279:13293-13296. [PubMed: 14966140]
26MiyauchiS, Gopal E, Babu E, Sonne SR, Kubo Y, Umapathy NS, et al. Sodium-coupled electrogenic transport of pyroglutamate (5-oxoproline) via SLC5A8, a monocarboxylate transporter. Biochim Biophys Acta. 2010; 1798:1164-1171. [PubMed: 20211600]
27ParkJY, Zheng W, Kim D, Cheng JQ, Kumar N, Ahmad N, et al. Candidate tumor suppressor gene SLC5A8 is frequently down-regulated by promoter hypermethylation in prostate cancer. Cancer Detect Prev. 2007; 31:359-365. [PubMed: 18037591]
28ParkJY, Helm JF, Zheng W, Ly QP, Hodul PJ, Centeno BA, et al. Silencing of the candidate tumor suppressor gene solute carrier family 5 member 8 (SLC5A8) in human pancreatic cancer. Pancreas. 2008; 36:e32-e39. [PubMed: 18437076]
29PearsonH. Kankerpatiënten kiezen voor niet-goedgekeurd medicijn. Nature. 2007; 446:474-475. [PubMed: 17392750]
30PorraV, Ferraro-Peyret C, Durand C, Selmi-Ruby S, Giroud H, Berger-Dutrieux N, et al. Silencing of the tumor suppressor gene SLC5A8 is associated with BRAF mutations is classical papillary thyroid carcinomas. J Clin Endocrinol Metab. 2005; 90:3028-3035. [PubMed: 15687339]
31SemenzaGL. HIF-1: upstream en downstream van het kanker metabolisme. Curr Opin Genet Dev. 2010; 20:51-56. [PubMed: 19942427]
32StacpoolePW, Henderson GN, Yan Z, Cornett R, James MO. Pharmacokinetics, metabolism and toxicology of dichloroacetate. Drug Metab Rev. 1998; 30:499-539. [PubMed: 9710704]
33StacpoolePW, Nagaraja NV, Hutson AD. Efficacy of dichloroacetate as a lactate-lowering drug. J Clin Pharmacol. 2003; 43:683-691. [PubMed: 12856382]
34StacpoolePW, Kurtz TL, Han Z, Langaee T. Role of dichloroacetate in the treatment of genetic mitochondrial diseases. Adv Drug Deliv Rev. 2008; 60:1478-1487. [PubMed: 18647626]
35StockwinLH, Yu SX, Borgel S, Hancock C, Wolfe TL, Phillips LR, Hollingshead MG, Newton DL. Sodium dichloroacetate (DCA) richt zich selectief op cellen met defecten in de mitochondriale ETC. Int J Cancer. 2010 in press.
36SunRC, Fadia M, Dahlstrom JE, Parish CR, Board PG, Blackburn AC. Reversal of the glycolytic phenotype by dichloroacetate inhibits metastatic breast cancer cell growth in vitro and in vivo. Breast Cancer Res Treat. 2010; 120:253-260. [PubMed: 19543830]
37ThangarajuM, Gopal E, Martin PM, Ananth S, Smith SB, Prasad PD, et al. SLC5A8 triggers tumor cell apoptosis through pyruvate-dependent inhibition of histone deacetylases. Cancer Res. 2006; 66:11560-11564. [PubMed: 17178845]
38ThangarajuM, Cresci G, Itagaki S, Mellinger J, Browning DD, Berger FG, et al. Sodium-coupled transport of the short-chain fatty acid butyrate by SLC5A8 and its relevance to colon cancer. J Gastrointest Surg. 2008; 12:1773-1782. [PubMed: 18661192]
39ThangarajuM, Karunakaran S, Itagaki S, Gopal E, Elangovan S, Prasad PD, et al. Transport via SLC5A8 met daaropvolgende remming van histon deacetylases HDAC1 en HDAC3 ligt ten grondslag aan de antitumoractiviteit van 3-bromopyruvate. Cancer. 2009a; 115:4655-4666. [PubMed: 19637353]
40ThangarajuM, Carswell KN, Prasad PD, Ganapathy V. Colon cancer cells maintain low levels of pyruvate to avoid cell death caused by inhibition of HDAC1/HDAC3. Biochem J. 2009b; 417:379-389. [PubMed: 18789002]
41UenoM, Toyota M, Akino K, Suzuki H, Kusano M, Satoh A, et al. Aberrant methylation and histone deacetylation associated with silencing of SLC5A8 in gastric cancer. Tumour Biol. 2004; 25:134- 140. [PubMed: 15361710]
42VanderHeiden MG, Cantley LC, Thompson CB. Understanding the Warburg effect: the metabolic requirements of cell proliferation. Science. 2009; 324:1029-1033. [PubMed: 19460998]
43WarburgO. On the origin of cancer cells. Science. 1956; 123:309-314. [PubMed: 13298683]
44WeimerLH, Sachdev N. Update on medication-induced peripheral neuropathy. Curr Neurol Neurosci Rep. 2009; 9:69-75. [PubMed: 19080756]
45WhitehouseS, Cooper RH, Randle PJ. Mechanism of activation of pyruvate dehydrogenase by dichloroacetate and other halogenated carboxylic acids. Biochem J. 1974; 141:761-774. [PubMed: 4478069]
46WongJY, Huggins GS, Debidda M, Munshi NC, De Vivo I. Dichloroacetate induces apoptosis in endometrial cancer cells. Gynecol Oncol. 2008; 109:394-402. [PubMed: 18423823]
47XiaoL, Li X, Niu N, Qian J, Xie G, Wang Y. Dichloroacetate (DCA) verbetert tumorceldood in combinatie met oncolytisch adenovirus gewapend met MDA-7/IL-24. Mol Cell Biochem. 2010; 340:31-40. [PubMed: 20165905]