D.L. Kolesnik1, O.N. Pyaskovskaya1, I.V. Boychuk1, O.I. Dasyukevich1, O.R. Melnikov1, A.S. Tarasov1, G.I. Solyanik1
1R.E. Kavetsky Instituut voor Experimentele Pathologie, Oncologie en Radiobiologie, NAS van Oekraïne, Kyiv 03022, Oekraïne.
Correspondentie: D.L. Kolesnik, E-mail: [email protected]
Ingezonden: 20 maart 2015
Abstract
Een kenmerk van maligniteit is overmatige tumorglycolyse, zelfs in aanwezigheid van zuurstof, die lactacidose veroorzaakt in de tumormicro-omgeving en tumorcelproliferatie en -overleving bevordert. Daarom wordt uitgebreid onderzoek gedaan naar antimetabolische middelen die het metabolisme van tumorcellen aanpakken als veelbelovende geneesmiddelen tegen kanker. Doel: Onderzoeken van het effect van lactacidose op de overleving van Lewis longcarcinoom (LLC) cellen bij een tekort aan voedingssubstraat in vitro en evaluatie van de antitumorale en antimetastatische activiteit tegen LLC/R9 in vivo. Materialen en methoden: LLC-variant LLC/R9 werd gebruikt als experimenteel tumormodel. De levensvatbaarheid van tumorcellen werd bepaald met behulp van trypanblauwkleuring. Het apoptoseniveau werd geteld met behulp van Hoechst 33258-kleurstof. Het lactaatgehalte in het tumorweefsel werd geëvalueerd met behulp van een enzymmethode waarbij lactaatdehydrogenase werd gebruikt. Reactieve zuurstofspecies werden bepaald met 2,7-dichloorfluoresceïne-diacetaat. De effecten van dichlooracetaat (DCA) op de groei en metastase van LLC/R9 werden geanalyseerd met routineprocedures. Evaluatie van het effect van DCA op componenten van de elektronentransportketen (ETC) werd uitgevoerd met behulp van EPR. Resultaten: Er werd aangetoond dat onder de omstandigheden van lactacidose en glucosetekort de levensvatbaarheid van LLC/R9-cellen in vitro 30% hoger was (р < 0,05) en het apoptoseniveau driemaal lager was (р < 0,05) dan deze indices onder de omstandigheden van alleen glucosetekort. Bij muizen met getransplanteerde LLC/R9-tumoren die gedurende 3 weken per os werden behandeld met DCA in een totale dosis van 1,5 g/kg lichaamsgewicht vanaf de volgende dag na de tumortransplantatie, was het primaire tumorvolume slechts 30% lager dan dat in de controlegroep. Tegelijkertijd waren het aantal en het volume van de longmetastasen bij de met DCA behandelde dieren respectievelijk 59% (р < 0,05) en 94% (р < 0,05) lager dan deze indices in de controlegroep. DCA behandeling resulteerde in bijna 30% toename (р < 0,05) van het lactaatgehalte in tumorweefsel vergeleken met dat in de controle, maar had geen significante invloed op de niveaus van heemijzercomplexen met NO (bij gmed = 2,007) in mitochondriale ETC eiwitten en Fe-S cluster eiwitten (bij g = 1,94) in tumorcellen. Conclusies: Er is aangetoond dat lactacidose de overleving van LLC/R9-cellen onder de omstandigheden van glucosetekort in vitro aanzienlijk bevorderde. Als LLC/R9 zich in vivo ontwikkelde, onderdrukte DCA als de verbinding met antilactacidose-activiteit de primaire tumorgroei niet significant, maar oefende wel een significante antimetastatische activiteit uit.
Trefwoorden: dichlooracetaat; hypoxische radiosensitiviteit; borstkanker; reactieve zuurstofsoorten
Afkortingen: DCA – dichlooracetaat, ETC – elektronentransportketen; LLC/R9 – Lewis longcarcinoom variant; PDH – pyruvaat dehydrogenase; PDK – pyruvaat dehydrogenase kinase.
INLEIDING
Het is bekend dat lactacidose, grote accumulatie van lactaat en afname van рН, de belangrijkste kenmerken zijn van het metabole micromilieu van tumorcellen in vitro en in vivo. Eerder werd lactacidose beschouwd als een ballastproduct van het tumorcelmetabolisme. Recentelijk is echter aangetoond dat het door tumorcellen kan worden gebruikt als een effectieve energetische brandstof en een van de factoren is die verantwoordelijk zijn voor de weerstand van de tumor tegen een tekort aan glucose [1-3]. Zoals wij hebben aangetoond met Lewis longcarcinoom (LLC)/R9 cellen, een LLC variant die gevoelig is voor antiangiogene kankertherapie [4,5], zou lactacidose de overleving van tumorcellen kunnen bevorderen onder omstandigheden van voedingstekort. Dergelijke omstandigheden werden gegenereerd door langdurige incubatie van tumorcellen zonder vervanging van het kweekmedium (“unfed culture” model) [6]. De studie van de kinetiek van de tumorcelgroei onder de omstandigheden van een “niet-gevoede cultuur” heeft aangetoond dat bij volledige afwezigheid van glucose in het incubatiemedium op dag 7-8 van de celgroei het aantal levensvatbare cellen niet daalde onder het derde deel van het maximum dat op dag 3-4 was geregistreerd, en praktisch op dit niveau bleef totde10e dag. Het hoge overlevingspercentage van LLC/R9-cellen in de omstandigheden van een “niet-gevoede cultuur” hield met name verband met het vermogen van deze cellen tot macro-autofagie. Het kon echter niet worden uitgesloten dat het vermogen van LLC/R9-cellen om zich aan te passen aan een tekort aan voedingssubstraten werd bepaald door lactacidose, die zich ontwikkelde als gevolg van het langdurig kweken van tumorcellen zonder vervanging van het incubatiemedium.
Als lactacidose de overleving van tumorcellen kan vergroten, dan zouden de verbindingen die lactacidosevorming in het tumormilieu onderdrukken, in het bijzonder dichlooracetaat (DCA) als verbinding met antilactacidose-activiteit, antitumoractiviteit moeten vertonen. Deze studie was gericht op het testen van een dergelijke veronderstelling.
Het is bekend dat DCA een remmer is van pyruvaatdehydrogenase kinase (PDK), daarom wordt het beschouwd als een negatieve regulator van enzymen van het mitochondriale pyruvaatdehydrogenase (PDH) complex, dat een sleutelrol speelt in de regulering van tricarbonzuur en oxidatieve fosforylering [7]. Als het PDH-complex wordt gefosforyleerd, wordt de opname van pyruvaat in de Krebs-cyclus geremd, zodat de glycolyse wordt geactiveerd. Door remming van de PDK kan DCA leiden tot indirecte activering van de enzymen van het PDH-complex, waardoor de energiebalans van de cel verschuift van glycolyse naar activering van oxidatieve fosforylering. Daarom is DCA veel gebruikt voor de correctie van lactikemie veroorzaakt door een hoge intensiteit van glycolyse of gebrekkige celademhaling.
Volgens gegevens uit de literatuur ligt het vermogen van DCA om de oxidatieve fosforylering te activeren ten grondslag aan zijn antitumoractiviteit en wordt het met name gerealiseerd via de afname van lactacidose en de inductie van reactieve zuurstofspecies (ROS) [8-12]. Het doel van onze studie was het analyseren van de invloed van lactacidose op de overleving van LLC/R9 cellen in de omstandigheden van voedingsstoftekort in vitro en het evalueren van de antitumor- en antimetastatische activiteit van DCA tegen LLC/R9 in vivo.
MATERIALEN EN METHODEN
Proefdieren, tumorcellen
De studie werd uitgevoerd met 2,0-2,5 maanden oude C57Bl/6 muizen met een gewicht van 18-23 g, gefokt in de dierfaciliteit van het R.E. Kavetsky Instituut voor Experimentele Pathologie, Oncologie en Radiobiologie van de NAS van Oekraïne. Protocollen voor dierstudies en operationele procedures werden uitgevoerd in overeenstemming met de belangrijkste vereisten voor het houden van en werken met proefdieren en met de regels van het plaatselijke Comité voor Bio-ethiek.
In de studie werd gebruik gemaakt van de LLC variant LLC/R9, afgeleid van de wild-type LLC stam door 9 opeenvolgende chemotherapie in vivo sessies op basis van cis-diaminedichloroplatinum (cis-DDP) [13]. LLC/R9 cellen werden onderhouden in RPMI kweekmedium (Sigma, VS) aangevuld met 10% foetaal kalfsserum (FCS) (Sigma, VS) en 40 mg/ml gentamycine bij 37 °C in een vochtige atmosfeer met5%CO2.
Experimenten in vitro
Het aantal cellen in suspensie en hun levensvatbaarheid werden routinematig geanalyseerd op een hemocytometer met behulp van de trypanblauwe exclusietest.
Voor de evaluatie van de effecten van lactacidose op de levensvatbaarheid van LLC/R9-cellen werden 1,5-105 cellen/well gezaaid in een 24-wells plaat in RPMI 1640 medium (Sigma, USA) met standaard glucosegehalte. Na een nacht incuberen werd het celincubatiemedium vervangen door de verse media met verschillende gehaltes glucose, lactaat en met verschillende pH voor simulatie van de omstandigheden van glucosetekort, lactacidose op de achtergrond van glucosetekort, alsmede standaard (tabel 1). Glucosetekortmedium werd bereid op basis van RPMI 1640-medium zonder glucose (Sigma, VS). Lactacidose werd opgewekt door toevoeging van zuiver melkzuur (Sigma, VS) aan het glucosetekortmedium tot een eindconcentratie van 14 ± 0,7 mM en pH 6,7.
| Medium | Glucosegehalte, mM | Lactaatgehalte, mM | рН |
|---|---|---|---|
| Standaard | 9.0 ± 0.5 | 1.6 ± 0.1 | 7.4 ± 0.01 |
| Glucose tekort | 3.0 ± 0.1 | 1.6 ± 0.1 | 7.4 ± 0.01 |
| Lactacidose | 3.0 ± 0.1 | 14.0 ± 0.7 | 6.7 ± 0.01 |
Het effect van de verschillende incubatieomstandigheden op de overleving van de tumorcellen, de ROS-productie, het glucoseverbruik en de lactaatproductie werd geschat opdetweede dag van de incubatie van de tumorcellen.
Het glucosegehalte in kweekmedia en in tumorweefselhomogenaten werd bepaald met behulp van de enzymatische glucose-oxidantmethode met behulp van de kit voor glucoseanalyse in biologische vloeistoffen (Sigma, USA) volgens de instructies van de fabrikant. Het lactaatgehalte in incubatiemedia en in tumorweefselhomogenaten werd bepaald door enzym-spectrofotometriemethode met lactaatdehydrogenase (Sigma, VS) [14]. Monsters van medium en tumorweefsel werden verzameld en bewaard bij -20°С of in vloeibare stikstof, overeenkomstig, tot de uitvoering van de meting.
Het apoptoseniveau in tumorcellen werd geanalyseerd met behulp van de kleurstof Hoechst 33258 (Sigma, VS) en fluorescentiemicroscopie volgens de standaardmethode.
De productie van ROS in tumorcellen werd bepaald met behulp van 2,7-dichloorfluoresceïne-diacetaat (Sigma, VS) door middel van spectrofluorometrie (excitatie bij 495 nm, emissie bij 530 nm) volgens [15].
Alle metingen werden herhaald.
Experimenten in vivo
Voor in vivo experimenten werden LLC/R9-cellen in vitro gekweekt onder standaardomstandigheden en i.m. geïnoculeerd bij muizen (1,0-106 cel/dier in 0,1 ml Hanks’ oplossing).
Na inoculatie van LLC/R9-cellen werden de dieren verdeeld in 2 groepen: groep 1 – muizen behandeld met DCA (Sigma, VS) in een totale dosis van 1,5 g/kg (LD50/3) (n = 13); groep 2 – muizen behandeld met water in dezelfde dosering en in hetzelfde volume (controle, n = 12).
De behandeling is gestart op de volgende dag na de tumorceltransplantatie volgens een metronomisch schema, 5 keer per week gedurende 3 weken. DCA werd ex tempore bereid in water, en werd per os toegediend in een volume van 0,4 ml/dier.
Het primaire tumorvolume werd berekend aan de hand van de diameter, gemeten met een schuifmaatelke3e dag vanafde10e dag na de inoculatie van de tumorcellen, met de formule:
V = π (d)3/6,
waarin d – diameter van de tumor (mm).
Het metastaseniveau in tumordragende muizen werd op de 21e dag na inoculatie van de tumorcellen geëvalueerd aan de hand van het aantal en het volume van de longmetastasen met behulp van een binoculaire microscoop en een millimeterschaal.
Het totale volume van de uitzaaiingen werd berekend met de formule:
V = Σ niπ(di)3/6,
waarin V – totaal volume van de uitzaaiingen (mm3),ni – aantal uitzaaiingen met de diametervandi (mm).
Analyse van de functionele activiteit van mitochondriale ademhalingsketencomponenten in tumorcellen werd uitgevoerd met behulp van EPR opde21e dag na inoculatie van tumorcellen. Tumorweefsel werd gesneden in de monsters van speciale grootte (d = 4,0 mm, l = 25-35 mm), ingevroren en opgeslagen bij -70 °C. EPR-analyse van de monsters werd uitgevoerd bij 77 К met behulp van spectrofotometer Е-109 Varian (VS) bij een potentiële sweep-snelheid van 500 Е/min, modulatieamplitude van 1,25×10 Е, vermogen van de SHF-bestraling van 10 .0 mW, constante sessie van het apparaat van 1,0 s. De niveaus van heemijzercomplexen met NO (bij gmed= 2,007) in mitochondriale ETC eiwitten en Fe-S cluster eiwitten (bij g = 1,94) in tumorcellen werden bepaald door de gegevens van EPR spectra.
Statistische analyse van de verkregen resultaten werd uitgevoerd door middel van beschrijvende methoden, niet-lineaire regressieanalyse en Student’s t-test met behulp van de programma’s Microsoft Excel en Microcal Origin.
RESULTATEN
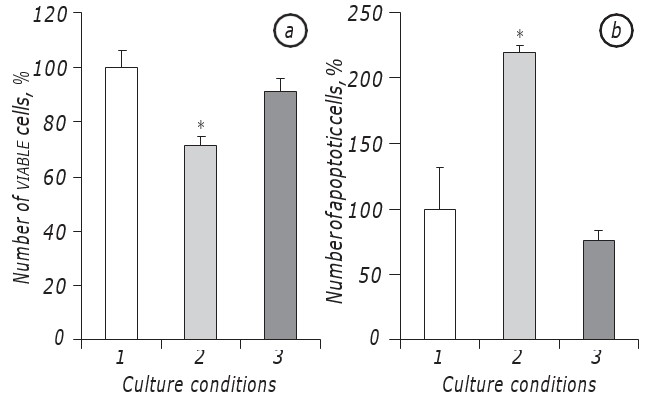
Er is aangetoond dat lactacidose onder omstandigheden van glucosetekort de overleving van LLC/R9-cellen aanzienlijk bevorderde. De groeikinetiek van de tumorcellen geïncubeerd onder de omstandigheden van lactacidose bij glucosetekort verschilde namelijk niet significant van die van de cellen geïncubeerd in het medium met standaard glucosegehalte, althans tijdens hun exponentiële groei. Met name het aantal levensvatbare cellen opdetweede dag van de incubatie onder de omstandigheden van lactacidose tegen een achtergrond van glucosetekort was praktisch hetzelfde als bij incubatie in het medium met een standaard glucosegehalte. Tegelijkertijd was in beide gevallen (lactacidose en standaard) het aantal levensvatbare cellen bijna 30% hoger (р < 0,05) dan in het geval van celincubatie onder de omstandigheden van glucosetekort zelf (Fig. 1, a).
Bovendien verschilde het aantal apoptotische cellen onder de omstandigheden van lactacidose ook niet statistisch van die index in het geval van celincubatie in het medium met standaard glucosegehalte en was opde2e dag gelijk aan 8,5 ± 0,9%, terwijl onder de omstandigheden van glucosetekort het aantal apoptotische cellen bijna driemaal hoger was (p < 0,05) dan dat in het geval van lactacidose (Fig. 1, b).
Interessant is dat onder de omstandigheden van lactacidose in LLC/R9-cellen het glucoseverbruik significant lager was. Het lage glucoseverbruik van de tumorcellen bij lactacidose, dat alleen opdeeerste dag van hun incubatie werd geregistreerd, werd opdetweede dag hersteld en was 70% lager (p < 0,05) dan in het geval van het medium met standaard glucosegehalte (tabel 2). In het geval van glucosetekort in tegenstelling tot lactacidose opdetweede dag daalt het glucosegehalte in het incubatiemedium tot nul, wat ook blijkt uit het verminderde glucoseverbruik van LLC/R9-cellen onder lactacidoseomstandigheden.
Terwijl lactacidose leidde tot een verminderde glucoseopname door LLC/R9-cellen, nam het niveau van intracellulaire ROS in de cellen die onder dergelijke omstandigheden overleefden, aanzienlijk toe. Deze gegevens zijn weergegeven in tabel 2 en tonen aan dat het ROS-niveau in de cellen die in lactacidose werden geïncubeerd, bijna 150% (p < 0,05) en 230% (p < 0,05) hoger was dan de overeenkomstige indexen voor de cellen die werden geïncubeerd in respectievelijk standaard- en glucosearme media.
De verkregen gegevens hebben dus aangetoond dat lactacidose de overleving van LLC/R9-cellen onder de omstandigheden van glucosetekort in vitro aanzienlijk bevordert, wat wordt ondersteund door de hoge aantallen cellen die onder dergelijke ongunstige omstandigheden overleefden, en door het lage apoptosepercentage. De celoverleving ging gepaard met een onverwachte toename van het intracellulaire ROS-niveau en een verminderd glucoseverbruik in LLC/R9.
| Medium | Glucoseverbruik, % | ROS, % |
|---|---|---|
| Standaard | 100.0 ± 5.9 | 100.0 ± 24.8 |
| Glucosetekort | 0.0 ± 0.0* | 75.8 ± 10.7 |
| Lactacidose | 29.8 ± 1.5* | 248.7 ± 53.2* |
Opmerking: *p < 0,05.
Deze overlevingspatronen van LLC/R9-cellen in de omstandigheden van lactacidose bij glucosetekort in vitro wijzen op het feit dat een verlaagd lactaatgehalte in de tumormicro-omgeving de overleving van tumorcellen in omstandigheden van metabole stress kan voorkomen en daardoor een antitumoreffect kan hebben. Deze hypothese werd door ons getest met het gebruik van DCA als een verbinding die lactacidose kan verminderen.
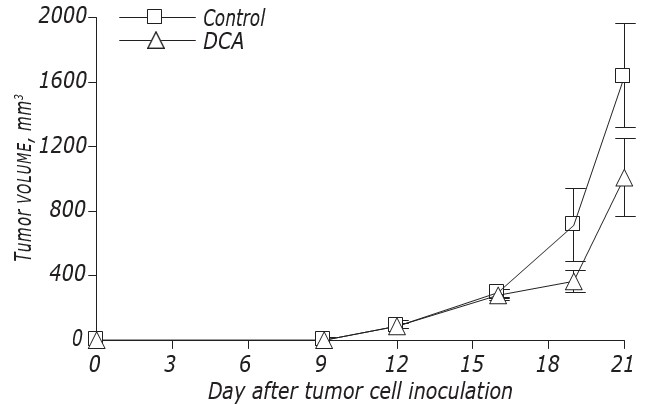
De gegevens over de invloed van DCA op de LLC/R9-groeikinetiek en -metastase zijn weergegeven in fig. 2 en tabel 3. Volgens deze gegevens had DCA geen significante invloed op de groei van primaire tumoren, maar veroorzaakte het een uitgesproken onderdrukking van metastase. De groeikinetiek van primaire tumoren in muizen met LLC/R9 behandeld met DCA verschilde praktisch niet van die in controlemuizen, en opde21e dag na de tumortransplantatie was het volume van de primaire tumoren in de experimentele groep slechts 39% lager dan dat in de controlegroep (zie fig. 2, tabel 3). Ondanks het feit dat DCA geen noemenswaardige onderdrukking van de primaire tumorgroei uitvoerde, bleek de antimetastatische activiteit tegen LLC/R9 opvallend te zijn. Het aantal en het volume van de longmetastasen in met DCA behandelde tumormuizen waren respectievelijk 59% (р < 0,05) en 94% (р < 0,05) lager dan deze indexen in de controlegroep (zie Tabel 3).
| Groep muizen | Tumorvolume,mm3 | Aantal uitzaaiingen | Volume van uitzaaiingen, mm3 |
|---|---|---|---|
| Controle (n = 13) | 1702.7 ± 333.9 | 10.9 ± 1.2 | 17.9 ± 5.6 |
| DCA (n = 13) | 1046.0 ± 258.3 | 4.5 ± 1.6* | 1.1 ± 0.4* |
Opmerking: *р < 0,05, verschillen zijn significant in vergelijking met de waarde voor de controle.
Een analyse van het lactaatgehalte in tumorweefselmonsters heeft aangetoond dat DCA onverwacht een aanzienlijke toename van het lactaatgehalte in tumorweefsel veroorzaakte, althans opde21e dag na de tumortransplantatie. Zoals men kan zien in Tabel 4, was het lactaatgehalte in het tumorweefsel van muizen behandeld met DCA, bijna 30% hoger (р < 0,05) dan dat in de controle. Aangezien DCA als PDH-kinaseremmer het energiemetabolisme van kwaadaardige tumoren kan reorganiseren in de richting van oxidatieve fosforylering, hebben wij de lactaatproductie door tumorcellen beschouwd als een surrogaatmarker van de remming van de glycolyse onder invloed van DCA. De toename van het lactaatgehalte in de tumor als gevolg van DCA wees erop dat de toediening ervan aan muizen met LLC/R9 in een totale dosis van 1,5 g/kg lichaamsgewicht onvoldoende zou kunnen zijn voor de activering van oxidatieve fosforylering in de tumorcellen, wat ten dele de geringe werkzaamheid tegen primaire tumoren verklaart.
| Groep muizen | Lactaat (µmol/1 g weefsel) |
|---|---|
| Controle (n = 4) | 11.1 ± 0.6 |
| DCA (n = 5) | 14.4 ± 1.5* |
Opmerking: р < 0,05, verschillen zijn significant ten opzichte van de waarde voor de controle.
Een analyse van EPR spectra van tumormonsters heeft aangetoond dat DCA de functionele toestand van de ETC componenten in tumorcel mitochondriën niet significant beïnvloedde (Tabel 5). Bijvoorbeeld, bij muizen met LLC/R9 behandeld met DCA was de intensiteit van de EPR-signalen die corresponderen met nitrosyl-heemijzer eiwitcomplexen (gсер= 2,007) in ETC-eiwitten van tumorcelmitochondriën niet significant hoger dan die in controlemuizen. Het is bekend dat accumulatie van NO-complexen van heemijzer aan de ene kant kan wijzen op een redox-onbalans in de richting van overheersing van vrije radicale processen, met name NO-hyperproductie, en aan de andere kant op mogelijke remming van de celademhaling via nitrosylering van heemeiwitten. DCA, waarvan wordt aangenomen dat het belangrijkste antitumormechanisme verband houdt met de inductie van ROS-productie door mitochondriën [8, 10, 11], veroorzaakte echter geen verhoging van heemijzercomplexen met NO in tumorweefsel. Deze laatste waarneming kan mogelijk verband houden met de kenmerken van LLC/R9-cellen, namelijk een extreem hoog gehalte aan deze complexen, kenmerkend voor deze tumor, en de progressieve accumulatie daarvan tijdens de ontwikkeling van de tumor in vivo is door ons geregistreerd, zelfs zonder behandeling [16].
| Relatieve EPR-signaalintensiteit | Relatieve EPR-signaalintensiteit | |
| Groep muizen | Nitrosyl-heemijzer-eiwitcomplexen (g = 2,007) | Fe-S-eiwit (g = 1,94) |
| Controle | 54.3 ± 4.5 | 15.8 ± 0.5 |
| DCA | 97.8 ± 30.1 | 17.8 ± 2.1 |
Een afwezigheid van significant effect van DCA op de functionele activiteit van mitochondriale ETC componenten in tumorcellen werd ook ondersteund door de gegevens over de intensiteit van EPR signalen die corresponderen met Fe-S cluster eiwitten (g = 1,94) (complexen І, ІІ, ІІІ), die vrijwel gelijk was in beide diergroepen (zie Tabel 5).
Concluderend kan worden gesteld dat de resultaten van onze studie hebben aangetoond dat lactacidose de overleving van de LLC-variant LLC/R9 onder omstandigheden van glucosetekort aanzienlijk bevordert. Tegelijkertijd oefende DCA, als LLC/R9 zich in vivo ontwikkelde, geen antitumoractiviteit uit tegen primaire tumoren. Het uitblijven van de antitumorwerking van DCA tegen de groei van LLC/R9 was in overeenstemming met het ontbreken van het remmende effect van DCA op het lactaatgehalte in de tumor, alsmede met het ontbreken van een merkbaar effect van DCA op de ROS-productie van tumorcellen. Hoewel DCA de groei van LLC/R9 niet beïnvloedde, maar metastase drastisch remde, kon deze waarneming niet worden verklaard door de werking van DCA in de primaire tumor en zijn verdere aanvullende studies naar de antimetastatische werking vereist.
VERWIJZINGEN
1 Feron O. Pyruvate into lactate and back: from the Warburg effect to symbiotic energy fuel exchange in cancer cells. Radiother Oncol 2009; 92: 329-33. doi: 10.1016/j.radonc.2009.06.025.
2 Wu H, Ding Z, Hu D, et al. Central role of lactic acidosis in cancer cell resistance to glucose deprivation-induced cell death. J Pathol 2012; 227: 189-99. doi: 10.1002/path.3978.
3 Fiaschi T, Marini A, Giannoni E, et al. Reciprocal metabolic reprogramming through lactate shuttle coordinately influences tumor-stroma interplay. Cancer Res 2012; 72: 5130-40.
4 Solyanik GI, Fedorchuk AG, Pyaskovskaya ON, et al. Antikankeractiviteit van aconitine-bevattend kruidenextract BC1. Exp Oncol 2004; 26: 307-11.
5 Pyaskovskaya ON. Anti-angiogene werking van cyclofosfamide tegen experimentele metastatische tumoren. J Med Chem 2012; 2: 25-9 (in het Oekraïens).
6 Kolesnik DL, Pyaskovskaya ON, Tregubova NV, Solyanik GI. Lewis longcarcinoom variant met een hoge gevoeligheid voor antitumor antiangiogene therapie vertoont een hoge capaciteit voor autofagie. Cytol Genet 2012; 46: 155-60. doi: 10.3103/S009545271203005X.
7 Stacpoole PW. De farmacologie van dichlooracetaat. Metabolism 1989; 38: 1124-44.
8 Bonnet S, Archer SL, Allalunis-Turner J, et al. A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth. Cancer Cell 2007; 11: 37-51.
9 Wong JY, Huggins GS, Debidda M, et al. Dichloroacetate induceert apoptose in endometriumkankercellen. Gynecol Oncol 2008; 109: 394-402. doi: 10.1016/j.ygyno.2008.01.038.
10 Michelakis ED, Sutendra G, Dromparis P, et al. Metabolic modulation of glioblastoma with dichloroacetate. Sci Transl Med 2010; 2: 31-4. doi: 10.1126/scitranslmed.3000677.
11 Stockwin LH, Yu SX, Borgel S, et al. Sodium dichloroacetate selectively targets cells with defects in the mitochondrial ETC Int J Cancer 2010; 127; 2510-19.
12 Kumar A, Kant S, Singh SM. Novel molecular mechanisms of antitumor action of dichloroacetate against T cell lymphoma: Implication of altered glucose metabolism, pH homeostasis and cell survival regulation. Chem Biol Interact 2012; 199: 29-37.
13 Pyaskovskaya ON, Dasyukevich OI, Kolesnik DL, et al. Changes in VEGF level and tumor growth characteristics during Lewis lung carcinoma progression towards cis-DDP resistance. Exp Oncol 2007; 29: 197-202.
14 Biochemische methoden (vet- en energiemetabolisme). MI Prohorova, ed. L.: Leningrad Univ, 1982. 272 p.
15 Wang H, Joseph JA. Quantifying cellular oxidative stress by dichlorofluorescein assay using microplate reader. Free Radic Biol Med 1999; 27: 612-6.
16 Pyaskovskaya ON, Sorokina LV, Kolesnik DL, et al. Dynamics of changes of antioxidant system indexes during the growth of two Lewis lung carcinoma variants. Exp Oncol 2014; 36: 29-33.