D.L. Kolesnik1, O.N. Pyaskovskaya1i.V. Boychuk1o.I. Dasyukevich1, O.R. Melnikov1, A.S. Tarasov1, G.I. Solyanik1
1R.E. Kavetsky Institute of Experimental Pathology, Oncology and Radiobiology, NAS of Ukraine, Kyiv 03022, Ukraine.
Correspondance : D.L. Kolesnik, Courriel : [email protected]
Soumis le : 20 mars 2015
Résumé
Une caractéristique de la malignité est une glycolyse tumorale excessive, même en présence d’oxygène, qui provoque une lactacidose dans le microenvironnement tumoral et favorise la prolifération et la survie des cellules tumorales. Pour cette raison, les agents antimétaboliques qui ciblent le métabolisme des cellules tumorales font l’objet de recherches approfondies en tant que médicaments anticancéreux prometteurs. Objectif : étudier l’effet de la lactacidose sur la survie des cellules de carcinome pulmonaire de Lewis (LLC) dans des conditions de carence en substrat nutritionnel in vitro et évaluer l’activité antitumorale et antimétastatique contre LLC/R9 in vivo. Matériaux et Méthodes : La variante LLC/R9 a été utilisée comme modèle tumoral expérimental. La viabilité des cellules tumorales a été déterminée par coloration au bleu trypan. Le niveau d’apoptose a été compté avec l’utilisation du colorant Hoechst 33258. La teneur en lactate dans le tissu tumoral a été évaluée par une méthode enzymatique avec l’utilisation de la lactate déshydrogénase. Les espèces réactives de l’oxygène ont été déterminées en utilisant le diacétate de 2,7-dichlorofluorescéine. Les effets du dichloroacétate (DCA) sur la croissance et les métastases de LLC/R9 ont été analysés par des procédures de routine. L’évaluation de l’effet du DCA sur les composants de la chaîne de transport d’électrons (ETC) a été réalisée par RPE. Résultats : Il a été montré que dans les conditions de lactacidose et de carence en glucose, la viabilité des cellules LLC/R9 in vitro était supérieure de 30% (р < 0,05) et le niveau d’apoptose était trois fois plus faible (р < 0,05) que ces indices dans les conditions de carence en glucose uniquement. Chez les souris porteuses de tumeurs LLC/R9 transplantées et traitées pendant 3 semaines per os avec du DCA à la dose totale de 1,5 g/kg de poids corporel à partir du jour suivant la transplantation de la tumeur, le volume de la tumeur primaire était inférieur de 30% à celui du groupe témoin. Parallèlement, le nombre et le volume des métastases pulmonaires chez les animaux traités au DCA étaient respectivement inférieurs de 59 % (р < 0,05) et de 94 % (р < 0,05) à ces indices dans le groupe témoin. Le traitement au DCA a entraîné une augmentation de près de 30 % (р < 0,05) de la teneur en lactate dans le tissu tumoral par rapport à celle du groupe témoin, mais n’a pas affecté de manière significative les niveaux de complexes de fer hémique avec NO (à gmed = 2,007) dans les protéines ETC mitochondriales et les protéines du groupe Fe-S (à g = 1,94) dans les cellules tumorales. Conclusions : Il a été démontré que la lactacidose favorisait significativement la survie des cellules LLC/R9 dans des conditions de carence en glucose in vitro. Si les cellules LLC/R9 se sont développées in vivo, le DCA, en tant que composé ayant une activité antilactacidose, n’a pas supprimé de manière significative la croissance de la tumeur primaire mais a exercé une activité antimétastatique significative.
Mots clés : dichloroacétate ; radiosensibilité hypoxique ; cancer du sein ; espèces réactives de l’oxygène
Abréviations : DCA – dichloroacétate, ETC – chaîne de transport d’électrons ; LLC/R9 – variante du carcinome pulmonaire de Lewis ; PDH – pyruvate déshydrogénase ; PDK – pyruvate déshydrogénase kinase.
INTRODUCTION
Il est bien connu que la lactacidose, large accumulation de lactate et diminution du рН, est la principale caractéristique du microenvironnement métabolique des cellules tumorales in vitro et in vivo. Auparavant, la lactacidose était considérée comme un produit de lest du métabolisme des cellules tumorales. Cependant, il a été récemment démontré qu’il pouvait être utilisé par les cellules tumorales comme un carburant énergétique efficace et faire partie des facteurs responsables de la résistance des tumeurs à la carence en glucose [1-3]. Comme nous l’avons montré en utilisant des cellules de carcinome pulmonaire de Lewis (LLC)/R9, variante de LLC sensible à la thérapie antiangiogénique [4,5], la lactacidose pourrait favoriser la survie des cellules tumorales dans des conditions de carence nutritionnelle. De telles conditions ont été générées par l’incubation à long terme de cellules tumorales sans remplacement du milieu de culture (modèle « culture non alimentée ») [6]. L’étude de la cinétique de croissance des cellules tumorales dans des conditions de « culture non alimentée » a démontré qu’en l’absence totale de glucose dans le milieu d’incubation aux jours 7-8 de la croissance cellulaire, le nombre de cellules viables n’est pas tombé en dessous du tiers de leur maximum enregistré aux jours 3-4, et est resté pratiquement à ce niveau jusqu’au10ème jour. Le taux de survie élevé des cellules LLC/R9 dans les conditions de « culture non alimentée » est lié en particulier à la capacité de ces cellules à la macroautophagie. Cependant, il n’a pas pu être exclu que la capacité d’adaptation des cellules LLC/R9 à une carence en substrat nutritionnel soit déterminée par la lactacidose qui s’est développée à la suite d’une culture prolongée de cellules tumorales sans remplacement du milieu d’incubation.
Si la lactacidose est capable d’augmenter la survie des cellules tumorales, alors les composés supprimant la formation de lactacidose dans le microenvironnement tumoral, en particulier, le dichloroacétate (DCA) en tant que composé ayant une activité antilactacidose devrait démontrer une activité antitumorale. La présente étude visait à vérifier cette hypothèse.
Il est connu que le DCA est un inhibiteur de la pyruvate déshydrogénase kinase (PDK), c’est pourquoi il est considéré comme un régulateur négatif des enzymes du complexe pyruvate déshydrogénase (PDH) mitochondrial qui joue un rôle clé dans la régulation de l’acide tricarboxylique et de la phosphorylation oxydative [7]. Si le complexe PDH est phosphorylé, l’entrée du pyruvate dans le cycle de Krebs est inhibée, ce qui active la glycolyse. En raison de l’inhibition de la PDK, le DCA est capable d’entraîner une activation indirecte des enzymes du complexe PDH et provoque respectivement le déplacement de l’équilibre énergétique cellulaire de la glycolyse vers l’activation de la phosphorylation oxydative. Par conséquent, le DCA a été largement utilisé pour corriger la lacticémie causée par une intensité élevée de la glycolyse ou une respiration cellulaire défectueuse.
Selon les données de la littérature, une capacité du DCA à activer la phosphorylation oxydative sous-tend son activité antitumorale et se réalise, notamment, via la diminution de la lactacidose et l’induction d’espèces réactives de l’oxygène (ROS) [8-12]. Le but de notre étude était d’analyser l’influence de la lactacidose sur la survie des cellules LLC/R9 dans des conditions de carence nutritive in vitro et d’évaluer l’activité antitumorale et antimétastatique du DCA contre les LLC/R9 in vivo.
MATÉRIEL ET MÉTHODES
Animaux expérimentaux, cellules tumorales
L’étude a été réalisée sur des souris C57Bl/6 âgées de 2,0-2,5 mois et pesant 18-23 g, élevées dans l’animalerie de l’Institut R.E. Kavetsky de pathologie expérimentale, d’oncologie et de radiobiologie de la NAS d’Ukraine. Les protocoles d’étude sur les animaux et les procédures opérationnelles ont été réalisés conformément aux principales exigences relatives à la détention et au travail avec des animaux de laboratoire et aux règles du comité de bioéthique local.
L’étude a utilisé la variante LLC/R9 dérivée de la souche LLC de type sauvage par 9 sessions séquentielles de chimiothérapie in vivo à base de cis-diamminedichloroplatine (cis-DDP) [13]. Les cellules LLC/R9 ont été maintenues dans un milieu de culture RPMI (Sigma, USA) complété par 10% de sérum de veau fœtal (FCS) (Sigma, USA), et 40 mg/ml de gentamycine à 37 °C en atmosphère humidifiée avec 5% deCO2.
Expériences in vitro
Le nombre de cellules en suspension et leur viabilité ont été systématiquement analysés sur un hémocytomètre en utilisant le test d’exclusion au bleu trypan.
Pour évaluer les effets de la lactacidose sur la viabilité des cellules LLC/R9, 1,5-105 cellules/puits ont été ensemencées dans une plaque 24 puits dans un milieu RPMI 1640 (Sigma, USA) avec une teneur en glucose standard. Après une incubation d’une nuit, le milieu d’incubation des cellules a été remplacé par un milieu frais avec différentes teneurs en glucose et en lactate et différents pH pour simuler les conditions de carence en glucose, de lactacidose dans un contexte de carence en glucose, ainsi que les conditions standard (Tableau 1). Le milieu déficient en glucose a été préparé sur la base du milieu RPMI 1640 sans glucose (Sigma, USA). La lactacidose a été générée en ajoutant de l’acide lactique pur (Sigma, USA) au milieu déficient en glucose jusqu’à une concentration finale de 14 ± 0,7 mM et un pH de 6,7.
| Milieu | Teneur en glucose, mM | Teneur en lactate, mM | рН |
|---|---|---|---|
| Standard | 9.0 ± 0.5 | 1.6 ± 0.1 | 7.4 ± 0.01 |
| Déficit en glucose | 3.0 ± 0.1 | 1.6 ± 0.1 | 7.4 ± 0.01 |
| Lactacidose | 3.0 ± 0.1 | 14.0 ± 0.7 | 6.7 ± 0.01 |
L’effet des différentes conditions d’incubation sur la survie des cellules tumorales, la production de ROS, la consommation de glucose et la production de lactate ont été estimés au2ème jour d’incubation des cellules tumorales.
Le contenu en glucose des milieux de culture et des homogénats de tissus tumoraux a été déterminé par la méthode de l’enzyme glucose-oxydant en utilisant le kit pour l’analyse du glucose dans les fluides biologiques (Sigma, USA) selon les instructions du fabricant. La teneur en lactate dans les milieux d’incubation et dans les homogénats de tissus tumoraux a été déterminée par une méthode de spectrophotométrie enzymatique utilisant la lactate déshydrogénase (Sigma, USA) [14]. Les échantillons de milieu et de tissus tumoraux ont été collectés et conservés à -20 °С ou dans l’azote liquide, respectivement, jusqu’à la réalisation des mesures.
Le niveau d’apoptose dans les cellules tumorales a été analysé avec l’utilisation du colorant Hoechst 33258 (Sigma, USA) et la microscopie fluorescente par méthode standard.
La production de ROS dans les cellules tumorales a été déterminée à l’aide du diacétate de 2,7-dichlorofluorescéine (Sigma, USA) par spectrofluorométrie (excitation à 495 nm, émission à 530 nm) selon [15].
Toutes les mesures ont été répétées.
Expériences in vivo
Pour les expériences in vivo, les cellules LLC/R9 ont été propagées in vitro dans des conditions standard et ont été inoculées i.m. à des souris (1,0-106 cellules/animal dans 0,1 ml de solution de Hanks).
Après l’inoculation des cellules LLC/R9, les animaux ont été répartis en 2 groupes : groupe 1 – souris traitées avec du DCA (Sigma, USA) à la dose totale de 1,5 g/kg (LD50/3) (n = 13) ; groupe 2 – souris traitées avec de l’eau selon le même schéma et dans le même volume (contrôle, n = 12).
Le traitement a été initié le jour suivant la transplantation des cellules tumorales selon un régime métronomique, 5 fois par semaine pendant 3 semaines. Le DCA a été préparé ex tempore dans l’eau, et a été administré per os dans un volume de 0,4 ml/animal.
Le volume de la tumeur primaire a été calculé sur la base de son diamètre mesuré à l’aide d’un pied à coulisse tous les3 jours à partir du10ème jour après l’inoculation des cellules tumorales, par la formule :
V = π (d)3/6,
où d – diamètre de la tumeur (mm).
Le niveau de métastases chez les souris porteuses de tumeurs a été évalué au 21e jour après l’inoculation des cellules tumorales par le nombre et le volume des métastases pulmonaires à l’aide d’un microscope binoculaire et d’une échelle millimétrique.
Le volume total des métastases a été calculé par la formule :
V = Σ niπ(di)3/6,
où V – volume total des métastases (mm3),ni – nombre de métastases avec le diamètre dedi (mm).
L’analyse de l’activité fonctionnelle des composants de la chaîne respiratoire mitochondriale dans les cellules tumorales a été réalisée à l’aide de l’EPR au21e jour après l’inoculation des cellules tumorales. Le tissu tumoral a été découpé en échantillons de taille spéciale (d = 4,0 mm, l = 25-35 mm), congelé et stocké à -70 °C. L’analyse RPE des échantillons a été réalisée à 77 К à l’aide du spectrophotomètre Е-109 Varian (USA) à une vitesse de balayage du potentiel de 500 Е/min, une amplitude de modulation de 1,25×10 Е, une puissance d’irradiation SHF de 10.0 mW, session constante de l’appareil de 1,0 s. Les niveaux des complexes de fer hémique avec NO (à gmed= 2,007) dans les protéines ETC mitochondriales et les protéines de l’amas Fe-S (à g = 1,94) dans les cellules tumorales ont été déterminés par les données des spectres RPE.
L’analyse statistique des résultats obtenus a été effectuée par des méthodes descriptives, une analyse de régression non linéaire et un test t de Student à l’aide des programmes Microsoft Excel et Microcal Origin.
RÉSULTATS
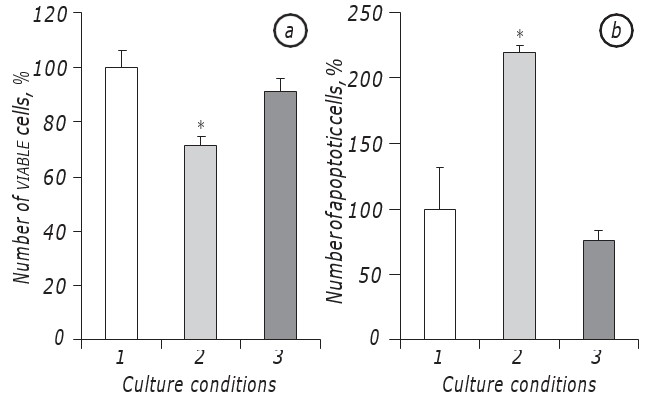
Il a été montré que la lactacidose dans des conditions de carence en glucose favorisait significativement la survie des cellules LLC/R9. En effet, la cinétique de croissance des cellules tumorales incubées dans les conditions de lactacidose dans un contexte de carence en glucose ne diffère pas significativement de celle des cellules incubées dans le milieu à teneur standard en glucose, au moins pendant la période de leur croissance exponentielle. En particulier, le nombre de cellules viables audeuxième jour d’incubation dans les conditions de lactacidose sur fond de carence en glucose était pratiquement le même que dans le cas de l’incubation des cellules dans le milieu à teneur standard en glucose. En même temps, dans les deux cas (lactacidose et standard), le nombre de cellules viables était presque 30% plus élevé (р < 0.05) que dans le cas d’une incubation de cellules dans des conditions de carence en glucose (Fig. 1, a).
En outre, le nombre de cellules apoptotiques dans les conditions de lactacidose ne diffère pas non plus statistiquement de l’indice dans le cas de l’incubation des cellules dans le milieu avec une teneur en glucose standard et au2ème jour était égal à 8,5 ± 0,9%, tandis que dans les conditions de carence en glucose le nombre de cellules apoptotiques était presque trois fois plus élevé (p < 0,05) que dans le cas de la lactacidose (Fig. 1, b).
Il est intéressant de noter que dans les conditions de lactacidose, la consommation de glucose des cellules LLC/R9 était significativement plus faible. Le faible taux de consommation de glucose par les cellules tumorales lors de la lactacidose, enregistré juste au1er jour de leur incubation, a été restauré au2ème jour et était de 70% inférieur (p < 0,05) à celui du milieu avec une teneur en glucose standard (Tableau 2). Dans le cas d’une carence en glucose, contrairement à la lactacidose, au2ème jour, le niveau de glucose dans le milieu d’incubation est tombé à zéro, ce qui a également mis en évidence la diminution de la consommation de glucose par les cellules LLC/R9 dans les conditions de lactacidose.
Alors que la lactacidose a conduit à une diminution de la consommation de glucose par les cellules LLC/R9, le niveau de ROS intracellulaire dans les cellules qui ont survécu dans ces conditions a augmenté de manière significative. Ces données sont présentées dans le tableau 2 et démontrent que le niveau de ROS dans les cellules incubées dans des conditions de lactacidose était presque 150% (p < 0,05) et 230% (p < 0,05) plus élevé que les indices correspondants pour les cellules incubées dans des milieux standard et déficients en glucose, respectivement.
Ainsi, les données obtenues ont démontré que le lactacidose favorise significativement la survie des cellules LLC/R9 dans des conditions de carence en glucose in vitro, ce qui est confirmé par le nombre élevé de cellules ayant survécu dans ces conditions défavorables et par le faible taux d’apoptose. La survie cellulaire a été associée à une augmentation inattendue du niveau de ROS intracellulaire et à une diminution de la consommation de glucose dans les cellules LLC/R9.
| Milieu | Consommation de glucose (%) | TAUX DE ROS, EN % |
|---|---|---|
| Standard | 100.0 ± 5.9 | 100.0 ± 24.8 |
| Déficit en glucose | 0.0 ± 0.0* | 75.8 ± 10.7 |
| Lactacidose | 29.8 ± 1.5* | 248.7 ± 53.2* |
Note : *p < 0,05.
Ces schémas de survie des cellules LLC/R9 dans des conditions de lactacidose dans un contexte de carence en glucose in vitro ont mis en évidence le fait que la diminution du contenu en lactate dans le microenvironnement tumoral peut empêcher la survie des cellules tumorales dans des conditions de stress métabolique et donc exercer un effet antitumoral. Nous avons testé cette hypothèse en utilisant le DCA comme composé capable de réduire la lactacidose.
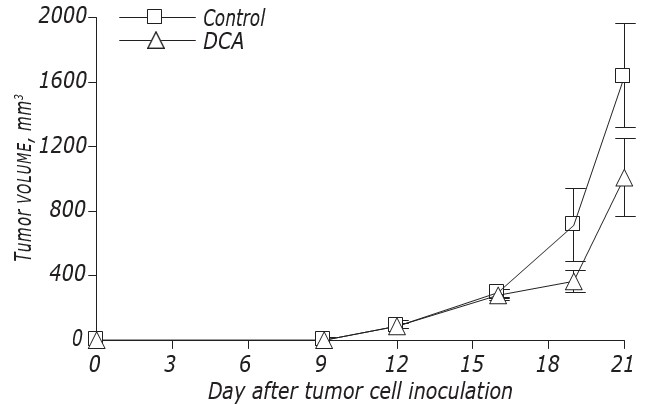
Les données sur l’influence du DCA sur la cinétique de croissance et les métastases de LLC/R9 sont présentées sur la Fig. 2 et le Tableau 3. D’après ces données, le DCA n’a pas affecté de manière significative la croissance des tumeurs primaires, mais a provoqué une suppression exprimée des métastases. La cinétique de croissance des tumeurs primaires chez les souris LLC/R9 traitées au DCA ne différait pratiquement pas de celle des souris témoins, et au21ème jour après la transplantation de la tumeur, le volume des tumeurs primaires du groupe expérimental était juste de 39% inférieur à celui du groupe témoin (voir Fig. 2, Tableau 3). Bien que le DCA n’ait pas exercé de suppression notable de la croissance des tumeurs primaires, son activité antimétastatique sur les LLC/R9 s’est avérée frappante. Le nombre et le volume des métastases pulmonaires chez les souris porteuses de tumeurs traitées avec le DCA étaient respectivement inférieurs de 59% (р < 0,05) et 94% (р < 0,05) à ces indices dans le groupe témoin (voir Tableau 3).
| Groupe de souris | Volume de la tumeur, mm3 | Nombre de métastases | Volume des métastases, mm3 |
|---|---|---|---|
| Témoin (n = 13) | 1702.7 ± 333.9 | 10.9 ± 1.2 | 17.9 ± 5.6 |
| DCA (n = 13) | 1046.0 ± 258.3 | 4.5 ± 1.6* | 1.1 ± 0.4* |
Note: *р < 0,05, les différences sont significatives par rapport à la valeur du contrôle.
Une analyse du contenu en lactate dans les échantillons de tissu tumoral a démontré que le DCA a provoqué de manière inattendue une augmentation significative du contenu en lactate dans le tissu tumoral, au moins au21ème jour après la transplantation de la tumeur. Comme on peut le voir dans le tableau 4, la teneur en lactate dans le tissu tumoral des souris traitées avec le DCA était presque 30 % plus élevée (р < 0,05) que celle du contrôle. Compte tenu de la capacité du DCA en tant qu’inhibiteur de la PDH kinase à réorganiser le métabolisme énergétique de la tumeur maligne vers la phosphorylation oxydative, nous avons considéré la production de lactate par les cellules tumorales comme un marqueur de substitution de l’inhibition de la glycolyse sous l’influence du DCA. L’augmentation du niveau de lactate dans la tumeur provoquée par le DCA indique que son administration à des souris atteintes de LLC/R9 à une dose totale de 1,5 g/kg de poids corporel de l’animal pourrait être insuffisante pour activer la phosphorylation oxydative dans les cellules tumorales ce qui explique en partie sa faible efficacité contre les tumeurs primaires.
| Groupe de souris | Lactate (µmol/1 g de tissu) |
|---|---|
| Contrôle (n = 4) | 11.1 ± 0.6 |
| DCA (n = 5) | 14.4 ± 1.5* |
Remarque: р < 0,05, les différences sont significatives par rapport à la valeur du contrôle.
Une analyse des spectres RPE des échantillons tumoraux a montré que le DCA n’a pas affecté de manière significative l’état fonctionnel des composants du CTE dans les mitochondries des cellules tumorales (Tableau 5). Par exemple, chez les souris LLC/R9 traitées au DCA, l’intensité des signaux RPE correspondant aux complexes protéiques nitrosyl-herme-fer (gсер= 2,007) dans les protéines du CTE des mitochondries des cellules tumorales n’était pas significativement plus élevée que chez les souris témoins. On sait que l’accumulation de complexes NO-fer héminique peut indiquer d’une part le déséquilibre redox vers la domination des processus de radicaux libres, en particulier l’hyperproduction de NO, et d’autre part une possible inhibition de la respiration cellulaire via la nitrosylation des protéines héminiques. Cependant, le DCA, dont on pense que le principal mécanisme d’action antitumorale est lié à l’induction de la production de ROS par les mitochondries [8, 10, 11], n’a pas provoqué d’élévation des complexes fer-hème avec NO dans les tissus tumoraux. Cette dernière observation pourrait être liée aux caractéristiques des cellules LLC/R9, à savoir un contenu extrêmement élevé de ces complexes caractéristiques de cette tumeur et dont l’accumulation progressive au cours du développement tumoral in vivo a été enregistrée par nous même en l’absence de traitement [16].
| Intensité relative du signal RPE | Intensité relative du signal RPE | |
| Groupe de souris | Complexes protéiques de fer nitrosyl-hémique (g = 2,007) | Protéine Fe-S (g = 1,94) |
| Contrôle | 54.3 ± 4.5 | 15.8 ± 0.5 |
| DCA | 97.8 ± 30.1 | 17.8 ± 2.1 |
L’absence d’effet significatif du DCA sur l’activité fonctionnelle des composants de l’ETC mitochondrial dans les cellules tumorales a également été confirmée par les données sur l’intensité des signaux RPE correspondant aux protéines de l’amas Fe-S (g = 1,94) (complexes І, ІІ, ІІІ), qui était pratiquement égale dans les deux groupes d’animaux (voir tableau 5).
En conclusion, les résultats de notre étude ont montré que la lactacidose favorisait significativement la survie de la variante LLC/R9 dans des conditions de carence en glucose. En même temps, si les LLC/R9 se développaient in vivo, le DCA n’exerçait pas d’activité antitumorale contre les tumeurs primaires. L’échec de l’action antitumorale du DCA contre la croissance des LLC/R9 était en accord avec l’absence d’effet d’inhibition du DCA sur le contenu en lactate de la tumeur ainsi qu’une absence d’effet notable du DCA sur la production de ROS des cellules tumorales. Bien que le DCA n’ait pas affecté la croissance des cellules LLC/R9 mais qu’il ait considérablement inhibé les métastases, cette observation ne peut pas être expliquée par l’action du DCA dans la tumeur primaire et des études supplémentaires sur son action antimétastatique sont nécessaires.
RÉFÉRENCES
1 Feron O. Pyruvate into lactate and back : from the Warburg effect to symbiotic energy fuel exchange in cancer cells. Radiother Oncol 2009 ; 92 : 329-33. doi : 10.1016/j.radonc.2009.06.025.
2 Wu H, Ding Z, Hu D, et al. Central role of lactic acidosis in cancer cell resistance to glucose deprivation-induced cell death. J Pathol 2012 ; 227 : 189-99. doi : 10.1002/path.3978.
3 Fiaschi T, Marini A, Giannoni E, et al. La reprogrammation métabolique réciproque par la navette lactate influence de manière coordonnée l’interaction tumeur-stroma. Cancer Res 2012 ; 72 : 5130-40.
4 Solyanik GI, Fedorchuk AG, Pyaskovskaya ON, et al. Anticancer activity of aconitine-containing herbal extract BC1. Exp Oncol 2004 ; 26 : 307-11.
5 Pyaskovskaya ON. Action antiangiogénique du cyclophosphamide sur des tumeurs métastatiques expérimentales. J Med Chem 2012 ; 2 : 25-9 (en ukrainien).
6 Kolesnik DL, Pyaskovskaya ON, Tregubova NV, Solyanik GI. La variante du carcinome pulmonaire de Lewis avec une sensibilité élevée à la thérapie antiangiogénique antitumorale présente une grande capacité d’autophagie. Cytol Genet 2012 ; 46 : 155-60. doi : 10.3103/S009545271203005X.
7 Stacpoole PW. La pharmacologie du dichloroacétate. Metabolism 1989 ; 38 : 1124-44.
8 Bonnet S, Archer SL, Allalunis-Turner J, et al. A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth. Cancer Cell 2007 ; 11 : 37-51.
9 Wong JY, Huggins GS, Debidda M, et al. Le dichloroacétate induit l’apoptose dans les cellules cancéreuses de l’endomètre. Gynecol Oncol 2008 ; 109 : 394-402. doi : 10.1016/j.ygyno.2008.01.038.
10 Michelakis ED, Sutendra G, Dromparis P, et al. Metabolic modulation of glioblastoma with dichloroacetate. Sci Transl Med 2010 ; 2 : 31-4. doi : 10.1126/scitranslmed.3000677.
11 Stockwin LH, Yu SX, Borgel S, et al. Sodium dichloroacetate selectively targets cells with defects in the mitochondrial ETC Int J Cancer 2010 ; 127 ; 2510-19.
12 Kumar A, Kant S, Singh SM. Nouveaux mécanismes moléculaires de l’action antitumorale du dichloroacétate contre le lymphome à cellules T. Implication de l’altération du métabolisme du glucose et de l’augmentation du nombre de cellules : Implication de l’altération du métabolisme du glucose, de l’homéostasie du pH et de la régulation de la survie cellulaire. Chem Biol Interact 2012 ; 199 : 29-37.
13 Pyaskovskaya ON, Dasyukevich OI, Kolesnik DL, et al. Changes in VEGF level and tumor growth characteristics during Lewis lung carcinoma progression towards cis-DDP resistance. Exp Oncol 2007 ; 29 : 197-202.
14 Méthodes biochimiques (métabolisme lipidique et énergétique). MI Prohorova, ed. L. : Leningrad Univ, 1982. 272 p.
15 Wang H, Joseph JA. Quantifying cellular oxidative stress by dichlorofluorescein assay using microplate reader. Free Radic Biol Med 1999 ; 27 : 612-6.
16 Pyaskovskaya ON, Sorokina LV, Kolesnik DL, et al. Dynamique des changements des indices du système antioxydant pendant la croissance de deux variantes de carcinome pulmonaire de Lewis. Exp Oncol 2014 ; 36 : 29-33.