Xiao Lu,1,* Dong Zhou,1,* Bing Hou,1 Quan-Xing Liu,1 Qian Chen,2 Xu-Feng Deng,1,3 Zu-Bin Yu,1 Ji-Gang Dai,1 Hong Zheng1
1 Afdeling Thoraxchirurgie, Xinqiao Ziekenhuis, Derde Militaire Medische Universiteit, Chongqing, Volksrepubliek China
2 Instituut voor Pathologie en Zuidwest Kankercentrum, Zuidwest Ziekenhuis, Derde Militaire Medische Universiteit, Chongqing, Volksrepubliek China
3 Afdeling Cardiothoracale Chirurgie, Eerste Volksziekenhuis van Zunyi, Guizhou, Volksrepubliek China
*Deze auteurs hebben in gelijke mate bijgedragen aan dit werk
Correspondentie: Hong Zheng; Ji-Gang Dai
Afdeling Thoraxchirurgie, Xinqiao Hospital, Third Military Medical University, No. 183, Xinqiao Street, Shapingba District, Chongqing 400037, Volksrepubliek China
Tel.: +86 23 6877 4724
Fax: +86 23 6877 4724
E-mail: [email protected]; [email protected]
Ontvangen: 14 september 2020
Aanvaard: 4 december 2020
Gepubliceerd: 9 december 2020
Abstract
Achtergrond: Chemotherapie is nog steeds de primaire adjuvante strategie van kankertherapie; de opkomst van multi-drug resistentie is echter een reden tot zorg. Autofagie heeft een beschermende rol tegen chemotherapeutische middelen in kankercellen, en autofagie inhibitie wordt algemeen beschouwd als een veelbelovende therapeutische strategie. De schaarste aan effectieve en specifieke autofagie-inhibitoren beperkt echter de toepassing ervan.
Doel: Het doel van deze studie was om het effect te onderzoeken van DCA, een klein moleculair antitumormiddel, op de autofagieregulatie en chemosensitisatie in NSCLC-cellen.
Methoden: We onderzochten de autofagie regulatie van dichlooracetaat (DCA) door laser confocale microscopie en western blotting in A549 en H1975 cellijnen. De MTT-test en flowcytometrie werden uitgevoerd om de chemosensitisatie-effectiviteit van DCA te onderzoeken. De resultaten werden gecontroleerd met een onderhuids tumormodel in naakte muizen en de immunohistochemie werd toegepast voor het beoordelen van het niveau van celapoptose en autofagie in vivo na behandeling.
Resultaten: Wij vonden dat DCA, dat antitumor eigenschappen vertoonde in verschillende carcinoma modellen, apoptose induceerde van niet-kleincellige longkankercellen (NSCLC) door de autofagie van kankercellen te remmen. Bovendien kan Perifosine, een AKT-remmer, het vermogen tot het induceren van apoptose door DCA sterk verzwakken. De resultaten wijzen erop dat de AKT-mTOR-route, een belangrijke negatieve regulator van autofagie, betrokken is bij de door DCA veroorzaakte remming van autofagie. Vervolgens werd de effectiviteit van autofagieremming door DCA vastgesteld. Bij co-behandeling met het chemotherapeutische middel paclitaxel (PTX) verminderde DCA duidelijk de autofagie van de cel, versterkte apoptose en remde proliferatie in A549- en H1975-cellen. De resultaten van het xenograft-experiment tonen aan dat co-behandeling van PTX en DCA de celproliferatie in vivo aanzienlijk kan verminderen en de overleving van muizen kan verlengen.
Conclusie: Onze resultaten suggereren dat DCA de autofagie van cellen geïnduceerd door chemotherapeutica kan remmen, wat een nieuwe weg biedt voor de sensibilisering van kankerchemotherapie.
Trefwoorden: DCA, autofagie, multi-drug resistentie, niet-kleincellige longkanker, paclitaxel, xenograft naakte muizen, chemosensibilisatie
INLEIDING
Niet-kleincellige longkanker (NSCLC) is wereldwijd een van de belangrijkste oorzaken van kankersterfte. Het is de meest voorkomende vorm van kanker bij mannen en vrouwen, met een incidentie die groter is dan de gecombineerde incidentie van borst-, baarmoederhals- en colorectale kanker.[1,2] Hoewel chemotherapie nog steeds het belangrijkste middel van adjuvante therapie is voor inoperabele kankerpatiënten en patiënten die een operatie ondergaan, zijn de klinische voordelen van op platina en paclitaxel gebaseerde postoperatieve chemotherapieën bescheiden, vooral bij gevorderd NSCLC. Tegelijkertijd zijn de bijwerkingen van de medicijnen ernstiger geworden, en is er ook resistentie tegen de medicijnen ontstaan.[3] Daarom is er dringend behoefte aan nieuwe strategieën om de traditionele chemotherapie te vervangen/aan te vullen.
De laatste jaren is er steeds meer bewijs dat tumorcellen bij voorkeur energie produceren voor celgroei en -deling via glycolytische processen en melkzuurgisting. De snelheid van anaërobe stofwisseling en glycolyse in snel groeiende kwaadaardige tumorcellen is aanzienlijk hoger dan in normale cellen. Deze herprogrammering van het energiemetabolisme staat bekend als het Warburg-effect, en kan worden benut als therapeutisch doelwit om tumorgroei te remmen. Onder de talrijke geneesmiddelen die zich richten op het metabolisme, heeft dichlooracetaat (DCA) een uitstekend potentieel getoond vanwege zijn positieve bijdrage aan de behandeling van kanker.[4,5]
Een ander mechanisme dat volledig veranderd is in kankercellen is autofagie, een homeostatisch cellulair afbraaksysteem dat verantwoordelijk is voor het afbreken van beschadigde of onnodige cellulaire organellen of eiwitten.[6] Tijdens autofagie wordt cellulaire lading, bestemd voor afbraak, ingesloten in een autofagosoom, een dubbelmembraanblaasje. Het geladen autofagosoom versmelt soepel met een lysosoom om een autolysosoom te vormen, waar het geleverde cellulaire materiaal wordt afgebroken door verschillende lysosomale hydrolytische enzymen. Het autofagieproces is uitgebreid onderzocht. Het wordt steeds duidelijker dat veranderde autofagie-activiteit in verband wordt gebracht met tumorvorming en -progressie.[7-9] Omdat autofagie een beschermende rol speelt in kankercellen tegen chemotherapeutische geneesmiddelen, wordt autofagie-onderdrukking tijdens chemotherapie beschouwd als een nieuwe therapeutische strategie.[10-12] Momenteel wordt alleen chloroquine (CQ) in klinische settings gebruikt als een effectieve autofagieremmer. Hoewel de werkzaamheid en haalbaarheid van chloroquine bij kankertherapie zijn aangetoond, kunnen de ongewenste bijwerkingen een probleem vormen voor de klinische behandeling. Het ontdekken en gebruiken van aanvullende autofagie-remmers bij kankertherapie zou van groot klinisch belang zijn.[13-15]
DCA is een mitochondria-gerichte stof die werkt als een metabole schakelaar, die het abnormale kankercelmetabolisme omkeert van anaërobe glycolyse naar aërobe glucose-oxidatie door de activiteit van mitochondriaal PDK1 te verminderen en de levensvatbaarheid van PDH te vergroten. DCA verhoogt dus de mitochondriale reactieve zuurstofspecies en induceert zo apoptose in kwaadaardige tumorcellen zonder de normale cellen aan te tasten.[16,17] De regulerende werking van DCA voor autofagie bij longkanker is echter nog onduidelijk. In deze studie toonden wij aan dat DCA de celproliferatie remde en de apoptose van tumorcellen verbeterde door de downregulatie van autofagie, waardoor de efficiëntie van celdood toenam wanneer het werd gebruikt in co-behandeling met chemotherapeutische middelen.
Materialen en methoden
Celcultuur en reagentia
Menselijk longadenocarcinoom A549 cellen werden gekweekt in Dulbecco’s Modified Eagle Medium met 10% foetaal runderserum, en H1975 cellen werden gekweekt in Roswell Park Memorial Institute-1640 medium met 10% foetaal runderserum in een bevochtigde incubator met 95% lucht en 5%CO2 bij 37°C. De A549 (TCHu150) en H1975 (TCHu193) cellijnen werden gekocht van de Library of Typical Culture of the Chinese Academy of Sciences (Shanghai, Volksrepubliek China). Nadat de cellen langs de wand van de kweekschaal waren gegroeid, werd 0,25% trypsine (HyClone, Buckinghamshire, UK) gebruikt voor het losmaken en subkweken. De in deze studie gebruikte reagentia waren DCA (Sigma-Aldrich, St. Louis, MO, VS), paclitaxel (PTX; Sigma-Aldrich), cisplatine (cis-diamminedichloroplatinum [CDDP]; Sigma-Aldrich), adenovirus (GFP-RFP-LC3; Hanbio, Shanghai, Volksrepubliek China), TUNEL (terminal deoxynucleotidyl transferase dUTP nick end labeling; Promega, Fitchburg, WI, USA), APC-Annexine V, propidiumjodide (BD Pharmingen, Franklin Lakes, NJ, USA), en MTT-kit (Sangon Biotech, Shanghai, Volksrepubliek China). De antilichamen waren LC3-I/II, p62, PARP (alle Abcam, Cambridge, UK), β-actine (Sigma-Aldrich), mTOR/p-mTOR (Sigma-Aldrich), en Ki-67 (Biovisualab, Shanghai, Volksrepubliek China).
Immunofluorescentiemicroscopie
Cellen (1×105) werden geënt in een 24-wells plaat en een nacht geïncubeerd. Voorafgaand aan het experiment werden de cellen geïnfecteerd met adenovirus dat tandem GFP-RFP-LC3-structuren bevatte. Om 24 uur na de infectie werden de media veranderd, en de cellen werden behandeld met 25 mM DCA of Hank’s balanced salt solution (HBSS; Sigma Aldrich) gedurende 24 uur. Voor immunokleuring werden de cellen gefixeerd in 4% paraformaldehyde en gewassen met PBS. De cellen werden gedurende 5 minuten geïncubeerd met DAPI (4′,6-diamidino-2-fenylindool; Beyotime Biotechnology, Shanghai, Volksrepubliek China) en driemaal gewassen met PBS. De dekglaasjes werden gemonteerd op dia’s met montage medium. De beelden werden gemaakt met een LSM 780 Meta confocale microscoop (Carl Zeiss MicroImaging GmbH, Jena, Duitsland) en verwerkt met behulp van de door de fabrikant geleverde software.
Apoptosetest
Cellen (1×105) werden geïnoculeerd in een 24-wells plaat en ’s nachts geïncubeerd. Voorafgaand aan de experimenten werden de cellen gedurende 24 uur behandeld met verschillende concentraties 25 mM DCA, chemotherapeutisch middel plus DCA of andere reagentia. De cellen werden gekleurd met APC-Annexine V en propidiumjodide om de snelheid van apoptose te meten met flowcytometrie. Elk experiment werd driemaal herhaald.
Western blot
De cellenwerden op ijs gelyseerd door behandeling met RIPA-lysebuffer (Sangon Biotech) met Halt™ Protease and Phosphatase Inhibitor Cocktail (Thermo Fisher Scientific, Waltham, MA, USA) gedurende 15 min. De supernatanten werden na centrifugeren verzameld. De eiwitconcentraties werden gemeten met de bicinchoninezuur (BCA) protein assay kit (Beyotime Biotechnology). Eiwitmonsters werden geëlektroforeerd op 10% natriumdodecylsulfaat-polyacrylamidegels en overgebracht op een Immobilon PVDF-membraan. De membranen werden overnacht bij 4°C geprobed met het aangegeven primaire antilichaam en vervolgens geïncubeerd met een mierikswortelperoxidase-geconjugeerd secundair antilichaam. De banden werden gevisualiseerd met chemiluminescentie-detectiebuffer (Takara, Shiga, Japan) en de bandintensiteit werd gekwantificeerd met door de fabrikant geleverde software.
Levensvatbaarheidstest
Cellen werden gekweekt in 96-wellsplaten (1000 cellen in 100 µL kweekmedium/well). Na behandeling met geneesmiddelen werd 10 µL MTT (0,5 mg/ml) toegevoegd en gedurende 4 uur geïncubeerd. Het medium werd vervolgens weggegooid en de formazankristallen werden opgelost door toevoeging van DMSO (dimethylsulfoxide; Sigma-Aldrich). De absorptie bij 570 nm werd gemeten. De levensvatbaarheid van de cellen werd genormaliseerd ten opzichte van die van de controlegroep.
In vivo tumor xenograft studies
Voor deze test werden 5×106 cellen subcutaan geïnjecteerd in naakte muizen (BALB/c, specifieke pathogeenvrije klasse, 4-5 weken oud, gekocht van het Model Animal Research Center van de Nanjing Universiteit, Nanjing, Volksrepubliek China). Wanneer de tumorgrootte 100 mm3 bereikte (15-20 dagen), werden de muizen willekeurig verdeeld in 4 groepen (PBS, PTX, DCA, en PTX plus DCA). De dosering PTX was 20 mg/kg/d, en de dosering DCA was 100 mg/kg/d. De lengte en breedte van de tumoren werden om de twee dagen gemeten over hun twee loodrechte diameters (berekend volume = kortste diameter2 × langste diameter/2). Het aantal en de data van overlijden van de muizen werden geregistreerd om het overlevingspercentage te berekenen. Alle manipulaties met levende muizen werden goedgekeurd door het Animal Care and Use Committee van het Xinqiao-ziekenhuis en volgden de Chinese Guideline of Welfare and Ethics for Laboratory Animals, en alles werd in het werk gesteld om het lijden tot een minimum te beperken.
Histologisch onderzoek
Alle tumoren werden na 24 dagen ontleed voor histopathologisch onderzoek. Secties (4 tot 5 µm dik) van de tumorweefsels werden gefixeerd met 10% formaline en vervolgens gedetecteerd met Ki-67, LC3B-antilichaam en TUNEL-test. De secties werden driemaal gewassen en behandeld met diaminobenzidine voor kleurontwikkeling. Histologische onderzoeken werden uitgevoerd en foto’s werden genomen met een NanoZoomer 2.0-RS optische microscoop (Hamamatsu Photonics, Hamamatsu City, Japan).
Statistische analyse
De gegevens worden gepresenteerd als het gemiddelde ± standaarddeviatie. Eenzijdige variantieanalyse en onafhankelijke steekproef t-toets werden gebruikt om de variantie te analyseren. Overlevingscurven werden verkregen met de Kaplan-Meier methode, en vergelijkingen werden gemaakt met de log-rank test. Alle statistische analyses werden uitgevoerd met de statistische software SPSS 19.0 (SPSS; IBM Corporation, Armonk, NY, USA). P-waarden<0,05 of <0,01 werden als statistisch significant beschouwd.
Resultaten
DCA remde autofagie in longadenocarcinoomcellen
Cytosolische LC3 en SQSTM (p62) zijn sterk geconserveerde eiwitten die geacht worden een essentiële rol te spelen tijdens belangrijke fasen van autofagie. Om de rol van DCA in de regulering van autofagie te onderzoeken, onderzochten we de cellulaire lokalisatie van LC3 met een confocale laser-scanning microscoop. A549 en H1975 cellen werden geïnfecteerd met adenovirus dat codeert voor een tandem GFP-RFP-LC3 construct om de verandering in autofagieflux te detecteren. Een verschil in de pH-gevoeligheid kan de verschillende mate van GFP-LC3- en RFP-LC3-eiwitaccumulatie in neutrale autofagosomen en zure autolysosomen veroorzaken. Na de behandeling met HBSS werd het aantal GFP- of RFP-LC3-stippen aanzienlijk verhoogd, wat aantoont dat HBSS-geïnduceerde verhongering de autofagieflux in A549- en H1975-cellen aanzienlijk bevorderde. De DCA-behandeling remde echter met succes de expressie van LC3-eiwitten ten opzichte van de controle of HBSS-behandeling in zowel A549-cellen als H1975-cellen (figuur 1A en D, p<0,01).
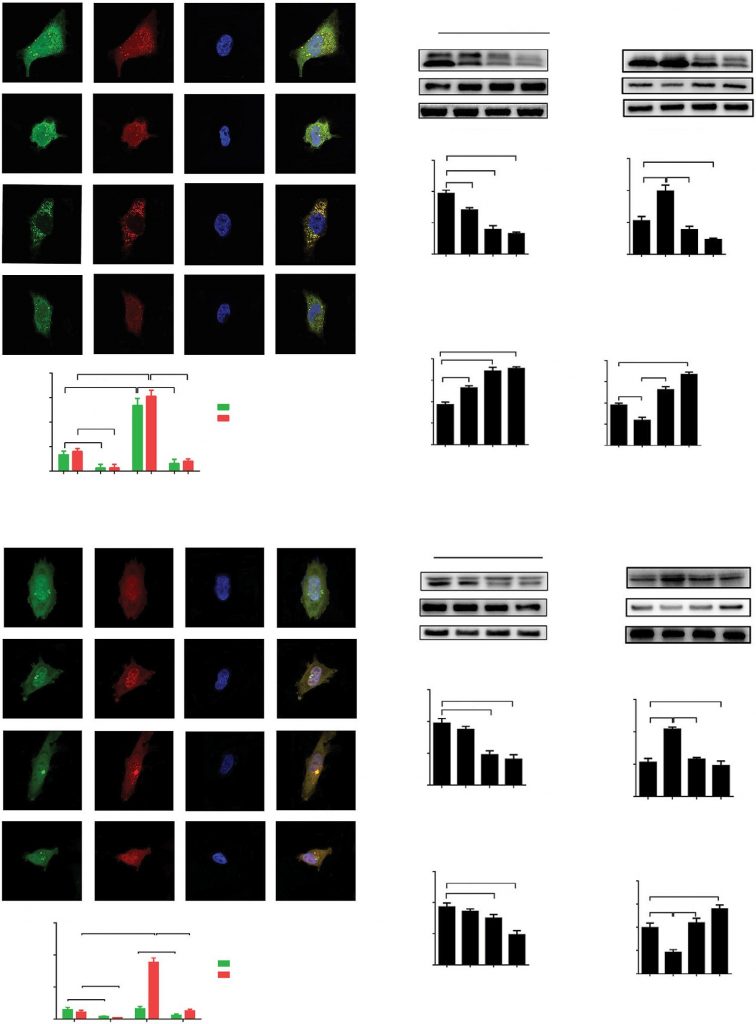
Afkortingen: DAPI, 4′,6-diamidino-2-fenylindool; DCA, dichlooracetaat; HBSS, gebalanceerde zoutoplossing van Hank; ns, niet significant.
het p62-eiwit hoopt zich op wanneer autofagie wordt geremd en neemt af wanneer autofagie wordt geïnduceerd. Western blotting analyse werd uitgevoerd om de eiwitniveaus van p62 en LC3-II na DCA behandeling te onderzoeken. Wij constateerden een significante afname van de LC3-niveaus en een toename van p62 na DCA-behandeling op een concentratie-afhankelijke manier in zowel A549 als H1975-cellen (figuur 1B en E, p<0,01). Autofagie werd versterkt tijdens incubatie met HBSS, wat werd omgekeerd bij cotreatie met DCA (figuur 1C en F, p<0,01). Al deze resultaten wijzen erop dat de autofagische flux in A549 en H1975 cellen aanzienlijk werd geremd door de behandeling met DCA.
Het effect van autofagiebevordering op celdood geïnduceerd door DCA
Systematisch onderzoek naar de antikankereffecten van DCA werd uitgevoerd. Eerst werd het antikankervermogen van DCA in vitro onderzocht. Beide cellen werden gedurende 24 uur geïncubeerd in aanwezigheid van verschillende concentraties DCA, en de celapoptose en -levensvatbaarheid werden beoordeeld. Wij constateerden dat het antikankervermogen van DCA, zoals weergegeven in de remming van de levensvatbaarheid en de apoptose van de cellen, in A549-cellen en H1975-cellen concentratie-afhankelijk toenam (figuur 2A en B, E en F, p<0,01).
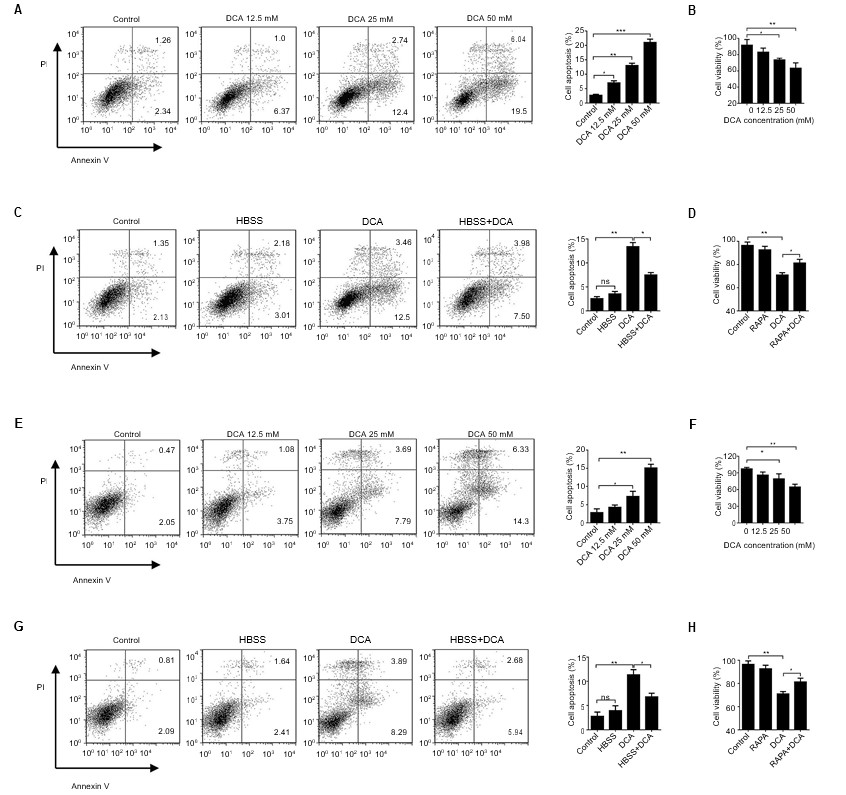
Afkortingen: DCA, dichlooracetaat; FITC/PI, fluoresceïne-isothiocyanaat/propidiumjodide; HBSS, gebalanceerde zoutoplossing van Hank.
DCA activeerde de metabole schakelaar die het abnormale metabolisme in kankercellen omkeerde van anaërobe glycolyse naar glucoseoxidatie, hetgeen resulteerde in mitochondriale disfunctie en celdood. Uit onze voorlopige experimenten bleek dat autofagie aanzienlijk werd geremd door DCA-behandeling. Om te bepalen of de DCA-gemedieerde autofagie-inhibitie betrokken was bij apoptose, werden A549 en H1975 cellen behandeld met DCA na HBSS gedurende 24 uur. Celapoptose geïnduceerd door DCA werd geremd wanneer de cellen werden samengevoegd met HBSS in vergelijking met de DCA-behandeling alleen. Behalve het veranderen van het abnormale metabolisme, bevestigt dit resultaat dat DCA ook celdood kan activeren door autofagie in kankercellen te remmen. De resultaten van de levensvatbaarheid van de cellen zijn in overeenstemming met deze conclusie (figuur 2C en D, G en H, p<0,05).
Remming van de AKT pathway verminderde DCA-geïnduceerde apoptose
De ATK-mTOR pathway werd in eerdere studies geacht een kritische rol te spelen in de regulering van autofagie.[18-21] Perifosine,[22] een chemisch reagens dat AKT-fosforylering en -activering voorkomt, werd gebruikt om te onderzoeken of de ATK-mTOR pathway betrokken is bij het autofagie-remmende proces van DCA. De cellen werden gedurende 24 uur gelijktijdig behandeld met DCA en perifosine. De celapoptose werd bijna gehalveerd in de samenvallende groep in vergelijking met de DCA-behandelingsgroep, hetgeen overeenkomt met de levensvatbaarheidstests (figuur 3A en B, D en E, p<0,05). Vervolgens onderzochten wij de niveaus van cruciale apoptose-gerelateerde eiwitten, PARP en procaspase3. AKT-fosforylering werd geremd, en de niveaus van apoptose-gerelateerde eiwitten werden significant verlaagd in de medebehandelingsgroep (figuur 3C, p<0,05). Deze bevindingen werden ook verkregen in de H1975-cellen (figuur 3F, p<0,05).
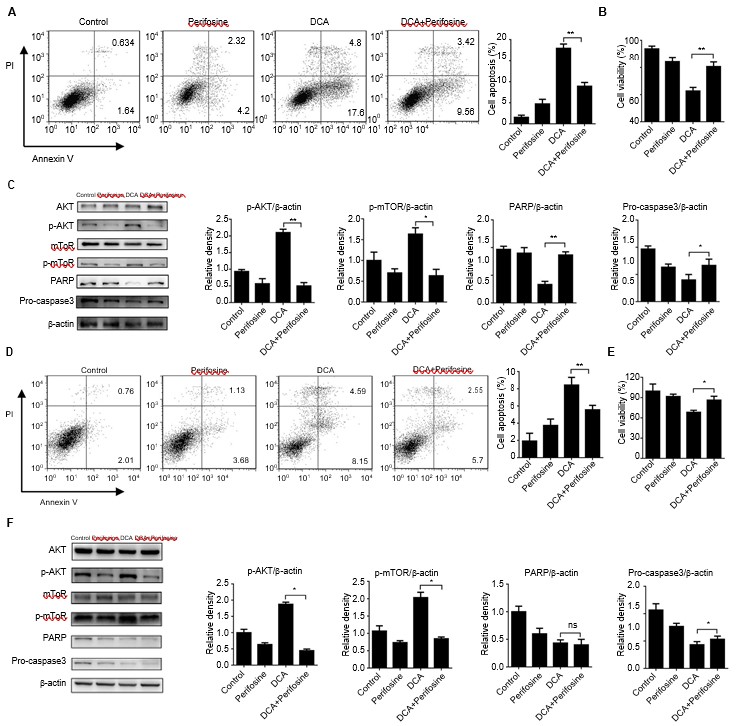
Afkortingen: DCA, dichlooracetaat.
DCA verhoogt de gevoeligheid voor PTX en CDDP door de chemotherapie-geïnduceerde autofagie om te keren
De remming van autofagie wordt beschouwd als een nieuwe strategie om de gevoeligheid van chemotherapeutica te vergroten.[23,24] Om te onderzoeken of co-behandeling met DCA en een chemotherapeutisch middel een synergetisch effect heeft om de celgroei te onderdrukken, werden A549 cellen co-behandeld met DCA en PTX of CDDP. Zoals getoond in figuur 4A-C, verhoogde de behandeling met chemotherapeutica en DCA de apoptoseniveaus in vergelijking met de medicijnbehandeling alleen of in combinatie met CQ, en de resultaten waren consistent met de levensvatbaarheidstests van de cellen (p<0,05). Om te bepalen of DCA de door PTX geïnduceerde autofagie kan afremmen, werden de cellen gedurende 24 uur behandeld met PTX en DCA en geoogst voor Western blotting. De niveaus van autofagie-gerelateerde eiwitten werden onderzocht. LC3 expressie werd duidelijk gestimuleerd door de PTX-behandeling, en werd significant verlaagd bij gelijktijdige behandeling met DCA. Het niveau van het cruciale apoptose-gerelateerde eiwit PARP werd significant verlaagd na de co-behandeling (figuur 4D-F, p<0,05). Al deze resultaten wijzen erop dat DCA de geneesmiddelenresistentie van A549 cellen tegen PTX verminderde door autofagie te remmen.
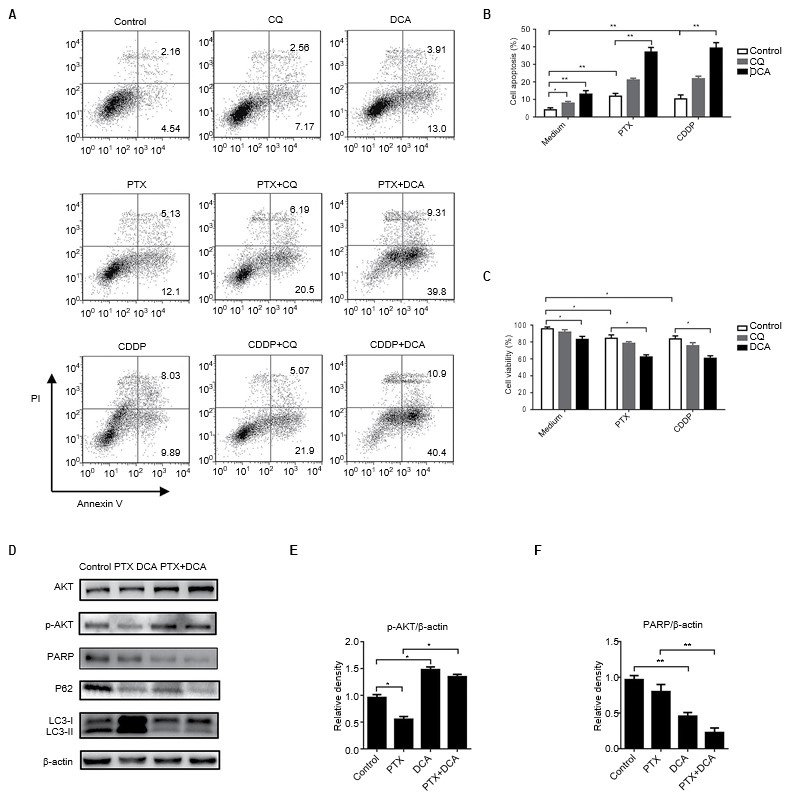
Afkortingen: CDDP, cis-diamminedichloroplatinum; CQ, chloroquine; DCA, dichlooracetaat; PTX, paclitaxel.
DCA versterkte de antikankerwerking van PTX in vivo door remming van autofagie
Omdat cotreating van cellen met PTX en DCA de snelheid van celdood in vitro verhoogde in vergelijking met behandeling met één van beide geneesmiddelen alleen, beoordeelden we ook de in vivo werkzaamheid van de combinatietherapie van DCA en PTX in een xenograft tumormodel van de muis. Zodra de omvang van de onderhuidse xenografttumor 150 mm3 had bereikt, werden de muizen verdeeld in vier groepen: controle, DCA, PTX, en DCA plus PTX. De toediening van PTX alleen remde de tumorgroei niet significant, maar de behandeling met PTX plus DCA remde duidelijk de tumorgroei en verlengde de overleving van de muis (figuur 5A, en B, p<0,05). Zoals getoond in figuur 5C, nam de tumorverdubbelingstijd van de A549-cellen aanzienlijk toe van 3 dagen in de controlegroep tot 10 dagen in de medebehandelingsgroep (p<0,05), en nam de tumorverdubbelingstijd van de H1975-cellen toe van 2,6 tot 7,5 dagen (figuur 5D-F, p<0,05). Deze resultaten wijzen erop dat DCA de in vivo antikankerwerking van PTX kan versterken.
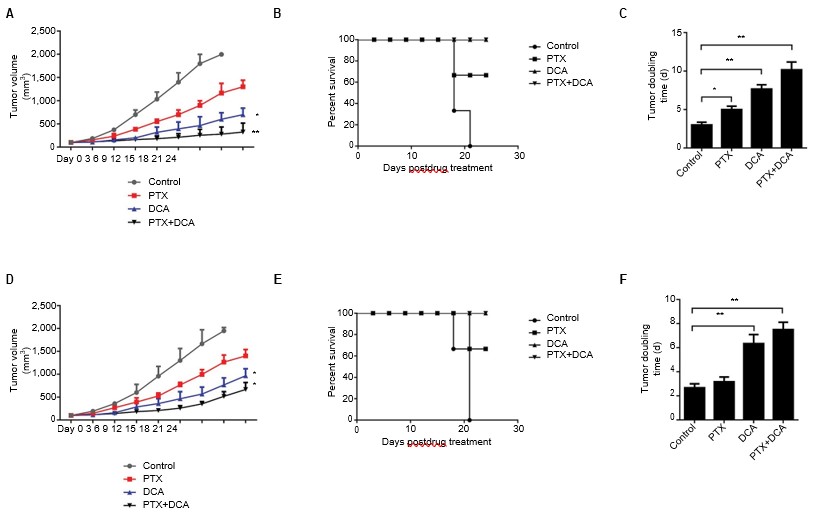
Afkortingen: DCA, dichlooracetaat; PTX, paclitaxel.
Behandeling met DCA plus PTX remde de tumorkiemkracht aanzienlijk
Om na te gaan of de combinatietherapie van DCA en PTX leidde tot de morfologische veranderingen die kenmerkend zijn voor apoptose in de A549-cellen in vivo, werden alle tumoren op dag 24 teruggehaald, doorgesneden, gekleurd met TUNEL en geanalyseerd met immunohistochemie. Er was een minimale toename van het aantal TUNEL-positieve cellen in de DCA- of PTX-behandelingsgroepen ten opzichte van de controlegroep. Het aandeel TUNEL-positieve cellen in de medebehandelingsgroep nam echter dramatisch toe in vergelijking met de controle- of enkelvoudige behandelingsgroepen (figuur 6A).
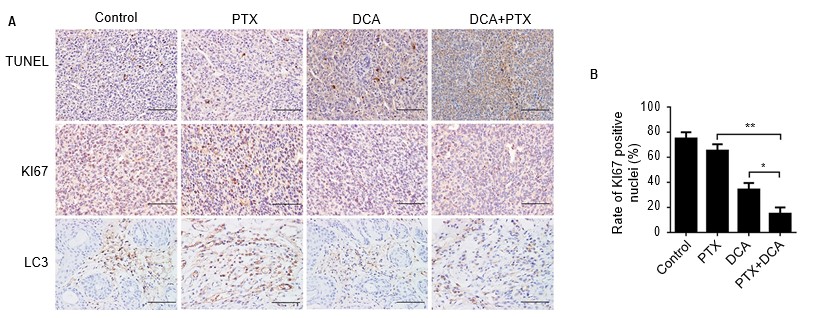
Afkortingen: DCA, dichlooracetaat; PTX, paclitaxel.
Vervolgens onderzochten wij de expressie van het aan proliferatie gerelateerde Ki-67 en het cruciale autofagie-eiwit LC3B in de tumoren door middel van immunohistochemische kleuring. De Ki-67 expressie in de controlemuizen was significant hoger, terwijl de expressie sterk verminderde in de tumoren van dieren die de combinatiebehandeling kregen, en de expressie van LC3B was gelijk aan die van Ki-67. Concluderend kan worden gesteld dat de behandeling met DCA plus PTX de apoptose aanzienlijk verbeterde en de expressie van Ki-67 en LC3B in vivo verminderde (figuur 6A en B, p<0,01).
Bespreking
Met de ontwikkeling van het kankeronderzoek is een toenemend aantal behandelingsstrategieën toegepast bij de behandeling van longkanker.[25-27] Hoewel veel longkankerpatiënten, vooral in het late of progressieve stadium, baat hebben gehad bij EGFR-TKI en PD-1 antilichaam, is het voor de meeste patiënten exorbitant duur. Conventionele chemotherapie is in China nog steeds de belangrijkste aanpak voor de behandeling van gevorderde longkanker. Multiresistentie is echter een moeilijk obstakel bij de behandeling van kanker; daarom is het huidige onderzoek gericht op het zoeken naar nieuwe manieren om de gevoeligheid van chemotherapie te verbeteren of de resistentie tegen geneesmiddelen te vertragen. Recentelijk is autofagie regulering beschouwd als een doelwit voor antikanker therapie; veel bewijs heeft aangetoond dat het remmen van autofagie het tumor onderdrukkende effect van chemotherapeutica en radiotherapie kan bevorderen.[23,28-30] Gewoonlijk genereren de meeste vaste carcinomen energie via de glycolytische route, ongeacht of er voldoende zuurstof aanwezig is; dit wordt het “Warburg-effect” genoemd.[29-31] DCA, een antitumormiddel met kleine moleculen, kan deze metabolische modus van de mitochondriën omkeren van anaërobe ademhaling naar aërobe ademhaling, waardoor tumorcellen sterven. Of DCA kan worden gebruikt in combinatie met andere chemotherapeutica is echter onbekend. In deze studie vonden wij dat co-behandeling met DCA en PTX doeltreffender kan zijn bij het onderdrukken van de groei van longkankercellen in vitro en in vivo. DCA remde de beschermende autofagie die kankercellen gebruiken in reactie op PTX-behandeling door AKT-fosforylering te activeren en celdood te bevorderen. Het synergetisch effect van deze twee middelen versterkt de celdood, waardoor de tumorgroei doeltreffender wordt geremd.
Zoals bekend is het celmetabolisme een effectief doelwit voor de behandeling van kanker,[32] en steeds meer bewijs heeft de antitumoreigenschappen van DCA in het celmetabolisme aangetoond. De effecten van DCA zijn echter controversieel, omdat verschillende resultaten zijn gerapporteerd in verschillende kankermodellen.[33,34] In de huidige studie vonden wij dat de combinatie van DCA en PTX doeltreffender was in het remmen van celproliferatie en het versterken van apoptose dan PTX alleen. In het in deze studie gebruikte subcutane tumor xenograft model, verminderde de behandeling met DCA plus PTX de groei van de A549 cellen die in de muizen waren geïnjecteerd met 60%. Onze gegevens toonden aan dat DCA krachtige antikanker effecten uitoefende en synergetisch werkte met PTX op A549 cellen. Multidrug therapie die synergetisch werkt, kan de therapeutische werkzaamheid verbeteren door de toxiciteit en de resistentie tegen geneesmiddelen te verminderen.[35] In onze experimenten keerde DCA de multidrug resistentie van A549 cellen om door de autofagie geïnduceerd door PTX te remmen en apoptose te induceren. Daarom zou toevoeging van DCA aan het chemotherapieregime de schadelijkheid van meervoudige geneesmiddelenresistentie in NSCLC kunnen verminderen.
Autofagie is een sterk geconserveerde metabolische route waarbij cellen verouderde of defecte eiwitten, organellen en andere cellulaire componenten afleveren aan lysosomen voor afbraak om de cellulaire homeostase te handhaven.[36,37] Er is veel bewijs dat de meeste chemotherapeutische middelen en ioniserende straling autofagie induceren, wat leidt tot resistentie tegen meerdere geneesmiddelen. Aanpassing van autofagie vergemakkelijkt het overleven van tumorcellen in een micro-omgeving van verhoogde metabole stress of geneesmiddelentoxiciteit. Stress-geïnduceerde autofagie is een belangrijke beschermende strategie die de overleving van cellen kan handhaven, wat uiteindelijk resulteert in geneesmiddelenresistentie in verschillende soorten tumorcellen.[38] In deze studie remde DCA-behandeling cellulaire autofagie en bevorderde apoptose. RARA, een autofagie-activator, kan de cellen resistenter maken tegen DCA, wat erop wijst dat DCA celdood veroorzaakt door het verstoren van het kankercelmetabolisme en het remmen van autofagie. De PI3K-AKT-mTOR-route is een belangrijke negatieve regulator van autofagie. Daarom kan het aanpakken van de PI3K-AKT-mTOR signalering een nieuwe strategie zijn voor kankertherapie. DCA bevordert selectief AKT-kinase fosforylering, waardoor autofagie wordt geremd. De activering van de PI3K-AKT-mTOR-route door DCA remt dus de door PTX geïnduceerde autofagie. Behandeling met EGFR-TKIs is naar verluidt gerelateerd aan het autofagie niveau van longkankercellen, en autofagie remming zou de antitumor effecten van EGFR-TKIs kunnen vergemakkelijken. Dit zou een nieuw aandachtspunt voor de behandeling van longkanker kunnen zijn.
Sommige onderzoekers stellen echter dat autofagie een “tweesnijdend zwaard” is voor kankercellen, en dat het de overleving en proliferatie in de tumormicro-omgeving kan onderdrukken.[26,39,40] Bovendien werd het induceren van autofagie bij kanker ook beschouwd als een strategie voor chemotherapie-sensitisatie. De verschillende functies van autofagie in kankercellen zouden kunnen worden veroorzaakt door de verschillende statussen van kankercellen of tumortypes; dus, het begrijpen van de onderliggende functies van autofagie regulering tussen verschillende kankercellen zal nieuw licht werpen op de aanwijzing van strategie tegen chemotherapie resistentie.[24]
Interessant is dat DCA dubbele kenmerken van autofagie-regulatie in verschillende tumorcellen blijkt te hebben. Lin et al[33] hebben gemeld dat DCA apoptose kan induceren in colorectale kankercellen en tegelijkertijd autofagie kan bevorderen. Hieruit volgt dat een complexer moleculair mechanisme betrokken is bij de autofagie regulering van DCA. Het onderzoeken van het principe van de verschillende effecten van DCA op autofagie zou ons op nieuwe ideeën brengen om nieuwe adjuvante chemotherapiemiddelen te ontwerpen door middel van autofagieremming.
Conclusie
Onze gegevens toonden aan dat autofagie kan worden geactiveerd tijdens chemotherapie, en autofagie-inhibitie door DCA kan celdood bevorderen en de gevoeligheid van tumorcellen voor chemotherapiemedicijnen vergroten. Bovendien waren autofagie en kankermetabolisme betrokken bij een reeks tumorgebeurtenissen, zoals tumorontwikkeling, tumorgroei en chemotherapie. Het ophelderen van de relatie tussen autofagie en metabolisme[32] in verschillende kankercellen zou ons nieuwe mogelijkheden kunnen bieden voor het ontwerpen van geneesmiddelen die gericht zijn op deze belangrijke cellulaire gebeurtenissen tegen kanker en geneesmiddelenresistentie.
Erkenning
De studie werd ondersteund door financiering van de National Natural Science Foundation van China (81702247) en het Basic Science and Frontier Technology Project van Chongqing voor Zheng (cstc2017jcyjAX0048), de National Natural Science Foundation van China voor Dai (81472188), en het Clinical Research Project van Xinqiao Hospital voor Yu (2015YLC21).
Openbaarmaking
De auteurs melden geen belangenconflicten in dit werk.
VERWIJZINGEN
1 Maher AR, Miake-Lye IM, Beroes JM, Shekelle PG. Treatment of Metastatic Non-Small Cell Lung Cancer: A Systematic Review of Comparative Effectiveness and Cost-Effectiveness. Washington (DC): Department of Veterans Affairs (VS); 2012.2 Spiro SG, Porter JC. Longkanker – waar staan we vandaag? Current advances in staging and nonsurgical treatment. Am J Respir Crit Care Med. 2002;166:1166-1196.
3 Song W, Tang Z, Li M, et al. Polypeptide-based combination of paclitaxel and cisplatin for enhanced chemotherapy efficacy and reduced side-effects. Acta Biomater. 2014;10:1392-1402.
4 Ward PS, Thompson CB. Metabolic reprogramming: a cancer hallmark even Warburg did not anticipate. Cancer Cell. 2012;21:297-308.
5 Pathak RK, Marrache S, Harn DA, Dhar S. Mito-DCA: a mitochondria targeted molecular scaffold for efficacious delivery of metabolic modulator dichloroacetate. ACS Chem Biol. 2014;9:1178-1187.
6KimuraT, Takabatake Y, Takahashi A, Isaka Y. Chloroquine in cancer therapy: a double-edged sword of autophagy. Cancer Res. 2013;73:3-7.
7 Levine B, Kroemer G. Autofagie in de pathogenese van ziekte. Cell. 2008;132:27-42.
8 Gomes LR, Vessoni AT, Menck CF. Micro-omgeving en autofagie cross-talk: Implicaties in kankertherapie. Pharmacol Res. 2016;107:300-307.
9 Su Z, Yang Z, Xu Y, Chen Y, Yu Q. Apoptosis, autophagy, necroptosis, and cancer metastasis. Mol Cancer. 2015;14:48.
10 Koren I, Kimchi A. Celbiologie. Bevordering van tumorigenese door onderdrukking van autofagie. Science. 2012;338:889-890.
11 Rosenfeldt MT, Ryan KM. De rol van autofagie in tumorontwikkeling en kankertherapie. Expert Rev Mol Med. 2009;11:e36.
12 Rubinsztein DC, Codogno P, Levine B. Autophagy modulation as a potential therapeutic target for divers diseases. Nat Rev Drug Discov. 2012;11:709-730.
13EggerME, Huang JS, Yin W, McMasters KM, McNally LR. Remming van autofagie met chloroquine is effectief bij melanoom. J Surg Res. 2013;184:274-281.
14 Rangwala R, Chang YC, Hu J, et al. Combined MTOR and autophagy inhibition: phase I trial of hydroxychloroquine and temsirolimus in patients with advanced solid tumors and melanoma. Autofagie. 2014;10:1391-1402.
15 Vogl DT, Stadtmauer EA, Tan KS, et al. Combined autophagy and proteasome inhibition: a phase 1 trial of hydroxychloroquine and bortezomib in patients with relapsed/refractory myeloma. Autofagie. 2014;10:1380-1390.
16 Bonnet S, Archer SL, Allalunis-Turner J, et al. A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth. Cancer Cell. 2007;11:37-51.
17 Christofk HR, Vander HM, Harris MH, et al. The M2 splice isoform of pyruvate kinase is important for cancer metabolism and tumour growth. Nature. 2008;452:230-233.
18 Tan J, Jiang X, Yin G, et al. Anacardic acid induceert celapoptose van prostaatkanker via autofagie door ER stress/DAPK3/Akt signaleringsroute. Oncol Rep. 2017;38(3):1373-1382.
19 Chen LM, Song TJ, Xiao JH, Huang ZH, Li Y, Lin TY. Tripchlorolide induceert autofagie in longkankercellen door de PI3K/AKT/mTOR-route te remmen en verbetert de cisplatinegevoeligheid in A549/DDP-cellen. Oncotarget. 2017;8(38):63911–63922.
20 Wang Z, Wang N, Liu P, Xie X. AMPK en kanker. EXS. 2016;107:203-226.
21 Umezawa S, Higurashi T, Nakajima A. AMPK: therapeutisch doelwit voor diabetes en kankerpreventie. Curr Pharm Des. 2017;23(25):3629–3644.
22 Kieuwen JJ, Dennis PA. Perifosine: update over een nieuwe Akt-remmer. Curr Oncol Rep. 2009;11:102-110.
23 Janku F, McConkey DJ, Hong DS, Kurzrock R. Autophagy as a target for anticancer therapy. Nat Rev Clin Oncol. 2011;8:528-539.
24 Rubinsztein DC, Codogno P, Levine B. Autophagy modulation as a potential therapeutic target for divers diseases. Nat Rev Drug Discov. 2012;11:709-730.
25 Ma W, Gilligan BM, Yuan J, Li T. Current status and perspectives in translational biomarker research for PD-1/PD-L1 immune checkpoint blockade therapy. J Hematol Oncol. 2016;9:47.
26 Dholaria B, Hammond W, Shreders A, Lou Y. Opkomende therapeutische middelen voor longkanker. J Hematol Oncol. 2016;9:138.
27 Wang S, Cang S, Liu D. Third-generation inhibitors targeting EGFR T790M mutation in advanced non-small cell lung cancer. J Hematol Oncol. 2016;9:34.
28 White E, Karp C, Strohecker AM, Guo Y, Mathew R. Role of autophagy in suppression of inflammation and cancer. Curr Opin Cell Biol. 2010;22:212-217.
29 Mathew R, Karantza-Wadsworth V, White E. Role of autophagy in cancer. Nat Rev Cancer. 2007;7:961-967.
30 Apel A, Herr I, Schwarz H, Rodemann HP, Mayer A. Blocked autophagy sensitizes resistant carcinoma cells to radiation therapy. Cancer Res. 2008;68:1485-1494.
31 Zhou W, Liotta LA, Petricoin EF. The Warburg effect and mass spectrometry-based proteomic analysis. Cancer Genomics Proteomics. 2017;14:211-218.
32 Ho WL, Hsu WM, Huang MC, Kadomatsu K, Nakagawara A. Protein glycosylation in cancers and its potential therapeutic applications in neuroblastoma. J Hematol Oncol. 2016;9:100.
33 Lin G, Hill DK, Andrejeva G, et al. Dichlooracetaat induceert autofagie in colorectale kankercellen en tumoren. Br J Cancer. 2014;111:375-385.
34 Gong F, Peng X, Sang Y, et al. Dichloroacetate induceert beschermende autofagie in LoVo-cellen: betrokkenheid van cathepsine D/thioredoxin-like protein 1 en Akt-mTOR-gemedieerde signalering. Cell Death Dis. 2013;4:e913.
35 Chou TC. Theoretische basis, experimenteel ontwerp en gecomputeriseerde simulatie van synergisme en antagonisme in geneesmiddelencombinatiestudies. Pharmacol Rev. 2006;58:621-681.
36 Eskelinen EL. De dubbele rol van autofagie bij kanker. Curr Opin Pharmacol. 2011;11:294-300.
37 Ravikumar B, Sarkar S, Davies JE, et al. Regulation of mammalian autophagy in physiology and pathophysiology. Physiol Rev. 2010;90:1383-1435.
38 Naveed S, Aslam M, Ahmad A. Starvation based differential chemotherapy: a novel approach for cancer treatment. Oman Med J. 2014;29:391-398.
39 Yoshida GJ. Therapeutische strategieën van herpositionering van geneesmiddelen gericht op autofagie om kanker celdood te induceren: van pathofysiologie tot behandeling. J Hematol Oncol. 2017;10:67.
40 Choi AM, Ryter SW, Levine B. Autophagy in human health and disease. N Engl J Med. 2013;368:651-662.
Gerelateerde inhoud: