Serena Vella1*, Matteo Conti2*, Roberta Tasso1, Ranieri Cancedda1,3 en Aldo Pagano1,3
1 Afdeling Oncologie, Biologie en Genetica (DOBiG), Universiteit van Genua, Genua-Italië
2 Laboratorium voor Klinische Farmacologie en Toxicologie, Ospedale S. Maria delle Croci, 48100 Ravenna-Italië
3 Nationaal Instituut voor Kankeronderzoek (IST) Genua, Largo R. Benzi, 10, 16132 Genua-Italië
De kleine, in water oplosbare molecule dichlooracetaat (DCA) wekt sinds kort grote belangstelling op het gebied van de kankertherapie, omdat is aangetoond dat deze molecule de groei van menselijke tumoren kan remmen door specifiek in te werken op de mitochondriën van kankercellen zonder de fysiologie van niet-kwaadaardige cellen te verstoren. Neuroblastoom was een van de tumortypes waarop DCA als ondoeltreffend werd beschouwd, omdat het bestaat uit cellen met weinig erkende mitochondriale afwijkingen. Neuroblastoom is echter samengesteld uit verschillende celtypes in termen van metabolisme, fenotype en kwaadaardig potentieel. Ondanks de bovenstaande voorspelling tonen wij in dit werk aan dat (i) DCA een onverwacht antikankereffect heeft op NB-tumorcellen en (ii) dit effect selectief is gericht op zeer kwaadaardige NB-cellen, terwijl de meer gedifferentieerde/minder kwaadaardige NB-cellen refractair zijn voor DCA-behandeling. Dit resultaat bevestigt de noodzaak van een gedetailleerd onderzoek naar de antikankereigenschappen van DCA tegen dit tumortype, met als einddoel het mogelijke gebruik ervan als therapeutisch middel.
Het kleine molecuul/weesgeneesmiddel DCA is onlangs in de schijnwerpers gekomen omdat het de groei van glioblastoma multiforme (GBM) tumoren kan beperken bij doseringen die verenigbaar zijn met de afwezigheid van bijwerkingen.1-4 Gezien de goed verdraagbare toxiciteit en de lage kosten, wekt DCA veel belangstelling voor het mogelijke gebruik ervan bij kankertherapie en bij de genezing van bepaalde tumortypes.5 Hoewel DCA effectief is gebleken bij kleincellig longcarcinoom,6 borstkanker,7 prostaatkanker8, endometriumkanker9 en glioblastoomcellijnen,2 is de werkzaamheid van deze kleine molecule als antikankerbehandeling tot dusver alleen klinisch aangetoond bij humane GBM, zodat de bewezen werkzaamheid van DCA bij andere maligniteiten nog moet worden geëvalueerd.10 In detail, vanwege het werkingsmechanisme, wordt verwacht dat DCA niet effectief zal zijn op tumoren die gekenmerkt worden door een lage mitochondriale polarisatie, zoals havercel longkanker, lymfomen, neuroblastoom (NB) en sarcomen.5 DCA als remmer van het mitochondriale enzym pyruvaatdehydrogenase kinase (PDK) activeert pyruvaatdehydrogenase (PDH), een poortwachtersenzym dat de flux van pyruvaat naar de mitochondriën regelt, waardoor de verhouding tussen glucose-oxidatie en glycolyse toeneemt.4-6 Bonnet et al. toonden aan dat deze verhoging van de oxidatieve fosforylering selectief pro-apoptotisch is in kankercellen, wat leidt tot een afname van hun typische mitochondriale hyperpolarisatie die gepaard gaat met weerstand tegen apoptose.6 Hoewel NB aanvankelijk werd beschouwd als een tumortype waarop DCA hoogstwaarschijnlijk niet effectief is, vanwege het specifieke kenmerk van kleine cellen en de veronderstelde afwezigheid van mitochondriale membraanhyperpolarisatie,5 worden prolifererende NB-cellen in stand gehouden door een glycolytisch fenotype.11 Wij onderzochten de mogelijke werkzaamheid van DCA-behandeling in het remmen van de groei van menselijke NB-knobbels gegenereerd in NOD-SCID muizen. Verrassend genoeg zagen we dat DCA de tumorgroei in vivo aanzienlijk beperkt. In menselijke NB-tumoren zijn er drie verschillende celtypes: I-type stamcellen, N-type neuroblastic/neuro-endocrine precursors en de stam-achtige S-type Schwannian/melanoblastic precursors. Deze cellen hebben verschillende morfologische, biochemische en tumorigene eigenschappen en variabele differentiatiestadia.12 Interessant is dat wij, gebruikmakend van genetisch gemanipuleerde SKNBE2 NB-cellen die gekenmerkt worden door een duidelijke neuronachtige toewijding en een zeer laag kwaadaardig potentieel, hebben ontdekt dat het effect van DCA beperkt blijft tot ongedifferentieerde, zeer kwaadaardige, volledig cyclische cellen, terwijl het geen invloed heeft op de proliferatiesnelheid van meer gedifferentieerde, slecht kwaadaardige cellen. De hier gerapporteerde experimenten suggereren om de mogelijke werkzaamheid van DCA als antikankermedicijn uit te breiden tot NB die differentieel werkt op sterk en/of slecht maligne cellen.
Trefwoorden: dichlooracetaat, neuroblastoom, mitochondriën *S.V. en M.C. hebben in gelijke mate bijgedragen aan dit werk.
Subsidiesponsor: Italiaans Ministerie van Universiteit en Onderzoek-MIUR (2007 PRIN Program prot.); Subsidienummer: 2007945BZN; Subsidiesponsor: Associazione Italiana Ricerca sul Cancro (2009 AIRC Program); Subsidienummer: IG9378; Subsidiesponsor: Italiaans Ministerie van Universiteit en Onderzoek-MIUR (2007 Internationaal FIRB Programma), Associazione Italiana per la Lotta al Neuroblastoma (Genua, Italië)
DOI: 10.1002/ijc.26173
Geschiedenis: Ontvangen 25 feb 2011; Geaccepteerd 20 apr 2011; Online 9
mei 2011
Correspondentie naar: Aldo Pagano, Afdeling Oncologie, Biologie en Genetica (DOBiG), Universiteit van Genua, Genua, Italië, Tel.: þ/39/ 010-5737241, Fax: þ/39/010-5737257, E-mail: [email protected]
Int. J. Cancer: 130, 1484-1493 (2012) VC 2011 UICC
Materiaal en methoden
Muizen
Homozygote NOD-SCID (NOD.CB17-Prkdcscid) muizen werden gekocht van het Jackson Laboratory (Bar Harbor, MA). De muizen werden gebruikt tussen 5 en 8 weken oud. Alle dieren werden gefokt en gehouden in de dierfaciliteit van het Nationaal Instituut voor Kankeronderzoek in Genua, Italië. De verzorging en het gebruik van de dieren waren in overeenstemming met de wetten van het Italiaanse ministerie van Volksgezondheid en de richtlijnen van de Europese Gemeenschap.
In vivo tumorigeniciteitstest
Een celsuspensie van SKNBE2 cellen in PBS (107 cellen) werd subcutaan geïnjecteerd in 37 NOD/SCID muizen. De muizen werden verdeeld in vier groepen: -controlegroep (n ¼ 13 muizen): gesteriliseerd water; -met DCA (25 mg/kg/dosis) behandelde groep (n ¼ 14 muizen); -met DCA (2,5 mg/kg/dosis) behandelde groep (n ¼ 5 muizen); -geïmpregneerde groep (n ¼ 5 muizen): muizen die subcutaan werden geïnjecteerd met de celsuspensie, maar werden opgeofferd vóór enige vorm van behandeling. DCA, evenals gesteriliseerd water, werd intragastrisch toegediend, eenmaal per dag/5 dagen per week/ gedurende 4 weken. De behandelingen begonnen wanneer de neoplasie een drempeldiameter van 5 mm bereikte. De muizen werden wekelijks geobserveerd op het verschijnen van tumoren op de injectieplaatsen; de tumorgrootte werd in alle groepen wekelijks gemeten met schuifmaten. Beeldvorming van elke muis werd verzameld op elk beschouwd tijdstip.
Celculturen
SKNBE2 wt, Mock en S1 cellen werden onderhouden op RPMI 1640 medium (Sigma-Aldrich, Milaan, Italië), 10% FBS (GIBCO, S.Giuliano Milanese, Milaan, Italië), L-glutamine (2 mM; EuroClone, Devon, UK), penicilline-streptomycine (100 U/ml/ 100 lg/ml; EuroClone) (standaard medium). U2-OS-cellen werden onderhouden op Dulbecco’s modified Eagles medium (DMEM) (Sigma-Aldrich), 10% FBS (GIBCO), L-glutamine (2 mM; EuroClone) en penicilline-streptomycine (100 U/ml/ 100 lg/ml; EuroClone). Dichlooracetaat werd als waterige oplossing bereid en aan het medium toegevoegd. Delen van elke overwogen tumor werden gewassen in PBS en gedestrueerd met 12,5 U/ml Collagenase type I (Biochrom AG, Berlijn, Duitsland) en 12 U/ml Dispase (Roche, Duitsland) in PBS gedurende 20 minuten bij 37oC. Vers geïsoleerde cellen werden gebruikt voor zowel flowcytometrische analyse als in vitro expansie in standaardmedium. Alle celculturen werden onderhouden bij 37oCin een 95% lucht/5% CO2 atmosfeer bij 100% luchtvochtigheid.
Histologische analyse en immunohistochemie
Voor histologisch onderzoek werden tumoren van elke experimentele groep operatief verwijderd en gefixeerd in 10% neutraal-gebufferde formaline, gedroogd en ingebed in paraffine met behulp van standaard histologische technieken. Seriële secties van 4 lm werden gesneden en gekleurd met hematoxyline en eosine (H/E) om morfologische kenmerken te onderzoeken of verwerkt voor immunohistochemie. Na hydratatie werd antigeen retrieval met hitte geïnduceerd in citraatbuffer pH 6,0 en endogene peroxidases werden geblokkeerd met 3% H2O2 in water. Aspecifieke binding werd geremd door incubatie van de objectglaasjes in 10% normaal geitenserum (Sigma-Aldrich, Milaan, Italië). Het volgende primaire antilichaam werd gebruikt: monoklonaal anti-humaan Ki-67 (kloon K-3; Oncogene, San Diego, CA). Negatieve controles met pre-immuun serum werden parallel uitgevoerd. Na uitgebreid wassen in Tris gebufferde zoutoplossing werden de objectglaasjes geïncubeerd met een antimuis secundair antilichaam (BioSpa, Milaan, Italië). Na het wassen werd mierikswortelperoxidase-geconjugeerde streptavidine (BioSpa) toegevoegd en gedurende 30 minuten geïncubeerd. De plaatjes werden vervolgens gekleurd met diaminobenzidine chromogeen (Lab Vision, Fremont, CA). Tegenkleuring werd uitgevoerd met hematoxyline. Beelden werden vastgelegd door middel van doorvallend licht microscopie met een Zeiss Axiovert 200M microscoop uitgerust met een Zeiss Axio-Cam MRc gekoelde 3CCD kleurencamera (Zeiss, Wetzlar, Duitsland). De H/E-gekleurde objectglaasjes werden onder dezelfde doorvallende lichtmicroscoop bekeken. De grootte van de cellen werd geanalyseerd met de public domain ImageJ-software (Wayne Rasband, NIH, Bethesda, MD; http://rsb.info.nih.gov/ ij/). De drempelwaarde werd ingesteld om de omtrek van elke cel te onderscheiden van de achtergrond, en elk beeld werd omgezet in binair (zwart-wit). De “waterscheiding” werd gebruikt om de afzonderlijke cellen te scheiden van de klonters. Oppervlakten werden berekend met ”deeltjes analyseren” met een drempelwaarde voor de deeltjesgrootte van 100 pixels. Veranderingen in celvolume werden bepaald door het aantal pixels met medicijnbehandeling te delen door het aantal pixels zonder medicijnbehandeling.
Apoptose-analyse
Apoptose werd geanalyseerd door flowcytometrie, met behulp van Annexin V volgens de instructies van de fabrikant (Annexin VFITC Apoptosis Kit, Immunological Sciences, Rome, Italië; Annexin V-APC Apoptosis Detection Kit I; BD Biosciences, Oxford, UK; DAPI, Sigma-Aldrich, Milaan, Italië). In het kort werden uit tumormassa’s geïsoleerde cellen gewassen in PBS en geresuspendeerd in serumvrij medium. Annexine V-FITC en propidiumjodide (PI) werden toegevoegd aan de celpreparaten (105 cellen) en gedurende 15 minuten in het donker bij kamertemperatuur geïncubeerd. Mock- en S1-cellen werden getrypsiniseerd, gewassen in PBS en geresuspendeerd in serumvrij medium. Annexine V-APC en DAPI werden toegevoegd aan de celpreparaten (105 cellen) en gedurende 15 minuten geïncubeerd in het donker bij kamertemperatuur. De monsters werden geanalyseerd met een Cyan ADP-cytofluorimeter (Beckman-Coulter, Brea CA). Voor elk monster werden 20.000 gebeurtenissen geregistreerd. De gegevens werden geanalyseerd met behulp van Summit 4.3.1 software (DakoCytomation, U.K.).
Celproliferatie assays
(i) Voor celtelling studies, Mock en S1 cellen werden gezaaid bij 5 ×105 cellen in 10-cm weefselkweekschaaltjes, geïncubeerd in standaard medium, met of zonder toevoeging van DCA (5 en 50 mM) en geteld met behulp van een hemocytometer na 48 uur behandeling. (ii) De celproliferatie werd ook beoordeeld met het xCELLigence RTCA MP-systeem (Roche, Duitsland) dat carcinogenese Vella et al. 1485 cellulaire gebeurtenissen in real time controleert door elektrische impedantie te meten over geïnterdigiteerde gouden micro-elektroden die geïntegreerd zijn op de bodem van weefselkweekplaten. De impedantiemeting levert kwantitatieve informatie over de biologische status van de cellen, waaronder het aantal cellen, de levensvatbaarheid en de morfologie.13 De impedantie van de celsensor wordt uitgedrukt in een arbitraire eenheid die Cell Index (CI) wordt genoemd. Om de celindex te bepalen, werden uit elke tumormassa geïsoleerde cellen gezaaid in 100 ll standaardmedium in 96 microtiterplaten (EPlate-Roche, Duitsland). De achtergrondimpedantie werd bepaald met 100 ll standaardmedium. Celhechting, verspreiding en proliferatie werden om de 30 minuten gecontroleerd met het xCELLigence-systeem. De celproliferatie werd gedurende 72 uur gecontroleerd. Experimentele resultaten werden uitgevoerd met RTCA Software 1.2 die de populatieverdubbeling berekende door de curve te passen in een exponentiële vergelijking.
Real time kwantitatieve RT-PCR-analyse
Totaal RNA van de monsters werd geëxtraheerd met TRIzol-reagens (Invitrogen, Carlsbad, CA) volgens het protocol van de fabrikant en onderworpen aan omgekeerde transcriptie door Transcriptor First Strand cDNA Synthesis Kit (Roche, Duitsland) volgens de instructies van de fabrikant. Het totale RNA van de monsters werd gemeten door real-time kwantitatieve RTPCR met PE ABI PRISM@ 7700 Sequence Detection System (Perkin Elmer Corp./Applied Biosystems, Foster City, CA) en Sybr Green-methode volgens de instructies van de fabrikant. De sequenties van de voorwaartse en achterwaartse primers waren als volgt:
NF-68: voor 5′ -CAAGGACGAGGTGTCCGAG-3′ , rev 5′ – CCCGGCATGCTTCGA-3′ ;
NDM29: voor 5′ -GGCAGGCGGGTTCGTT-3′ , rev 5′ – CCACGCCTGGCTAAGTTTTG-3′ ;
c-Kit: voor 5′ -GCAAGTCAGTGCTGTCGGAA-3′ , rev 5′ – AAGATAGCTTGCTTTGGACACAGA-3′ . Voor endogene controle werd de expressie van Glyceraldehyde-3-fosfaatdehydrogenase (GAPDH) onderzocht, aangezien is aangetoond dat DCA de cellulaire GAPDH-activiteit niet beïnvloedt.14 De sequenties voor menselijke GAPDH-primers waren 5′ – GAAGGTGAAGGTCGGAGTC-3′ en 5′ – GAAGATGGTGATGGATTTC-3′ . De relatieve transcriptniveaus werden bepaald aan de hand van de relatieve standaardcurve die werd opgebouwd uit cDNA-stockverdunningen en gedeeld door de doelhoeveelheid van de kalibrator volgens de instructies van de fabrikant.
Mitochondriaal membraanpotentieel (∆Ψm) assay
Mitochondriaal membraanpotentieel (∆Ψm) werd bestudeerd in levende cellen met behulp van JC-1 (Cayman Chemical Company, Ann Arbor, MI). Voor de analyse van het potentieel werden SKNBE2 wt, Mock, S1 en U2-OS wt uitgezet bij een dichtheid van106 cellen/well met of zonder DCA (50 mM). Na 72 uur behandeling werden de cellen behandeld met JC-1 oplossing en geïncubeerd bij 37oCgedurende 15-30 minuten. De cellen werden geobserveerd met een Axiophot Zeiss microscoop (Zeiss, Jena, Duitsland) [(Texas Red: excitatie/emissie 590/610nm) (FITC: excitatie/emissie 485/535nm)]. De fluorescentiekwantificering werd bepaald met ImageJ-software (Wayne Rasband, NIH, Bethesda, MD; http://rsb.info.nih.gov/ij/).
Statistische analyse
Statistische significantie van waargenomen verschillen tussen verschillende experimentele groepen werd berekend met behulp van een tweezijdige t-toets. p-waarden < 0,05 werden als statistisch significant beschouwd.
Resultaten
DCA is effectief op menselijke neuroblastoomcellen
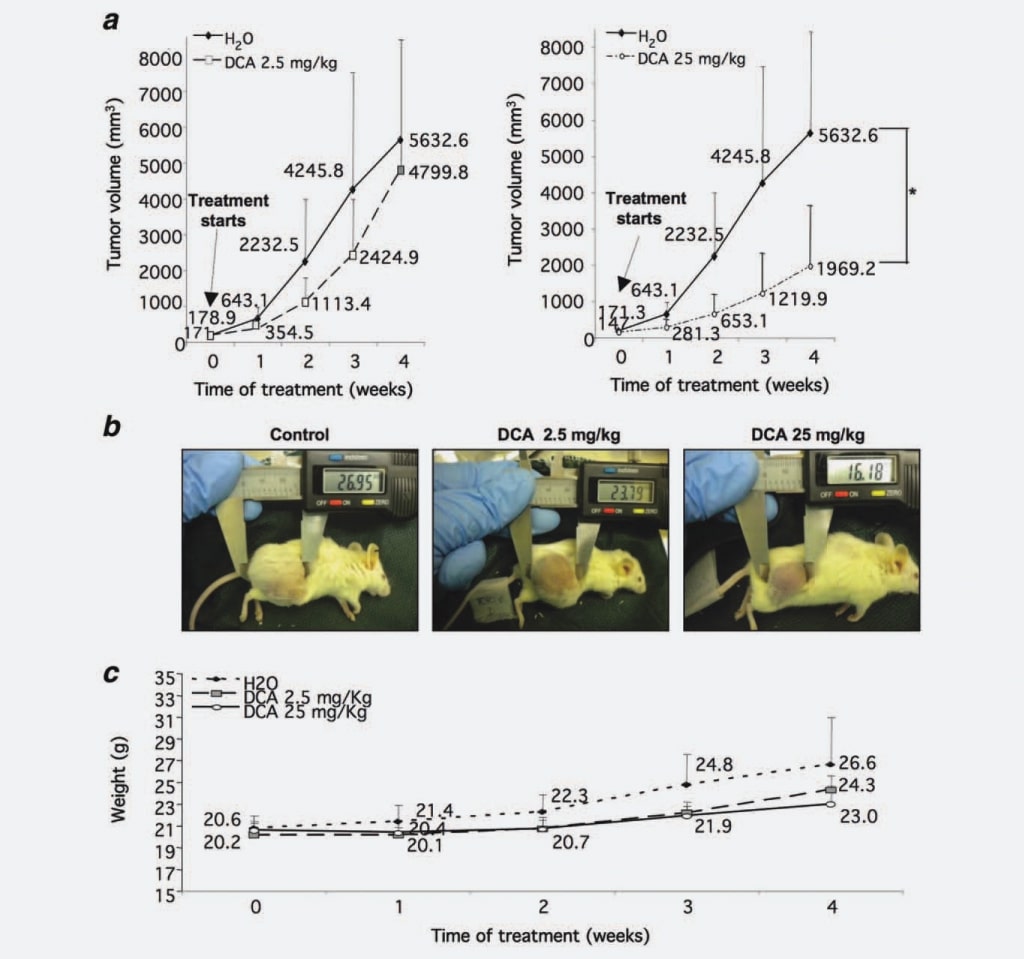
Om eerst na te gaan of DCA de groei van NB-knobbels beïnvloedt zoals waargenomen bij GBM, testten we het vermogen ervan om de groei van NB-tumormassa’s in vivo te beperken. We injecteerden 37 NOD-SCID muizen met SKNBE2 cellen, een menselijke N-myc geamplificeerde NB cellijn gekenmerkt door een hoog kwaadaardig potentieel,17 om tumorknobbels te genereren die met DCA moesten worden behandeld. Wanneer de tumorknobbels een drempeldiameter van 5 mm bereikten, werden vijf muizen vóór de behandeling gedood, vijf muizen werden behandeld met 2,5 mg/kg/dosis DCA, 14 muizen werden behandeld met 25 mg/kg/dosis DCA, terwijl de overige 13 dieren werden behandeld met water als controle. Wij kozen voor de intragastrische toediening van DCA, aangezien sommige literatuurgegevens meldden dat parenterale toediening niet effectief was in het verminderen van de tumorgroei.16 Wekelijks werden tumormassa’s gemeten, waaruit bleek dat de tumorvolumes van muizen die waren behandeld met 2,5 mg/kg/dosis DCA 30% waren afgenomen in vergelijking met de controlegroep. Deze groeiremming werd statistisch significant (p ¼ 0,0008) wanneer de muizen werden behandeld met 25 mg/kg/dosis DCA (55% vermindering vergeleken met de controlegroep) (Fig. 1a en 1b). Om de verdraagbaarheid van de DCA-behandeling te beoordelen, evalueerden we wekelijks het gewicht van de muizen. Dieren behandeld met DCA (2,5 en 25 mg/kg/dosis) vertoonden geen statistisch significante verschillen ten opzichte van de controlegroep, hoewel het gewicht van de onbehandelde controlegroep licht toenam, waarschijnlijk als gevolg van de grote tumormassa’s (fig. 1c). Ook de wateropname had geen invloed op de behandelde dieren (gegevens niet getoond).
Al met al wijzen bovenstaande gegevens op een krachtig, dosisafhankelijk effect van DCA op de groei van NB-tumoren.
DCA vermindert de proliferatie van kankercellen
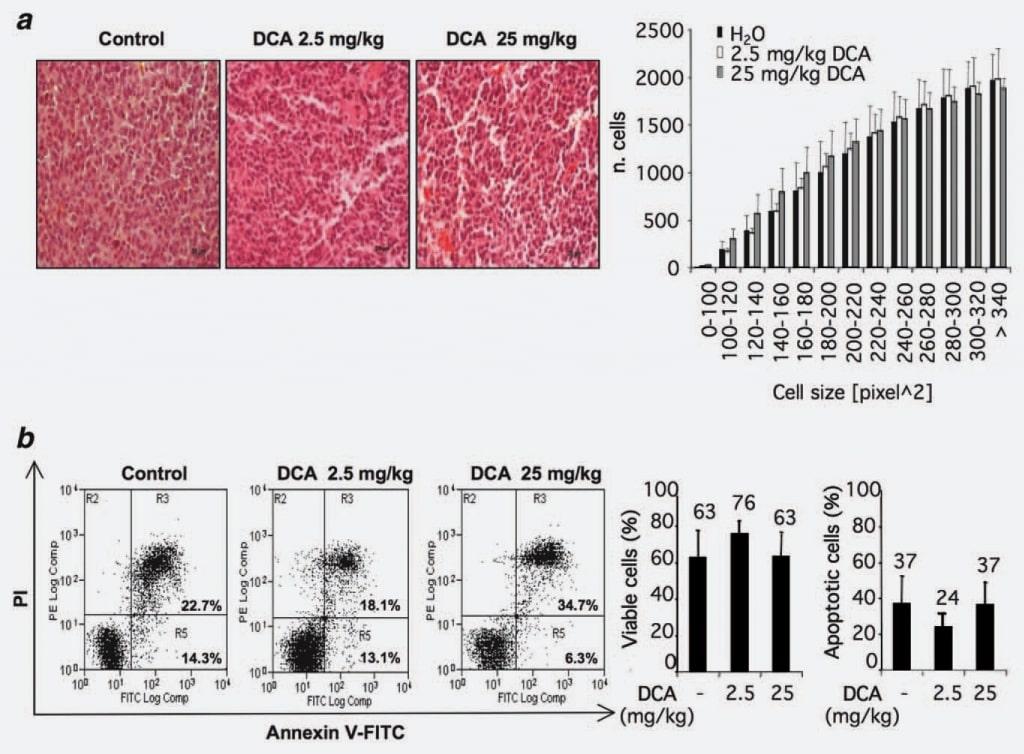
Om mogelijke werkingsmechanismen van DCA te identificeren, evalueerden wij of de waargenomen vermindering van de tumorgroei kon worden toegeschreven aan een verlies van celvolume. Daartoe analyseerden wij de morfologie en/of de grootte van de cellen in tumorknobbels die al dan niet met DCA waren behandeld. Twaalf coupes van de controlegroep en twaalf van de met DCA behandelde groepen (2,5 en 25 mg/kg) werden in aanmerking genomen. Er werden geen statistisch significante verschillen waargenomen in de met DCA behandelde groepen in vergelijking met de controlegroep (fig. 2a).
Aangezien gepubliceerde rapporten over de pro-apoptotische effecten van DCA tegenstrijdig zijn en gezien de recente waarnemingen van een mogelijke celtypespecificiteit van het pro-apoptotische effect van DCA,15 hebben wij dit fenomeen in onze experimentele setting onderzocht door flowcytometrische analyse van cellen van met DCA behandelde en/of onbehandelde tumoren. De resultaten toonden aan dat het percentage annexine V-positieve cellen in de beschouwde groepen vergelijkbaar is, hetgeen erop wijst dat DCA-behandeling geen toename van de apoptosegraad in het grootste deel van de cellen van de tumorknobbels teweegbracht (fig. 2b).
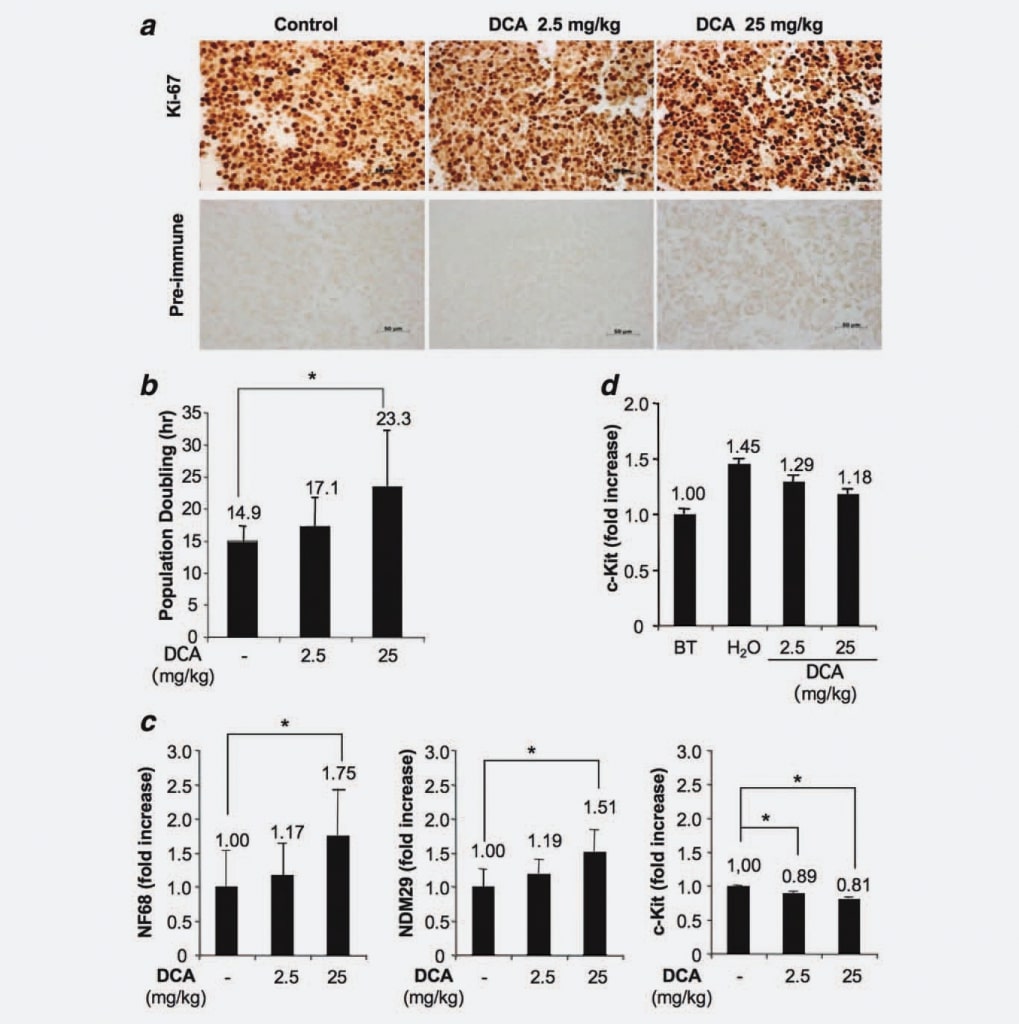
Aangezien de tumoren in ons experimentele model ontstonden door injectie van een homogene cellijn en aangezien wij hebben aangetoond dat DCA behandeling noch een verminderd tumorcelvolume noch een verhoogde apoptose tot gevolg had, stelden wij een mogelijk effect van DCA op het proliferatievermogen van de cellen als hypothese. Om deze hypothese te testen, analyseerden we cellen van behandelde en onbehandelde knobbels door middel van immunohistochemie met behulp van een specifiek monoklonaal anti-Ki67 antilichaam. De resultaten toonden geen significante verschillen in de fractie van prolifererende/cyclerende cellen tussen de groepen. Dit resultaat geeft dus aan dat DCA-behandeling het aantal cyclische cellen niet vermindert, in overeenstemming met het ontbreken van volledige uitroeiing van de tumor na DCA-behandelingen (fig. 3a). Vervolgens gebruikten wij het xCELLigence-systeem (Roche, Duitsland) om een mogelijke dosisafhankelijke toename van de populatieverdubbeling als gevolg van DCA-behandeling op te sporen. Wij vonden dat tumorcellen afkomstig van behandelde muizen (25 mg/kg) verdubbelen in 23,3 uur, cellen van dieren behandeld met 2,5 mg/kg verdubbelen in 17,1 uur, terwijl cellen afkomstig van controlemuizen een populatieverdubbelingstijd vertonen van 14,9 uur (Fig. 3b). Aangezien de verschillen statistisch significant waren (DCA 25 mg/kg vs. controlegroep; p ¼ 0,0476), tonen deze resultaten aan dat DCA-behandeling een dosis-afhankelijke vertraging van de celcyclus induceert. Vervolgens onderzochten wij of de celcyclusvertraging van cellen van behandelde tumoren gepaard ging met een verhoogde differentiatie/commitment. Daartoe hebben we met Real Time RT-PCR NB-celdifferentiatiemarkers [Neuroblastoma Differentiation Marker 29 (NDM29), Neurofilament 68 (NF68)] en c-Kit, een eiwit dat specifiek tot expressie komt bij stamcellen/tumorinitiërende cellen, gemeten in met DCA behandelde en onbehandelde tumorweefsels. Zoals getoond in figuur 3c, werd een algemene toename van de synthese van NB-celdifferentiatiemarkers waargenomen in cellen van met DCA behandelde tumoren. Inderdaad leidde DCA in de hogere concentratie tot een verhoogde expressie van NF68 (75%, p < 0,001), terwijl de lagere dosis een bescheiden toename veroorzaakte (17%, niet statistisch significant). Evenzo was de toename van de expressie van NDM29 statistisch significant in tumoren behandeld met DCA 25 mg/kg (51% toename, vergeleken met de controlegroep; p < 0,001), terwijl slechts een gering verschil werd waargenomen tussen cellen van tumoren behandeld met 2,5 mg/kg en cellen van onbehandelde tumoren. Interessant genoeg werden de met DCA behandelde monsters ook gekenmerkt door een verminderde expressie van c-Kit (11% vermindering in vergelijking met DCA 2,5 mg/kg vs. controlemonsters en 19% vermindering in vergelijking met DCA 25 mg/kg vs. controlemonsters, p < 0,001), hetgeen erop wijst dat DCA een vermindering induceert van het stam-achtige/tumor-initiërende potentieel in prolifererende tumorcellen. Ook deze resultaten ondersteunen een vertraging van de proliferatiesnelheid en mogelijk een vermindering van het kwaadaardige potentieel van met DCA behandelde cellen.
Om na te gaan of DCA de fractie ongedifferentieerde prolifererende cellen kan beïnvloeden, hebben we vervolgens de c-Kit expressie gemeten in tumorweefsels van muizen die vóór de DCA-behandeling waren gedood en in knobbels van behandelde tumoren. Wij vonden dat, hoewel de c-Kit expressie (en, vermoedelijk, het kwaadaardig potentieel) geleidelijk toeneemt tijdens de groei van de knobbels (zieH2Ovs. vóór de behandeling), de toediening van DCA geneesmiddel dit fenomeen lijkt te beperken, hetgeen bevestigt in de weefsels van tumormassa’s wat reeds werd waargenomen in de cellen en een verklaring biedt voor het gebrek aan tumoruitroeiing in met DCA behandelde muizen (fig. 3d).
DCA werkt specifiek op kwaadaardige NB-cellen en is niet effectief op gedifferentieerde, slecht kwaadaardige NB-cellen
Steeds meer experimenteel bewijs suggereert dat de prognose van NB en de respons op antikankerbehandelingen afhankelijk zijn van het differentiatiestadium van NB-knobbels. Een bijzonder kenmerk van NB is inderdaad de opmerkelijke heterogeniteit van de cellen die in verschillende stadia kunnen voortkomen uit verschillende neurale crest-lijnen.12,17 In deze context is het redelijk om een mogelijke variabele gevoeligheid voor DCA van verschillende celtypes te veronderstellen. Om deze hypothese te verifiëren gebruikten wij een in vitro model van NB-celdifferentiatie gebaseerd op de expressie van een pol III getranscribeerd ncRNA. Inderdaad, we hebben onlangs een nieuw RNA polymerase (pol) III-getranscribeerd niet-coderend (nc) RNA (namelijk NDM29) geïsoleerd, waarvan de expressie de neuronachtige differentiatie van NB-cellen stimuleert, waardoor het maligne potentieel en de expressie van tumor-initiërende/stamcelmarkers sterk worden verminderd. Door extra kopieën van NDM29 transcriptionele eenheid in SKNBE2 tumorcellen te integreren, genereerden we een NDM29-overexpressie SKNBE2 cellijn (hierna S1 genoemd) en de corresponderende Mock-negatief die NDM29 op endogeen niveau tot expressie brengt. S1-cellen vertonen een gedeeltelijk gedifferentieerd/neuronachtig fenotype, zijn slecht kwaadaardig en worden gekenmerkt door een duidelijke vertraging van de celcyclus.18,19
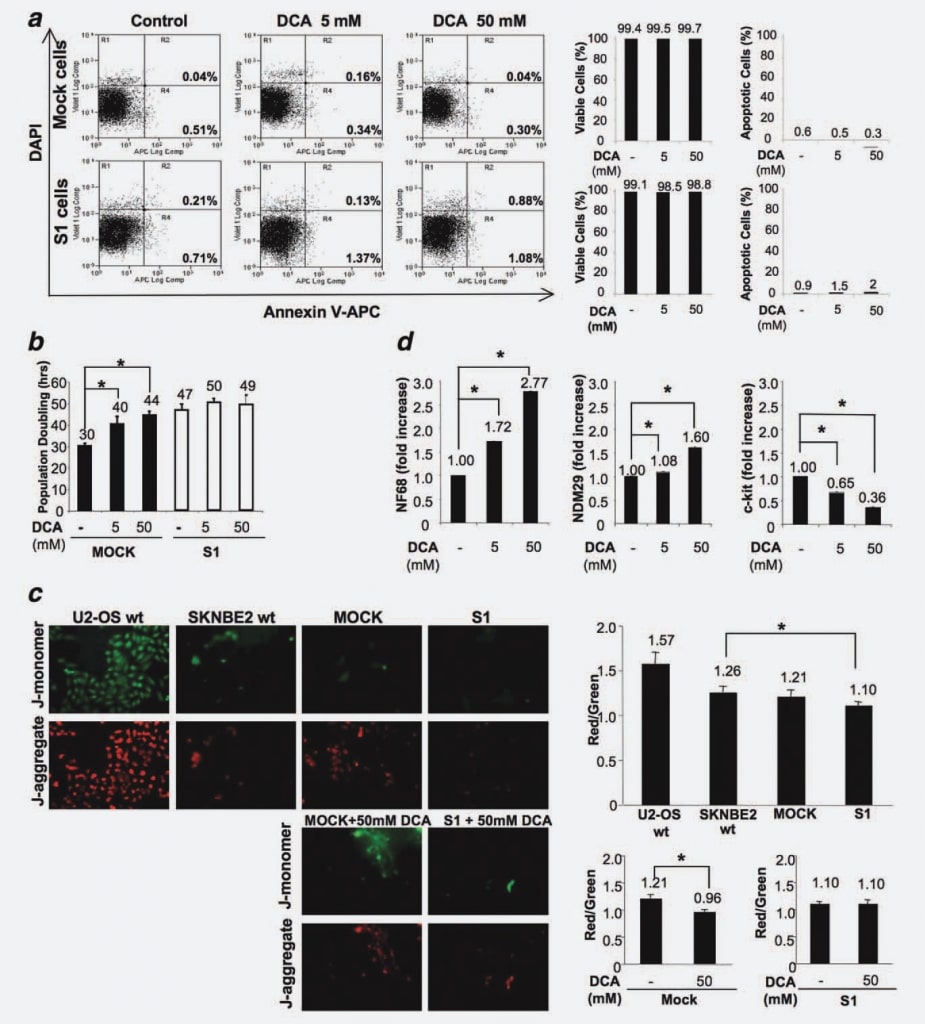
Om uit te sluiten dat DCA-behandeling apoptose in vitro zou kunnen induceren, zoals aangetoond in de in vivo experimenten, maten we het percentage apoptotische cellen in Mock- en S1-cellijnen, behandeld en/of onbehandeld met het geneesmiddel gedurende 48 uur. Er werden geen verschillen waargenomen tussen de cellijnen (onbehandeld of behandeld met verschillende doses DCA), hetgeen bevestigt dat DCA geen apoptose in NB-cellen uitlokt (fig. 4a).
Om de effecten op de proliferatie van Mock- versus S1-cellen vast te stellen, behandelden we de cellen met 5 mM en 50 mM DCA en maten we de verdubbelingstijd van de celpopulatie (PD) in vier onafhankelijke experimenten. De concentratie van 50 mM werd gekozen als de maximale dosis omdat verschillende eerdere studies meldden dat DCA relatief inactief bleek te zijn in verschillende cellijnen bij gebruik in lagere doses.16,20 Zoals getoond in figuur 4b, is de PD-tijd significant verhoogd door DCA behandeling op een dosis-afhankelijke manier in Mock cellen. In afwezigheid van behandeling dupliceerde Mock namelijk in 30 uur, terwijl de toediening van 5 mM DCA een celcyclusvertraging van 10 uur induceerde en de hogere dosis van 50 mM DCA leidde tot een toename van 14 uur (p < 0,001). Deze resultaten tonen aan dat DCA een celcyclusvertraging induceert in ongedifferentieerde/veelprolifererende NB-cellen. De PD voor S1-cellen bleef daarentegen ongeveer onveranderd en verschoof van 47 uur voor onbehandelde cellen naar 50 uur voor cellen behandeld met 5 mM DCA tot 49 uur voor cellen behandeld met 50 mM DCA (fig. 4b). Dit resultaat toont aan dat de respons op DCA-behandeling rechtstreeks samenhangt met het differentiatie-/proliferatiestadium van NB-cellen, aangezien gedifferentieerde cellen met een zeer laag kwaadaardig potentieel slecht reageren op de behandeling, terwijl hun volledig prolifererende/zeer kwaadaardige tegenhangers sterk worden beïnvloed door DCA-behandeling.
Om dit fenomeen beter te begrijpen en overwegende dat de effecten van DCA gerelateerd zijn aan PDK remming, mitochondriale oxidatieve fosforylering en specifieke mitochondriale hyperpolarisatie reductie,6 hebben wij Mock en S1 cellen getest op hun mogelijke veranderingen in mitochondriale hyperpolarisatie als basis van de differentiële gevoeligheid van deze cellen voor DCA. Daartoe behandelden wij de cellen met JC-1 (5,5′,6,6′ -tetrachloor-1,1′,3,3′ -tetraethylbenzimidazolocarbocyaninejodide), een fluorescerende kleurstof waarvan de opname evenredig is met de mitochondriale potentiaal. JC-1 kan selectief in mitochondriën binnendringen en verandert omkeerbaar van kleur van groen naar rood als de mitochondriale potentiaal toeneemt, zodat een verminderde rood/groene fluorescentieverhouding een mitochondriale reactivering aangeeft. Wij vergeleken de mitochondriale membraanpolarisatie van U2-OS osteosarcoomcellen (hypergepolariseerde controlecellen21), SKNBE2 wt, Mock en S1 cellen. Wij vonden dat Mock cellen een vergelijkbare polarisatiegraad vertonen in vergelijking met SKNBE2 wt cellen, terwijl S1 cellen worden gekenmerkt door een verminderde mitochondriale polarisatiegraad (p ¼ 0,0184) (fig. 4c). Uit de resultaten, die betrekking hebben op drie herhalingen, blijkt dat in Mock-cellen een door DCA gestuurde mitochondriale reactivering plaatsvindt (25% vermindering van de rood/groene fluorescentieverhouding; p ¼ 0,0077), terwijl in S1-cellen de mitochondriale activiteit niet wordt gewijzigd door de aanwezigheid van DCA (fig. 4c). Deze resultaten tonen dus aan dat de gevoeligheid van maligne/vol cyclische cellen samenhangt met een mitochondriale status die gevoelig is voor de werking van DCA, terwijl geëngageerde/differentiële, slecht cyclische cellen ongevoelig zijn voor de werking van dit geneesmiddel.
Vervolgens hebben wij, om mogelijke effecten van DCA op het differentiatiepotentieel op te sporen, met Real Time RT-PCR het expressieniveau gemeten van NDM29, NF68 en c-Kit in met DCA behandelde en onbehandelde Mock-cellen. Wij voerden deze analyse specifiek uit op Mock-cellen omdat S1-cellen refractair waren voor de door DCA veroorzaakte proliferatievermindering. Zoals getoond in figuur 4d, resulteerde DCA-behandeling in een verhoogde expressie van de differentiatiemarker NF68 (Mock-cellen behandeld met 5 mM of 50 mM DCA vs. onbehandelde cellen, p < 0,0001). Evenzo was de expressie van NDM29 significant verhoogd in behandelde Mock-cellen ten opzichte van de controle (p < 0,001). Daarentegen werd de c-Kit-expressie in behandelde cellen op dosisafhankelijke wijze verminderd (p < 0,0001). Al met al suggereren deze resultaten dat het antitumoreffect van DCA in NB-cellen voornamelijk het gevolg is van een antiproliferatieve/prodifferentiatieve werking en niet resulteert in een verhoogde apoptose.
Bespreking
DCA is een kleine molecule die al meer dan 30 jaar bij mensen wordt gebruikt voor de behandeling van aangeboren en verworven melkziekte.22 Het is namelijk goed beschreven dat DCA-behandeling het lactaatgehalte in de circulatie verlaagt door het celmetabolisme te verschuiven van glycolyse naar glucoseoxidatie, zonder enig schadelijk effect op normale cellen.6 Vanwege zijn vermogen om het glucosemetabolisme door aërobe glycolyse te bevorderen, wordt DCA met succes gebruikt in klinische proeven voor hartziekten, waaronder congestief hartfalen en ischemische hartziekten, aangezien postischemische disfunctie van hypertrofe harten gepaard gaat met lage glucoseoxidatiesnelheden en hoge glycolytische snelheden.23
Een zeer aantrekkelijke eigenschap van DCA is de verdraagbaarheid en veiligheid ervan. Uit meer dan 40 klinische onderzoeken met DCA blijkt namelijk dat het belangrijkste nadelige effect van langdurige toediening van DCA een reversibele perifere neuropathie is.24,25
De laatste jaren zijn er zowel in vitro als in vivo modellen aanzienlijke aanwijzingen dat DCA ook nuttig zou kunnen zijn voor de behandeling van sommige soorten kanker bij de mens.6 DCA is namelijk in staat het Warburg-effect om te keren door het PDK te remmen, de mitochondriale membraanpotentiaal te herstellen en de ROS-productie te verhogen. Daarom werd DCA gevierd als de wondermiddel tegen kanker,1 ook al is het momenteel nog niet goedgekeurd voor de behandeling van kanker.26 Hoewel neuroblastoom tot dusver werd beschouwd als een kankertype waarvoor DCA-behandeling hoogstwaarschijnlijk niet effectief zou zijn, vanwege de veronderstelde afwezigheid van mitochondriale membraanhyperpolarisatie in cellen die NB-knobbels vormen,27 werd beschreven dat prolifererende NB-cellen een glycolytisch fenotype hebben,11 en dat NB-cellen zelfs onder aërobe omstandigheden opmerkelijke hoeveelheden glucose omzetten in lactaat in plaats van glucose-oxidatie te gebruiken.28 Op basis van deze bevinding was het doel van deze studie te bepalen of DCA een gunstig effect zou kunnen hebben op dit tumortype. Onze resultaten brengen een onverwacht positief effect van DCA op de groei van NB-tumoren aan het licht, zowel in vivo als in vitro modellen. DCA was inderdaad effectief bij gevestigde NB-tumoren, zonder duidelijke bijwerkingen bij de behandelde dieren.
In detail toonde de analyse van cellen afkomstig van behandelde tumoren aan dat DCA leidt tot een proliferatieve vertraging zonder tekenen van verhoogde apoptose of celdood. Dit komt overeen met de waargenomen afname van de tumormassa’s die niet gepaard ging met een volledige uitroeiing van de kanker. De onderliggende werkingsmechanismen van DCA zijn nog steeds controversieel. In dit verband contrasteren onze resultaten met eerdere studies waarin endometriale, prostaat-, colorectale en longkankercellen werden behandeld met DCA.6,9,20 In die gevallen werd melding gemaakt van verhoogde apoptose zonder effect op de
,21 of verhoogde apoptose in combinatie met verminderde proliferatie8. Anderzijds blijkt uit andere rapporten dat DCA de proliferatie van kankercellen remt, maar niet de apoptose of celdood verhoogt.7 Dit laatste mechanisme zou worden ondersteund door een proteomische analyse waarin DCA-behandeling eerder veranderingen in celproliferatiemarkers induceert dan in de hoeveelheid apoptosegerelateerde eiwitten.16 Dit tweeledige gedrag van DCA zou afhankelijk kunnen zijn van het celtype, waarschijnlijk door verschillen in de expressie van PDK-isoenzymen in de onderzochte kankercellen. Studies om PDK expressie te correleren met DCA gevoeligheid zijn gaande.
Interessant is dat wij hier aantonen dat een verhoogde expressie van sommige differentiatiemarkers, zoals NF68 en NDM29, samen met een verlaging van de expressie van c-kit, een stam-achtige/Tumor Initiating cells marker, gecorreleerd is met de waargenomen afname van de kankercelproliferatie. De DCA-afhankelijke inductie van een celcyclusvertraging die gepaard gaat met een verhoogde celdifferentiatie vormt dus een nieuw, nog niet beschreven werkingsmechanisme van dit geneesmiddel dat de DCA-effecten koppelt aan het differentiatiestadium van kankercellen.
Het is gedocumenteerd dat menselijke NB-tumoren worden gekenmerkt door verschillende celtypes met verschillende morfologische, biochemische en tumorigene eigenschappen en variabele differentiatiestadia.12 Om de mogelijke correlatie van de gevoeligheid voor DCA met het celdifferentiatieniveau te verdiepen, gebruikten we een in vitro model van NB-celdifferentiatie gebaseerd op de overexpressie van een pol III-getranscribeerd ncRNA (NDM29). Wij maakten een NDM29-overexpressie van SKNBE2-cellijn (hier S1 genoemd) en de overeenkomstige Mock negatieve controle.19 Deze cellijnen werden behandeld met 5 mM en 50 mM DCA. De concentratie van 50 mM werd gekozen als de maximale dosis, aangezien verschillende eerdere studies meldden dat DCA relatief inactief is in verschillende cellijnen bij gebruik in lagere doses,16,20 hoewel deze concentratie in vivo niet zal worden bereikt. In onze experimentele setting zijn de effecten van DCA echter duidelijk bij de lagere dosis (5 mM), zodat dit de geschikte concentratie is om in vivo te gebruiken.
Zoals verwacht vonden wij dat ook in Mock- en S1-cellen de behandeling met DCA geen tekenen van apoptose opleverde, wat onze in vivo resultaten bevestigt. Interessant genoeg vonden wij dat het effect van DCA beperkt is tot ongedifferentieerde, zeer kwaadaardige, volledig cyclische cellen (Mock-cellen), terwijl het geen invloed heeft op de proliferatiesnelheid van meer gedifferentieerde, slecht maligne cellen (S1-cellen). Dit effect zou kunnen worden toegeschreven aan de verschillende mate van mitochondriale polarisatie van deze celtypes. Wij hebben inderdaad aangetoond dat Mock-cellen een hogere mitochondriale polarisatie vertonen dan hun meer gedifferentieerde tegenhanger S1.
Daarom hebben wij hier aangetoond dat de verschillende cellen waaruit de NB-tumormassa’s bestaan, verschillend gevoelig zijn voor DCA, dat selectief werkt op de zeer kwaadaardige en volledig prolifererende cellen, terwijl het een zeer gering effect heeft op de weinig kwaadaardige, meer gedifferentieerde cellen. Een soortgelijke differentiële werking van DCA werd ook gerapporteerd in een studie over glioblastoma multiforme (GBM)2 waar de auteurs aantoonden dat kankerstamcellen, in vergelijking met de meer gedifferentieerde tegenhangers waaruit GBM bestaat, dezelfde metabole en mitochondriale remodellering vertonen, maar in versterkte mate omdat zij de meeste gehyperpolariseerde mitochondriën hebben.2
Concluderend ondersteunen de hier beschreven experimenten de opvatting dat DCA een zeer selectief geneesmiddel is dat kan helpen bij NB-kankerbehandelingen zonder aanzienlijke bijwerkingen op gezonde cellen. Daarom breidt deze voorlopige studie het mogelijke gebruik van DCA voor NB-kankertherapie uit, waarbij de noodzaak van een gedetailleerd onderzoek naar de antikankereigenschappen tegen dit tumortype wordt ondersteund.
Dankbetuigingen
R.C. werd ondersteund door het Italiaanse Ministerie van Universiteit en OnderzoekMIUR (2007 International FIRB Program). A.P. werd ondersteund door het Italiaanse Ministerie van Universiteit en Onderzoek-MIUR (2007 PRIN Program prot. 2007945BZN), door de Associazione Italiana Ricerca sul Cancro (2009 AIRC Program no. IG9378) en door de Associazione Italiana per la Lotta al Neuroblastoma (Genua, Italië).
VERWIJZINGEN
1 Heshe D, Hoogestraat S, Brauckmann C, Karst U, Boos J, Lanvers-Kaminsky C. Dichloroacetate metabolically targeted therapy defeats cytotoxicity of standard anticancer drugs. Cancer Chemother Pharmacol 2011;67:647-55
2 Michelakis ED, Sutendra G, Dromparis P, Webster L, Haromy A, Niven E, Maguire C, Gammer TL, Mackey JR, Fulton D, Abdulkarim B, McMurtry MS, et al. Metabolic modulation of glioblastoma with dichloroacetate. Sci Transl Med; 2010;2:31ra4.
3 Stacpoole PW, Henderson GN, Yan Z, James MO. Klinische farmacologie en toxicologie van dichlooracetaat. Environ Health Perspect 1998;106 Suppl 4:989-94.
4 Stacpoole PW. De farmacologie van dichlooracetaat. Metabolisme 1989;38: 1124-44.
5 Michelakis ED, Webster L, Mackey JR. Dichloroacetate (DCA) as a potential metabolic-targeting therapy for cancer. Br J Cancer 2008;99:989-94.
6 Bonnet S, Archer SL, Allalunis-Turner J, Haromy A, Beaulieu C, Thompson R, Lee CT, Lopaschuk GD, Puttagunta L, Harry G, Hashimoto K, Porter CJ, et al. A mitochondria-Kþ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth. Cancer Cell 2007;11:37-51.
7 Sun RC, Fadia M, Dahlstrom JE, Parish CR, Board PG, Blackburn AC. Reversal of the glycolytic phenotype by dichloroacetate inhibits metastatic breast cancer cell growth in vitro and in vivo. Breast Cancer Res Treat 2010;120:253-60.
8 Cao W, Yacoub S, Shiverick KT, Namiki K, Sakai Y, Porvasnik S, Urbanek C, Rosser CJ. Dichloroacetate (DCA) sensibiliseert zowel wild-type als over-expressing Bcl-2 prostaatkankercellen in vitro voor straling. Prostaat 2008;68:1223-31.
9 Wong JY, Huggins GS, Debidda M, Munshi NC, De Vivo I. Dichloroacetate induceert apoptose in endometriumkankercellen. Gynecol Oncol 2008;109:394-402.
10 Vander Heiden MG. Targeting cell metabolism in cancer patients. Sci Transl Med 2009;2:31ed1.
11 Almeida A, Bolanos JP, Moncada S. E3 ubiquitin-ligase APC/C-Cdh1 verklaart het Warburg-effect door glycolyse te koppelen aan celproliferatie. Proc Natl Acad Sci USA; 107:738-41.
12 Walton JD, Kattan DR, Thomas SK, Spengler BA, Guo HF, Biedler JL, Cheung NK, Ross RA. Characteristics of stem cells from human neuroblastoma cell lines and in tumors. Neoplasia 2004;6:838-45.
13 Vistejnova L, Dvorakova J, Hasova M, Muthny T, Velebny V, Soucek K, Kubala L. The comparison of impedance-based method of cell proliferation monitoring with commonly used metabolic-based techniques. Neuro Endocrinol Lett 2009;30 Suppl 1:121-7.
14 Schmidt MM, Rohwedder A, Dringen R. Effects of chlorinated acetates on the glutathione metabolism and on glycolysis of cultured astrocytes. Neurotox Res 2011; 19:628-37.
15 Papandreou I, Goliasova T, Denko NC. Antikankermedicijnen die het metabolisme aanpakken: is dichlooracetaat het nieuwe paradigma? Int J Cancer 2011;128:1001-8.
16 Stockwin LH, Yu SX, Borgel S, Hancock C, Wolfe TL, Phillips LR, Hollingshead MG, Newton DL. Natriumdichlooracetaat richt zich selectief op cellen met defecten in de mitochondriale ETC. Int J Cancer 2010;127: 2510-9.
17 George RE, Variend S, Cullinane C, Cotterill SJ, McGuckin AG, Ellershaw C, Lunec J, Pearson AD. Relatie tussen histopathologische kenmerken. MYCN-amplificatie en prognose: een UKCCSG-studie. United Kingdom Children Cancer Study Group. Med Pediatr Oncol 2001;36: 169-76.
18 Pagano A, Castelnuovo M, Tortelli F, Ferrari R, Dieci G, Cancedda R. New small nuclear RNA gene-like transcriptional units as sources of regulatory transcripts. PLoS Genet 2007;3:e1.
19 Castelnuovo M, Massone S, Tasso R, Fiorino G, Gatti M, Robello M, Gatta E, Berger A, Strub K, Florio T, Dieci G, Cancedda R, et al. An Alu-like RNA promotes cell differentiation and reduces malignancy of human neuroblastoma cells. FASEB J 2010;24:4033-46.
20 Madhok BM, Yeluri S, Perry SL, Hughes TA, Jayne DG. Dichlooracetaat induceert apoptose en celcyclusstilstand in colorectale kankercellen. Br J Cancer 2010;102:1746-52.
21 Liu TJ, Lin SY, Chau YP. Inhibition of poly(ADP-ribose) polymerase activation attenuates beta-lapachone-induced necrotic cell death in human osteosarcoma cells. Toxicol Appl Pharmacol 2002;182:116-25.
22 Stacpoole PW, Kerr DS, Barnes C, Bunch ST, Carney PR, Fennell EM, Felitsyn NM, Gilmore RL, Greer M, Henderson GN, Hutson AD, Neiberger RE, et al. Controlled clinical trial of dichloroacetate for treatment of congenital lactic acidosis in children. Pediatrics 2006;117: 1519-31.
23 Wargovich TJ, MacDonald RG, Hill JA, Feldman RL, Stacpoole PW, Pepine CJ. Myocardial metabolic and hemodynamic effects of dichloroacetate in coronary artery disease. Am J Cardiol 1988;61: 65-70.
24 Kaufmann P, Engelstad K, Wei Y, Jhung S, Sano MC, Shungu DC, Millar WS, Hong X, Gooch CL, Mao X, Pascual JM, Hirano M, et al. Dichloroacetate causes toxic neuropathy in MELAS: a randomized, controlled clinical trial. Neurologie 2006;66: 324-30.
25 Stacpoole PW, Henderson GN, Yan Z, Cornett R, James MO. Farmacokinetiek, metabolisme en toxicologie van dichlooracetaat. Drug Metab Rev 1998;30: 499-539.
26 Pearson H. Cancer patients opt for unapproved drug. Nature 2007;446: 474-5.
27 Chen LB. Mitochondrial membrane potential in living cells. Annu Rev Cell Biol 1988;4:155-81.
28 Deubzer B, Mayer F, Kuci Z, Niewisch M, Merkel G, Handgretinger R, Bruchelt G. H(2)O(2)-mediated cytotoxicity of pharmacologic ascorbate concentrations to neuroblastoma cells: potential role of lactate and ferritin. Cell Physiol Biochem 2010;25:767-74.