Серена Велла1*, Маттео Конти2*, Роберта Тассо1, Раньери Канседда1,3 и Альдо Пагано1,3
1 Отделение онкологии, биологии и генетики (DOBiG), Университет Генуи, Генуя-Италия
2 Лаборатория клинической фармакологии и токсикологии, Ospedale S. Maria delle Croci, 48100 Равенна-Италия
Национальный институт исследования рака (IST) Генуя, Largo R. Benzi, 10, 16132 Генуя-Италия
Небольшая, растворимая в воде молекула дихлорацетата (ДХА) в последнее время вызывает живой интерес в области терапии рака, поскольку было показано, что она способна подавлять рост опухолей человека, действуя специфически на митохондрии раковых клеток без нарушения физиологии не злокачественных клеток. Нейробластома была одним из типов опухолей, в отношении которых DCA считался неэффективным, поскольку она состоит из клеток с небольшим количеством признанных митохондриальных аномалий. Однако нейробластома состоит из различных типов клеток с точки зрения метаболизма, фенотипа и злокачественного потенциала. Несмотря на вышеизложенное предсказание, в данной работе мы показали, что (i) DCA оказывает неожиданный противораковый эффект на опухолевые клетки НБ и (ii) этот эффект избирательно направлен на очень злокачественные клетки НБ, тогда как более дифференцированные/менее злокачественные клетки НБ рефрактерны к лечению DCA. Этот результат подтверждает необходимость детального изучения противораковых свойств DCA против этого типа опухолей с конечной целью его возможного использования в качестве терапевтического средства.
Небольшая молекула/орфанный препарат DCA недавно оказался в центре внимания благодаря своей способности ограничивать рост опухоли glioblastoma multiforme (GBM) в дозах, совместимых с отсутствием побочных эффектов.1-4 Таким образом, учитывая его хорошо переносимую токсичность и низкую стоимость, DCA вызывает живой интерес в связи с его потенциальным использованием в терапии рака и лечении некоторых типов опухолей.5 Действительно, хотя DCA показал свою эффективность в отношении мелкоклеточной карциномылегких6, рака молочнойжелезы7, простаты8, эндометрия9 и клеточных линийглиобластомы2, эффективность этой небольшой молекулы в качестве противоракового лечения пока клинически продемонстрирована только в отношении GBM человека, поэтому доказанную эффективность DCA в отношении других злокачественных опухолей еще предстоитоценить10 Более подробно, в силу своего механизма действия, DCA, как ожидается, будет неэффективен в отношении опухолей, характеризующихся низкой митохондриальной поляризацией, таких как овсяноклеточный рак легких, лимфомы, нейробластома (NB) и саркомы.5 DCA как ингибитор митохондриального фермента киназы пируватдегидрогеназы (PDK) активирует пируватдегидрогеназу (PDH), фермент-привратник, который регулирует поток пирувата в митохондрии, увеличивая соотношение окисления глюкозы и гликолиза.4-6 Bonnet и др. показали, что это усиление окислительного фосфорилирования является избирательно про-апоптотическим в раковых клетках, приводя к снижению их типичной гиперполяризации митохондрий, связанной с устойчивостью к апоптозу.6 Несмотря на то, что НБ изначально считался одним из типов опухолей, в отношении которого DCA, скорее всего, неэффективен, из-за его специфической мелкоклеточной особенности и предполагаемого отсутствия гиперполяризации митохондриальной мембраны,5 пролиферирующие клетки НБ поддерживаются гликолитическим фенотипом.11 Мы изучили возможную эффективность лечения DCA в подавлении роста узелков НБ человека, сформированных у мышей NOD-SCID. Удивительно, но мы заметили, что DCA значительно ограничивает рост опухоли in vivo. В опухолях НБ человека существует три различных типа клеток: I-тип стволовых клеток, N-тип нейробластических/нейроэндокринных предшественников и стволовые S-тип шванновских/меланобластических предшественников. Эти клетки обладают различными морфологическими, биохимическими и опухолегенными свойствами и варьируют по стадиям дифференцировки.12 Интересно, что, используя генетически сконструированные клетки SKNBE2 NB, характеризующиеся выраженной нейроноподобной приверженностью и очень низким злокачественным потенциалом, мы обнаружили, что эффект DCA ограничивается недифференцированными, очень злокачественными, полностью циклическими клетками, тогда как он не влияет на скорость пролиферации более дифференцированных, слабо злокачественных клеток. Представленные здесь эксперименты позволяют расширить возможную эффективность DCA как противоракового препарата до NB, действующего дифференцированно на сильно и/или слабо злокачественные клетки.
Ключевые слова: дихлорацетат, нейробластома, митохондрии *С.В. и М.К. внесли равный вклад в эту работу.
Спонсор гранта: Министерство университетов и исследований Италии — MIUR (2007 PRIN Program prot.); номер гранта: 2007945BZN; спонсор гранта: Associazione Italiana Ricerca sul Cancro (2009 AIRC Program); номер гранта: IG9378; спонсор гранта: Министерство университетов и исследований Италии — MIUR (2007 Международная программа FIRB), Ассоциация итальянского общества по борьбе с нейробластомой (Генуя, Италия)
DOI: 10.1002/ijc.26173
История: Получено 25 февраля 2011 г.; Принято 20 апреля 2011 г.; Онлайн 9
мая 2011 г
Переписка по адресу: Альдо Пагано, отделение онкологии, биологии и генетики (DOBiG), Университет Генуи, Генуя, Италия, тел.: þ/39/ 010-5737241, факс: þ/39/010-5737257, e-mail: [email protected]
Int. J. Cancer: 130, 1484-1493 (2012) VC 2011 UICC
Материал и методы
Мыши
Гомозиготные мыши NOD-SCID (NOD.CB17-Prkdcscid) были приобретены в Джексоновской лаборатории (Бар-Харбор, штат Массачусетс). Мышей использовали в возрасте от 5 до 8 недель. Все животные были выращены и содержались в питомнике Национального института исследования рака, Генуя, Италия. Уход и использование животных осуществлялись в соответствии с законами Министерства здравоохранения Италии и руководящими принципами Европейского сообщества.
Анализ опухолеродности in vivo
Суспензию клеток SKNBE2 в PBS (107 клеток) подкожно вводили 37 мышам NOD/SCID. Мыши были разделены на четыре группы: — контрольная группа (n ¼ 13 мышей): стерилизованная вода; — группа, обработанная DCA (25 мг/кг/доза) (n ¼ 14 мышей); — группа, обработанная DCA (2,5 мг/кг/доза) (n ¼ 5 мышей); — группа без обработки (n ¼ 5 мышей): мышам подкожно вводили суспензию клеток, но они были принесены в жертву перед любым видом обработки. DCA, как и стерилизованную воду, вводили внутрижелудочно, один раз в день/5 дней в неделю/в течение 4 недель. Лечение начинали, когда неоплазия достигала порогового диаметра 5 мм. Мышей еженедельно наблюдали за появлением опухолей в местах инъекций; размер опухолей измеряли каждую неделю штангенциркулем во всех группах. Изображения каждой мыши собирали в каждой рассматриваемой временной точке.
Клеточные культуры
Клетки SKNBE2 wt, Mock и S1 поддерживали на среде RPMI 1640 (Sigma-Aldrich, Милан, Италия), 10% FBS (GIBCO, S.Giuliano Milanese, Милан, Италия), L-глутамин (2 мМ; EuroClone, Девон, Великобритания), пенициллин-стрептомицин (100 U/мл/ 100 lg/мл; EuroClone) (стандартная среда). Клетки U2-OS поддерживали на среде Дульбекко, модифицированной Иглсом (DMEM) (Sigma-Aldrich), 10% FBS (GIBCO), L-глутамин (2 мМ; EuroClone) и пенициллин-стрептомицин (100 U/ml/ 100 lg/ml; EuroClone). Дихлорацетат готовили в виде водного раствора и добавляли в среду. Порции каждой рассматриваемой опухоли промывали в PBS и переваривали с 12,5 Ед/мл коллагеназы I типа (Biochrom AG, Берлин, Германия) и 12 Ед/мл диспазы (Roche, Германия) в PBS в течение 20 мин при 37oC. Свежевыделенные клетки использовали как для флоуцитометрического анализа, так и для экспансии in vitro в стандартной среде. Все клеточные культуры поддерживались при 37oCв атмосфере 95% воздуха/5% CO2 при 100% влажности.
Гистологический анализ и иммуногистохимия
Для гистологического исследования опухоли, полученные из каждой экспериментальной группы, были хирургически удалены, зафиксированы в 10% нейтрально-буферном формалине, обезвожены и помещены в парафин с использованием стандартных гистологических методов. Серийные 4-лм срезы вырезали и окрашивали гематоксилином и эозином (H/E) для изучения морфологических особенностей или обрабатывали для иммуногистохимии. После гидратации, извлечение антигена вызывали нагреванием в цитратном буфере pH 6.0, а эндогенные пероксидазы блокировали 3% H2O2 в воде. Неспецифическое связывание ингибировалось путем инкубации предметных стекол в 10% нормальной козьей сыворотке (Sigma-Aldrich, Милан, Италия). Использовали следующее первичное антитело: моноклональное античеловеческое Ki-67 (клон K-3; Oncogene, San Diego, CA). Отрицательные контроли с преиммунной сывороткой проводились параллельно. После тщательной промывки в Трис забуференном физиологическом растворе, слайды инкубировали с антимышиным вторичным антителом (BioSpa, Милан, Италия). После промывки добавляли стрептавидин, конъюгированный с пероксидазой хрена (BioSpa), и инкубировали в течение 30 минут. Затем предметные стекла окрашивали хромогеном диаминобензидином (Lab Vision, Фримонт, Калифорния). Окрашивание проводилось гематоксилином. Изображения получали методом микроскопии в проходящем свете с помощью микроскопа Zeiss Axiovert 200M, оснащенного цветной охлаждаемой 3CCD-камерой Zeiss Axio-Cam MRc (Zeiss, Wetzlar, Германия). Окрашенные H/E слайды наблюдались под тем же микроскопом в проходящем свете. Размер клеток анализировали с помощью общедоступного программного обеспечения ImageJ (Wayne Rasband, NIH, Bethesda, MD; http://rsb.info.nih.gov/ ij/). Порог был установлен для того, чтобы отличить контур каждой клетки от фона, и каждое изображение было преобразовано в двоичное (черно-белое). Для отделения одиночных клеток от скоплений использовалось разделение »Watershed». Площади рассчитывались с помощью «анализа частиц» с порогом отсечения размера частиц в 100 пикселей. Изменения в объеме клеток определялись путем деления количества пикселей с лекарственной обработкой на количество пикселей без лекарственной обработки.
Анализ апоптоза
Апоптоз анализировали методом проточной цитометрии, используя Annexin V в соответствии с инструкциями производителя (Annexin VFITC Apoptosis Kit, Immunological Sciences, Рим, Италия; Annexin V-APC Apoptosis Detection Kit I; BD Biosciences, Оксфорд, Великобритания; DAPI, Sigma-Aldrich, Милан, Италия). Вкратце, клетки, выделенные из опухолевых масс, промывали в PBS и ресуспендировали в бессывороточной среде. Аннексин V-FITC и йодистый пропидий (PI) добавляли к препаратам клеток (105 клеток) и инкубировали в течение 15 минут в темноте при комнатной температуре. Клетки Mock и S1 трипсинизировали, промывали в PBS и ресуспендировали в бессывороточной среде. Аннексин V-APC и DAPI добавляли к препаратам клеток (105 клеток) и инкубировали в течение 15 мин в темноте при комнатной температуре. Образцы анализировали с помощью цитофлуориметра Cyan ADP (Beckman-Coulter, Brea CA). Для каждого образца было получено 20 000 событий. Данные анализировали с помощью программного обеспечения Summit 4.3.1 (DakoCytomation, Великобритания).
Анализы пролиферации клеток
(i) Для подсчета клеток, клетки Mock и S1 высевали в количестве 5 ×105 клеток в 10-см чашки для культуры ткани, инкубировали в стандартной среде с добавлением DCA (5 и 50 мМ) или без него и подсчитывали с помощью гемоцитометра после 48 ч обработки. (ii) Пролиферацию клеток также оценивали с помощью системы xCELLigence RTCA MP System (Roche, Германия), которая позволяет отслеживать клеточные события в режиме реального времени путем измерения электрического импеданса на пересекающихся золотых микроэлектродах, встроенных в дно планшетов с тканевыми культурами. Измерение импеданса дает количественную информацию о биологическом статусе клеток, включая их количество, жизнеспособность и морфологию.13 Импеданс клеточного сенсора выражается в произвольной единице, называемой клеточным индексом (КИ). Для определения клеточного индекса клетки, выделенные из каждой опухолевой массы, высевали в 100 мл стандартной среды в 96 микротитровальных планшетах (EPlate-Roche, Германия). Фоновый импеданс определялся с использованием 100 мл стандартной среды. Прикрепление, распространение и пролиферация клеток отслеживались каждые 30 минут с помощью системы xCELLigence. Пролиферацию клеток отслеживали в течение 72 ч. Результаты экспериментов проводились с использованием программного обеспечения RTCA Software 1.2, которое рассчитывало удвоение популяции путем подгонки кривой под экспоненциальное уравнение.
Количественный анализ РТ-ПЦР в реальном времени
Общую РНК из образцов выделяли с помощью реагента TRIzol (Invitrogen, Carlsbad, CA) в соответствии с протоколом производителя и подвергали обратной транскрипции с помощью Transcriptor First Strand cDNA Synthesis Kit (Roche, Германия), следуя инструкциям производителя. Суммарную РНК из образцов определяли методом количественной РТПЦР в реальном времени с использованием PE ABI PRISM@ 7700 Sequence Detection System (Perkin Elmer Corp./Applied Biosystems, Foster City, CA) и метода Sybr Green в соответствии с инструкциями производителя. Последовательности прямого и обратного праймеров были следующими:
NF-68: для 5′ -CAAGGACGACGAGGTGTCCGAG-3′, rev 5′ — CCCGGCATGCTTCGA-3′;
NDM
: для 5′ -GGCAGGCAGGCGGGTTCGTTT-3′ , rev 5′ — CCACGCCTGGCTAAGTTTTTG-3′ ;
c-Kit: для 5′ -GCAAGTCAGTGCTGTCGGAA-3′ , rev 5′ — AAGATAGCTTGCTTTGGACACAGA-3′ . Для эндогенного контроля была исследована экспрессия глицеральдегид-3-фосфатдегидрогеназы (GAPDH), поскольку было показано, что DCA не влияет на клеточную активность GAPDH.14 Последовательности праймеров для GAPDH человека были 5′ — GAAGGTGAAGGTGTCGGAGTC-3′ и 5′ — GAAGATGGTGATGGATGATTTC-3′ . Относительные уровни транскриптов определяли по относительной стандартной кривой, построенной из разведений исходной кДНК, и делили на целевое количество калибратора в соответствии с инструкциями производителя.
Анализ митохондриального мембранного потенциала (∆Ψm)
Митохондриальный мембранный потенциал (∆Ψm) исследовали в живых клетках с помощью JC-1 (Cayman Chemical Company, Ann Arbor, MI). Для анализа потенциала, SKNBE2 wt, Mock, S1 и U2-OS wt высевали при плотности106 клеток/лунку с или без DCA (50 мМ). Через 72 часа после обработки клетки обрабатывали раствором JC-1 и инкубировали при 37oCв течение 15-30 минут. Клетки наблюдали с помощью микроскопа Axiophot Zeiss (Zeiss, Jena, Германия) [(Texas Red: возбуждение/эмиссия 590/610 нм) (FITC: возбуждение/эмиссия 485/ 535 нм)]. Количественную оценку флуоресценции определяли с помощью программного обеспечения ImageJ (Wayne Rasband, NIH, Bethesda, MD; http://rsb.info.nih.gov/ij/).
Статистический анализ
Статистическая значимость наблюдаемых различий между разными экспериментальными группами рассчитывалась с помощью двуххвостового t-теста. p-значения < 0,05 считались статистически значимыми.
Результаты
DCA действует на клетки нейробластомы человека
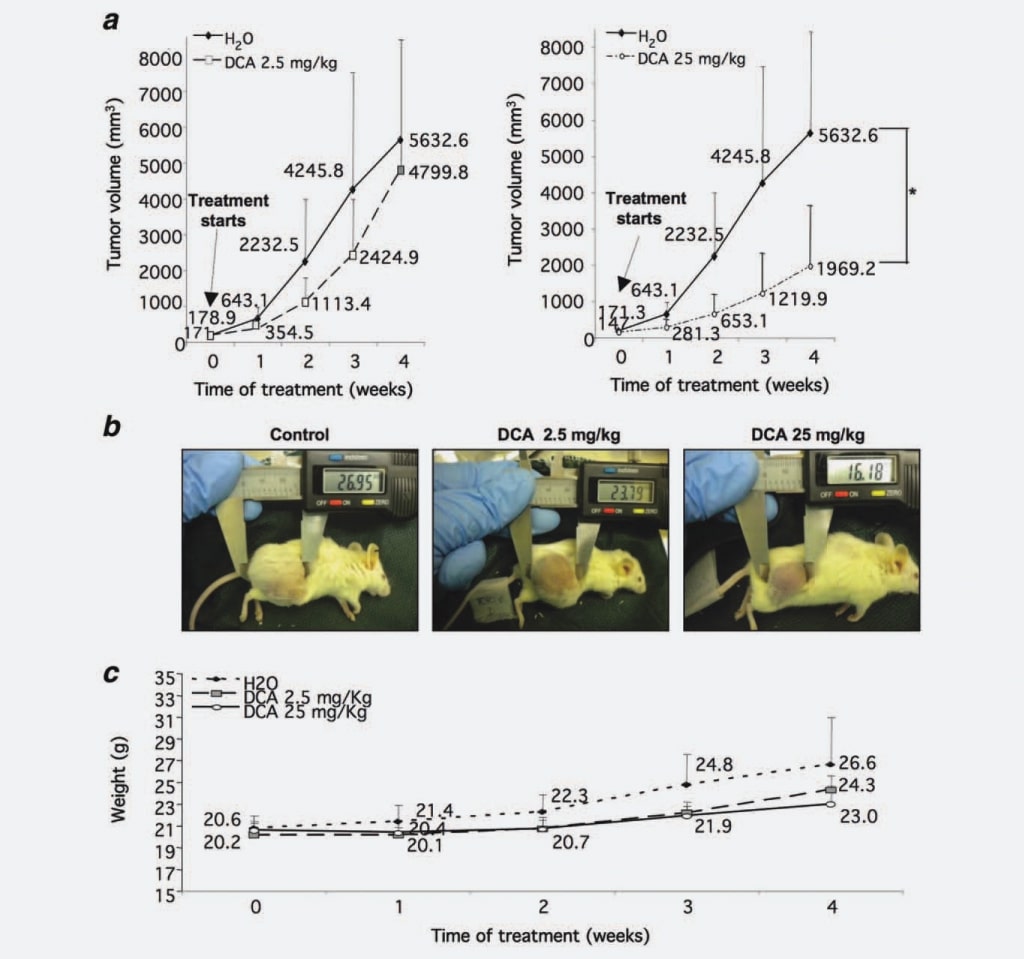
Сначала, чтобы проверить, влияет ли DCA на рост узлов НБ, как это наблюдается в GBM, мы проверили его способность ограничивать рост опухолевой массы НБ in vivo. Мы ввели 37 мышам NOD-SCID клетки SKNBE2, человеческую N-myc амплифицированную клеточную линию НБ, характеризующуюся высоким злокачественнымпотенциалом17, для создания опухолевых узелков, которые обрабатывались DCA. Когда опухолевые узелки достигли порогового диаметра 5 мм, пять мышей были принесены в жертву до начала лечения, пять мышей были обработаны 2,5 мг/кг/дозу DCA, 14 мышей были обработаны 25 мг/кг/дозу DCA, а остальные 13 животных были обработаны водой в качестве контроля. Мы выбрали внутрижелудочное введение DCA, поскольку в некоторых литературных данных сообщалось, что парентеральное введение неэффективно для снижения роста опухоли.16 Каждую неделю измерялась масса опухоли, что показало, что объем опухоли, полученной от мышей, получавших 2,5 мг/кг/дозу DCA, уменьшился на 30% по сравнению с контрольной группой. Это торможение роста стало статистически значимым (p ¼ 0,0008), когда мышей лечили 25 мг/кг/дозу DCA (55% снижения по сравнению с контрольной группой) (рис. 1a и 1b). Для оценки переносимости лечения DCA мы еженедельно оценивали вес мышей. Животные, получавшие DCA (2,5 и 25 мг/кг/доза), не имели статистически значимых различий по сравнению с контрольной группой, хотя вес нелеченной контрольной группы был немного увеличен, скорее всего, из-за больших опухолевых масс (рис. 1в). Кроме того, потребление воды не оказывало влияния на леченных животных (данные не показаны).
В целом, приведенные выше данные свидетельствуют о мощном, дозозависимом эффекте DCA на рост опухоли НБ.
DCA снижает пролиферацию раковых клеток
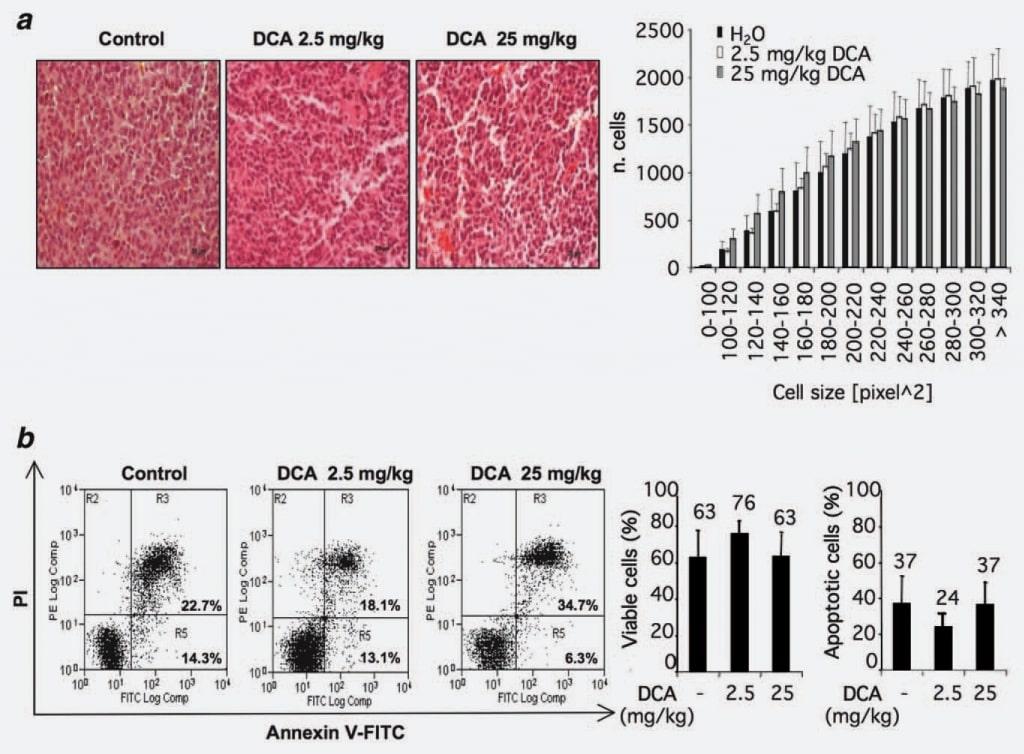
Чтобы определить возможные механизмы действия DCA, мы проанализировали, может ли наблюдаемое снижение роста опухоли быть связано с потерей объема клеток. Для этого мы проанализировали морфологию и/или размер клеток в опухолевых узелках, обработанных или не обработанных ДКА. Были рассмотрены 12 срезов из контрольной группы и 12 срезов из групп, получавших DCA (2,5 и 25 мг/кг). Статистически значимых различий в группах, обработанных DCA, по сравнению с контрольной группой не наблюдалось (рис. 2а).
Поскольку опубликованные сообщения о проапоптотическом эффекте ДКА противоречивы, а также учитывая недавние наблюдения о возможной клеточной специфичности проапоптотического эффекта ДКА,15 мы исследовали это явление в наших экспериментальных условиях с помощью флоуцитометрического анализа клеток из опухолей, обработанных ДКА и/или не обработанных. Результаты показали, что процент аннексин V-позитивных клеток одинаков в рассматриваемых группах, что указывает на то, что лечение ДКА не провоцирует увеличение скорости апоптоза в основной массе клеток опухолевых узлов (рис. 2б).
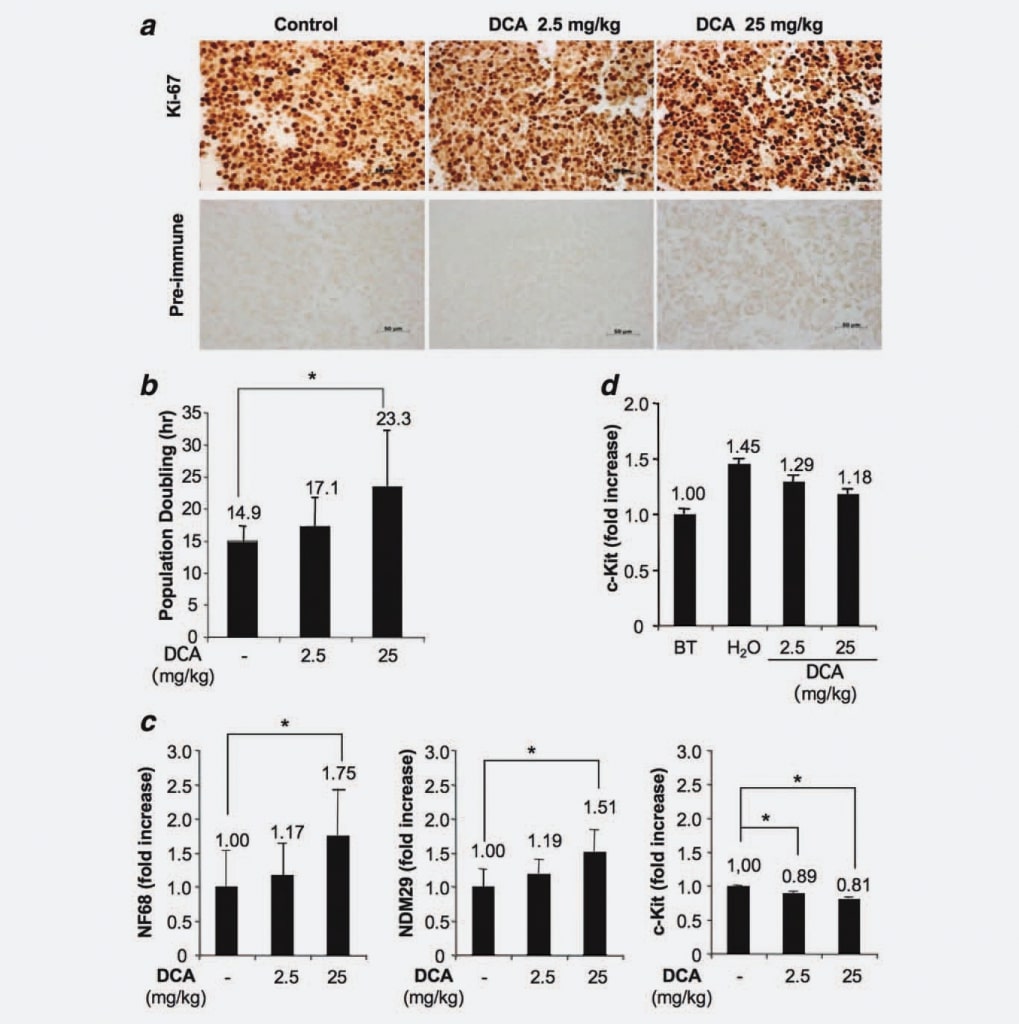
Поскольку опухоли, образовавшиеся в нашей экспериментальной модели, были получены в результате инъекции однородной клеточной линии, и учитывая, что мы продемонстрировали, что лечение DCA не повлияло ни на уменьшение объема опухолевых клеток, ни на увеличение апоптоза, мы предположили возможное влияние DCA на пролиферативную способность клеток. Для проверки этой гипотезы мы проанализировали клетки из обработанных и необработанных узлов с помощью иммуногистохимии, используя специфическое моноклональное антитело анти-Ki67. Результаты не выявили существенных различий по доле пролиферирующих/циклирующих клеток между группами. Таким образом, этот результат указывает на то, что лечение DCA не снижает количество циклирующих клеток, что согласуется с отсутствием полной эрадикации опухоли после лечения DCA (рис. 3а). Далее мы использовали систему xCELLigence (Roche, Германия) для выявления возможного дозозависимого увеличения удвоения популяции, вызванного лечением DCA. Мы обнаружили, что опухолевые клетки, полученные от обработанных мышей (25 мг/кг), дублируются через 23,3 часа, клетки от животных, обработанных 2,5 мг/кг, дублируются через 17,1 часа, тогда как клетки, полученные от контрольных мышей, демонстрируют время удвоения популяции 14,9 часа (рис. 3б). Поскольку различия были статистически значимыми (DCA 25 мг/кг против контрольной группы; p ¼ 0,0476), эти результаты показывают, что лечение DCA вызывает дозозависимую задержку клеточного цикла. Далее мы исследовали, связана ли задержка клеточного цикла клеток из обработанных опухолей с увеличением дифференцировки/привязанности. Для этого мы измерили в режиме реального времени методом RT-PCR маркеры дифференцировки клеток NB [Neuroblastoma Differentiation Marker 29 (NDM29), Neurofilament 68 (NF68)] и c-Kit, белок, специфически экспрессируемый стволоподобными/инициирующими опухоль клетками, в опухолевых тканях, обработанных DCA и не обработанных. Как показано на рисунке 3c, общее увеличение синтеза маркеров дифференцировки клеток НБ наблюдалось в клетках из опухолей, обработанных ДКА. Действительно, DCA, использованный в более высокой концентрации, вызывал увеличение экспрессии NF68 (75%, p < 0,001), тогда как более низкая доза вызывала скромное увеличение (17%, не является статистически значимым). Аналогично, увеличение экспрессии NDM29 было статистически значимым в опухолях, обработанных DCA 25 мг/кг (51% увеличение, по сравнению с контрольной группой; p < 0,001), тогда как лишь незначительная разница наблюдалась между клетками из опухолей, обработанных 2,5 мг/кг, и клетками из необработанных опухолей. Интересно, что образцы, обработанные DCA, также характеризовались снижением экспрессии c-Kit (11% снижение при сравнении DCA 2,5 мг/кг с контрольными образцами и 19% снижение при сравнении DCA 25 мг/кг с контрольными образцами, p < 0,001), что указывает на то, что DCA индуцирует снижение стволоподобного/инициирующего опухоль потенциала в пролиферирующих опухолевых клетках. Опять же, эти результаты подтверждают замедление скорости пролиферации и, возможно, снижение злокачественного потенциала клеток, обработанных DCA.
Далее, чтобы оценить, может ли DCA влиять на фракцию недифференцированных пролиферирующих клеток, мы измерили экспрессию c-Kit в опухолевых тканях мышей, принесенных в жертву до лечения DCA, и в узлах обработанных опухолей. Мы обнаружили, что, хотя экспрессия c-Kit (и, предположительно, злокачественный потенциал) прогрессивно увеличивается в процессе роста узелков (см. H2Oпротив до лечения), доставка препарата DCA имеет тенденцию ограничивать это явление, подтверждая в тканях опухолевых образований то, что уже наблюдалось в клетках, и давая обоснование отсутствию эрадикации опухоли у мышей, леченных DCA (рис. 3д).
DCA действует специфически на злокачественные клетки НБ и неэффективен на дифференцированные, слабо злокачественные клетки НБ
Все больше экспериментальных данных свидетельствует о том, что прогноз НБ и его ответ на противораковое лечение зависят от стадии дифференцировки узлов НБ. Действительно, особенностью НБ является замечательная гетерогенность клеток, которые могут происходить из различных линий нервного гребня на разных стадиях.12,17 В этом контексте разумно предположить возможную различную восприимчивость к ДКА различных типов клеток. Для проверки этой гипотезы мы использовали модель дифференцировки клеток НБ in vitro, основанную на экспрессии транскрибируемой pol III нкРНК. Действительно, недавно мы выделили новую РНК-полимеразу (pol) III-транскрибируемую некодирующую (nc) РНК (а именно NDM29), экспрессия которой вызывает нейроноподобную дифференцировку клеток НБ (NB), сильно снижая их злокачественный потенциал и экспрессию маркеров опухолевых инициаторов/стволоподобных клеток. Встраивая дополнительные копии транскрипционной единицы NDM29 в опухолевые клетки SKNBE2, мы создали линию клеток SKNBE2, сверхэкспрессирующую NDM29 (далее S1), и соответствующую Mock negative, экспрессирующую NDM29 на эндогенном уровне. Клетки S1 демонстрируют частично дифференцированный/нейроноподобный фенотип, слабо злокачественны и характеризуются выраженной задержкой клеточного цикла.18,19
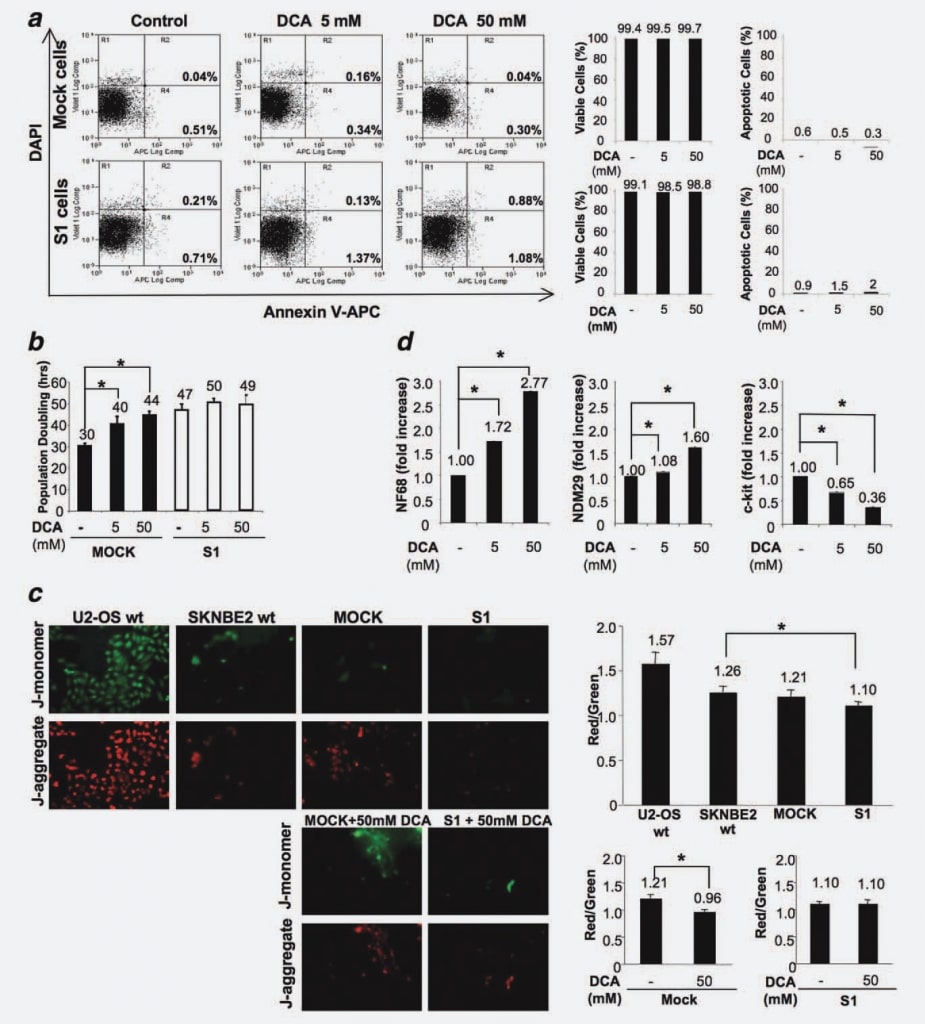
Чтобы исключить, что обработка DCA может индуцировать апоптоз in vitro, как это продемонстрировано в экспериментах in vivo, мы измерили процент апоптотических клеток в клеточных линиях Mock и S1, обработанных и/или не обработанных препаратом в течение 48 ч. Никаких различий между клеточными линиями (необработанными или обработанными разными дозами DCA) не наблюдалось, что подтверждает, что DCA не провоцирует апоптоз в клетках NB (рис. 4a).
Чтобы определить влияние на пролиферацию клеток Mock и S1, мы обработали клетки 5 мМ и 50 мМ DCA и измерили время удвоения клеточной популяции (PD) в четырех независимых экспериментах. Концентрация 50 мМ была выбрана в качестве максимальной дозы, поскольку в различных предыдущих исследованиях сообщалось, что DCA, по-видимому, относительно неактивен в различных клеточных линиях при использовании более низких доз.16,20 Как показано на рисунке 4b, время PD значительно увеличивается при обработке DCA в дозозависимой манере в клетках Mock. Действительно, в отсутствие лечения, Mock дуплицировались через 30 ч, тогда как доставка 5 мМ DCA индуцировала задержку клеточного цикла на 10 ч, а более высокая доза 50 мМ DCA привела к увеличению на 14 ч (p < 0,001). Эти результаты показывают, что DCA индуцирует задержку клеточного цикла в недифференцированных/полностью пролиферирующих клетках NB. Напротив, ПД для клеток S1 оставался приблизительно неизменным, смещаясь от 47 ч для необработанных клеток к 50 ч для клеток, обработанных 5 мМ ДКА, и к 49 ч для клеток, обработанных 50 мМ ДКА (рис. 4б). Этот результат показывает, что ответ на лечение DCA напрямую зависит от стадии дифференцировки/пролиферации клеток НБ, поскольку дифференцированные клетки с очень низким злокачественным потенциалом слабо реагируют на лечение, в то время как их полностью пролиферирующие/очень злокачественные аналоги сильно страдают от лечения DCA.
Чтобы лучше понять этот феномен и учитывая, что эффекты DCA связаны с ингибированием PDK, активацией окислительного фосфорилирования митохондрий и специфическим снижением гиперполяризации митохондрий,6 мы протестировали клетки Mock и S1 на предмет возможных изменений в гиперполяризации митохондрий как основы дифференциальной восприимчивости этих клеток к DCA. Для этого мы обработали клетки JC-1 (5,5′,6,6′-тетрахлор-1,1′,3,3′-тетраэтилбензимидазолокарбоцианин йодид), флуоресцентным красителем, поглощение которого пропорционально потенциалу митохондрий. JC-1 может избирательно проникать в митохондрии и обратимо меняет цвет с зеленого на красный при увеличении митохондриального потенциала, так что уменьшение соотношения красной и зеленой флуоресценции указывает на реактивацию митохондрий. Мы сравнили поляризацию митохондриальных мембран клеток остеосаркомы U2-OS (гиперполяризованные контрольные клетки21), клеток SKNBE2 wt, Mock и S1. Мы обнаружили, что клетки Mock демонстрируют сходную степень поляризации по сравнению с клетками SKNBE2 wt, тогда как клетки S1 характеризуются сниженной степенью поляризации митохондрий (p ¼ 0,0184) (рис. 4c). Результаты, полученные в трех повторах, показали, что в клетках Mock происходит реактивация митохондрий под действием ДКА (снижение отношения красной/зеленой флуоресценции на 25%; p ¼ 0,0077), тогда как в клетках S1 митохондриальная активность не изменяется в присутствии ДКА (рис. 4c). Таким образом, эти результаты показывают, что восприимчивость злокачественных/полностью циклических клеток связана с митохондриальным статусом, чувствительным к действию DCA, тогда как коммитированные/дифференцированные, плохо циклические клетки рефрактерны к действию этого препарата.
Далее, чтобы выявить возможное влияние ДКА на потенциал дифференцировки, мы измерили методом RT-PCR в реальном времени уровень экспрессии NDM29, NF68 и c-Kit в обработанных ДКА и необработанных клетках Mock. Мы провели этот анализ именно на клетках Mock, поскольку клетки S1 были рефрактерны к снижению пролиферации, вызванному DCA. Как показано на рисунке 4d, обработка DCA привела к увеличению экспрессии маркера дифференцировки NF68 (клетки Mock, обработанные 5 мМ или 50 мМ DCA по сравнению с необработанными клетками, p < 0,0001). Аналогично, экспрессия NDM29 была значительно увеличена в обработанных клетках-макетах по сравнению с контролем (p < 0,001). Напротив, экспрессия c-Kit была снижена дозозависимым образом в обработанных клетках (p < 0,0001). В целом, эти результаты свидетельствуют о том, что в клетках НБ противоопухолевый эффект DCA обусловлен в основном антипролиферативным/дифференцирующим действием и не приводит к увеличению уровня апоптоза.
Обсуждение
DCA — это небольшая молекула, которая уже более 30 лет используется для лечения врожденного и приобретенного молочнокислого ацидоза.22 Действительно, хорошо описано, что лечение DCA снижает уровень лактата в циркуляции путем смещения клеточного метаболизма с гликолиза на окисление глюкозы, без какого-либо пагубного влияния на нормальные клетки.6 Благодаря своей способности благоприятствовать метаболизму глюкозы путем аэробного гликолиза, DCA успешно используется в клинических испытаниях при заболеваниях сердца, включая застойную сердечную недостаточность и ишемическую болезнь сердца, поскольку постишемическая дисфункция гипертрофированного сердца связана с низкой скоростью окисления глюкозы и высокой скоростью гликолиза.23
Очень привлекательным свойством DCA является его переносимость и безопасность. Действительно, более чем в 40 клинических исследованиях ДКА сообщается, что наиболее значительным побочным эффектом длительного приема ДКА является обратимая периферическая нейропатия.24,25
В последние годы на моделях in vitro и in vivo получены убедительные доказательства того, что ДКА может быть полезен для лечения некоторых видов рака у человека.6 Действительно, ДКА способен обращать эффект Варбурга, ингибируя PDK, восстанавливая мембранный потенциал митохондрий и увеличивая продукцию ROS. По этой причине DCA прославился как волшебная пуля против рака,1 даже если в настоящее время он еще не одобрен для лечения рака.26 Несмотря на то, что нейробластома до сих пор считалась типом рака, для которого лечение ДКА, скорее всего, неэффективно, из-за предполагаемого отсутствия гиперполяризации митохондриальной мембраны в клетках, составляющих узелки НБ,27 было описано, что пролиферирующие клетки НБ поддерживают гликолитический фенотип,11 и что даже в аэробных условиях клетки НБ превращают значительное количество глюкозы в лактат вместо того, чтобы использовать окисление глюкозы.28 Исходя из этого, целью данного исследования было определить, может ли DCA оказывать благоприятное воздействие на этот тип опухоли. Наши результаты выявили непредсказуемое положительное влияние ДКА на рост опухоли НБ как в моделях in vivo, так и in vitro. Действительно, DCA был эффективен в установленных опухолях НБ, не вызывая никаких явных побочных эффектов у леченных животных.
Более подробный анализ, проведенный на клетках, полученных из обработанных опухолей, показал, что DCA приводит к задержке пролиферации без признаков усиления апоптоза или гибели клеток. Это согласуется с наблюдаемым уменьшением объема опухолевых масс, не сопровождающимся полным уничтожением рака. Механизмы действия DCA до сих пор остаются спорными. В этом контексте наши результаты контрастируют с предыдущими исследованиями, в которых клетки рака эндометрия, простаты, толстой кишки и легких обрабатывались DCA.6,9,20 В этих случаях отмечалось усиление апоптоза без влияния на распределение клеточного
,21 или усиление апоптоза, сопровождаемое снижением пролиферации8. С другой стороны, по другим данным, DCA подавляет пролиферацию раковых клеток, но не увеличивает апоптоз или гибель клеток.7 Этот последний механизм подтверждается протеомным анализом, в котором лечение DCA вызывает изменения маркеров клеточной пролиферации, а не количество белков, связанных с апоптозом.16 Такое двойственное поведение DCA может зависеть от типа клеток, возможно, из-за различий в экспрессии изоферментов PDK в исследуемых раковых клетках. В настоящее время ведутся исследования по соотнесению экспрессии PDK с чувствительностью к DCA.
Интересно, что мы показали, что увеличение экспрессии некоторых маркеров дифференцировки, таких как NF68 и NDM29, сопровождающееся снижением экспрессии c-kit, маркера стволовых/опухолеобразующих клеток, коррелирует с наблюдаемым снижением пролиферации раковых клеток. Таким образом, DCA-зависимая индукция задержки клеточного цикла, сопровождающаяся усилением дифференцировки клеток, представляет собой новый, еще не описанный механизм действия этого препарата, который связывает эффекты DCA со стадией дифференцировки раковых клеток.
Документально подтверждено, что опухоли НБ человека характеризуются различными типами клеток, которые имеют различные морфологические, биохимические и туморигенные свойства и различные стадии дифференцировки.12 Чтобы углубить возможную корреляцию восприимчивости к DCA с уровнем дифференцировки клеток, мы использовали модель дифференцировки клеток НБ in vitro, основанную на сверхэкспрессии pol III-транскрибируемой нцРНК (NDM29). Мы создали линию клеток SKNBE2, сверхэкспрессирующую NDM29 (здесь и далее обозначается как S1), и соответствующий отрицательный контроль Mock.19 Эти линии клеток обрабатывали 5 мМ и 50 мМ DCA. Концентрация 50 мМ была выбрана в качестве максимальной дозы, поскольку в различных предыдущих исследованиях сообщалось, что DCA относительно неактивен в различных клеточных линиях при использовании более низких доз,16,20 хотя эта концентрация не может быть достигнута in vivo. Тем не менее, в наших экспериментальных условиях действие DCA проявляется при более низкой дозе (5 мМ), что является подходящей концентрацией для использования in vivo.
Как и ожидалось, мы обнаружили, что и в клетках Mock и S1 обработка DCA не вызвала признаков апоптоза, что подтверждает наши результаты in vivo. Интересно, что эффект DCA ограничивается недифференцированными, очень злокачественными, полностью циклическими клетками (клетки Mock), тогда как он не влияет на скорость пролиферации более дифференцированных, слабо злокачественных клеток (клетки S1). Этот эффект может быть связан с различной степенью поляризации митохондрий в этих типах клеток. Действительно, мы продемонстрировали, что клетки Mock имеют более высокую степень митохондриальной поляризации, чем их более дифференцированный аналог S1.
Таким образом, мы продемонстрировали, что различные клетки, составляющие опухолевые массы НБ, по-разному восприимчивы к DCA, который избирательно действует на очень злокачественные и полностью пролиферирующие клетки, тогда как на слабо злокачественные, более дифференцированные клетки он оказывает очень слабое воздействие. Подобное дифференцированное действие DCA было также отмечено в исследовании, посвященном глиобластоме (GBM)2, где авторы показали, что раковые стволовые клетки, по сравнению с более дифференцированными аналогами, составляющими GBM, демонстрируют те же метаболические и митохондриальные перестройки, но в более высокой степени, поскольку они имеют большинство гиперполяризованных митохондрий.2
В заключение, описанные здесь эксперименты поддерживают мнение о DCA как об очень избирательном препарате, который может помочь в противораковом лечении NB без значительных побочных эффектов на здоровые клетки. Таким образом, это предварительное исследование расширяет возможности использования DCA для лечения рака НБ, подтверждая необходимость детального изучения его противораковых свойств против этого типа опухолей.
Благодарности
R.C. была поддержана Министерством университетов и исследований ИталииMIUR (2007 Международная программа FIRB). А.П. был поддержан Министерством университетов и исследований Италии (2007 PRIN Program prot. 2007945BZN), Итальянской ассоциацией по изучению рака (2009 AIRC Program no. IG9378) и Итальянской ассоциацией по борьбе с нейробластомой (Генуя, Италия).
ССЫЛКИ
1 Heshe D, Hoogestraat S, Brauckmann C, Karst U, Boos J, Lanvers-Kaminsky C. Метаболически направленная терапия дихлорацетатом побеждает цитотоксичность стандартных противораковых препаратов. Cancer Chemother Pharmacol 2011;67:647-55
2 Michelakis ED, Sutendra G, Dromparis P, Webster L, Haromy A, Niven E, Maguire C, Gammer TL, Mackey JR, Fulton D, Abdulkarim B, McMurtry MS, et al. Metabolic modulation of glioblastoma with dichloroacetate. Sci Transl Med; 2010;2:31ra4.
3 Stacpoole PW, Henderson GN, Yan Z, James MO. Клиническая фармакология и токсикология дихлорацетата. Environ Health Perspect 1998;106 Suppl 4:989-94.
4 Stacpoole PW. The pharmacology of dichloroacetate. Metabolism 1989;38: 1124-44.
5 Michelakis ED, Webster L, Mackey JR. Дихлорацетат (DCA) как потенциальная метаболическая таргетная терапия рака. Br J Cancer 2008;99:989-94.
6 Bonnet S, Archer SL, Allalunis-Turner J, Haromy A, Beaulieu C, Thompson R, Lee CT, Lopaschuk GD, Puttagunta L, Harry G, Hashimoto K, Porter CJ, et al. A mitochondria-Kþ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth. Cancer Cell 2007;11:37-51.
7 Sun RC, Fadia M, Dahlstrom JE, Parish CR, Board PG, Blackburn AC. Обращение гликолитического фенотипа дихлорацетатом подавляет рост метастатических клеток рака молочной железы in vitro и in vivo. Breast Cancer Res Treat 2010;120:253-60.
8 Cao W, Yacoub S, Shiverick KT, Namiki K, Sakai Y, Porvasnik S, Urbanek C, Rosser CJ. Дихлорацетат (DCA) сенсибилизирует клетки рака простаты как дикого типа, так и экспрессирующие Bcl-2 in vitro к радиации. Prostate 2008;68:1223-31.
9 Wong JY, Huggins GS, Debidda M, Munshi NC, De Vivo I. Дихлорацетат индуцирует апоптоз в клетках рака эндометрия. Gynecol Oncol 2008;109:394-402.
10 Vander Heiden MG. Таргетинг клеточного метаболизма у больных раком. Sci Transl Med 2009;2:31ed1.
11 Almeida A, Bolanos JP, Moncada S. E3 убиквитин лигаза APC/C-Cdh1 объясняет эффект Варбурга, связывая гликолиз с клеточной пролиферацией. Proc Natl Acad Sci USA; 107:738-41.
12 Walton JD, Kattan DR, Thomas SK, Spengler BA, Guo HF, Biedler JL, Cheung NK, Ross RA. Характеристика стволовых клеток из клеточных линий нейробластомы человека и в опухолях. Neoplasia 2004;6:838-45.
13 Vistejnova L, Dvorakova J, Hasova M, Muthny T, Velebny V, Soucek K, Kubala L. Сравнение импедансного метода мониторинга клеточной пролиферации с широко используемыми метаболическими методами. Neuro Endocrinol Lett 2009;30 Suppl 1:121-7.
14 Schmidt MM, Rohwedder A, Dringen R. Влияние хлорированных ацетатов на метаболизм глутатиона и гликолиз культивируемых астроцитов. Neurotox Res 2011; 19:628-37.
15 Papandreou I, Goliasova T, Denko NC. Противораковые препараты, направленные на метаболизм: является ли дихлорацетат новой парадигмой? Int J Cancer 2011;128:1001-8.
16 Stockwin LH, Yu SX, Borgel S, Hancock C, Wolfe TL, Phillips LR, Hollingshead MG, Newton DL. Дихлорацетат натрия избирательно нацелен на клетки с дефектами митохондриального ЭТЦ. Int J Cancer 2010;127: 2510-9.
17 George RE, Variend S, Cullinane C, Cotterill SJ, McGuckin AG, Ellershaw C, Lunec J, Pearson AD. Взаимосвязь между гистопатологическими характеристиками. Амплификация MYCN и прогноз: исследование UKCCSG. United Kingdom Children Cancer Study Group. Med Pediatr Oncol 2001;36: 169-76.
18 Pagano A, Castelnuovo M, Tortelli F, Ferrari R, Dieci G, Cancedda R. New small nuclear RNA gene-like transcriptional units as sources of regulatory transcripts. PLoS Genet 2007;3:e1.
19 Castelnuovo M, Massone S, Tasso R, Fiorino G, Gatti M, Robello M, Gatta E, Berger A, Strub K, Florio T, Dieci G, Cancedda R, et al. Alu-like RNA promotes cell differentiation and reduces malignancy of human neuroblastoma cells. FASEB J 2010;24:4033-46.
20 Madhok BM, Yeluri S, Perry SL, Hughes TA, Jayne DG. Дихлорацетат вызывает апоптоз и остановку клеточного цикла в клетках колоректального рака. Br J Cancer 2010;102:1746-52.
21 Liu TJ, Lin SY, Chau YP. Ингибирование активации поли(ADP-рибоза) полимеразы ослабляет бета-лапахон-индуцированную некротическую гибель клеток в клетках остеосаркомы человека. Toxicol Appl Pharmacol 2002;182:116-25.
22 Stacpoole PW, Kerr DS, Barnes C, Bunch ST, Carney PR, Fennell EM, Felitsyn NM, Gilmore RL, Greer M, Henderson GN, Hutson AD, Neiberger RE, et al. Controlled clinical trial of dichloroacetate for treatment of congenital lactic acidosis in children. Pediatrics 2006;117: 1519-31.
23 Wargovich TJ, MacDonald RG, Hill JA, Feldman RL, Stacpoole PW, Pepine CJ. Миокардиальные метаболические и гемодинамические эффекты дихлорацетата при ишемической болезни сердца. Am J Cardiol 1988;61: 65-70.
24 Kaufmann P, Engelstad K, Wei Y, Jhung S, Sano MC, Shungu DC, Millar WS, Hong X, Gooch CL, Mao X, Pascual JM, Hirano M, et al. Dichloroacetate causes toxic neuropathy in MELAS: a randomized, controlled clinical trial. Неврология 2006;66: 324-30.
25 Stacpoole PW, Henderson GN, Yan Z, Cornett R, James MO. Фармакокинетика, метаболизм и токсикология дихлорацетата. Drug Metab Rev 1998;30: 499-539.
26 Pearson H. Онкологические больные выбирают неодобренный препарат. Nature 2007;446: 474-5.
27 Chen LB. Мембранный потенциал митохондрий в живых клетках. Annu Rev Cell Biol 1988;4:155-81.
28 Deubzer B, Mayer F, Kuci Z, Niewisch M, Merkel G, Handgretinger R, Bruchelt G. H(2)O(2)-опосредованная цитотоксичность фармакологических концентраций аскорбата для клеток нейробластомы: потенциальная роль лактата и ферритина. Cell Physiol Biochem 2010;25:767-74.