D.L. Kolesnik*, O.N. Pyaskovskaya, O.V. Yurchenko, G.I. Solyanik
R.E. Kavetsky Institute of Experimental Pathology, Oncology and Radiobiology, NAS of Ukraine, Kyiv 03022, Ukraine
Inviato: 06 maggio 2019.
*Corrispondenza: E-mail: [email protected] Abbreviazioni utilizzate: DCA – dicloroacetato di sodio; MTF – metformina; Δψm – potenziale di membrana mitocondriale; IC50 – semimassima concentrazione inibitoria
Estratto
È noto che l’arsenale di agenti chemioterapici per il trattamento dei tumori cerebrali maligni è piuttosto limitato, il che determina l’elevata rilevanza della ricerca volta a trovare nuovi regimi antitumorali efficaci, compreso l’uso di modificatori del metabolismo energetico. Obiettivo: studiare l’attività anti-glioma del dicloroacetato di sodio (DCA) e della metformina (MTF) usati in combinazione in vitro e in vivo. Materiali e metodi: La sopravvivenza cellulare, il ciclo cellulare, l’apoptosi, il potenziale di membrana mitocondriale (Δψm), il livello di ATP, il tasso di consumo di glucosio e il tasso di produzione di lattato sono stati determinati in vitro in cellule di glioma C6 coltivate. L’azione antitumorale degli agenti in vivo è stata valutata di routine mediante il prolungamento della durata di vita di ratti con glioma C6 intracerebrale trapiantato ed è stata confermata dall’esame istologico del tessuto tumorale. Risultati: La concentrazione inibitoria semimassimale (IC50) per il DCA e l’MTF usati separatamente è stata rispettivamente di 79,2 ± 2,1 mM e 78,4 ± 4,0 mM, mentre l’IC50 per il DCA usato in combinazione con 7,8 mM di MTF è stata 3,3 volte inferiore (24,0 ± 1,2 mM, p < 0,05). L’incubazione per 1 giorno di cellule con DCA a una concentrazione vicina all’IC50 (25 mM), in combinazione con MTF a una concentrazione di ordine inferiore all’IC50 (7,8 mM), a differenza del loro uso separato, ha portato a una diminuzione del numero di cellule vitali del 40% (p < 0. 05); la ridistribuzione del numero di cellule vitali è stata del 40% (p < 0. 05).05); la ridistribuzione delle cellule in base alle fasi del ciclo cellulare ha portato a una diminuzione della percentuale di cellule nella fase S del 46% (p < 0,05) e a un aumento della percentuale di cellule nella fase G0/G1 del 24% (p < 0,05) rispetto a indici simili nel controllo. L’elevata attività pro-apoptotica del DCA in combinazione con MTF è stata supportata da una percentuale significativamente più alta di cellule apoptotiche in vitro rispetto al controllo (18,9 ± 4,4% vs 5,7 ± 1,3%, p < 0,05) e da un elevato numero di cellule tumorali con segni di apoptosi rivelati durante l’esame istologico della patomorfosi tumorale. L’effetto combinato di DCA e MTF ha portato a una diminuzione di quasi 4 volte del tasso di consumo di glucosio da parte delle cellule di glioma C6 (0,23 ± 0,05 μmol/106 cellule/h vs 0,91 ± 0,12 μmol/106 cellule/h, p<0.05) rispetto ai parametri corrispondenti nel controllo, e un aumento di 2 volte del tasso di produzione di lattato (1,06 ± 0,03 μmol/106 cellule/h vs 0,53 ± 0,03 μmol/106 cellule/h, p <0,05). Allo stesso tempo, sia il Δψm che il livello di ATP intracellulare nelle cellule di glioma C6 trattate con DCA e MTF, sia separatamente che in combinazione, non differivano significativamente da quelli del controllo. Negli studi in vivo, la vita media dei ratti con glioma C6 trapiantato a livello intracranico, trattati con DCA in combinazione con MTF in una dose totale di 1,1 e 2,6 g/kg di peso corporeo, rispettivamente, è stata del 50% superiore (p < 0,001) rispetto al gruppo di controllo. Al contrario, nel caso dell’uso singolo (alla dose di 2,6 g/kg), l’MTF ha aumentato la durata di vita degli animali portatori del tumore solo del 19% (p < 0,01), mentre il DCA da solo (alla dose di 1,1 g/kg) non ha modificato significativamente il tempo di sopravvivenza dei ratti. Conclusioni: I dati ottenuti indicano il sinergismo dell’azione anti-glioma di DCA e MTF in un caso di uso combinato sia in vitro che in vivo e possono essere considerati un punto di partenza per lo sviluppo di regimi di trattamento efficaci per i tumori cerebrali maligni basati sull’uso combinato di DCA e MTF.
Parole chiave: glioma C6, dicloroacetato di sodio, metformina.
I gliomi maligni sono noti per essere i tumori umani più aggressivi, solitamente con prognosi sfavorevole, anche con gli attuali progressi nella terapia antitumorale, tra cui la terapia anti-angiogenica, la terapia molecolare mirata e l’immunoterapia. L’introduzione di nuovi metodi di terapia multimodale anti-glioma porta a un certo aumento dell’aspettativa di vita media dei pazienti, ma, purtroppo, di solito un paziente non guadagna più di 3-6 mesi di vita [1-4]. Tenendo conto dell’innegabile rinascita nel campo degli studi relativi al metabolismo del glucosio nelle cellule tumorali [5, 6], da un lato, e dell’elevata dipendenza delle cellule cerebrali dal glucosio [7], dall’altro, il tentativo di aumentare l’efficacia della terapia antitumorale modificando le vie metaboliche di utilizzo del glucosio nelle cellule tumorali sembra essere promettente.
In studi sperimentali la metformina (MTF), un inibitore della catena respiratoria mitocondriale (complesso I), ampiamente utilizzata per il trattamento del diabete di tipo 2 come agente ipoglicemizzante, ha dimostrato la capacità di inibire la proliferazione e la migrazione delle cellule di glioblastoma [8], di inibire la crescita degli xenotrapianti di glioma U87 e LN18 negli animali [9] ecc. I risultati di uno studio epidemiologico condotto su un ampio database validato hanno dimostrato che l’uso a lungo termine di MTF, pur non essendo associato a una riduzione del rischio di sviluppo di glioma, contribuisce a una migliore sopravvivenza dei pazienti con glioma maligno [10].
L’attività antitumorale del dicloroacetato di sodio (DCA), un farmaco non cancerogeno utilizzato da 30 anni come mezzo per il trattamento dei disturbi metabolici, in particolare dell’acidosi lattica, è stata confermata in vitro e in vivo, in particolare contro le cellule di glioma [11-13].
Lo scopo di questo lavoro è stato quello di studiare l’attività antiglioma di DCA e MTF nel caso del loro uso combinato in vitro e in vivo.
MATERIALI E METODI
Animali da esperimento e linee cellulari tumorali. Gli studi sono stati condotti su ratti femmina inbred di 2,5-3 mesi di età, del peso di 100-130 g, provenienti dal vivarium dell’Istituto di Patologia Sperimentale, Oncologia e Radiobiologia (IEPOR) dell’Accademia Nazionale delle Scienze dell’Ucraina (NASU), Kyiv, Ucraina. La ricerca sugli animali è stata condotta in conformità alle disposizioni dei Principi etici generali della sperimentazione animale adottati dal Primo Congresso di Bioetica (Kyiv, 2001) e ai requisiti internazionali in conformità alla Convenzione europea per la protezione degli animali vertebrati utilizzati a fini sperimentali e ad altri fini (Strasburgo, 1986).
Come modello tumorale sperimentale è stata utilizzata la linea cellulare di glioma C6, ottenuta dalla Banca Nazionale di Linee Cellulari e Ceppi Tumorali dell’IEPOR NASU.
Le cellule di glioma C6 sono state mantenute in vitro in DMEM con 10% di siero fetale di vitello (Sigma, USA) e 40 mg/ml di gentamicina a 37 °С in atmosfera umidificata con il 5% di СО2.
Per gli esperimenti in vivo, le cellule sono state coltivate in vitro in condizioni standard e trapiantate in ratti in anestesia generale mediante inoculazione intracerebrale di 0,6-106 cellule in 0,05 ml di soluzione fisiologica nella regione parietale sinistra del cervello.
Agenti, dosi e modalità di somministrazione. Come composti in studio sono stati utilizzati DCA (Sigma, USA) e MTF (Sigma, USA).
Per valutare l’attività antitumorale di DCA, MTF e della loro combinazione nei ratti dopo l’inoculazione di cellule tumorali, gli animali sono stati randomizzati in base al peso e distribuiti in 4 gruppi: 1) ratti a cui è stato somministrato solo DCA in una dose totale di 1,5 g/kg (n = 12).1 g/kg (n = 12); 2) ratti somministrati solo con MTF in una dose totale di 2,6 g/kg (n = 12); 3) ratti somministrati con DCA in combinazione con MTF (n = 13) alle dosi sopra indicate; e 4) ratti somministrati con acqua (controllo, n = 12).
In tutti i casi, gli agenti sono stati disciolti in acqua e somministrati per via orale con una sonda, una volta al giorno, a partire dal primo giorno dopo l’inoculazione delle cellule tumorali. Nel caso dell’uso combinato di DCA e MTF, quest’ultimo è stato somministrato 3-4 ore dopo la somministrazione di DCA.
Tutti gli agenti sono stati preparati ex tempore.
Gli effetti citotossici/citostatici di DCA e MTF da soli e in combinazione sono stati valutati mediante l’indice di concentrazione inibitoria semimassimale (IC50) – concentrazione dell’agente che causa una riduzione del 50% del numero di cellule vitali rispetto al controllo a causa della sua azione citotossica e/o citostatica.
Le cellule di glioma C6 sono state seminate in una piastra Petri da 35 mm a una densità di 0,5-106 cellule/ml. Dopo il periodo di preincubazione (16-18 ore), il terreno di coltura è stato sostituito da uno nuovo con l’aggiunta degli agenti sperimentali e l’incubazione è proseguita per 1 giorno.
In tutti i casi, le cellule incubate in condizioni analoghe, ma senza l’aggiunta di agenti, sono servite da controllo.
Ogni concentrazione e combinazione di agenti è stata valutata in 3 repliche (per la determinazione dell’IC50 ) o in 5 repliche (per determinare gli effetti di 25 mM DCA, 7,8 mM MTF e della loro combinazione).
Il numero di cellule vitali all’inizio dell’incubazione (N0) e dopo 1 giorno (N24) è stato valutato mediante conteggio diretto in un emocitometro utilizzando il blu di tripan.
La distribuzione delle cellule in base alle fasi del ciclo cellulare e il livello di apoptosi sono stati valutati mediante citometria a flusso utilizzando ioduro di propidio e RNAasi A [14]. Il numero di cellule apoptotiche è stato valutato in base al picco sub-G0/G1.
Iltasso di consumo di glucosio e di produzione di lattato da parte delle cellule tumorali è stato stimato in base al contenuto di substrati nel terreno di incubazione e al numero di cellule vitali all’inizio del periodo di incubazione e dopo 1 giorno.
Il livello di glucosio e lattato è stato determinato in campioni deproteinizzati di surnatanti utilizzando un analizzatore biochimico e kit commerciali per la loro determinazione.
Il potenziale di membrana interno dei mitocondri (Δψm) delle cellule tumorali è stato determinato utilizzando la citometria a flusso e il colorante cationico JC-10 (Sigma, USA) mediante il rapporto tra l’intensità della fluorescenza nelle regioni rossa (FL2) e verde (FL1).
L’efficacia dell’azione antitumorale degli agenti studiati è stata valutata in base al prolungamento della durata di vita (LSP) degli animali dei gruppi sperimentali rispetto alla durata di vita degli animali del gruppo di controllo, calcolata con la formula:
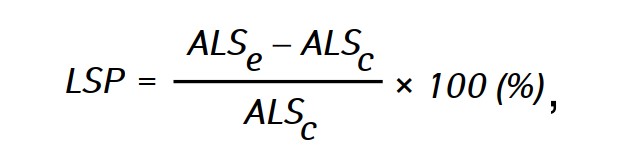
dove ALSe e ALSc-la durata media della vita dei ratti nei gruppi sperimentali e di controllo rispettivamente.
Per l’esame istologico, i campioni di tessuto tumorale dei ratti con glioma C6 sono stati fissati in soluzione di formalina tamponata neutra al 10% per 24 ore, disidratati in alcoli a concentrazioni crescenti e incorporati in paraffina. Le sezioni istologiche sono state colorate con ematossilina-eosina e analizzate con il microscopio AxioStarPlusZeiss.
L’analisi statistica dei dati è stata eseguita utilizzando statistiche descrittive, test t di Student e test u di Mann- Whitney, analisi di regressione non lineare utilizzando Microsoft Excel e il software Microcal Origin. I dati sono presentati come M ± m, dove M è il valore medio; m è l’errore standard del valore medio.
RISULTATI E DISCUSSIONE
Abbiamo dimostrato che l’MTF ha potenziato in modo significativo l’attività citotossica e/o citostatica del DCA contro le cellule di glioma C6 in vitro. In particolare, nel caso del suo uso singolo, l’IC50 del DCA era di 79,2 ± 2,1 mM, mentre questo indice per il DCA usato in combinazione con MTF anche a bassa concentrazione non citotossica è diminuito di oltre tre volte (p < 0,05) (Tabella 1, Fig. 1). Inoltre, se la morte necrotica delle cellule dovuta all’azione del DCA e dell’MTF usati separatamente era piuttosto bassa in un ampio intervallo di concentrazioni di entrambi gli agenti e non superava il 15% anche alle massime concentrazioni studiate, l’uso del DCA in combinazione con l’MTF 7,8 mM ha determinato un forte aumento concentrazione-dipendente del numero di cellule morte, soprattutto nell’intervallo di concentrazioni di DCA superiori all’IC50 (Fig. 1, c).
| Agente | DCA | MTF | IC50, mM |
| DCA | 10-100 | – | 79.2 ± 2.1 |
| MTF | – | 7.8-80 | 78.4 ± 4.0 |
| DCA + MTF | 10-40 | 7.8 | 24.0 ± 1.2* |
Nota: *p < 0,05 rispetto al valore corrispondente nel caso di uso singolo.
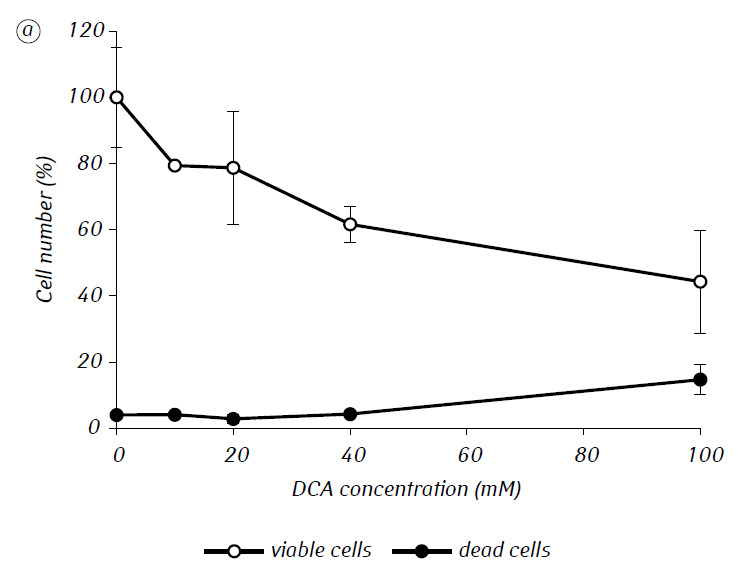
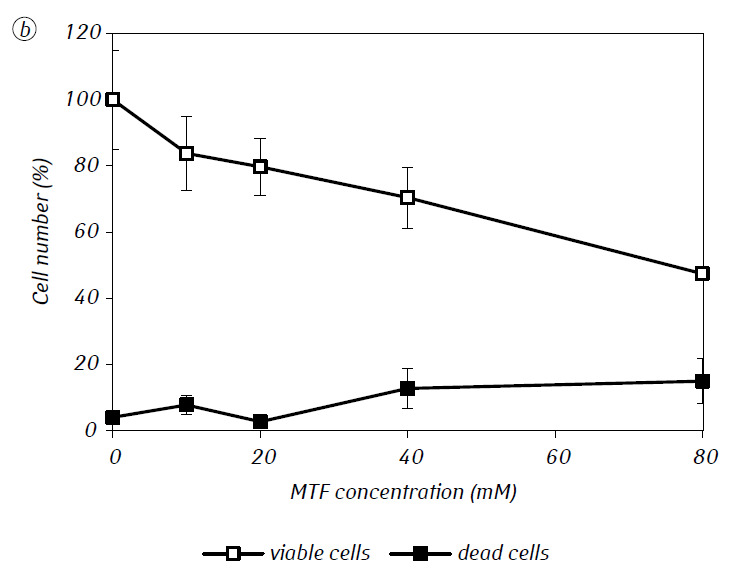
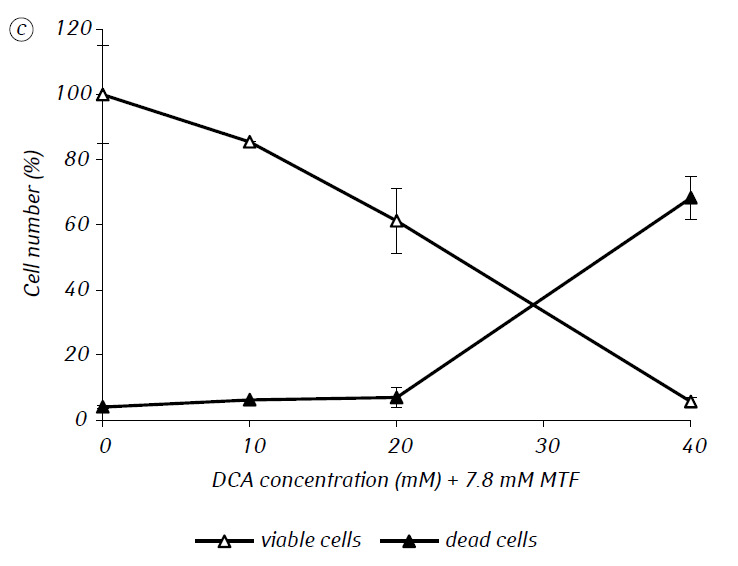
Per una valutazione più dettagliata dell’azione sinergica dei due agenti, le cellule di glioma C6 sono state incubate per 1 giorno con 25 mM di DCA (concentrazione vicina all’IC50) e 7,8 mM di MTF (concentrazione inferiore all’IC50), in combinazione e separatamente. I dati ottenuti sulla loro influenza sulle caratteristiche di crescita delle cellule di glioma C6, nonché sulle caratteristiche associate al loro metabolismo energetico, sono presentati nella Tabella 2.
| Indice | Controllo | 25 mM DCA | 7.8 mM MTF | 25 mM DCA+ 7,8 mM MTF |
| Numero di cellule vitali, % | 100.0 ± 5.3 | 91.5 ± 2.3 | 85.3 ± 6.7 | 60.2 ± 2.0 |
| N24/N0 | 1.9 ± 0.1 | 1.8 ± 0.04 | 1.7 ± 0.1 | 1.2 ± 0.04* |
| Necrosi, % | 2.6 ± 0.6 | 2.9 ± 0.8 | 5.5 ± 1.6 | 6.9 ± 2.6 |
| Apoptosi, % | 5.7 ± 1.3 | 30.2 ± 4.1* | 5.6 ± 2.5 | 18.9 ± 4.4* |
| G0/G1, % | 49.0 ± 2.3 | 49.6 ± 2.2 | 46.2 ± 3.3 | 60.8 ± 1.3* |
| G2/M, % | 30.7 ± 4.3 | 27.5 ± 1.7 | 29.7 ± 2.8 | 28.2 ± 3.07 |
| S, % | 20.3 ± 2.7 | 22.9 ± 1.0 | 21.1 ± 3.3 | 11.0 ± 1.8* |
| Δψm (FL2/FL1) | 0.85 ± 0.15 | 0.97 ± 0.01 | 0.81 ± 0.04 | 0.96 ± 0.01 |
| Il tasso di consumo di glucosio, µmol/106 cellule-h | 0.91 ± 0.12 | 0.16 ± 0.02* | 0.46 ± 0.07* | 0.23 ± 0.05* |
| Il tasso di produzione di lattato, µmol/106 cellule-h | 0.53 ± 0.03 | 0.42 ± 0.01* | 1.1 ± 0.02* | 1.06 ± 0.03* |
| Livello di ATP, pmol/106 cellule | 9835 ± 357 | 9819 ± 292 | – | 9379 ± 191 |
Nota: *p < 0,05 rispetto all’indice corrispondente nel controllo.
Come si evince dalla Tabella 2, l’azione sinergica del DCA in combinazione con l’MTF contro le cellule di glioma C6 è stata confermata da una netta diminuzione del numero di cellule vitali di quasi il 40% (p < 0,05) rispetto al corrispondente indice nel controllo, mentre nel caso del loro uso indipendente il numero di cellule vitali non è stato influenzato in modo significativo. Allo stesso tempo, il numero di cellule morte in tutti i casi è stato basso e praticamente non differiva da quello del controllo.
Analogamente, non è stato rilevato alcun effetto significativo del DCA in combinazione con il MTF sull’induzione dell’apoptosi nelle cellule di glioma C6. Il forte aumento di oltre tre volte (p < 0,05) del numero di cellule apoptotiche nel caso dell’uso combinato di DCA e MTF si è verificato solo grazie all’azione del DCA stesso. Quest’ultimo è stato confermato dall’alto livello di apoptosi indotta dal DCA, che nel caso del suo uso separato ha superato di 5,3 volte (p < 0,05) il valore corrispondente nel controllo (Tabella 2).
A differenza del DCA, il MTF 7,8 mM usato da solo non ha aumentato l’apoptosi in queste cellule e ha addirittura ridotto la sensibilità delle cellule all’azione pro-apoptotica del DCA se usato in combinazione. In particolare, il numero di cellule apoptotiche indotte dalla combinazione di DCA e MTF era quasi 1,5 volte inferiore (p < 0,05) a quello indotto dal DCA.
L’effetto sinergico anti-glioma di DCA e MTF è stato confermato anche dall’aumento di quasi il 24% (p <0,05) della percentuale di cellule nella fase G0/G1 e da una significativa diminuzione della loro frazione (di quasi il 46%, p <0,05) nella fase S, mentre DCA e MTF usati separatamente non hanno influenzato in modo significativo la distribuzione delle fasi del ciclo cellulare (Tabella 2).
È da notare che l’aggiunta di DCA e MTF, sia separatamente che in combinazione, ha ridotto in modo significativo il tasso di consumo di glucosio. Al contrario, il tasso di produzione di lattato nelle cellule trattate con DCA è stato fortemente ridotto, mentre questo indice nelle cellule trattate con MTF, da solo o in combinazione, è aumentato significativamente.
In particolare, nelle cellule trattate con DCA, si è osservata una forte riduzione del tasso di consumo di glucosio dell’82% (p < 0,05) insieme a una diminuzione del 21% (p < 0,05) del tasso di produzione di lattato rispetto a parametri di controllo simili. L’MTF, a differenza del DCA, ha aumentato notevolmente la produzione di lattato da parte delle cellule tumorali, sia in caso di uso separato che in combinazione con il DCA. Il tasso di produzione di lattato è aumentato di quasi il 108% (p < 0,05) e del 100% (p < 0,05) nelle cellule trattate con MTF da solo e in combinazione con DCA, rispettivamente, rispetto al controllo. È interessante notare che, nonostante l’effetto significativo di DCA e MTF sul metabolismo delle cellule tumorali, essi non hanno praticamente ridotto il livello di ATP nelle cellule tumorali. Come si può vedere dalla Tabella 2, il contenuto di ATP intracellulare nelle cellule trattate con DCA e MTF da soli o in combinazione non differiva significativamente da quello del controllo.
Negli esperimenti in vivo, l’MTF ha potenziato in modo significativo l’effetto antitumorale del DCA, determinando una sinergia della loro azione. Le curve di sopravvivenza degli animali da esperimento sono presentate nella Fig. 2. La vita media dei ratti con glioma C6 trapiantato a livello intracranico trattati con il solo DCA non differiva praticamente da quella del controllo, mentre la somministrazione del solo MTF prolungava significativamente la vita dei ratti con tumore di quasi il 20% (p < 0,01). L’uso combinato di DCA e MTF ha determinato un aumento significativo dei loro effetti anti-glioma, confermato da un prolungamento significativo della durata di vita degli animali del 50% (p < 0,001) e di oltre il 26% (p < 0,05) rispetto a questo indice nel gruppo di controllo e nel gruppo di ratti a cui è stato somministrato solo MTF, rispettivamente.
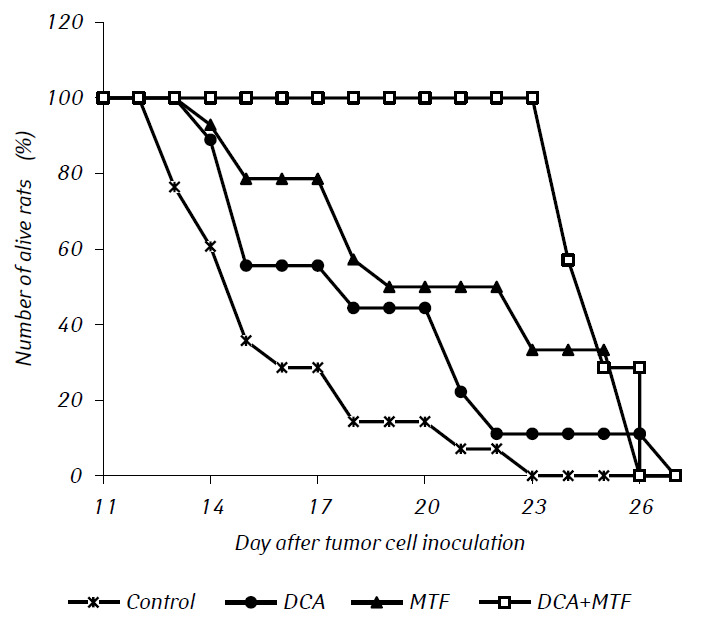
L’esame istologico del tessuto tumorale di ratti con glioma C6 ha rivelato alcuni cambiamenti nella sua struttura, che sono correlati all’elevata efficienza dell’azione antiglioma degli agenti studiati. Negli animali di controllo, il tumore si sviluppava generalmente negli strati molecolari o inferiori della corteccia cerebrale. Morfologicamente, la zona di neoplasia era rappresentata dall’accumulo di grandi cellule e nuclei di forma diversa, ipercromici o con moderato contenuto di cromatina. Nei campioni studiati, il polimorfismo cellulare e la presenza di grandi cellule multi-nucleo erano tipici. Le cellule tumorali possiedono, di norma, una forma allungata con citoplasma, strutture fibrose e nuclei ben espressi. Alcune cellule erano di dimensioni più piccole, arrotondate, con nuclei densi e ipercromici (Fig. 3).
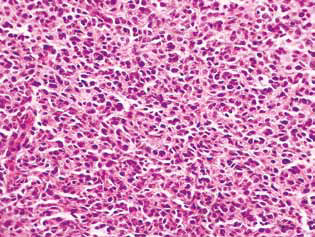
Nei ratti trattati con DCA e MTF da soli o in combinazione, nel tessuto tumorale è stato osservato un accumulo di cellule apoptotiche o di cellule con strutture ipercromiche a forma di anello alla periferia dei nuclei, come prova dell’attivazione dell’apoptosi. Va notato che questi fenomeni erano molto più espressi nel caso dell’uso combinato degli agenti (Fig. 4).
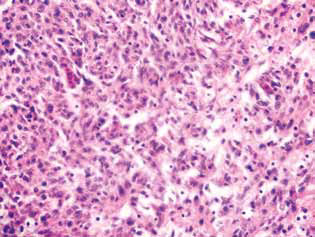
Una marcata manifestazione dell’azione anti-glioma del DCA in combinazione con il MTF è stata una significativa riduzione delle regioni satelliti nel tessuto cerebrale (Fig. 5). Nel gruppo di animali di controllo, le strutture satelliti erano situate vicino al nodo principale del tumore ed erano abbastanza comuni. Intorno alle diverse cellule maligne che migravano dal tessuto tumorale principale, ovviamente, si avviava il processo di angiogenesi neoplastica, che portava alla formazione di un vaso sanguigno e alla formazione di un bordo multistrato dalle cellule maligne intorno ad esso, che era poi accompagnato dalla fusione di tali strutture con la lesione principale e da un aumento delle dimensioni del tumore (Fig. 5, a).
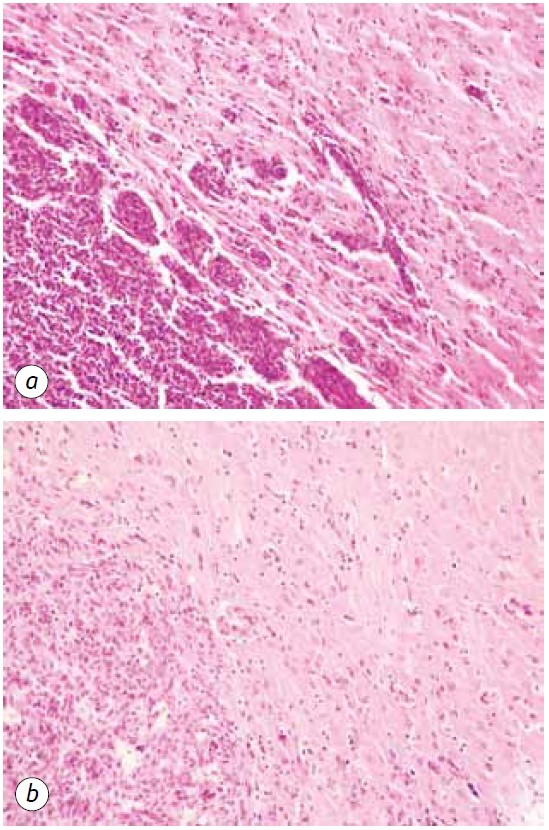
Invece, negli animali che hanno ricevuto DCA in combinazione con MTF, è stata osservata una netta diminuzione della formazione di lesioni tumorali satelliti, che potrebbe essere dovuta alla soppressione della neoangiogenesi e all’incapacità di formare nuovi siti di crescita neoplastica (Fig. 5, b). Inoltre, la patomorfosi tumorale negli animali che hanno ricevuto DCA in combinazione con MTF si è manifestata con la presenza di chiare lesioni tumorali devastate (Fig. 6) e un numero sufficientemente elevato di vasi sanguigni distrutti e devastati nel tessuto tumorale (Fig. 7).
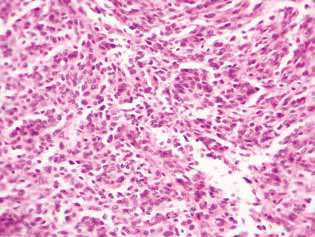
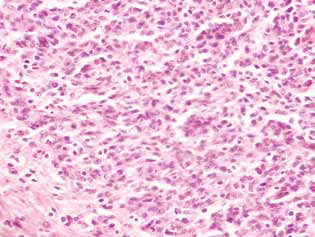
Di conseguenza, l’inibizione significativa della proliferazione delle cellule di glioma C6 in vitro dovuta all’uso combinato di 25 mM di DCA e 7,8 mM di MTF, che contrastava con una morte cellulare minore, era principalmente dovuta alla loro azione citostatica. La componente citostatica dell’effetto sinergico di DCA e MTF nei confronti delle cellule di glioma C6 è stata confermata anche dal significativo accumulo di cellule in fase G0/G1 e dalla diminuzione della loro frazione in fase S.
A quanto pare, il potenziamento dell’azione anti-glioma di DCA e MTF dovuto alla loro combinazione è stato causato dai loro effetti multidirezionali sul metabolismo energetico delle cellule tumorali. In particolare, il tasso di produzione di lattato nelle cellule di glioma C6 senza l’aggiunta di alcun agente (controllo) era quasi due volte inferiore al tasso di consumo di glucosio. Tale correlazione tra questi indici indica la presenza in queste cellule non solo della conversione glicolitica del glucosio in lattato, ma anche un’attività piuttosto elevata della fosforilazione ossidativa e dei processi anabolici di sintesi delle biomolecole.
Nelle cellule trattate con DCA, la forte diminuzione del consumo di glucosio e la contemporanea diminuzione del tasso di produzione di lattato indicano che il DCA, alla concentrazione di 25 mM, è in grado di realizzare il suo potenziale come inibitore della piruvato deidrogenasi chinasi e di aumentare l’intensità della respirazione mitocondriale e di sopprimere indirettamente la glicolisi in queste cellule.
La forte diminuzione del tasso di consumo di glucosio nelle cellule di glioma dovuta all’azione del DCA è stata associata alla sua spiccata attività di induzione dell’apoptosi. Nonostante il significativo effetto pro-apoptotico del DCA e lo spostamento del metabolismo cellulare verso la respirazione mitocondriale, non sono stati rilevati cambiamenti apparenti nel potenziale della membrana interna dei mitocondri nelle cellule di glioma C6.
A differenza del DCA, nelle cellule tumorali trattate con MTF è stato rilevato un aumento significativo della produzione di lattato, sia nel caso del suo uso separato che in combinazione con il DCA. Ovviamente, ciò è avvenuto attraverso l’inibizione del complesso I della catena di trasporto degli elettroni dei mitocondri da parte del MTF [15], anche a basse concentrazioni non tossiche. Tenendo conto del fatto che l’attivazione della glicolisi di solito promuove l’acquisizione della resistenza delle cellule tumorali contro gli stimoli pro-apoptotici [16], una riduzione di oltre 1,5 volte dell’apoptosi indotta dal DCA con l’uso combinato degli agenti può essere attribuita, almeno in parte, all’attivazione della glicolisi aerobica indotta dal MTF nelle cellule di glioma C6.
Nel caso della combinazione di DCA e MTF, la modifica del metabolismo energetico indotta dal MTF è stata attuata in misura maggiore. Dato l’alto tasso di produzione di lattato da parte delle cellule trattate con MTF da solo o in combinazione con DCA, si può concludere che in quest’ultimo caso la glicolisi indotta da MTF ha dominato sul metabolismo mitocondriale indotto da DCA nelle cellule tumorali.
Va notato che nonostante l’effetto significativo sul metabolismo tumorale di DCA e MTF, usati separatamente o in combinazione, non hanno praticamente ridotto il livello di ATP nelle cellule tumorali. L’assenza di variazioni del livello di ATP nelle cellule tumorali dovute all’effetto di DCA e MTF da soli e in combinazione indica l’attuazione di risposte compensatorie nelle cellule per mantenere l’approvvigionamento energetico cellulare e una plasticità metabolica sufficientemente elevata di queste cellule.
In precedenza, abbiamo dimostrato che l’effetto antitumorale dei modificatori del metabolismo energetico, in particolare del MTF, dipende sostanzialmente dal microambiente delle cellule tumorali e può differire radicalmente dagli effetti in vitro [17]. In questi studi, il sinergismo dell’attività anti-glioma di DCA in combinazione con MTF è stato rilevato non solo in vitro ma anche in vivo.
In condizioni in vivo, l’elevata efficacia antitumorale della combinazione di DCA e MTF ha portato a un significativo prolungamento della vita media dei ratti affetti da tumore. Secondo lo studio istologico del tessuto tumorale di ratti con glioma C6, un contributo significativo all’azione anti-glioma di DCA e MTF è stato dato dalla loro capacità di indurre l’apoptosi se usati in combinazione. Sebbene in vitro non sia stato osservato un aumento dell’azione pro-apoptotica della combinazione di DCA e MTF (apparentemente legato a una concentrazione studiata piuttosto bassa di quest’ultimo), i dati istologici hanno indicato la loro capacità di indurre sinergicamente l’apoptosi nei tumori. Nel lavoro [18], il sinergismo dell’azione pro-apoptotica di questi due agenti è stato dimostrato anche in relazione alle cellule tumorali ovariche.
Oltre all’azione pro-apoptotica, l’elevata efficacia dell’effetto anti-glioma del DCA in combinazione con il MTF è stata associata a una diminuzione del grado di invasione tumorale e alla distruzione dei vasi sanguigni nel tumore. Quest’ultima può causare un deficit di nutrienti, in particolare di glucosio, nel microambiente tumorale, con conseguente soppressione della crescita tumorale.
La maggiore efficacia antitumorale della combinazione di DCA e MTF può essere dovuta anche al coinvolgimento di ulteriori meccanismi di azione degli agenti, tra cui la loro azione sulle cellule normali dell’organismo, che possono alterare significativamente i livelli di substrati nutritivi nel microambiente tumorale, in particolare nel sangue. Questo vale per l’MTF, che, attraverso l’attivazione dell’AMP-activated protein kinase, è in grado di influenzare il metabolismo del glucosio e dei lipidi degli epatociti e dei muscoli scheletrici [19], e per il DCA, noto come universalmente efficace nell’abbassare i livelli di lattato [20]. In particolare, abbiamo precedentemente dimostrato che il DCA in combinazione con MTF riduce i livelli di lattato e glucosio nel sangue dei ratti, il che è correlato alla loro attività antitumorale [21]. È anche possibile che un certo contributo all’effetto anti-glioma della combinazione di DCA e MTF sia dato dalla loro capacità di correggere l’anemia e la trombocitopenia che si sviluppano sullo sfondo della crescita del glioma C6 nei ratti [21].
Pertanto, i dati presentati indicano il sinergismo dell’azione anti-glioma di DCA e MTF nel caso del loro uso combinato sia in vitro che in vivo e possono essere considerati un punto di partenza per lo sviluppo di regimi di trattamento efficaci per i tumori cerebrali maligni basati sull’uso combinato di DCA e MTF.
RIFERIMENTI
1 1. Taal W, Bromberg JE, van den Bent MJ. Chemioterapia nel glioma. CNS Oncol 2015; 4: 179-92.
2 Chowdhary MM, Ene CI, Silbergeld DL. Trattamento dei gliomi: come siamo arrivati a questo punto? Surg Neurol Int 2015; 6: S85-8.
3 Wang Y, Xing D, Zhao M, et al. Il ruolo di un singolo inibitore dell’angiogenesi nel trattamento del glioblastoma multiforme ricorrente: una meta-analisi e una revisione sistematica. PLoS One 2016; 11: e0152170.
4 Ameratunga M, Pavlakis N, Wheeler H, et al. Terapia antiangiogenica per il glioma di alto grado. Cochrane Database Syst Rev 2018; 11: CD008218.
5 Agnihotri S, Zadeh G. Metabolic reprogramming in glioblastoma: the influence of cancer metabolism on epigenetics and unanswered questions. Neuro-Oncol 2016; 18: 160-72.
6 Weber GF. Tempo e circostanze: il metabolismo delle cellule tumorali nelle varie fasi della progressione della malattia. Front Oncol 2016; 6: 257.
7 Seyfried TN, Sanderson TM, El-Abbadi MM, et al. Role of glucose and ketone bodies in the metabolic control of experimental brain cancer. Br J Cancer 2003; 89: 1375-82.
8 Seliger C, Meyer A-L, Renner K, et al. La metformina inibisce la proliferazione e la migrazione delle cellule di glioblastoma indipendentemente dal TGF-β2. Cell Cycle 2016; 15: 1755-66.
9 Sesen J, Dahan P, Scotland SJ, et al.La metformina inibisce la crescita delle cellule di glioblastoma umano e migliora la risposta terapeutica. PLoS One 2015; 10: e0123721.
10 Seliger C, Renner K. P08.52 Metformina come terapia adiuvante per il glioma. Neuro-Oncology 2017; 19: iii65.
11 Michelakis ED, Sutendra G, Dromparis P, et al. Modulazione metabolica del glioblastoma con dicloroacetato. Sci Transl Med 2010; 2: 31ra34.
12 Duan Y, Zhao X, Ren W, et al. Attività antitumorale del dicloroacetato sulle cellule di glioma C6: valutazione in vitro e in vivo. Onco Targets Ther 2013; 6: 189-98.
13 Fedorchuk AG, Pyaskovskaya ON, Gorbik GV, et al. L’efficacia del dicloroacetato di sodio contro il glioma C6 dipende dallo schema di somministrazione e dal dosaggio. Exp Oncol 2016; 38: 80-3.
14 Nicoletti I, Migliorati G, Pagliacci MC, et al. Un metodo rapido e semplice per misurare l’apoptosi dei timociti mediante colorazione con ioduro di propidio e citometria a flusso. J Immunol Methods 1991; 139: 271-80.
15 Wheaton WW, Weinberg SE, Hamanaka RB, et al. La metformina inibisce il complesso mitocondriale I delle cellule tumorali per ridurre la tumorigenesi. eLife 2014; 3: e02242.
16 Michelakis ЕD, Websterl L, Mackey JR. Il dicloroacetato (DCA) come potenziale terapia a bersaglio metabolico per il cancro. Br J Cancer 2008; 99: 989-94.
17 Pyaskovskaya ON, Kolesnik DL, Fedorchuk AG, et al. Cytotoxic activity of metformin in vitro does not correlate with its antitumor action in vivo. Exp Oncol 2017; 39: 264-8.
18 Bo Li, Xinzhe Li, Zhenhong Ni, et al. Dicloroacetato e metformina sopprimono sinergicamente la crescita delle cellule di cancro ovarico. Oncotarget 2016; 7: 59458-90.
19 Zhou G, Myers R, Li Y, et al. Ruolo dell’AMP-activated protein kinase nel meccanismo d’azione della metformina. J Clin Invest 2001; 108: 1167-74.
20 Abdelmalak M, Lew A, Ramezani R, et al. Sicurezza a lungo termine del dicloroacetato nell’acidosi lattica congenita. Mol Genet Metab 2013; 109: 139-43.
21 Prokhorova IV, Pyaskovskaya ON, Kolesnik DL, Solyanik GI. Influenza della metformina, del dicloroacetato di sodio e della loro combinazione sui parametri ematologici e biochimici del sangue di ratti con glioma C6. Exp Oncol 2018; 40: 205-10.