D.L. Kolesnik*, O.N. Pyaskovskaya, O.V. Yurchenko, G.I. Solyanik
R.E. Kavetsky Institut de pathologie expérimentale, d’oncologie et de radiobiologie, NAS d’Ukraine, Kyiv 03022, Ukraine
Soumis le 06 mai 2019.
*Correspondance : Courriel : [email protected] Abréviations utilisées : DCA – dichloroacétate de sodium ; MTF – metformine ; Δψm – potentiel de la membrane mitochondriale ; IC50 – concentration inhibitrice demi-maximale
Résumé
Il est connu que l’arsenal d’agents chimiothérapeutiques pour le traitement des tumeurs cérébrales malignes est assez limité, ce qui entraîne la grande pertinence de la recherche visant à trouver de nouveaux régimes antitumoraux efficaces, y compris l’utilisation de modificateurs du métabolisme énergétique. Objectif : étudier l’activité anti-gliome du dichloroacétate de sodium (DCA) et de la metformine (MTF) utilisés en combinaison in vitro et in vivo. Matériaux et méthodes : La survie cellulaire, le cycle cellulaire, l’apoptose, le potentiel de la membrane mitochondriale (Δψm), le niveau d’ATP, le taux de consommation de glucose et le taux de production de lactate ont été déterminés in vitro dans des cellules de gliome C6 en culture. L’action antitumorale des agents in vivo a été évaluée de façon routinière par la prolongation de la durée de vie de rats porteurs d’un gliome intracérébral C6 transplanté et a été confirmée par l’examen histologique des tissus tumoraux. Résultats : La concentration inhibitrice demi-maximale (CI50) du DCA et du MTF utilisés séparément était de 79,2 ± 2,1 mM et 78,4 ± 4,0 mM, respectivement, tandis que la CI50 du DCA utilisé en association avec 7,8 mM de MTF était 3,3 fois plus faible (24,0 ± 1,2 mM, p < 0,05). L’incubation des cellules pendant une journée avec du DCA à une concentration proche de la CI50 (25 mM), en combinaison avec du MTF à une concentration inférieure d’un ordre de grandeur à la CI50 (7,8 mM), contrairement à leur utilisation séparée, a entraîné une diminution du nombre de cellules viables de 40 % (p < 0.05) ; une redistribution des cellules selon les phases du cycle cellulaire vers une diminution de la proportion de cellules en phase S de 46% (p < 0,05) et une augmentation du pourcentage de cellules en phase G0/G1 de 24% (p < 0,05) par rapport à des indices similaires dans le contrôle. L’activité proapoptotique élevée du DCA en association avec le MTF a été confirmée par un pourcentage de cellules apoptotiques in vitro significativement plus élevé que dans le contrôle (18,9 ± 4,4 % contre 5,7 ± 1,3 %, p < 0,05) et un nombre élevé de cellules tumorales présentant des signes d’apoptose révélés lors de l’examen histologique de la pathomorphose tumorale. L’effet combiné du DCA et du MTF a entraîné une diminution de près de 4 fois du taux de consommation de glucose par les cellules de gliome C6 (0,23 ± 0,05 μmol/106 cellules/h vs 0,91 ± 0,12 μmol/106 cellules/h, p<0.05) par rapport aux paramètres correspondants dans le contrôle, et un taux de production de lactate 2 fois plus élevé (1,06 ± 0,03 μmol/106 cellules/h vs 0,53 ± 0,03 μmol/106 cellules/h, p < 0,05). Parallèlement, le Δψm et le niveau d’ATP intracellulaire dans les cellules de gliome C6 traitées par le DCA et le MTF, séparément et en combinaison, ne différaient pas significativement de ces indices dans le contrôle. Dans les études in vivo, la durée de vie moyenne des rats présentant un gliome C6 transplanté par voie intracrânienne, traités par le DCA en association avec le MTF à une dose totale de 1,1 et 2,6 g/kg de poids corporel, respectivement, était supérieure de 50 % (p < 0,001) à celle du groupe témoin. En revanche, dans le cas de l’usage unique (à une dose de 2,6 g/kg), le MTF a augmenté la durée de vie des animaux porteurs de tumeurs de seulement 19 % (p < 0,01), tandis que le DCA seul (à une dose de 1,1 g/kg) n’a pas modifié de manière significative la durée de survie des rats. Conclusions : Les données obtenues indiquent une synergie de l’action anti-gliome du DCA et du MTF dans le cas de leur utilisation combinée à la fois in vitro et in vivo et peuvent être considérées comme un point de départ pour le développement de schémas thérapeutiques efficaces pour les tumeurs cérébrales malignes basés sur l’utilisation combinée du DCA et du MTF.
Mots clés: gliome C6, dichloroacétate de sodium, metformine.
Les gliomes malins sont connus pour être les tumeurs humaines les plus agressives avec un pronostic généralement défavorable, même avec les progrès actuels de la thérapie antitumorale, y compris la thérapie anti-angiogénique, la thérapie moléculaire ciblée et l’immunothérapie. L’introduction de nouvelles méthodes de thérapie multimodale anti-gliome conduit à une certaine augmentation de l’espérance de vie moyenne des patients, mais, malheureusement, un patient ne gagne généralement pas plus de 3 à 6 mois de vie [1-4]. Compte tenu de l’indéniable renaissance dans le domaine des études liées au métabolisme du glucose dans les cellules tumorales [5, 6], d’une part, et de la forte dépendance des cellules cérébrales au glucose [7], d’autre part, la tentative d’augmenter l’efficacité de la thérapie antitumorale en modifiant les voies métaboliques de l’utilisation du glucose dans les cellules tumorales semble être prometteuse.
Dans des études expérimentales, la metformine (MTF), un inhibiteur de la chaîne respiratoire mitochondriale (complexe I), largement utilisée dans le traitement du diabète de type 2 comme agent hypoglycémiant, a montré sa capacité à inhiber la prolifération et la migration des cellules de glioblastome [8], à inhiber la croissance des xénogreffes de gliomes U87 et LN18 chez l’animal [9], etc. Les résultats d’une étude épidémiologique utilisant une large base de données validée ont montré que l’utilisation à long terme de MTF, bien que non associée à une réduction du risque de développement de gliome, contribue cependant à une meilleure survie des patients atteints de gliome malin [10].
L’activité antitumorale du dichloroacétate de sodium (DCA), un médicament non cancérigène utilisé depuis 30 ans pour le traitement des troubles métaboliques, en particulier l’acidose lactique, a été confirmée in vitro et in vivo, notamment contre les cellules de gliome [11-13].
L’objectif de ce travail était d’étudier l’activité antigliome du DCA et du MTF dans le cas de leur utilisation combinée in vitro et in vivo.
MATÉRIEL ET MÉTHODES
Animaux expérimentaux et lignées cellulaires tumorales. Les études ont été réalisées sur des rats femelles consanguins âgés de 2,5 à 3 mois et pesant de 100 à 130 g provenant du vivarium de l’Institut R.E. Kavetsky de pathologie expérimentale, d’oncologie et de radiobiologie (IEPOR) de l’Académie nationale des sciences d’Ukraine (NASU), Kyiv, Ukraine. Les recherches sur les animaux ont été menées conformément aux dispositions des principes éthiques généraux de l’expérimentation animale adoptés par le premier congrès sur la bioéthique (Kyiv, 2001) et aux exigences internationales conformément à la Convention européenne sur la protection des animaux vertébrés utilisés à des fins expérimentales ou autres (Strasbourg, 1986).
La lignée cellulaire de gliome C6 a été utilisée comme modèle tumoral expérimental. Elle a été obtenue auprès de la Banque nationale de lignées cellulaires et de souches tumorales de l’IEPOR NASU.
Les cellules de gliome C6 ont été maintenues in vitro dans du DMEM avec 10% de sérum de veau fœtal (Sigma, USA) et 40 mg/ml de gentamicine à 37 °С dans une atmosphère humidifiée à 5% СО2.
Pour les expériences in vivo, les cellules ont été cultivées in vitro dans des conditions standard et transplantées chez des rats sous anesthésie générale par inoculation intracérébrale de 0,6-106 cellules dans 0,05 ml de sérum physiologique dans la région pariétale gauche du cerveau.
Agents, doses et mode d’administration. Le DCA (Sigma, USA) et le MTF (Sigma, USA) ont été utilisés comme composés à l’étude.
Pour évaluer l’activité antitumorale du DCA, du MTF et de leur combinaison chez les rats après inoculation de cellules tumorales, les animaux ont été randomisés en fonction de leur poids et répartis en 4 groupes : 1)rats ayant reçu uniquement du DCA à une dose totale de 1.1 g/kg (n = 12) ; 2) rats auxquels on a administré uniquement du MTF à une dose totale de 2,6 g/kg (n = 12) ; 3) rats auxquels on a administré du DCA en combinaison avec du MTF (n = 13) aux doses ci-dessus ; et 4) rats auxquels on a administré de l’eau (contrôle, n = 12).
Dans tous les cas, les agents ont été dissous dans l’eau et administrés par voie orale à l’aide d’une sonde, une fois par jour, à partir du premier jour après l’inoculation des cellules tumorales. Dans le cas de l’utilisation combinée du DCA et du MTF, ce dernier a été administré 3-4 h après l’administration du DCA.
Tous les agents ont été préparés ex tempore.
Les effets cytotoxiques/cytostatiques du DCA et du MTF, seuls et en association, ont été évalués par l’indice de concentration inhibitrice demi-maximale (IC50) – concentration de l’agent qui provoque une réduction de 50 % du nombre de cellules viables par rapport au contrôle en raison de son action cytotoxique et/ou cytostatique.
Des cellules de gliome C6 ont été ensemencées dans une boîte de Pétri de 35 mm à une densité de 0,5-106 cellules/ml. Après la période de pré-incubation (16-18 h), le milieu a été remplacé par un milieu frais avec l’ajout des agents expérimentaux, et l’incubation s’est poursuivie pendant 1 jour.
Dans tous les cas, les cellules qui ont été incubées dans des conditions analogues, mais sans l’ajout d’aucun agent, ont servi de contrôle.
Chaque concentration d’agent et chaque combinaison de ces agents ont été évaluées dans 3 répétitions (pour la détermination de la CI50 ) ou 5 répétitions (pour la détermination des effets du DCA 25 mM, du MTF 7,8 mM et de leur combinaison).
Le nombre de cellules viables au début de l’incubation (N0) et après 1 jour (N24) a été évalué par leur comptage direct dans un hémocytomètre en utilisant du bleu trypan.
Ladistribution des cellules selon les phases du cycle cellulaire et le niveau d’apoptose ont été évalués par cytométrie en flux en utilisant l’iodure de propidium et la RNAase A [14]. Le nombre de cellules apoptotiques a été évalué par le pic sub-G0/G1.
Le taux de consommation de glucose et le taux de production de lactate par les cellules tumorales ont été estimés sur la base du contenu des substrats dans le milieu d’incubation et du nombre de cellules viables au début de la période d’incubation et après 1 jour.
Le niveau de glucose et de lactate a été déterminé dans des échantillons déprotéinés de surnageants en utilisant un analyseur biochimique et des kits commerciaux pour leur détermination.
Lepotentiel de la membrane interne des mitochondries (Δψm) des cellules tumorales a été déterminé à l’aide de la cytométrie en flux et du colorant cationique JC-10 (Sigma, USA) par le rapport de l’intensité de la fluorescence dans les régions rouge (FL2) et verte (FL1).
L’efficacité de l’action antitumorale des agents étudiés a été évaluée par la prolongation de la durée de vie (LSP) des animaux des groupes expérimentaux par rapport à la durée de vie des animaux du groupe témoin, qui a été calculée par la formule :
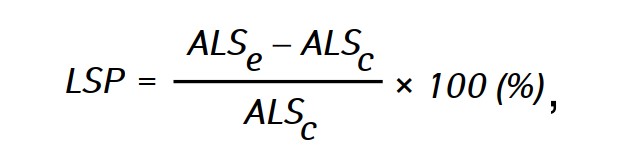
où ALSe et ALSc-la durée de vie moyenne des rats des groupes expérimental et témoin respectivement.
Pour l’examen histologique, les échantillons de tissu tumoral des rats atteints de gliome C6 ont été fixés dans une solution de formol tamponnée neutre à 10% pendant 24 heures, déshydratés dans des alcools de concentrations croissantes et inclus dans de la paraffine. Les coupes histologiques ont été colorées à l’hématoxyline-éosine et analysées à l’aide du microscope AxioStarPlusZeiss.
L’analyse statistique des données a été réalisée à l’aide de statistiques descriptives, du test t de Student et du test u de Mann- Whitney, de l’analyse de régression non linéaire à l’aide des logiciels Microsoft Excel et Microcal Origin. Les données sont présentées sous la forme M ± m, où M est la valeur moyenne ; m est l’erreur standard de la valeur moyenne.
RÉSULTATS ET DISCUSSION
Nous avons montré que le MTF augmente significativement l’activité cytotoxique et/ou cytostatique du DCA contre les cellules C6 de gliome in vitro. En particulier, dans le cas de son utilisation unique, la CI50 du DCA était de 79,2 ± 2,1 mM, alors que cet indice pour le DCA utilisé en combinaison avec le MTF, même à faible concentration non cytotoxique, a diminué de plus de trois fois (p < 0,05) (tableau 1, figure 1). En outre, si la mort cellulaire nécrotique due à l’action du DCA et du MTF utilisés séparément était assez faible dans une large gamme de concentrations des deux agents et ne dépassait pas 15 % même aux concentrations maximales étudiées, l’utilisation du DCA en combinaison avec 7,8 mM de MTF a entraîné une forte augmentation du nombre de cellules mortes en fonction de la concentration, surtout dans la gamme de concentrations de DCA supérieures à la CI50 (figure 1, c).
| Agent | DCA | MTF | IC50, mM |
| DCA | 10-100 | – | 79.2 ± 2.1 |
| MTF | – | 7.8-80 | 78.4 ± 4.0 |
| DCA + MTF | 10-40 | 7.8 | 24.0 ± 1.2* |
Remarque : *p < 0,05 par rapport à la valeur correspondante dans le cas d’un usage unique.
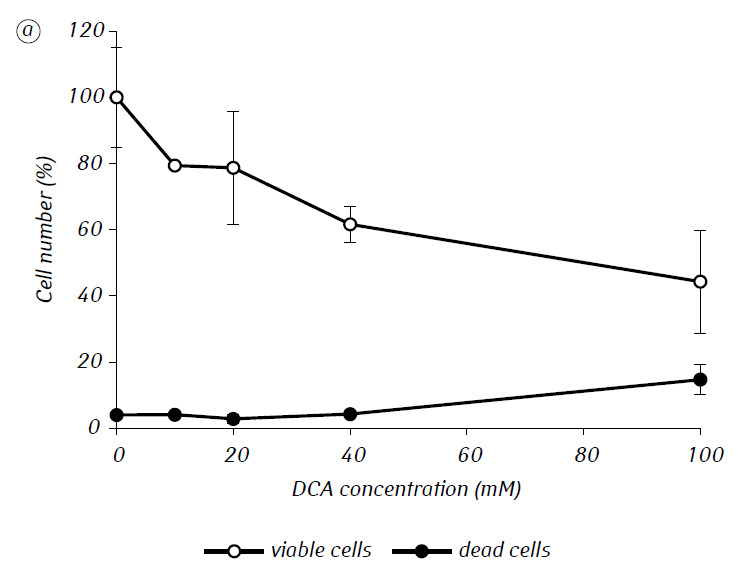
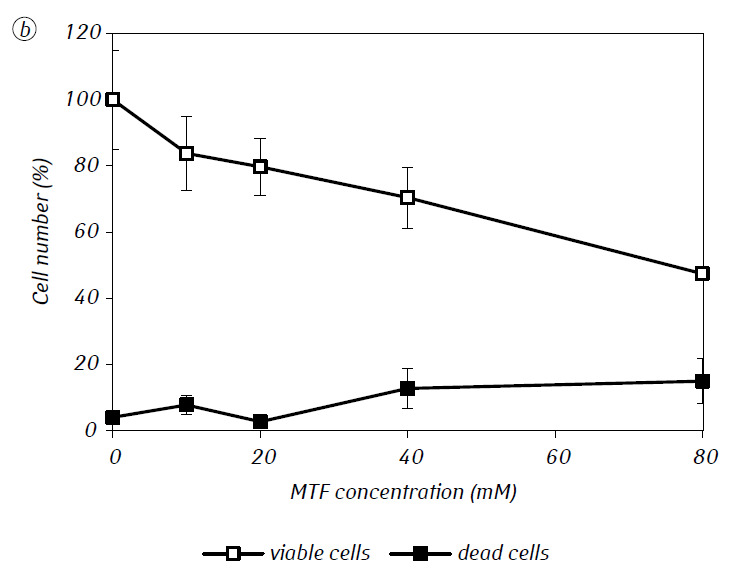
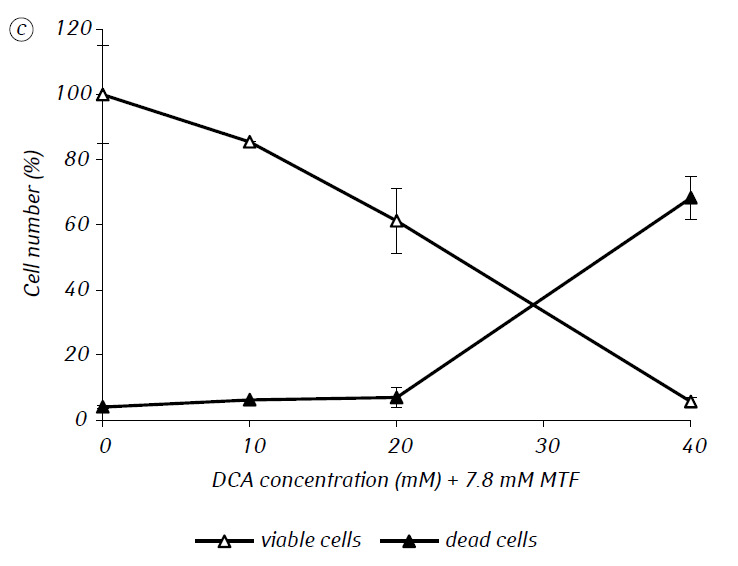
Pour une évaluation plus détaillée de l’action synergique des deux agents, les cellules de gliome C6 ont été incubées pendant 1 jour avec 25 mM de DCA (concentration proche de la CI50) et 7,8 mM de MTF (concentration inférieure à la CI50), en combinaison et séparément. Les données obtenues sur leur influence sur les caractéristiques de croissance des cellules C6 de gliome, ainsi que sur les caractéristiques associées à leur métabolisme énergétique, sont présentées dans le tableau 2.
| Indice | Contrôle | 25 mM DCA | 7.8 mM MTF | 25 mM DCA+ 7.8 mM MTF |
| Nombre de cellules viables, en % | 100.0 ± 5.3 | 91.5 ± 2.3 | 85.3 ± 6.7 | 60.2 ± 2.0 |
| N24/N0 | 1.9 ± 0.1 | 1.8 ± 0.04 | 1.7 ± 0.1 | 1.2 ± 0.04* |
| Nécrose, en pourcentage | 2.6 ± 0.6 | 2.9 ± 0.8 | 5.5 ± 1.6 | 6.9 ± 2.6 |
| Apoptose, en pourcentage | 5.7 ± 1.3 | 30.2 ± 4.1* | 5.6 ± 2.5 | 18.9 ± 4.4* |
| G0/G1, EN POURCENTAGE | 49.0 ± 2.3 | 49.6 ± 2.2 | 46.2 ± 3.3 | 60.8 ± 1.3* |
| G2/M, EN POURCENTAGE | 30.7 ± 4.3 | 27.5 ± 1.7 | 29.7 ± 2.8 | 28.2 ± 3.07 |
| S, % | 20.3 ± 2.7 | 22.9 ± 1.0 | 21.1 ± 3.3 | 11.0 ± 1.8* |
| Δψm (FL2/FL1) | 0.85 ± 0.15 | 0.97 ± 0.01 | 0.81 ± 0.04 | 0.96 ± 0.01 |
| Le taux de consommation de glucose, µmol/106 cellules-h | 0.91 ± 0.12 | 0.16 ± 0.02* | 0.46 ± 0.07* | 0.23 ± 0.05* |
| Taux de production de lactate, µmol/106 cellules-h | 0.53 ± 0.03 | 0.42 ± 0.01* | 1.1 ± 0.02* | 1.06 ± 0.03* |
| Niveau d’ATP, pmol/106 cellules | 9835 ± 357 | 9819 ± 292 | – | 9379 ± 191 |
Note : *p < 0,05 par rapport à l’indice correspondant dans le contrôle.
Comme on peut le voir dans le tableau 2, l’action synergique du DCA en combinaison avec le MTF contre les cellules de gliome C6 a été confirmée par une forte diminution du nombre de cellules viables de près de 40% (p < 0,05) par rapport à l’indice correspondant dans le contrôle, alors que dans le cas de leur utilisation indépendante, le nombre de cellules viables n’a pas été affecté de manière significative. Dans le même temps, le nombre de cellules mortes était faible dans tous les cas et ne différait pratiquement pas de celui du témoin.
De même, aucun effet significatif du DCA en association avec le MTF sur l’induction de l’apoptose dans les cellules de gliome C6 n’a été détecté. La forte augmentation de plus de trois fois (p < 0,05) du nombre de cellules apoptotiques dans le cas de l’utilisation combinée du DCA et du MTF s’est produite uniquement en raison de l’action du DCA lui-même. Ce dernier a été confirmé par le niveau élevé d’apoptose induite par le DCA, qui, dans le cas de son utilisation séparée, dépassait de 5,3 fois (p < 0,05) la valeur correspondante dans le contrôle (tableau 2).
Contrairement au DCA, le MTF 7,8 mM utilisé seul n’a pas augmenté l’apoptose dans ces cellules et a même réduit la sensibilité des cellules à l’action proapoptotique du DCA s’il était utilisé en association. En particulier, le nombre de cellules apoptotiques induites par la combinaison du DCA et du MTF était presque 1,5 fois inférieur (p < 0,05) à celui induit par le DCA.
L’effet synergique anti-gliome du DCA et du MTF a également été confirmé par une augmentation de près de 24 % (p < 0,05) du pourcentage de cellules en phase G0/G1 et une diminution significative de leur fraction (de près de 46 %, p < 0,05) en phase S, alors que le DCA et le MTF utilisés séparément n’ont pas affecté de manière significative la distribution des phases du cycle cellulaire (tableau 2).
Nous attirons l’attention sur le fait que l’ajout de DCA et de MTF, à la fois séparément et en combinaison, a réduit de manière significative le taux de consommation de glucose. En revanche, le taux de production de lactate dans les cellules traitées au DCA a été fortement réduit, tandis que cet indice dans les cellules traitées au MTF, seul ou en combinaison, a augmenté de manière significative.
En particulier, dans les cellules traitées au DCA, on a observé une forte baisse du taux de consommation de glucose de 82 % (p < 0,05) ainsi qu’une diminution de 21 % (p < 0,05) du taux de production de lactate par rapport à des paramètres de contrôle similaires. Le MTF, contrairement au DCA, a fortement augmenté la production de lactate par les cellules tumorales, que ce soit dans le cas d’une utilisation séparée ou en combinaison avec le DCA. Le taux de production de lactate a augmenté de près de 108 % (p < 0,05) et de 100 % (p < 0,05) dans les cellules traitées par le MTF seul et en combinaison avec le DCA, respectivement, par rapport à celui du témoin. Il est intéressant de noter que malgré l’effet significatif du DCA et du MTF sur le métabolisme des cellules tumorales, ils n’ont pratiquement pas réduit le niveau d’ATP dans les cellules tumorales. Comme on peut le voir dans le tableau 2, la teneur en ATP intracellulaire dans les cellules traitées par le DCA et le MTF, seuls ou en association, ne différait pas significativement de celle du témoin.
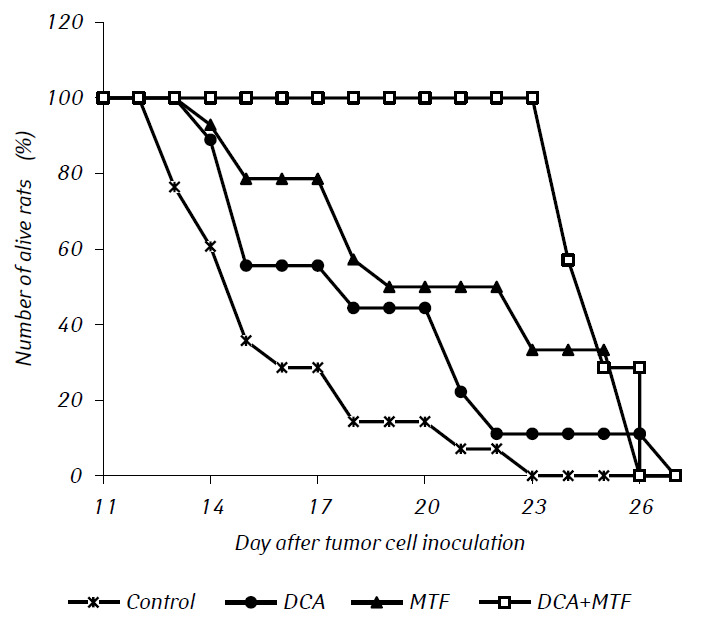
Dans les expériences in vivo, le MTF a significativement renforcé l’effet antitumoral du DCA, entraînant une synergie de leur action. Les courbes de survie des animaux expérimentaux sont présentées dans la figure 2. La durée de vie moyenne des rats atteints d’un gliome C6 transplanté par voie intracrânienne et traités uniquement avec du DCA ne différait pratiquement pas de celle des témoins, alors que l’administration de MTF uniquement prolongeait significativement la durée de vie des rats atteints de tumeurs de près de 20 % (p < 0,01). L’utilisation combinée de DCA et de MTF a entraîné une augmentation significative de leurs effets anti-gliomes, ce qui a été confirmé par une prolongation significative de la durée de vie des animaux de 50 % (p < 0,001) et de plus de 26 % (p < 0,05) par rapport à cet indice dans le groupe témoin et dans le groupe de rats auxquels on a administré uniquement du MTF, respectivement.
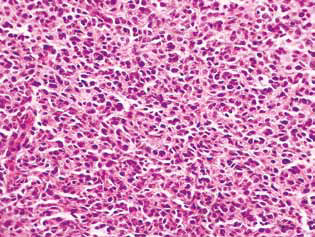
L’examen histologique du tissu tumoral des rats atteints de gliome C6 a révélé certaines modifications de sa structure, qui sont en corrélation avec la grande efficacité de l’action antigliome des agents étudiés. Chez les animaux témoins, la tumeur s’est généralement développée dans les couches moléculaires ou inférieures du cortex cérébral. Morphologiquement, la zone de néoplasie était représentée par l’accumulation de grandes cellules et de noyaux de forme diverse, hyperchromes ou à contenu chromatinien modéré. Dans les échantillons étudiés, le polymorphisme cellulaire et la présence de grandes cellules multi-nucléaires étaient typiques. Les cellules tumorales possèdent, en règle générale, une forme allongée avec un cytoplasme, avec des structures fibreuses, et des noyaux bien exprimés. Certaines cellules étaient de taille plus petite, arrondies, avec des noyaux denses hyperchromes (Fig. 3).
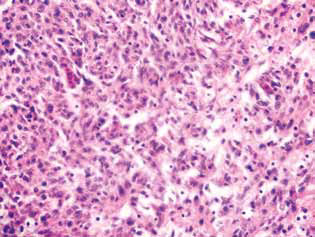
Chez les rats traités par le DCA et le MTF seuls ou en association, on a observé dans le tissu tumoral une accumulation de cellules apoptotiques ou de cellules présentant des structures annulaires hyperchromiques à la périphérie des noyaux, preuve de l’activation de l’apoptose. Il est à noter que ces phénomènes étaient beaucoup plus exprimés dans le cas de l’utilisation combinée des agents (Fig. 4).
Une manifestation marquée de l’action anti-gliome du DCA en association avec le MTF a été une diminution significative des régions satellites dans le tissu cérébral (Fig. 5). Dans le groupe d’animaux témoins, les structures satellites étaient situées près du nœud principal de la tumeur et étaient assez fréquentes. Autour des quelques cellules malignes qui ont migré à partir du tissu tumoral principal, le processus d’angiogenèse néoplasique a manifestement été lancé, ce qui a conduit à la formation d’un vaisseau sanguin et à la formation d’un rebord multicouche à partir des cellules malignes qui l’entourent, ce qui s’est ensuite accompagné de la fusion de ces structures avec la lésion principale et d’une augmentation de la taille de la tumeur (Fig. 5, a).
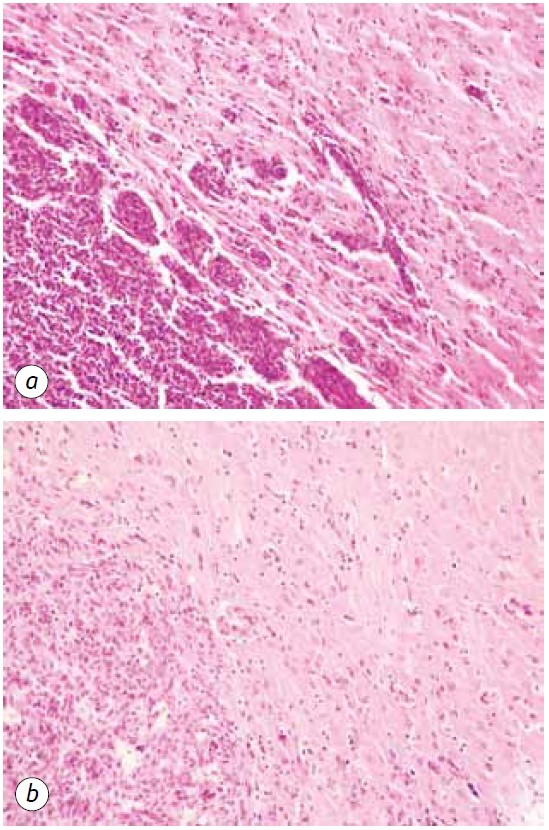
Au contraire, chez les animaux recevant du DCA en association avec du MTF, on a observé une forte diminution de la formation des lésions tumorales satellites, ce qui peut être dû à la suppression de la néoangiogenèse et à l’incapacité de former de nouveaux sites de croissance néoplasique (Fig. 5, b). En outre, la pathomorphose tumorale chez les animaux recevant du DCA en association avec du MTF s’est manifestée par la présence de lésions tumorales clairement dévastées (Fig. 6) et d’un nombre suffisamment important de vaisseaux sanguins détruits et dévastés dans le tissu tumoral (Fig. 7).
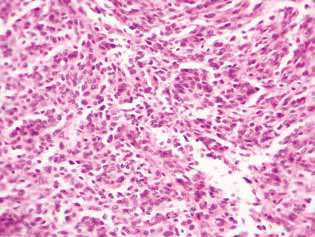
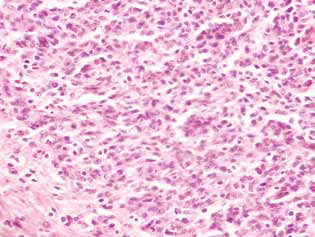
Par conséquent, l’inhibition significative de la prolifération des cellules du gliome C6 in vitro due à l’utilisation combinée de 25 mM de DCA et de 7,8 mM de MTF, qui contrastait avec une mort cellulaire mineure, était principalement due à leur action cytostatique. La composante cytostatique de l’effet synergique du DCA et du MTF sur les cellules de gliome C6 a également été confirmée par l’accumulation significative de cellules en phase G0/G1 et la diminution de leur fraction en phase S. Apparemment, le renforcement de l’action synergique du DCA et du MTF a permis d’augmenter le nombre de cellules en phase G0/G1.
Apparemment, le renforcement de l’action anti-gliome du DCA et du MTF grâce à leur association a été causé par leurs effets multidirectionnels sur le métabolisme énergétique des cellules tumorales. En particulier, le taux de production de lactate dans les cellules de gliome C6 sans l’ajout d’aucun agent (contrôle) était presque deux fois inférieur au taux de consommation de glucose. Une telle corrélation entre ces indices indique l’existence dans ces cellules non seulement de la conversion glycolytique du glucose en lactate, mais aussi d’une activité plutôt élevée de la phosphorylation oxydative et des processus anaboliques de synthèse des biomolécules.
Dans les cellules traitées au DCA, une forte diminution de la consommation de glucose accompagnée d’une diminution simultanée du taux de production de lactate a indiqué que le DCA à une concentration de 25 mM était capable de réaliser son potentiel en tant qu’inhibiteur de la kinase pyruvate déshydrogénase et d’augmenter l’intensité de la respiration mitochondriale et de supprimer indirectement la glycolyse dans ces cellules.
Une forte diminution du taux de consommation de glucose dans les cellules de gliome due à l’action du DCA a été associée à son activité prononcée d’induction de l’apoptose. Malgré l’effet pro-apoptotique significatif du DCA et le déplacement du métabolisme cellulaire vers la respiration mitochondriale, aucune modification apparente du potentiel de la membrane interne des mitochondries dans les cellules de gliome C6 n’a été détectée.
Contrairement au DCA, dans les cellules tumorales traitées avec le MTF, on a détecté une augmentation significative de la production de lactate, que ce soit dans le cas de son utilisation séparée ou en combinaison avec le DCA. De toute évidence, cela s’est produit par l’inhibition du complexe I de la chaîne de transport des électrons des mitochondries par le MTF [15], même à de faibles concentrations non toxiques. Si l’on tient compte du fait que l’activation de la glycolyse favorise généralement l’acquisition de la résistance des cellules tumorales aux stimuli pro-apoptotiques [16], la chute de plus de 1,5 fois de l’apoptose induite par le DCA lors de l’utilisation combinée des agents peut être attribuée, au moins en partie, à l’activation de la glycolyse aérobie induite par le MTF dans les cellules de gliome C6.
Dans le cas de l’association DCA et MTF, la modification du métabolisme énergétique induite par le MTF a été mise en œuvre dans une plus large mesure. Étant donné le taux élevé de production de lactate par les cellules traitées avec le MTF seul ou en combinaison avec le DCA, on peut conclure que dans ce dernier cas, la glycolyse induite par le MTF a dominé le métabolisme mitochondrial induit par le DCA dans les cellules tumorales.
Il convient de noter que malgré l’effet significatif sur le métabolisme tumoral du DCA et du MTF, utilisés séparément ou en association, ils n’ont pratiquement pas réduit le niveau d’ATP dans les cellules tumorales. L’absence de modification du niveau d’ATP dans les cellules tumorales due à l’effet du DCA et du MTF, seuls ou en combinaison, indique la mise en œuvre de réponses compensatoires dans les cellules pour maintenir l’approvisionnement en énergie et une plasticité métabolique suffisamment élevée de ces cellules.
Nous avons précédemment montré que l’effet antitumoral des modificateurs du métabolisme énergétique, en particulier le MTF, dépendait considérablement du microenvironnement des cellules tumorales et pouvait différer radicalement des effets in vitro [17]. Dans ces études, la synergie de l’activité anti-gliome du DCA en association avec le MTF a été détectée non seulement in vitro mais aussi in vivo.
Dans des conditions in vivo, l’efficacité antitumorale élevée de l’association de DCA et de MTF a entraîné une prolongation significative de la durée de vie moyenne des rats atteints de tumeurs. Selon l’étude histologique du tissu tumoral de rats atteints de gliome C6, une contribution significative à l’action anti-gliome du DCA et du MTF a été apportée par leur capacité à induire l’apoptose s’ils sont utilisés en association. Bien que l’on n’ait pas observé in vitro d’augmentation de l’action pro-apoptotique de l’association DCA et MTF (ce qui était apparemment lié à une concentration étudiée plutôt faible de ce dernier), les données histologiques ont indiqué leur capacité à induire de manière synergique l’apoptose dans les tumeurs. Dans le travail [18], la synergie de l’action pro-apoptotique de ces deux agents a également été démontrée en relation avec les cellules tumorales ovariennes.
En plus de l’action pro-apoptotique, la grande efficacité de l’effet anti-gliome du DCA en combinaison avec le MTF a été associée à une diminution du degré d’invasion de la tumeur et à la destruction des vaisseaux sanguins dans la tumeur. Ces derniers peuvent provoquer un déficit en nutriments, en particulier en glucose, dans le microenvironnement de la tumeur, entraînant la suppression de la croissance tumorale.
L’efficacité antitumorale supérieure de l’association du DCA et du MTF peut également être due à l’implication de mécanismes d’action supplémentaires des agents, notamment leur action sur les cellules normales de l’organisme, qui peuvent modifier de manière significative les niveaux de substrats nutritifs dans le microenvironnement tumoral, en particulier dans le sang. C’est le cas du MTF, qui, par l’activation de la protéine kinase activée par l’AMP, est capable d’affecter le métabolisme du glucose et des lipides des hépatocytes et des muscles squelettiques [19], et du DCA, connu pour son efficacité universelle dans la réduction des niveaux de lactate [20]. En particulier, nous avons déjà montré que le DCA associé au MTF diminue les taux de lactate et de glucose dans le sang des rats, ce qui est en corrélation avec leur activité antitumorale [21]. Il est également possible qu’une certaine contribution à l’effet anti-gliome de l’association DCA et MTF soit qu’ils soient capables de corriger l’anémie et la thrombocytopénie qui se développent dans le contexte de la croissance du gliome C6 chez le rat [21].
Ainsi, les données présentées indiquent la synergie de l’action anti-gliome du DCA et du MTF dans le cas de leur utilisation combinée à la fois in vitro et in vivo et peuvent être considérées comme un point de départ pour le développement de schémas thérapeutiques efficaces pour les tumeurs cérébrales malignes basés sur l’utilisation combinée du DCA et du MTF.
RÉFÉRENCES
1 1. Taal W, Bromberg JE, van den Bent MJ. La chimiothérapie dans les gliomes. CNS Oncol 2015 ; 4 : 179-92.
2 Chowdhary MM, Ene CI, Silbergeld DL. Traitement des gliomes : comment en est-on arrivé là ? Surg Neurol Int 2015 ; 6 : S85-8.
3 Wang Y, Xing D, Zhao M, et al. Le rôle d’un seul inhibiteur de l’angiogenèse dans le traitement du glioblastome multiforme récurrent : une méta-analyse et une revue systématique. PLoS One 2016 ; 11 : e0152170.
4 Ameratunga M, Pavlakis N, Wheeler H, et al. Traitement antiangiogénique pour les gliomes de haut grade. Cochrane Database Syst Rev 2018 ; 11 : CD008218.
5 Agnihotri S, Zadeh G. Reprogrammation métabolique dans le glioblastome : l’influence du métabolisme du cancer sur l’épigénétique et les questions sans réponse. Neuro-Oncol 2016 ; 18 : 160-72.
6 Weber GF. Le temps et les circonstances : le métabolisme des cellules cancéreuses à divers stades de la progression de la maladie. Front Oncol 2016 ; 6 : 257.
7 Seyfried TN, Sanderson TM, El-Abbadi MM, et al. Rôle du glucose et des corps cétoniques dans le contrôle métabolique du cancer expérimental du cerveau. Br J Cancer 2003 ; 89 : 1375-82.
8 Seliger C, Meyer A-L, Renner K, et al. La metformine inhibe la prolifération et la migration des cellules de glioblastome indépendamment du TGF-β2. Cell Cycle 2016 ; 15 : 1755-66.
9 Sesen J, Dahan P, Scotland SJ, et al.La metformine inhibe la croissance des cellules de glioblastome humain et améliore la réponse thérapeutique. PLoS One 2015 ; 10 : e0123721.
10 Seliger C, Renner K. P08.52 La metformine comme traitement adjuvant du gliome. Neuro-Oncologie 2017 ; 19 : iii65.
11 Michelakis ED, Sutendra G, Dromparis P, et al. Modulation métabolique du glioblastome avec le dichloroacétate. Sci Transl Med 2010 ; 2 : 31ra34.
12 Duan Y, Zhao X, Ren W, et al. Activité antitumorale du dichloroacétate sur la cellule de gliome C6 : évaluation in vitro et in vivo. Onco Targets Ther 2013 ; 6 : 189-98.
13 Fedorchuk AG, Pyaskovskaya ON, Gorbik GV, et al. L’efficacité du dichloroacétate de sodium contre le gliome C6 dépend du calendrier d’administration et du dosage. Exp Oncol 2016 ; 38 : 80-3.
14 Nicoletti I, Migliorati G, Pagliacci MC, et al. Une méthode rapide et simple pour mesurer l’apoptose des thymocytes par coloration à l’iodure de propidium et cytométrie de flux. J Immunol Methods 1991 ; 139 : 271-80.
15 Wheaton WW, Weinberg SE, Hamanaka RB, et al. La metformine inhibe le complexe mitochondrial I des cellules cancéreuses pour réduire la tumorigenèse. eLife 2014 ; 3 : e02242.
16 Michelakis ЕD, Websterl L, Mackey JR. Le dichloroacétate (DCA) comme une thérapie potentielle ciblant le métabolisme pour le cancer. Br J Cancer 2008 ; 99 : 989-94.
17 Pyaskovskaya ON, Kolesnik DL, Fedorchuk AG, et al. L’activité cytotoxique de la metformine in vitro n’est pas corrélée à son action antitumorale in vivo. Exp Oncol 2017 ; 39 : 264-8.
18 Bo Li, Xinzhe Li, Zhenhong Ni, et al. Le dichloroacétate et la metformine suppriment en synergie la croissance des cellules cancéreuses ovariennes. Oncotarget 2016 ; 7 : 59458-90.
19 Zhou G,Myers R, Li Y, et al. Rôle de la protéine kinase activée par l’AMP dans le mécanisme d’action de la metformine. J Clin Invest 2001 ; 108 : 1167-74.
20 Abdelmalak M, Lew A, Ramezani R, et al. Sécurité à long terme du dichloroacétate dans l’acidose lactique congénitale. Mol Genet Metab 2013 ; 109 : 139-43.
21 Prokhorova IV, Pyaskovskaya ON, Kolesnik DL, Solyanik GI. Influence de la metformine, du dichloroacétate de sodium et de leur combinaison sur les paramètres sanguins hématologiques et biochimiques des rats atteints de gliome C6. Exp Oncol 2018 ; 40 : 205-10.