Д.Л. Колесник*, О.Н. Пясковская, О.В. Юрченко, Г.И. Соляник
Институт экспериментальной патологии, онкологии и радиобиологии
Е. Кавецкого НАН Украины, Киев 03022, Украина
Submitted: May 06, 2019.
*Переписка: E-mail: [email protected] Используемые сокращения: ДХА — дихлорацетат натрия; МТФ — метформин; Δψm — мембранный потенциал митохондрий; IC50 — половина максимальной ингибирующей концентрации
Аннотация
Известно, что арсенал химиотерапевтических средств для лечения злокачественных опухолей головного мозга весьма ограничен, что обуславливает высокую актуальность исследований, направленных на поиск новых эффективных противоопухолевых схем, в том числе с использованием модификаторов энергетического метаболизма. Цель: изучить антиглиомную активность дихлорацетата натрия (ДХА) и метформина (МТФ), используемых в комбинации in vitro и in vivo. Материалы и методы: Выживаемость клеток, клеточный цикл, апоптоз, мембранный потенциал митохондрий (Δψm), уровень АТФ, скорость потребления глюкозы и скорость выработки лактата определяли in vitro в культивируемых клетках глиомы C6. Противоопухолевое действие агентов in vivo оценивалось рутинно по увеличению продолжительности жизни крыс с трансплантированной внутримозговой глиомой C6 и подтверждалось гистологическим исследованием опухолевой ткани. Результаты: Половина максимальной ингибирующей концентрации (IC50) для DCA и MTF, используемых отдельно, составила 79,2 ± 2,1 мМ и 78,4 ± 4,0 мМ, соответственно, тогда как IC50 для DCA, используемого в комбинации с 7,8 мМ MTF, была в 3,3 раза ниже (24,0 ± 1,2 мМ, p < 0,05). 1-суточная инкубация клеток с ДКА в концентрации, близкой к IC50 (25 мМ), в сочетании с МТФ в концентрации на порядок ниже IC50 (7,8 мМ), в отличие от их раздельного применения, приводила к снижению количества жизнеспособных клеток на 40% (p < 0.05); перераспределение клеток по фазам клеточного цикла в сторону уменьшения доли клеток в S-фазе на 46% (p < 0,05) и увеличения доли клеток в фазе G0/G1 на 24% (p < 0,05) по сравнению с аналогичными показателями в контроле. Высокая проапоптотическая активность ДКА в комбинации с МТФ подтверждалась значительно большим процентом апоптотических клеток in vitro по сравнению с контролем (18,9 ± 4,4% против 5,7 ± 1,3%, p < 0,05) и большим количеством опухолевых клеток с признаками апоптоза, выявленных при гистологическом исследовании патоморфоза опухоли. Совместное действие ДКА и МТФ привело к почти 4-кратному снижению скорости потребления глюкозы клетками глиомы С6 (0,23 ± 0,05 мкмоль/106 клеток/ч против 0,91 ± 0,12 мкмоль/106 клеток/ч, p<0.05) по сравнению с соответствующими параметрами в контроле, и в 2 раза увеличилась скорость выработки лактата (1,06 ± 0,03 мкмоль/106 клеток/ч против 0,53 ± 0,03 мкмоль/106 клеток/ч, p<0,05). В то же время, как Δψm, так и уровень внутриклеточного АТФ в клетках глиомы С6, обработанных DCA и MTF, как отдельно, так и в комбинации, существенно не отличались от показателей в контроле. В исследованиях in vivo средняя продолжительность жизни крыс с внутричерепно пересаженной глиомой С6, леченных ДКА в комбинации с МТФ в общей дозе 1,1 и 2,6 г/кг массы тела соответственно, была на 50% выше (p < 0,001), чем в контрольной группе. Напротив, в случае однократного применения (в дозе 2,6 г/кг) МТФ увеличил продолжительность жизни опухоленосителей всего на 19% (p < 0,01), тогда как только ДКА (в дозе 1,1 г/кг) существенно не изменил время выживания крыс. Выводы: Полученные данные свидетельствуют о синергизме противоглиомного действия ДКА и МТФ при их совместном применении как in vitro, так и in vivo и могут рассматриваться как отправная точка для разработки эффективных схем лечения злокачественных опухолей головного мозга на основе комбинированного применения ДКА и МТФ.
Ключевые слова: глиома С6, дихлорацетат натрия, метформин.
Известно, что злокачественные глиомы являются наиболее агрессивными опухолями человека, как правило, с неблагоприятным прогнозом, даже с учетом современных достижений в противоопухолевой терапии, включая антиангиогенную терапию, таргетную молекулярную терапию и иммунотерапию. Внедрение новых методов мультимодальной противоглиомной терапии приводит к некоторому увеличению средней продолжительности жизни пациентов, но, к сожалению, обычно пациент проживает не более 3-6 месяцев [1-4]. Учитывая несомненный ренессанс в области исследований, связанных с метаболизмом глюкозы в опухолевых клетках [5, 6], с одной стороны, и высокую зависимость клеток мозга от глюкозы [7], с другой, перспективной представляется попытка повысить эффективность противоопухолевой терапии путем модификации метаболических путей утилизации глюкозы в опухолевых клетках.
В экспериментальных исследованиях метформин (МТФ), ингибитор митохондриальной дыхательной цепи (комплекса I), широко применяемый для лечения сахарного диабета 2 типа в качестве гипогликемического средства, показал способность подавлять пролиферацию и миграцию клеток глиобластомы [8], тормозить рост ксенотрансплантатов глиомы U87 и LN18 у животных [9] и др. Результаты эпидемиологического исследования с использованием большой валидированной базы данных показали, что длительное применение МТФ, хотя и не связано со снижением риска развития глиомы, однако способствует лучшей выживаемости пациентов со злокачественной глиомой [10].
Противоопухолевая активность дихлорацетата натрия (ДХА), неракового препарата, который уже 30 лет используется как средство для лечения метаболических нарушений, в частности, молочнокислого ацидоза, была подтверждена in vitro и in vivo, в частности, против клеток глиомы [11-13].
Целью данной работы было исследование противоглиомной активности ДКА и МТФ при их совместном применении in vitro и in vivo.
МАТЕРИАЛЫ И МЕТОДЫ
Экспериментальные животные и линии опухолевых клеток. Исследования проводили на инбредных крысах-самках в возрасте 2,5-3 месяцев весом 100-130 г из вивария Института экспериментальной патологии, онкологии и радиобиологии имени Р.Е. Кавецкого (ИЭПОР) Национальной академии наук Украины (НАНУ), Киев, Украина. Исследования на животных проводились в соответствии с положениями Общих этических принципов проведения экспериментов на животных, принятых Первым конгрессом по биоэтике (Киев, 2001) и международными требованиями в соответствии с Европейской конвенцией о защите позвоночных животных, используемых для экспериментальных и других целей (Страсбург, 1986).
В качестве экспериментальной опухолевой модели использовали линию клеток глиомы С6, полученную из Национального банка клеточных линий и опухолевых штаммов ИЕПОР НАНУ.
Клетки глиомы С6 поддерживали in vitro в среде DMEM с 10% фетальной телячьей сывороткой (Sigma, США) и 40 мг/мл гентамицина при 37 °С в увлажненной атмосфере с 5% СО2.
Для экспериментов in vivo клетки выращивали in vitro в стандартных условиях и пересаживали крысам под общим наркозом путем внутримозговой инокуляции 0,6-106 клеток в 0,05 мл физиологического раствора в левую теменную область мозга.
Агенты, дозы и способ введения. В качестве исследуемых соединений использовали DCA (Sigma, США) и MTF (Sigma, США).
Для оценки противоопухолевой активности DCA, MTF и их комбинации у крыс после инокуляции опухолевых клеток животные были рандомизированы по весу и распределены на 4 группы: 1) крысы, которым вводили только DCA в общей дозе 1.1)крысы, которым вводили только ДКА в общей дозе 1 г/кг (n = 12); 2)крысы, которым вводили только МТФ в общей дозе 2,6 г/кг (n = 12); 3)крысы, которым вводили ДКА в комбинации с МТФ (n = 13) в указанных дозах; и 4)крысы, которым вводили воду (контроль, n = 12).
Во всех случаях агенты растворяли в воде и вводили перорально с зондом, один раз в день, начиная с первого дня после инокуляции опухолевых клеток. В случае комбинированного применения DCA и MTF, последний вводился через 3-4 часа после введения DCA.
Все препараты готовились ex tempore.
Цитотоксическое/цитостатическое действие DCA и MTF отдельно и в комбинации оценивали по показателю половинной максимальной ингибирующей концентрации (IC50) — концентрации агента, которая вызывает 50% снижение количества жизнеспособных клеток по отношению к контролю за счет его цитотоксического и/или цитостатического действия.
Клетки глиомы С6 высевали в 35 мм чашки Петри при плотности 0,5-106 клеток/мл. После периода преинкубации (16-18 ч) среду заменяли свежей с добавлением исследуемых агентов, и инкубация продолжалась в течение 1 дня.
Во всех случаях клетки, инкубированные в аналогичных условиях, но без добавления каких-либо агентов, служили контролем.
Каждая концентрация агента и их комбинация оценивались в 3 репликах (для определения IC50 ) или 5 репликах (для определения эффектов 25 мМ DCA, 7,8 мМ MTF и их комбинации).
Количество жизнеспособных клеток в начале инкубации (N0) и через 1 день (N24) оценивали путем их прямого подсчета в гемоцитометре с использованием трипанового синего.
Распределение клеток по фазам клеточного цикла и уровень апоптоза оценивали методом проточной цитометрии с использованием йодистого пропидия и РНКазы А [14]. Количество апоптотических клеток оценивали по пику sub-G0/G1.
Скорость потребления глюкозы и скорость выработки лактата опухолевыми клетками оценивали по содержанию субстратов в инкубационной среде и количеству жизнеспособных клеток в начале инкубационного периода и через 1 день.
Уровень глюкозы и лактата определяли в депротеинизированных образцах супернатантов с использованием биохимического анализатора и коммерческих наборов для их определения.
Внутренний мембранный потенциал митохондрий (Δψm) опухолевых клеток определяли с помощью проточной цитометрии и катионного красителя JC-10 (Sigma, США) по соотношению интенсивности флуоресценции в красной (FL2) и зеленой (FL1) областях.
Эффективность противоопухолевого действия исследуемых средств оценивали по увеличению продолжительности жизни (УПЖ) животных в опытных группах по сравнению с продолжительностью жизни животных в контрольной группе, которую рассчитывали по формуле:
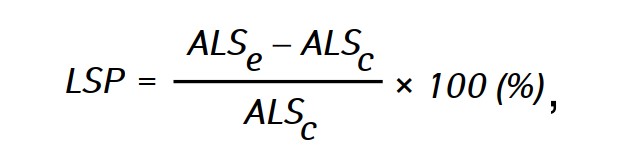
где ALSe и ALSc— средняя продолжительность жизни крыс в опытной и контрольной группах соответственно.
Для гистологического исследования образцы опухолевой ткани крыс с глиомой С6 фиксировали в 10% нейтральном забуференном растворе формалина в течение 24 ч, обезвоживали в спиртах возрастающей концентрации и заключали в парафин. Гистологические срезы окрашивали гематоксилин-эозином и анализировали с помощью микроскопа AxioStarPlusZeiss.
Статистический анализ данных проводили с использованием описательной статистики, t-теста Стьюдента и u-теста Манна-Уитни, нелинейного регрессионного анализа с использованием программ Microsoft Excel и Microcal Origin. Данные представлены в виде M ± m, где M — среднее значение; m — стандартная ошибка среднего значения.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Мы показали, что MTF значительно усиливал цитотоксическую и/или цитостатическую активность DCA против клеток глиомы C6 in vitro. В частности, в случае его однократного применения IC50 ДКА составляла 79,2 ± 2,1 мМ, тогда как этот показатель для ДКА, используемого в комбинации с МТФ даже в низкой нецитотоксической концентрации, снижался более чем в три раза (p < 0,05) (табл. 1, рис. 1). Кроме того, если некротическая гибель клеток под действием ДКА и МТФ, используемых отдельно, была достаточно низкой в широком диапазоне концентраций обоих агентов и не превышала 15% даже при максимальных исследованных концентрациях, то применение ДКА в комбинации с 7,8 мМ МТФ приводило к резкому концентрационно-зависимому увеличению числа погибших клеток, особенно в диапазоне концентраций ДКА выше IC50 (рис. 1, в).
| Агент | DCA | МТФ | IC50, мМ |
| DCA | 10-100 | — | 79.2 ± 2.1 |
| МТФ | — | 7.8-80 | 78.4 ± 4.0 |
| DCA + MTF | 10-40 | 7.8 | 24.0 ± 1.2* |
Примечание: *p < 0,05 по сравнению с соответствующим значением в случае однократного использования.
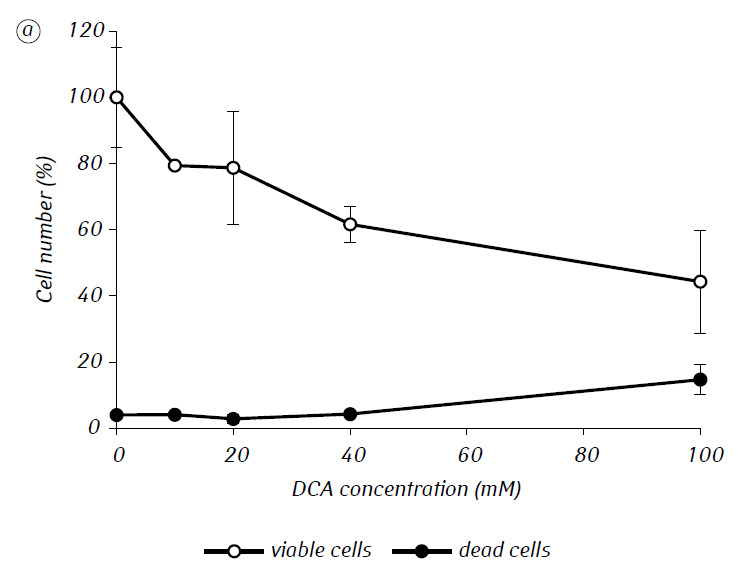
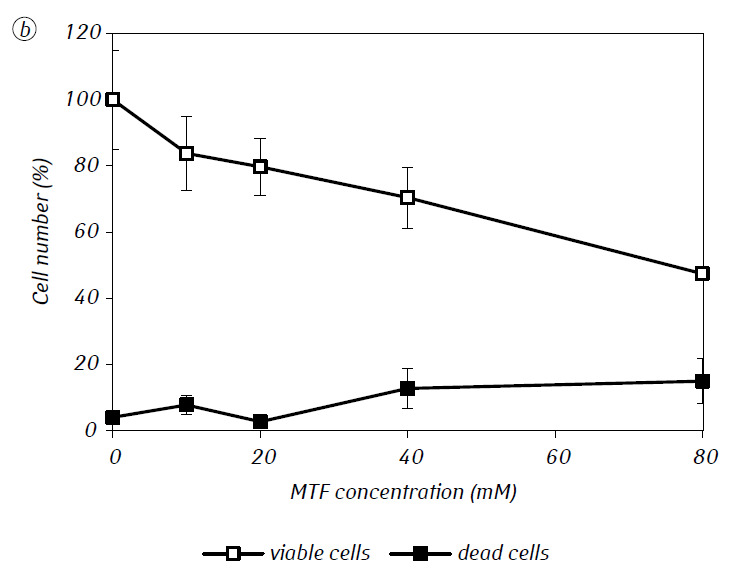
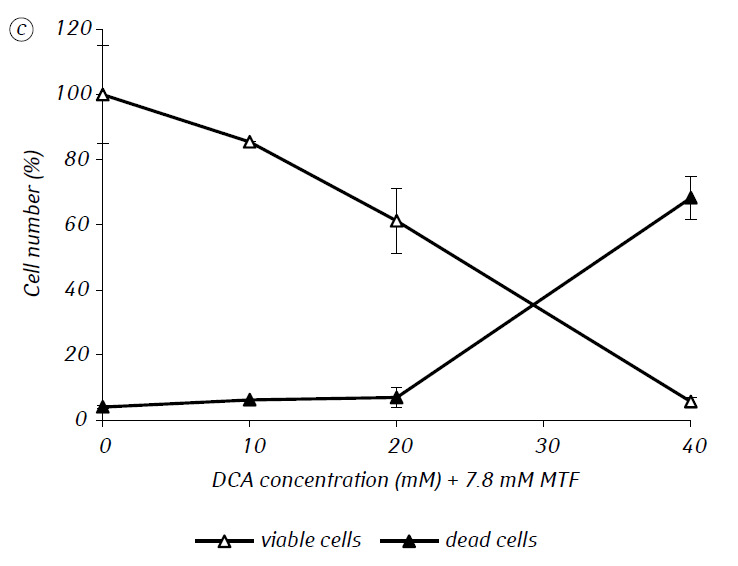
Для более детальной оценки синергического действия двух агентов клетки глиомы С6 инкубировали в течение 1 суток с 25 мМ ДКА (концентрация близкая к IC50) и 7,8 мМ МТФ (концентрация меньше IC50) в комбинации и по отдельности. Полученные данные об их влиянии на характеристики роста клеток глиомы С6, а также характеристики, связанные с их энергетическим метаболизмом, представлены в таблице 2.
| Показатель | Контроль | 25 мМ DCA | 7.8 мМ МТФ | 25 мМ DCA+ 7,8 мМ MTF |
| Количество жизнеспособных клеток, % | 100.0 ± 5.3 | 91.5 ± 2.3 | 85.3 ± 6.7 | 60.2 ± 2.0 |
| N24/N0 | 1.9 ± 0.1 | 1.8 ± 0.04 | 1.7 ± 0.1 | 1.2 ± 0.04* |
| Некроз, % | 2.6 ± 0.6 | 2.9 ± 0.8 | 5.5 ± 1.6 | 6.9 ± 2.6 |
| Апоптоз, % | 5.7 ± 1.3 | 30.2 ± 4.1* | 5.6 ± 2.5 | 18.9 ± 4.4* |
| G0/G1, % | 49.0 ± 2.3 | 49.6 ± 2.2 | 46.2 ± 3.3 | 60.8 ± 1.3* |
| G2/M, % | 30.7 ± 4.3 | 27.5 ± 1.7 | 29.7 ± 2.8 | 28.2 ± 3.07 |
| S, % | 20.3 ± 2.7 | 22.9 ± 1.0 | 21.1 ± 3.3 | 11.0 ± 1.8* |
| Δψm (FL2/FL1) | 0.85 ± 0.15 | 0.97 ± 0.01 | 0.81 ± 0.04 | 0.96 ± 0.01 |
| Скорость потребления глюкозы, мкмоль/106 клеток-ч | 0.91 ± 0.12 | 0.16 ± 0.02* | 0.46 ± 0.07* | 0.23 ± 0.05* |
| Скорость выработки лактата, мкмоль/106 клеток-ч | 0.53 ± 0.03 | 0.42 ± 0.01* | 1.1 ± 0.02* | 1.06 ± 0.03* |
| Уровень АТФ, пмоль/106 клеток | 9835 ± 357 | 9819 ± 292 | — | 9379 ± 191 |
Примечание: *p < 0,05 по сравнению с соответствующим показателем в контроле.
Как видно из таблицы 2, синергическое действие ДКА в комбинации с МТФ против клеток глиомы С6 подтверждается резким снижением количества жизнеспособных клеток почти на 40% (p < 0,05) по сравнению с соответствующим показателем в контроле, тогда как в случае их независимого применения количество жизнеспособных клеток существенно не изменялось. В то же время количество мертвых клеток во всех случаях было низким и практически не отличалось от такового в контроле.
Аналогичным образом не было выявлено значительного влияния ДКА в комбинации с МТФ на индукцию апоптоза в клетках глиомы С6. Резкое увеличение более чем в три раза (p < 0,05) количества апоптотических клеток в случае комбинированного применения ДКА и МТФ происходило только за счет действия самого ДКА. Последнее подтверждалось высоким уровнем ДКА-индуцированного апоптоза, который в случае его раздельного применения в 5,3 раза (p < 0,05) превышал соответствующее значение в контроле (табл. 2).
В отличие от ДКА, 7,8 мМ МТФ, использованный отдельно, не увеличивал апоптоз в этих клетках и даже снижал чувствительность клеток к проапоптотическому действию ДКА при его совместном применении. В частности, количество апоптотических клеток, индуцированных комбинацией DCA и MTF, было почти в 1,5 раза меньше (p < 0,05), чем индуцированных DCA.
Синергический антиглиомный эффект ДКА и МТФ подтверждался также увеличением почти на 24% (p < 0,05) процента клеток в фазе G0/G1 и значительным снижением их доли (почти на 46%, p < 0,05) в фазе S, тогда как ДКА и МТФ, использованные по отдельности, не оказывали существенного влияния на распределение фаз клеточного цикла (табл. 2).
Обращает на себя внимание тот факт, что добавление ДКА и МТФ, как отдельно, так и в комбинации, значительно снижало скорость потребления глюкозы. Напротив, скорость выработки лактата в клетках, обработанных DCA, резко снижалась, тогда как этот показатель в клетках, обработанных MTF, отдельно или в комбинации, значительно возрастал.
В частности, в клетках, обработанных ДКА, наблюдалось резкое снижение скорости потребления глюкозы на 82% (p < 0,05) наряду с 21% (p < 0,05) снижением скорости выработки лактата по сравнению с аналогичными контрольными параметрами. MTF, в отличие от DCA, значительно увеличивал выработку лактата опухолевыми клетками, как при отдельном применении, так и в комбинации с DCA. Скорость выработки лактата увеличилась почти на 108% (p < 0,05) и на 100% (p < 0,05) в клетках, обработанных только МТФ и в комбинации с DCA, соответственно, по сравнению с контролем. Интересно, что, несмотря на значительное влияние ДКА и МТФ на метаболизм опухолевых клеток, они практически не снижали уровень АТФ в опухолевых клетках. Как видно из таблицы 2, содержание внутриклеточного АТФ в клетках, обработанных DCA и MTF отдельно или в комбинации, существенно не отличалось от контроля.
В экспериментах in vivo МТФ значительно усилил противоопухолевый эффект ДКА, что привело к синергизму их действия. Кривые выживаемости экспериментальных животных представлены на рис. 2. Средняя продолжительность жизни крыс с внутричерепной трансплантированной глиомой С6, получавших только ДКА, практически не отличалась от контрольной, тогда как введение только МТФ значительно увеличивало продолжительность жизни крыс с опухолями почти на 20% (p < 0,01). Комбинированное применение ДКА и МТФ привело к значительному усилению их антиглиомного действия, что подтверждалось значительным увеличением продолжительности жизни животных на 50% (p < 0,001) и более чем на 26% (p < 0,05) по сравнению с этим показателем в контрольной группе и в группе крыс, которым вводили только МТФ, соответственно.
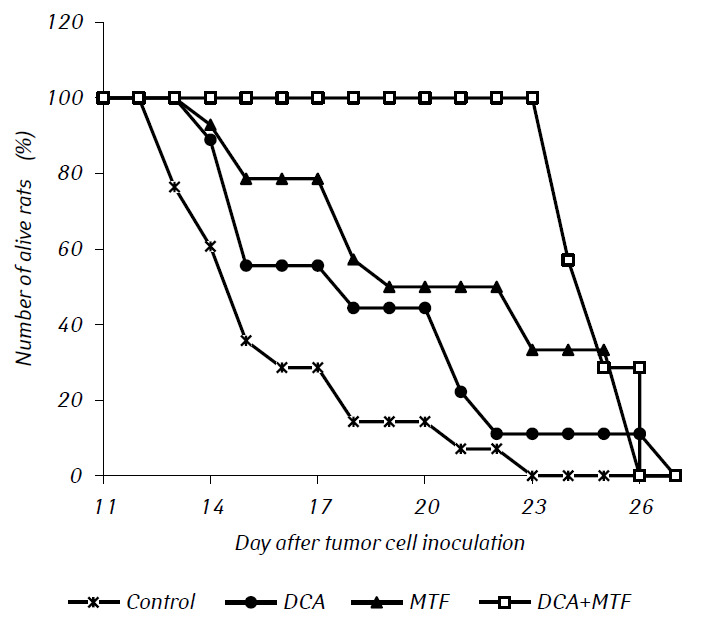
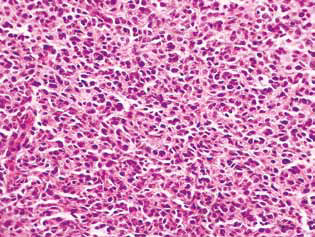
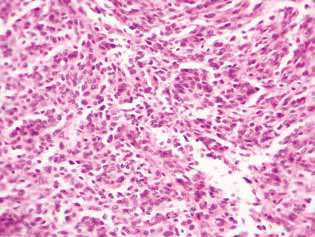
Гистологическое исследование опухолевой ткани крыс с глиомой С6 выявило некоторые изменения в ее структуре, что коррелировало с высокой эффективностью противоглиомного действия исследуемых агентов. У контрольных животных опухоль обычно развивалась в молекулярном или нижних слоях коры головного мозга. Морфологически зона неоплазии была представлена скоплением крупных клеток и ядер разнообразной формы, гиперхромных или с умеренным содержанием хроматина. Для исследованных образцов были характерны клеточный полиморфизм, наличие многоядерных крупных клеток. Опухолевые клетки обладали, как правило, вытянутой формой с цитоплазмой, с волокнистыми структурами, хорошо выраженными ядрами. Некоторые клетки были меньшего размера, округлой формы, с плотными гиперхромными ядрами (рис. 3).
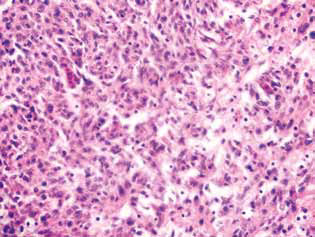
У крыс, получавших ДКА и МТФ отдельно или в комбинации, в опухолевой ткани наблюдалось накопление апоптотических клеток или клеток с гиперхромными кольцевидными структурами на периферии ядер как свидетельство активации апоптоза. Следует отметить, что эти явления были гораздо более выражены в случае комбинированного применения агентов (рис. 4).
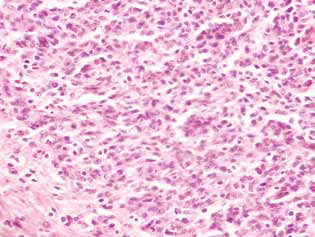
Ярким проявлением антиглиомного действия ДКА в комбинации с МТФ было значительное уменьшение сателлитных областей в ткани мозга (рис. 5). В контрольной группе животных сателлитные структуры располагались вблизи основного узла опухоли и были достаточно распространены. Вокруг нескольких злокачественных клеток, мигрировавших из основной ткани опухоли, очевидно, запускался процесс неопластического ангиогенеза, что приводило к образованию кровеносного сосуда и формированию вокруг него многослойного ободка из злокачественных клеток, что в дальнейшем сопровождалось слиянием таких структур с основным поражением и увеличением размеров опухоли (рис. 5, а).
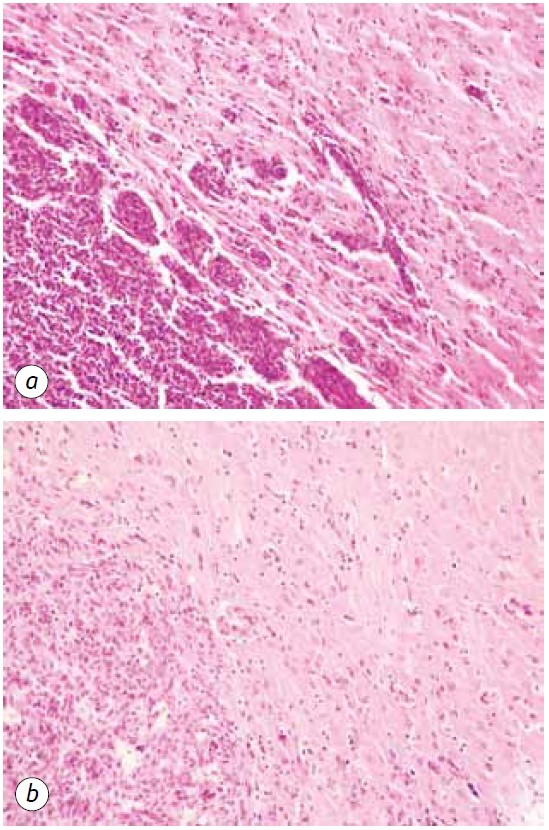
Напротив, у животных, получавших ДКА в комбинации с МТФ, наблюдалось резкое снижение образования сателлитных опухолевых очагов, что может быть связано с подавлением неоангиогенеза и невозможностью формирования новых участков неопластического роста (рис. 5, б). Кроме того, патоморфоз опухоли у животных, получавших ДКА в комбинации с МТФ, проявлялся наличием четких опустошенных опухолевых очагов (рис. 6) и достаточно большим количеством разрушенных и опустошенных кровеносных сосудов в опухолевой ткани (рис. 7).
Следовательно, значительное ингибирование пролиферации клеток глиомы С6 in vitro при совместном применении 25 мМ DCA и 7,8 мМ MTF, которое контрастировало с незначительной гибелью клеток, было обусловлено в основном их цитостатическим действием. Цитостатический компонент в синергетическом эффекте ДКА и МТФ в отношении клеток глиомы С6 подтверждался также значительным накоплением клеток в фазе G0/G1 и снижением их доли в S-фазе.
По-видимому, усиление антиглиомного действия ДКА и МТФ за счет их комбинации было обусловлено их разнонаправленным влиянием на энергетический метаболизм опухолевых клеток. В частности, скорость образования лактата в клетках глиомы С6 без добавления каких-либо агентов (контроль) была почти в два раза ниже, чем скорость потребления глюкозы. Такое соотношение между этими показателями указывало на наличие в этих клетках не только гликолитического превращения глюкозы в лактат, но и достаточно высокой активности окислительного фосфорилирования и анаболических процессов синтеза биомолекул.
В клетках, обработанных ДКА, резкое снижение потребления глюкозы при одновременном снижении скорости выработки лактата свидетельствовало о том, что ДКА в концентрации 25 мМ способен реализовать свой потенциал ингибитора киназы пируватдегидрогеназы, повысить интенсивность митохондриального дыхания и косвенно подавить гликолиз в этих клетках.
Резкое снижение скорости потребления глюкозы в клетках глиомы под действием DCA было связано с его выраженной апоптоз-индуцирующей активностью. Несмотря на значительный проапоптотический эффект DCA и сдвиг клеточного метаболизма в сторону митохондриального дыхания, явных изменений мембранного потенциала внутренней мембраны митохондрий в клетках глиомы С6 обнаружено не было.
В отличие от DCA, в опухолевых клетках, обработанных MTF, было обнаружено значительное увеличение продукции лактата, как в случае его отдельного применения, так и в комбинации с DCA. Очевидно, это происходило через ингибирование МТФ комплекса I электронно-транспортной цепи митохондрий [15], даже в низких нетоксичных концентрациях. Учитывая тот факт, что активация гликолиза обычно способствует приобретению опухолевыми клетками устойчивости к проапоптотическим стимулам [16], более чем 1,5-кратное снижение DCA-индуцированного апоптоза при комбинированном применении агентов может быть, по крайней мере частично, приписано MTF-индуцированной активации аэробного гликолиза в клетках глиомы C6.
В случае комбинации DCA и MTF, MTF-индуцированная модификация энергетического метаболизма была реализована в большей степени. Учитывая высокую скорость образования лактата клетками, обработанными МТФ отдельно или в комбинации с ДКА, можно сделать вывод, что в последнем случае МТФ-индуцированный гликолиз доминировал над ДКА-индуцированным митохондриальным метаболизмом в опухолевых клетках.
Следует отметить, что, несмотря на значительное влияние на опухолевый метаболизм ДКА и МТФ, применяемых отдельно или в комбинации, они практически не снижали уровень АТФ в опухолевых клетках. Отсутствие изменений уровня АТФ в опухолевых клетках под действием ДКА и МТФ по отдельности и в комбинации указывало на реализацию в клетках компенсаторных реакций для поддержания энергообеспечения клеток и достаточно высокую метаболическую пластичность этих клеток.
Ранее мы показали, что противоопухолевый эффект модификаторов энергетического метаболизма, в частности МТФ, существенно зависит от микроокружения опухолевых клеток и может радикально отличаться от эффектов in vitro [17]. В этих исследованиях синергизм антиглиомной активности DCA в комбинации с МТФ был обнаружен не только in vitro, но и in vivo.
В условиях in vivo высокая противоопухолевая эффективность комбинации DCA и MTF привела к значительному увеличению средней продолжительности жизни крыс с опухолями. По данным гистологического исследования опухолевой ткани крыс с глиомой С6, значительный вклад в противоглиомное действие DCA и MTF внесла их способность вызывать апоптоз при использовании в комбинации. Хотя in vitro не наблюдалось усиления проапоптотического действия комбинации DCA и MTF (что, видимо, было связано с достаточно низкой исследуемой концентрацией последнего), гистологические данные указывали на их способность синергично индуцировать апоптоз в опухолях. В работе [18] синергизм проапоптотического действия этих двух агентов был также показан в отношении клеток опухоли яичников.
Помимо проапоптотического действия, высокая эффективность антиглиомного действия DCA в комбинации с MTF была связана с уменьшением степени инвазии опухоли и разрушением кровеносных сосудов в опухоли. Последнее может вызвать дефицит питательных веществ, в частности глюкозы, в микроокружении опухоли, что приводит к подавлению роста опухоли.
Более высокая противоопухолевая эффективность комбинации DCA и MTF может быть также обусловлена вовлечением дополнительных механизмов действия агентов, включая их действие на нормальные клетки организма, которые могут существенно изменять уровни питательных субстратов в микроокружении опухоли, в частности в крови. Это относится и к МТФ, который через активацию AMP-активированной протеинкиназы способен влиять на глюкозный и липидный обмен гепатоцитов и скелетных мышц [19], и к DCA, известному как универсально эффективный в снижении уровня лактата [20]. В частности, ранее нами было показано, что ДКА в сочетании с МТФ снижает уровень лактата и глюкозы в крови крыс, что коррелирует с их противоопухолевой активностью [21]. Возможно также, что определенный вклад в противоглиомный эффект комбинации DCA и MTF вносит то, что они способны корректировать анемию и тромбоцитопению, развивающиеся на фоне роста глиомы С6 у крыс [21].
Таким образом, представленные данные свидетельствуют о синергизме противоглиомного действия ДКА и МТФ при их совместном применении как in vitro, так и in vivo и могут рассматриваться как отправная точка для разработки эффективных схем лечения злокачественных опухолей головного мозга на основе комбинированного применения ДКА и МТФ.
ССЫЛКИ
1 1. Taal W, Bromberg JE, van den Bent MJ. Химиотерапия при глиоме. CNS Oncol 2015; 4: 179-92.
2 Chowdhary MM, Ene CI, Silbergeld DL. Лечение глиомы: как мы дошли до этого? Surg Neurol Int 2015; 6: S85-8.
3 Wang Y, Xing D, Zhao M, et al. The role of a single angiogenesis inhibitor in the treatment of recurrent glioblastoma multiforme: a meta-analysis and systematic review. PLoS One 2016; 11: e0152170.
4 Ameratunga M, Pavlakis N, Wheeler H, et al. Antiangiogenic therapy for high-grade glioma. Cochrane Database Syst Rev 2018; 11: CD008218.
5 Agnihotri S, Zadeh G. Metabolic reprogramming in glioblastoma: the influence of cancer metabolism on epigenetics and unanswered questions. Neuro-Oncol 2016; 18: 160-72.
6 Weber GF. Время и обстоятельства: метаболизм раковых клеток на разных стадиях прогрессирования заболевания. Front Oncol 2016; 6: 257.
7 Seyfried TN, Sanderson TM, El-Abbadi MM, et al. Role of glucose and ketone bodies in the metabolic control of experimental brain cancer. Br J Cancer 2003; 89: 1375-82.
8 Seliger C, Meyer A-L, Renner K, et al. Метформин ингибирует пролиферацию и миграцию клеток глиобластомы независимо от TGF-β2. Cell Cycle 2016; 15: 1755-66.
9 Sesen J, Dahan P, Scotland SJ, et al.Метформин подавляет рост клеток глиобластомы человека и усиливает терапевтический ответ. PLoS One 2015; 10: e0123721.
10 Seliger C, Renner K. P08.52 Метформин как адъювантная терапия глиомы. Neuro-Oncology 2017; 19: iii65.
11 Michelakis ED, Sutendra G, Dromparis P, et al. Metabolic modulation of glioblastoma with dichloroacetate. Sci Transl Med 2010; 2: 31ra34.
12 Duan Y, Zhao X, Ren W, et al. Противоопухолевая активность дихлорацетата на клетках глиомы C6: оценка in vitro и in vivo. Onco Targets Ther 2013; 6: 189-98.
13 Fedorchuk AG, Pyaskovskaya ON, Gorbik GV, et al. Effectiveness of sodium dichloroacetate against glioma C6 depends on administration schedule and dosage. Exp Oncol 2016; 38: 80-3.
14 Nicoletti I, Migliorati G, Pagliacci MC, et al. A rapid and simple method for measuring thymocyte apoptosis by propidium iodide staining and flow cytometry. J Immunol Methods 1991; 139: 271-80.
15 Wheaton WW, Weinberg SE, Hamanaka RB, et al. Metformin inhibits mitochondrial complex I of cancer cells to reduce tumorigenesis. eLife 2014; 3: e02242.
16 Michelakis ЕD, Websterl L, Mackey JR. Дихлорацетат (ДХА) как потенциальная метаболически-таргетная терапия рака. Br J Cancer 2008; 99: 989-94.
17 Pyaskovskaya ON, Kolesnik DL, Fedorchuk AG, et al. Cytotoxic activity of metformin in vitro does not correlate with its antitumor action in vivo. Exp Oncol 2017; 39: 264-8.
18 Bo Li, Xinzhe Li, Zhenhong Ni, et al. Дихлорацетат и метформин синергически подавляют рост клеток рака яичников. Oncotarget 2016; 7: 59458-90.
19 Zhou G, Myers R, Li Y, et al. Роль AMP-активируемой протеинкиназы в механизме действия метформина. J Clin Invest 2001; 108: 1167-74.
20 Abdelmalak M, Lew A, Ramezani R, et al. Долгосрочная безопасность дихлорацетата при врожденном молочнокислом ацидозе. Mol Genet Metab 2013; 109: 139-43.
21 Прохорова И. В., Пясковская О. Н., Колесник Д. Л., Соляник Г. И. Влияние метформина, дихлорацетата натрия и их комбинации на гематологические и биохимические показатели крови крыс с глиомой С6. Exp Oncol 2018; 40: 205-10.