D.L. Kolesnik*, O.N. Pyaskovskaya, O.V. Yurchenko, G.I. Solyanik
R.E. Kavetsky Instituto de Patología Experimental, Oncología y Radiobiología, NAS de Ucrania, Kyiv 03022, Ucrania
Presentado: 06 de mayo de 2019.
*Correspondencia: Correo electrónico: [email protected] Abreviaturas utilizadas: DCA: dicloroacetato de sodio; MTF: metformina; Δψm: potencial de membrana mitocondrial; IC50: concentración inhibitoria media máxima
Resumen
Se sabe que el arsenal de agentes quimioterapéuticos para el tratamiento de tumores cerebrales malignos es bastante limitado, lo que provoca la gran relevancia de la investigación dirigida a encontrar nuevos regímenes antitumorales eficaces, incluyendo el uso de modificadores del metabolismo energético. Objetivo: Investigar la actividad antiglioma del dicloroacetato sódico (DCA) y la metformina (MTF) utilizados en combinación in vitro e in vivo. Materiales y métodos: La supervivencia celular, el ciclo celular, la apoptosis, el potencial de membrana mitocondrial (Δψm), el nivel de ATP, la tasa de consumo de glucosa y la tasa de producción de lactato se determinaron in vitro en cultivos de células de glioma C6. La acción antitumoral de los agentes in vivo se evaluó de forma rutinaria mediante la prolongación de la vida útil de ratas con glioma intracerebral C6 trasplantado y se confirmó mediante el examen histológico del tejido tumoral. Resultados: La concentración inhibitoria media máxima (IC50) para el DCA y el MTF utilizados por separado fue de 79,2 ± 2,1 mM y 78,4 ± 4,0 mM, respectivamente, mientras que la IC50 para el DCA utilizado en combinación con 7,8 mM de MTF fue 3,3 veces inferior (24,0 ± 1,2 mM, p < 0,05). La incubación durante 1 día de células con DCA a una concentración cercana a la IC50 (25 mM), en combinación con MTF a una concentración por orden inferior a la IC50 (7,8 mM), en contraste con su uso por separado, dio lugar a una disminución del número de células viables en un 40% (p < 0.05); redistribución de las células por las fases del ciclo celular hacia la disminución de la proporción de células en la fase S en un 46% (p < 0,05) y un aumento del porcentaje de células en la fase G0/G1 en un 24% (p < 0,05) en comparación con índices similares en el control. La elevada actividad proapoptótica del DCA en combinación con MTF se vio respaldada por un porcentaje significativamente mayor de células apoptóticas in vitro que en el control (18,9 ± 4,4% frente a 5,7 ± 1,3%, p < 0,05) y un elevado número de células tumorales con signos de apoptosis revelados durante el examen histológico de la patomorfosis tumoral. El efecto combinado de DCA y MTF resultó en una disminución de casi 4 veces de la tasa de consumo de glucosa por las células de glioma C6 (0,23 ± 0,05 μmol/106 células/h vs 0,91 ± 0,12 μmol/106 células/h, p<0.05) en comparación con los parámetros correspondientes en el control, y una tasa de producción de lactato 2 veces mayor (1,06 ± 0,03 μmol/106 células/h frente a 0,53 ± 0,03 μmol/106 células/h, p < 0,05). Al mismo tiempo, tanto el Δψm como el nivel de ATP intracelular en las células de glioma C6 tratadas con DCA y MTF, tanto por separado como en combinación, no difirieron significativamente de los índices del control. En estudios in vivo, la duración media de la vida de ratas con glioma C6 trasplantado intracranealmente, tratadas con DCA en combinación con MTF en una dosis total de 1,1 y 2,6 g/kg de peso corporal, respectivamente, fue un 50% mayor (p < 0,001) que en el grupo de control. Por el contrario, en el caso de un solo uso (a una dosis de 2,6 g/kg), el MTF aumentó la esperanza de vida de los animales portadores de tumores sólo en un 19% (p < 0,01), mientras que el DCA solo (a una dosis de 1,1 g/kg) no modificó significativamente el tiempo de supervivencia de las ratas. Conclusiones: Los datos obtenidos indican un sinergismo de la acción antiglioma del DCA y el MTF en un caso de su uso combinado tanto in vitro como in vivo y pueden considerarse un punto de partida para el desarrollo de regímenes de tratamiento eficaces para tumores cerebrales malignos basados en el uso combinado de DCA y MTF.
Palabras clave: glioma C6, dicloroacetato sódico, metformina.
Se sabe que los gliomas malignos son los tumores humanos más agresivos, generalmente con un pronóstico desfavorable, incluso con los avances actuales en la terapia antitumoral, incluyendo la terapia antiangiogénica, la terapia molecular dirigida y la inmunoterapia. La introducción de nuevos métodos de terapia multimodal antiglioma conlleva cierto aumento de la esperanza media de vida de los pacientes, pero, por desgracia, normalmente un paciente no gana más de 3-6 meses de vida [1-4]. Teniendo en cuenta el innegable renacimiento en el campo de los estudios relacionados con el metabolismo de la glucosa en las células tumorales [5, 6], por un lado, y la gran dependencia de las células cerebrales de la glucosa [7], por otro, parece prometedor el intento de aumentar la eficacia de la terapia antitumoral modificando las vías metabólicas de utilización de la glucosa en las células tumorales.
En estudios experimentales, la metformina (MTF), un inhibidor de la cadena respiratoria mitocondrial (complejo I), que se utiliza ampliamente para tratar la diabetes de tipo 2 como agente hipoglucemiante, ha demostrado la capacidad de inhibir la proliferación y migración de células de glioblastoma [8], de inhibir el crecimiento de xenoinjertos de glioma U87 y LN18 en animales [9], etc. Los resultados de un estudio epidemiológico en el que se utilizó una amplia base de datos validada demostraron que el uso a largo plazo de MTF, aunque no se asocia a una reducción del riesgo de desarrollo de glioma, sí contribuye a mejorar la supervivencia de los pacientes con glioma maligno [10].
La actividad antitumoral del dicloroacetato sódico (DCA), un fármaco no cancerígeno que se utiliza desde hace 30 años como medio para el tratamiento de trastornos metabólicos, en particular, la acidosis láctica, se ha confirmado in vitro e in vivo, en particular, frente a células de glioma [11-13].
El objetivo de este trabajo era investigar la actividad antiglioma del DCA y el MTF en el caso de su uso combinado in vitro e in vivo.
MATERIALES Y MÉTODOS
Animales de experimentación y líneas celulares tumorales. Los estudios se llevaron a cabo en ratas hembras consanguíneas de 2,5-3 meses de edad y 100-130 g de peso procedentes del vivario del Instituto R.E. Kavetsky de Patología Experimental, Oncología y Radiobiología (IEPOR) de la Academia Nacional de Ciencias de Ucrania (NASU), Kyiv, Ucrania. La investigación con animales se llevó a cabo de acuerdo con las disposiciones de los Principios éticos generales de la experimentación con animales aprobados por el Primer Congreso de Bioética (Kiev, 2001) y los requisitos internacionales de conformidad con el Convenio Europeo sobre protección de los animales vertebrados utilizados para experimentación y otros fines (Estrasburgo, 1986).
Como modelo tumoral experimental se utilizó la línea celular de glioma C6, obtenida del Banco Nacional de Líneas Celulares y Cepas Tumorales del IEPOR NASU.
Las células de glioma C6 se mantuvieron in vitro en DMEM con un 10% de suero fetal de ternera (Sigma, EE.UU.) y 40 mg/ml de gentamicina a 37 °С en una atmósfera humidificada con un 5% de СО2.
Para los experimentos in vivo, las células se cultivaron in vitro en condiciones estándar y se trasplantaron a ratas bajo anestesia general mediante inoculación intracerebral de 0,6-106 células en 0,05 ml de solución salina fisiológica en la región parietal izquierda del cerebro.
Agentes, dosis y modo de administración. Como compuestos objeto de estudio se utilizaron DCA (Sigma, EE.UU.) y MTF (Sigma, EE.UU.).
Para evaluar la actividad antitumoral del DCA, el MTF y su combinación en ratas tras la inoculación de células tumorales, los animales fueron aleatorizados por peso y distribuidos en 4 grupos: 1)ratas a las que se administró sólo DCA en una dosis total de 11 g/kg (n = 12); 2)ratas administradas sólo con MTF en una dosis total de 2,6 g/kg (n = 12); 3)ratas administradas con DCA en combinación con MTF (n = 13) a las dosis anteriores; y 4)ratas administradas con agua (control, n = 12).
En todos los casos, los agentes se disolvieron en agua y se administraron por vía oral con una sonda, una vez al día, a partir del primer día tras la inoculación de las células tumorales. En el caso del uso combinado de DCA y MTF, este último se administró 3-4 h después de la administración de DCA.
Todos los agentes se prepararon ex tempore.
Los efectos citotóxicos/citostáticos del DCA y el MTF solos y en combinación se evaluaron mediante el índice de concentración inhibitoria semimáxima (IC50) – concentración del agente que provoca una reducción del 50% en el número de células viables en relación con el control debido a su acción citotóxica y/o citostática.
Se sembraron células de glioma C6 en una placa Petri de 35 mm a una densidad de 0,5-106 células/ml. Tras el periodo de preincubación (16-18 h), se sustituyó el medio por otro nuevo con la adición de los agentes de investigación, y la incubación continuó durante 1 día.
En todos los casos, las células que se incubaron en condiciones análogas, pero sin la adición de ningún agente, sirvieron de control.
Cada concentración de agente y combinación de estos agentes se evaluó en 3 réplicas (para la determinación del IC50 ) o 5 réplicas (para determinar los efectos de 25 mM DCA, 7,8 mM MTF y su combinación).
El número de células viables al inicio de la incubación (N0) y después de 1 día (N24) se evaluó mediante su recuento directo en un hemocitómetro utilizando azul tripán.
La distribución de las células según las fases del ciclo celular y el nivel de apoptosis se evaluaron mediante citometría de flujo utilizando yoduro de propidio y ARNasa A [14]. El número de células apoptóticas se evaluó mediante el pico sub-G0/G1.
La tasa de consumo de glucosa y la tasa de producción de lact ato por parte de las células tumorales se estimó a partir de los contenidos de los sustratos en el medio de incubación y del número de células viables al inicio del periodo de incubación y al cabo de 1 día.
El nivel de glucosa y lactato se determinó en muestras desproteinizadas de sobrenadantes utilizando un analizador bioquímico y kits comerciales para su determinación.
El potencial de membrana mitocondrial interno (Δψm) de las células tumorales se determinó mediante citometría de flujo y el colorante catiónico JC-10 (Sigma, EE.UU.) por la relación de la intensidad de fluorescencia en las regiones roja (FL2) y verde (FL1).
La eficacia de la acción antitumoral de los agentes investigados se evaluó mediante la prolongación de la vida útil (LSP) de los animales de los grupos experimentales en comparación con la vida útil de los animales del grupo de control, que se calculó mediante la fórmula:
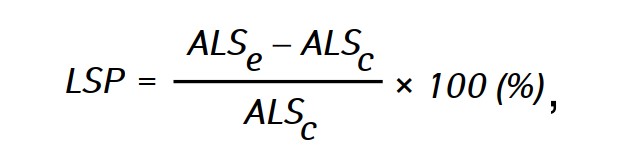
donde ALSe y ALSc-la duración media de la vida de las ratas de los grupos experimental y de control respectivamente.
Para el examen histológico, las muestras de tejido tumoral de las ratas con glioma C6 se fijaron en solución de formalina tamponada neutra al 10% durante 24 h, se deshidrataron en alcoholes de concentraciones ascendentes y se incluyeron en parafina. Los cortes histológicos se tiñeron con hematoxilina-eosina y se analizaron con el microscopio AxioStarPlusZeiss.
Elanálisis estadístico de los datos se realizó mediante estadística descriptiva, prueba t de Student y prueba u de Mann-Whitney, análisis de regresión no lineal con Microsoft Excel y el software Microcal Origin. Los datos se presentan como M ± m, donde M es el valor medio; m es el error estándar del valor medio.
RESULTADOS Y DISCUSIÓN
Hemos demostrado que el MTF potenció significativamente la actividad citotóxica y/o citostática del DCA frente a las células de glioma C6 in vitro. En particular, en el caso de su uso en solitario, el IC50 del DCA fue de 79,2 ± 2,1 mM, mientras que este índice para el DCA utilizado en combinación con MTF incluso en baja concentración no citotóxica disminuyó más de tres veces (p < 0,05) (Tabla 1, Fig. 1). Además, si la muerte celular necrótica debida a la acción de DCA y MTF utilizados por separado fue bastante baja en un amplio rango de concentraciones de ambos agentes y no superó el 15% incluso a las concentraciones máximas investigadas, el uso de DCA en combinación con 7,8 mM de MTF dio lugar a un fuerte aumento dependiente de la concentración en el número de células muertas, especialmente en el rango de concentraciones de DCA superiores al IC50 (Fig. 1, c).
| Agente | DCA | MTF | IC50, mM |
| DCA | 10-100 | – | 79.2 ± 2.1 |
| MTF | – | 7.8-80 | 78.4 ± 4.0 |
| DCA + MTF | 10-40 | 7.8 | 24.0 ± 1.2* |
Nota: *p < 0,05 en comparación con el valor correspondiente en el caso de un solo uso.
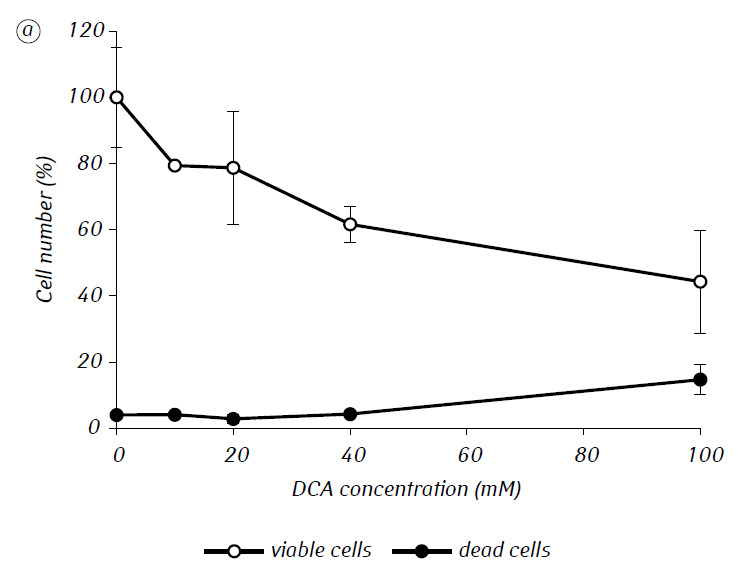
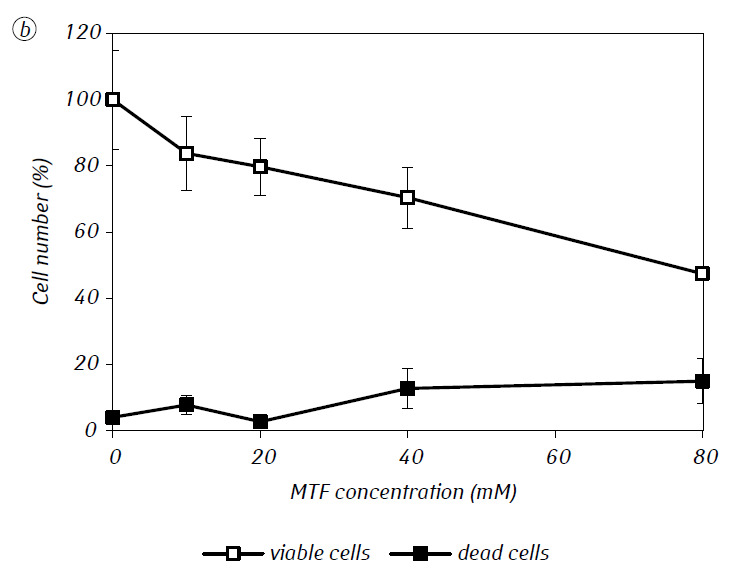
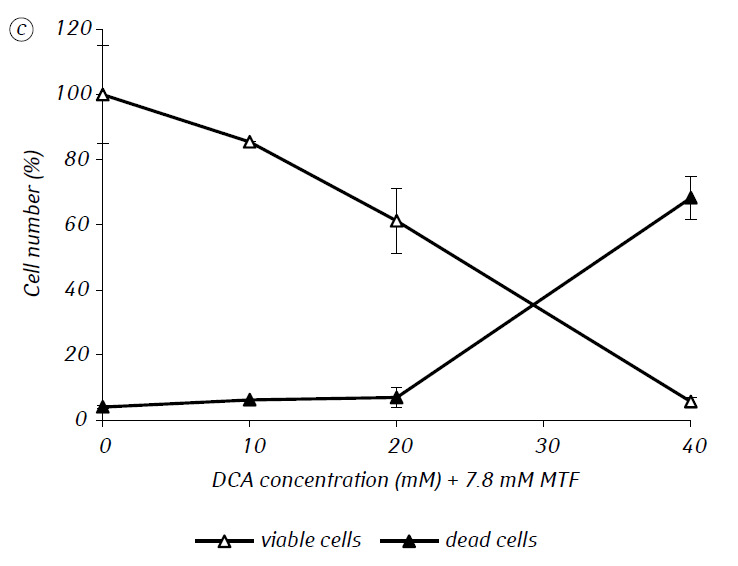
Para una evaluación más detallada de la acción sinérgica de los dos agentes, las células de glioma C6 se incubaron durante 1 día con 25 mM de DCA (concentración cercana a la IC50) y 7,8 mM de MTF (concentración inferior a la IC50), en combinación y por separado. Los datos obtenidos sobre su influencia en las características de crecimiento de las células de glioma C6, así como las características asociadas a su metabolismo energético, se presentan en la Tabla 2.
| Índice | Control | 25 mM DCA | 7.8 mM MTF | 25 mM DCA+ 7,8 mM MTF |
| Número de células viables, % | 100.0 ± 5.3 | 91.5 ± 2.3 | 85.3 ± 6.7 | 60.2 ± 2.0 |
| N24/N0 | 1.9 ± 0.1 | 1.8 ± 0.04 | 1.7 ± 0.1 | 1.2 ± 0.04* |
| Necrosis (%) | 2.6 ± 0.6 | 2.9 ± 0.8 | 5.5 ± 1.6 | 6.9 ± 2.6 |
| Apoptosis (%) | 5.7 ± 1.3 | 30.2 ± 4.1* | 5.6 ± 2.5 | 18.9 ± 4.4* |
| G0/G1, % 0 ± 2,3 | 49.0 ± 2.3 | 49.6 ± 2.2 | 46.2 ± 3.3 | 60.8 ± 1.3* |
| G2/M, EN % | 30.7 ± 4.3 | 27.5 ± 1.7 | 29.7 ± 2.8 | 28.2 ± 3.07 |
| S, % | 20.3 ± 2.7 | 22.9 ± 1.0 | 21.1 ± 3.3 | 11.0 ± 1.8* |
| Δψm (FL2/FL1) | 0.85 ± 0.15 | 0.97 ± 0.01 | 0.81 ± 0.04 | 0.96 ± 0.01 |
| La tasa de consumo de glucosa, µmol/106 células-h | 0.91 ± 0.12 | 0.16 ± 0.02* | 0.46 ± 0.07* | 0.23 ± 0.05* |
| La tasa de producción de lactato, µmol/106 células-h | 0.53 ± 0.03 | 0.42 ± 0.01* | 1.1 ± 0.02* | 1.06 ± 0.03* |
| Nivel de ATP, pmol/106 células | 9835 ± 357 | 9819 ± 292 | – | 9379 ± 191 |
Nota: *p < 0,05 en comparación con el índice correspondiente en el control.
Como puede observarse en la Tabla 2, la acción sinérgica del DCA en combinación con el MTF contra las células de glioma C6 se confirmó por una fuerte disminución del número de células viables en casi un 40% (p < 0,05) en comparación con el índice correspondiente en el control, mientras que en el caso de su uso independiente el número de células viables no se vio afectado significativamente. Al mismo tiempo, el número de células muertas en todos los casos fue bajo y prácticamente no difirió del del control.
Del mismo modo, no se detectó ningún efecto significativo del DCA en combinación con el MTF sobre la inducción de la apoptosis en las células del glioma C6. El fuerte aumento de más del triple (p < 0,05) del número de células apoptóticas en el caso del uso combinado de DCA y MTF se produjo únicamente debido a la acción del propio DCA. Esto último quedó confirmado por el alto nivel de apoptosis inducida por el DCA, que en el caso de su uso por separado superó en 5,3 veces (p < 0,05) el valor correspondiente en el control (Tabla 2).
A diferencia del DCA, el MTF 7,8 mM utilizado por separado no aumentó la apoptosis en estas células e incluso redujo la sensibilidad de las células a la acción proapoptótica del DCA si se utilizaba en combinación. En particular, el número de células apoptóticas inducidas por la combinación de DCA y MTF fue casi 1,5 veces menor (p < 0,05) que el inducido por DCA.
El efecto sinérgico antiglioma del DCA y el MTF también se confirmó por un aumento de casi el 24% (p < 0,05) del porcentaje de células en la fase G0/G1 y una disminución significativa de su fracción (en casi un 46%, p < 0,05) en la fase S, mientras que el DCA y el MTF utilizados por separado no afectaron significativamente a la distribución de las fases del ciclo celular (Tabla 2).
Llama la atención el hecho de que la adición de DCA y MTF, tanto por separado como en combinación, redujo significativamente la tasa de consumo de glucosa. Por el contrario, el índice de producción de lactato en las células tratadas con DCA se redujo drásticamente, mientras que este índice en las células tratadas con MTF, por separado o en la combinación, aumentó significativamente.
En particular, en las células tratadas con DCA se observó una fuerte caída del índice de consumo de glucosa en un 82% (p < 0,05) junto con una disminución del 21% (p < 0,05) del índice de producción de lactato en comparación con parámetros de control similares. El MTF, a diferencia del DCA, aumentó en gran medida la producción de lactato por parte de las células tumorales, tanto en caso de uso por separado como en combinación con el DCA. La tasa de producción de lactato aumentó casi un 108% (p < 0,05) y un 100% (p < 0,05) en las células tratadas con MTF solo y en combinación con DCA, respectivamente, en comparación con la del control. Curiosamente, a pesar del efecto significativo del DCA y el MTF sobre el metabolismo de las células tumorales, prácticamente no redujeron el nivel de ATP en las células tumorales. Como puede observarse en la Tabla 2, el contenido de ATP intracelular en las células tratadas con DCA y MTF solos, o en combinación, no difirió significativamente del del control.
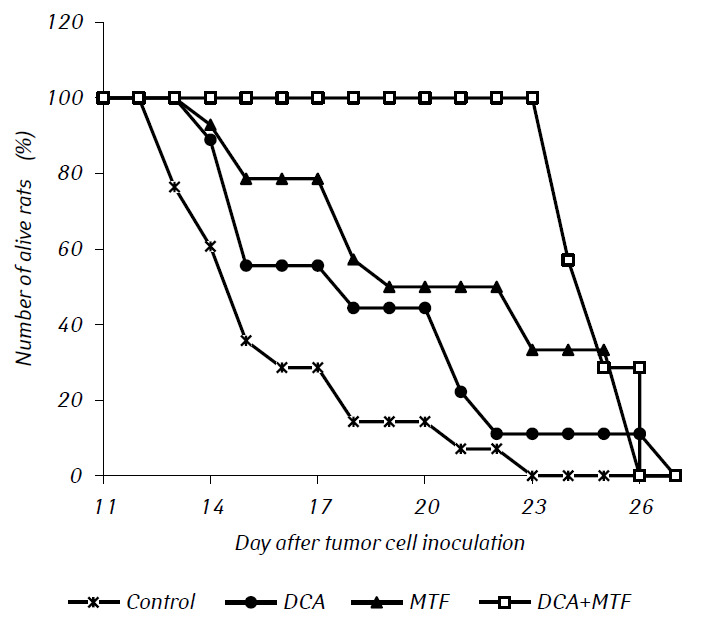
En experimentos in vivo, el MTF potenció significativamente el efecto antitumoral del DCA, dando lugar a la sinergia de su acción. En la Fig. 2 se presentan las curvas de supervivencia de los animales experimentales. La vida media de las ratas con glioma C6 trasplantado intracranealmente tratadas sólo con DCA prácticamente no difirió de la del control, mientras que la administración de MTF sólo prolongó significativamente la vida de las ratas con tumores en casi un 20% (p < 0,01). El uso combinado de DCA y MTF produjo un aumento significativo de sus efectos antigliomatosos, lo que se confirmó por una prolongación significativa de la duración de la vida de los animales en un 50% (p < 0,001) y en más de un 26% (p < 0,05) en comparación con este índice en el grupo de control y en el grupo de ratas a las que se administró MTF únicamente, respectivamente.
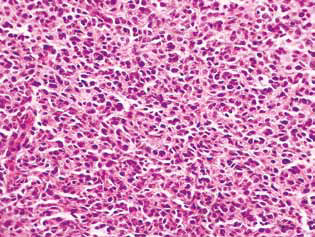
El examen histológico del tejido tumoral de las ratas con glioma C6 reveló algunos cambios en su estructura, que se correlacionaron con la alta eficacia de la acción antiglioma de los agentes investigados. En los animales de control, el tumor solía desarrollarse en las capas moleculares o inferiores de la corteza cerebral. Morfológicamente, la zona de neoplasia estaba representada por la acumulación de células grandes y núcleos de forma diversa, hipercrómicos o con contenido moderado de cromatina. En las muestras estudiadas eran típicos el polimorfismo celular y la presencia de células grandes multinucleadas. Las células tumorales poseían, por regla general, forma alargada con citoplasma, con estructuras fibrosas, y núcleos bien expresados. Algunas células eran de menor tamaño, redondeadas, con núcleos hipercrómicos densos (Fig. 3).
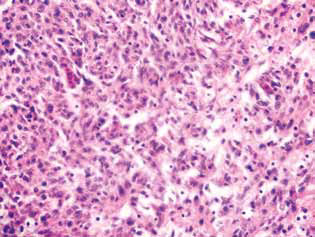
En las ratas tratadas con DCA y MTF solos o en combinación, en el tejido tumoral se observó una acumulación de células apoptóticas o células con estructuras hipercrómicas en forma de anillo en la periferia de los núcleos como evidencia de la activación de la apoptosis. Cabe señalar que estos fenómenos se expresaron mucho más en el caso del uso combinado de los agentes (Fig. 4).
Una manifestación marcada de la acción antiglioma del DCA en combinación con MTF fue una disminución significativa de las regiones satélite en el tejido cerebral (Fig. 5). En el grupo de animales de control, las estructuras satélite se localizaban cerca del nódulo principal del tumor y eran bastante frecuentes. Alrededor de varias células malignas que migraban desde el tejido tumoral principal, obviamente, se iniciaba el proceso de angiogénesis neoplásica, que conducía a la formación de un vaso sanguíneo y a la formación de un borde multicapa de las células malignas a su alrededor, que luego se acompañaba de la fusión de dichas estructuras con la lesión principal y de un aumento del tamaño del tumor (Fig. 5, a).
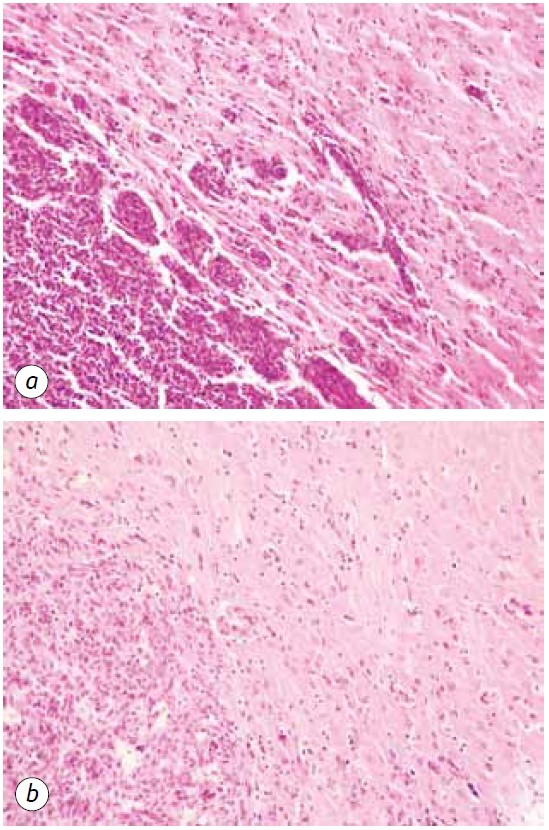
En cambio, en los animales que recibieron DCA en combinación con MTF, se observó una fuerte disminución de la formación de lesiones tumorales satélite, lo que puede deberse a la supresión de la neoangiogénesis y a la incapacidad de formar nuevos focos de crecimiento neoplásico (Fig. 5, b). Además, la patomorfosis tumoral en los animales que recibieron DCA en combinación con MTF se manifestó por la presencia de lesiones tumorales claramente devastadas (Fig. 6) y un número suficientemente grande de vasos sanguíneos destruidos y devastados en el tejido tumoral (Fig. 7).
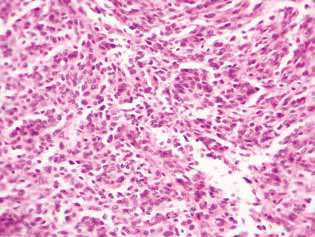
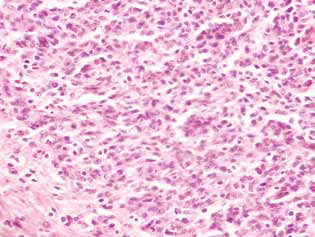
En consecuencia, la inhibición significativa de la proliferación de células de glioma C6 in vitro debida al uso combinado de 25 mM de DCA y 7,8 mM de MTF, que contrastó con una muerte celular menor, se debió principalmente a su acción citostática. El componente citostático en el efecto sinérgico del DCA y el MTF en relación con las células de glioma C6 también se confirmó por la acumulación significativa de células en la fase G0/G1 y la disminución de su fracción en la fase S.
Aparentemente, la potenciación de la acción antiglioma del DCA y el MTF debida a su combinación fue causada por sus efectos multidireccionales sobre el metabolismo energético de las células tumorales. En particular, la tasa de producción de lactato en las células de glioma C6 sin la adición de ningún agente (control) fue casi dos veces inferior a la tasa de consumo de glucosa. Tal correlación entre estos índices indicaba la ocurrencia en estas células no sólo de la conversión glucolítica de glucosa en lactato, sino también de una actividad bastante elevada de la fosforilación oxidativa y de los procesos anabólicos de síntesis de biomoléculas.
En las células tratadas con DCA, una fuerte disminución del consumo de glucosa junto con una disminución simultánea de la tasa de producción de lactato indicó que el DCA a una concentración de 25 mM era capaz de realizar su potencial como inhibidor de la piruvato deshidrogenasa quinasa y aumentar la intensidad de la respiración mitocondrial e indirectamente suprimir la glucólisis en estas células.
Una fuerte disminución de la tasa de consumo de glucosa en las células de glioma debido a la acción DCA se asoció con su pronunciada actividad inductora de apoptosis. A pesar del significativo efecto pro-apoptótico del DCA y del desplazamiento del metabolismo celular hacia la respiración mitocondrial, no se detectaron cambios aparentes en el potencial de membrana de la membrana interna de las mitocondrias en las células de glioma C6.
A diferencia del DCA, en las células tumorales tratadas con MTF se detectó un aumento significativo de la producción de lactato, tanto en el caso de su uso por separado como en combinación con el DCA. Obviamente, esto ocurrió a través de la inhibición del complejo I de la cadena de transporte de electrones de la mitocondria por el MTF [15], incluso en bajas concentraciones no tóxicas. Teniendo en cuenta el hecho de que la activación de la glucólisis suele promover la adquisición de resistencia de las células tumorales frente a los estímulos proapoptóticos [16], el descenso de más de 1,5 veces en la apoptosis inducida por el DCA bajo el uso combinado de los agentes puede atribuirse, al menos en parte, a la activación de la glucólisis aeróbica inducida por el MTF en las células C6 de glioma.
En el caso de la combinación de DCA y MTF, la modificación del metabolismo energético inducida por el MTF se implementó en mayor medida. Dada la elevada tasa de producción de lactato por las células tratadas con MTF solo o en combinación con DCA, puede concluirse que, en este último caso, la glucólisis inducida por MTF dominó sobre el metabolismo mitocondrial inducido por DCA en las células tumorales.
Cabe señalar que, a pesar del efecto significativo sobre el metabolismo tumoral del DCA y el MTF, utilizados por separado o en combinación, prácticamente no redujeron el nivel de ATP en las células tumorales. La ausencia de cambios en el nivel de ATP en las células tumorales debido al efecto de DCA y MTF solos y en combinación indicó la implementación de respuestas compensatorias en las células para mantener el suministro de energía celular y una plasticidad metabólica suficientemente alta de estas células.
Anteriormente, hemos demostrado que el efecto antitumoral de los modificadores del metabolismo energético, en particular, MTF, depende sustancialmente del microambiente de las células tumorales y puede diferir radicalmente de los efectos in vitro [17]. En estos estudios, el sinergismo de la actividad antiglioma del DCA en combinación con el MTF se detectó no sólo in vitro sino también in vivo.
En condiciones in vivo, la elevada eficacia antitumoral de la combinación de DCA y MTF se tradujo en una prolongación significativa de la vida media de las ratas con tumores. Según el estudio histológico del tejido tumoral de ratas con glioma C6, una contribución significativa a la acción antigliomatosa del DCA y el MTF se debe a su capacidad para inducir la apoptosis si se utilizan en combinación. Aunque in vitro no se observó un aumento de la acción proapoptótica de la combinación de DCA y MTF (lo que aparentemente estaba relacionado con una concentración estudiada bastante baja de este último), los datos histológicos indicaron su capacidad para inducir sinérgicamente la apoptosis en los tumores. En el trabajo [18], también se demostró el sinergismo de la acción proapoptótica de estos dos agentes en relación con las células tumorales de ovario.
Además de la acción pro-apoptótica, la alta eficacia del efecto anti-glioma del DCA en combinación con el MTF se asoció a una disminución del grado de invasión tumoral y a la destrucción de los vasos sanguíneos del tumor. Esto último puede causar un déficit de nutrientes, en particular de glucosa, en el microentorno tumoral, lo que da lugar a la supresión del crecimiento tumoral.
La mayor eficacia antitumoral de la combinación de DCA y MTF también puede deberse a la participación de mecanismos adicionales de acción de los agentes, incluida su acción sobre las células normales del organismo, que pueden alterar significativamente los niveles de sustratos nutrientes en el microentorno tumoral, en particular en la sangre. Este es el caso del MTF, que, a través de la activación de la proteína cinasa activada por AMP, es capaz de afectar al metabolismo de la glucosa y los lípidos de los hepatocitos y los músculos esqueléticos [19], y del DCA, conocido por su eficacia universal en la reducción de los niveles de lactato [20]. En particular, hemos demostrado anteriormente que el DCA en combinación con el MTF disminuye los niveles de lactato y glucosa en sangre de rata, lo que se correlaciona con su actividad antitumoral [21]. También es posible que una cierta contribución al efecto antiglioma de la combinación de DCA y MTF sea que son capaces de corregir la anemia y la trombocitopenia que se desarrollan en el contexto del crecimiento del glioma C6 en ratas [21].
Por lo tanto, los datos presentados indicaron el sinergismo de la acción antiglioma del DCA y el MTF en el caso de su uso combinado tanto in vitro como in vivo y pueden considerarse un punto de partida para el desarrollo de regímenes de tratamiento eficaces para tumores cerebrales malignos basados en el uso combinado de DCA y MTF.
REFERENCIAS
1 1. Taal W, Bromberg JE, van den Bent MJ. Quimioterapia en el glioma. CNS Oncol 2015; 4: 179-92.
2 Chowdhary MM, Ene CI, Silbergeld DL. Tratamiento de los gliomas: ¿cómo hemos llegado hasta aquí? Surg Neurol Int 2015; 6: S85-8.
3 Wang Y, Xing D, Zhao M, et al. El papel de un único inhibidor de la angiogénesis en el tratamiento del glioblastoma multiforme recurrente: un metaanálisis y revisión sistemática. PLoS One 2016; 11: e0152170.
4 Ameratunga M, Pavlakis N, Wheeler H, et al. Terapia antiangiogénica para el glioma de alto grado. Cochrane Database Syst Rev 2018; 11: CD008218.
5 Agnihotri S, Zadeh G. Reprogramación metabólica en el glioblastoma: la influencia del metabolismo del cáncer en la epigenética y preguntas sin respuesta. Neuro-Oncol 2016; 18: 160-72.
6 Weber GF. El tiempo y las circunstancias: metabolismo de las células cancerosas en diversas etapas de la progresión de la enfermedad. Front Oncol 2016; 6: 257.
7 Seyfried TN, Sanderson TM, El-Abbadi MM, et al. Papel de la glucosa y los cuerpos cetónicos en el control metabólico del cáncer cerebral experimental. Br J Cancer 2003; 89: 1375-82.
8 Seliger C, Meyer A-L, Renner K, et al. Metformin inhibits proliferation and migration of glioblastoma cells independently of TGF-β2. Cell Cycle 2016; 15: 1755-66.
9 Sesen J, Dahan P, Scotland SJ, et al.Metformin inhibits growth of human glioblastoma cells and enhances therapeutic response. PLoS One 2015; 10: e0123721.
10 Seliger C, Renner K. P08.52 Metformina como terapia adyuvante para el glioma. Neuro-Oncology 2017; 19: iii65.
11 Michelakis ED, Sutendra G, Dromparis P, et al. Modulación metabólica del glioblastoma con dicloroacetato. Sci Transl Med 2010; 2: 31ra34.
12 Duan Y, Zhao X, Ren W, et al. Antitumor activity of dichloroacetate on C6 glioma cell: in vitro and in vivo evaluation. Onco Targets Ther 2013; 6: 189-98.
13 Fedorchuk AG, Pyaskovskaya ON, Gorbik GV, et al. Effectiveness of sodium dichloroacetate against glioma C6 depends on administration schedule and dosage. Exp Oncol 2016; 38: 80-3.
14 Nicoletti I, Migliorati G, Pagliacci MC, et al. A rapid and simple method for measuring thymocyte apoptosis by propidium iodide staining and flow cytometry. J Immunol Methods 1991; 139: 271-80.
15 Wheaton WW, Weinberg SE, Hamanaka RB, et al. Metformin inhibits mitochondrial complex I of cancer cells to reduce tumorigenesis. eLife 2014; 3: e02242.
16 Michelakis ЕD, Websterl L, Mackey JR. Dichloroacetate (DCA) as a potential metabolic-targeting therapy for cancer. Br J Cancer 2008; 99: 989-94.
17 Pyaskovskaya ON, Kolesnik DL, Fedorchuk AG, et al. La actividad citotóxica de la metformina in vitro no se correlaciona con su acción antitumoral in vivo. Exp Oncol 2017; 39: 264-8.
18 Bo Li, Xinzhe Li, Zhenhong Ni, et al. Dicloroacetato y metformina suprimen sinérgicamente el crecimiento de células de cáncer de ovario. Oncotarget 2016; 7: 59458-90.
19 Zhou G,Myers R, Li Y, et al. Papel de la proteína quinasa activada por AMP en el mecanismo de acción de la metformina. J Clin Invest 2001; 108: 1167-74.
20 Abdelmalak M, Lew A, Ramezani R, et al. Seguridad a largo plazo del dicloroacetato en la acidosis láctica congénita. Mol Genet Metab 2013; 109: 139-43.
21 Prokhorova IV, Pyaskovskaya ON, Kolesnik DL, Solyanik GI. Influencia de la metformina, el dicloroacetato de sodio y su combinación en los parámetros hematológicos y bioquímicos de la sangre de ratas con glioma C6. Exp Oncol 2018; 40: 205-10.