D.L. Kolesnik*, O.N. Pyaskovskaya, O.V. Yurchenko, G.I. Solyanik
R.E. Kavetsky Institute of Experimental Pathology, Oncology and Radiobiology, NAS of Ukraine, Kyiv 03022, Ukraine
Eingereicht am: 06. Mai 2019.
*Korrespondenz: E-Mail: [email protected] Verwendete Abkürzungen: DCA – Natriumdichloracetat; MTF – Metformin; Δψm – mitochondriales Membranpotential; IC50 – halbe maximale inhibitorische Konzentration
Zusammenfassung
Es ist bekannt, dass das Arsenal an Chemotherapeutika für die Behandlung von bösartigen Hirntumoren recht begrenzt ist, was die hohe Relevanz der Forschung bei der Suche nach neuen wirksamen Antitumortherapien, einschließlich der Verwendung von Energiestoffwechselmodifikatoren, begründet. Ziel: Es sollte die Anti-Gliom-Aktivität von Natriumdichloracetat (DCA) und Metformin (MTF) in Kombination in vitro und in vivo untersucht werden. Materialien und Methoden: Zellüberleben, Zellzyklus, Apoptose, mitochondriales Membranpotenzial (Δψm), ATP-Spiegel, Glukoseverbrauchsrate und Laktatproduktionsrate wurden in kultivierten Gliomzellen C6 in vitro bestimmt. Die Antitumorwirkung der Mittel in vivo wurde routinemäßig durch die Verlängerung der Lebensdauer von Ratten mit transplantiertem intrazerebralem Gliom C6 bewertet und durch histologische Untersuchung von Tumorgewebe bestätigt. Ergebnisse: Die halbmaximale Hemmkonzentration (IC50) für DCA und MTF, die einzeln verwendet wurden, betrug 79,2 ± 2,1 mM bzw. 78,4 ± 4,0 mM, während die IC50 für DCA in Kombination mit 7,8 mM MTF um das 3,3-fache niedriger war (24,0 ± 1,2 mM, p < 0,05). Die eintägige Inkubation von Zellen mit DCA in einer Konzentration nahe der IC50 (25 mM) in Kombination mit MTF in einer Konzentration, die um eine Größenordnung niedriger ist als die IC50 (7,8 mM), führte im Gegensatz zu ihrer getrennten Verwendung zu einem Rückgang der Anzahl lebensfähiger Zellen um 40% (p < 0.05); Umverteilung der Zellen durch die Zellzyklusphasen in Richtung eines verringerten Anteils von Zellen in der S-Phase um 46% (p < 0,05) und eines erhöhten Anteils von Zellen in der G0/G1-Phase um 24% (p < 0,05) im Vergleich zu ähnlichen Indizes in der Kontrolle. Die hohe proapoptotische Aktivität von DCA in Kombination mit MTF wurde durch einen signifikant höheren Prozentsatz apoptotischer Zellen in vitro als in der Kontrolle (18,9 ± 4,4 % gegenüber 5,7 ± 1,3 %, p < 0,05) und eine hohe Anzahl von Tumorzellen mit Anzeichen von Apoptose bei der histologischen Untersuchung der Tumorpathomorphose bestätigt. Die kombinierte Wirkung von DCA und MTF führte zu einer fast 4-fachen Verringerung der Glukoseverbrauchsrate von C6-Gliomzellen (0,23 ± 0,05 μmol/106 Zellen/h gegenüber 0,91 ± 0,12 μmol/106 Zellen/h, p<0.05) im Vergleich zu den entsprechenden Parametern in der Kontrolle und eine 2-fach erhöhte Rate der Laktatproduktion (1,06 ± 0,03 μmol/106 Zellen/h vs. 0,53 ± 0,03 μmol/106 Zellen/h, p < 0,05). Gleichzeitig unterschieden sich sowohl Δψm als auch der Gehalt an intrazellulärem ATP in den mit DCA und MTF behandelten C6-Gliomzellen, sowohl einzeln als auch in Kombination, nicht signifikant von den Indizes in der Kontrollgruppe. In In-vivo-Studien war die durchschnittliche Lebensdauer von Ratten mit intrakraniell transplantiertem Gliom C6, die mit DCA in Kombination mit MTF in einer Gesamtdosis von 1,1 bzw. 2,6 g/kg Körpergewicht behandelt wurden, um 50% höher (p < 0,001) als in der Kontrollgruppe. Im Gegensatz dazu verlängerte MTF bei alleiniger Anwendung (in einer Dosis von 2,6 g/kg) die Lebensdauer der tumortragenden Tiere nur um 19% (p < 0,01), während DCA allein (in einer Dosis von 1,1 g/kg) die Überlebenszeit der Ratten nicht signifikant veränderte. Schlussfolgerungen: Die gewonnenen Daten weisen auf einen Synergismus der Anti-Gliom-Wirkung von DCA und MTF bei kombinierter Anwendung sowohl in vitro als auch in vivo hin und können als Ausgangspunkt für die Entwicklung wirksamer Behandlungsschemata für bösartige Hirntumore auf der Grundlage der kombinierten Anwendung von DCA und MTF betrachtet werden.
Schlüsselwörter: Gliom C6, Natriumdichloracetat, Metformin.
Bösartige Gliome sind bekanntlich die aggressivsten menschlichen Tumoren, die in der Regel eine ungünstige Prognose haben, selbst wenn die aktuellen Fortschritte in der Antitumortherapie, einschließlich der antiangiogenen Therapie, der gezielten molekularen Therapie und der Immuntherapie, genutzt werden. Die Einführung neuer Methoden der multimodalen Anti-Gliom-Therapie führt zwar zu einem gewissen Anstieg der durchschnittlichen Lebenserwartung der Patienten, aber leider gewinnt ein Patient in der Regel nicht mehr als 3-6 Monate an Lebenszeit [1-4]. Angesichts der unbestreitbaren Renaissance auf dem Gebiet der Studien zum Glukosestoffwechsel in Tumorzellen [5, 6] einerseits und der hohen Abhängigkeit der Gehirnzellen von Glukose [7] andererseits scheint der Versuch, die Wirksamkeit der Antitumortherapie durch Modifizierung der Stoffwechselwege der Glukoseverwertung in Tumorzellen zu erhöhen, vielversprechend zu sein.
In experimentellen Studien hat Metformin (MTF), ein Inhibitor der mitochondrialen Atmungskette (Komplex I), der bei der Behandlung von Typ-2-Diabetes als Hypoglykämikum weit verbreitet ist, die Fähigkeit gezeigt, die Proliferation und Migration von Glioblastomzellen zu hemmen [8] und das Wachstum von Gliom-U87- und -LN18-Xenografts in Tieren zu hemmen [9] usw. Die Ergebnisse einer epidemiologischen Studie, bei der eine große validierte Datenbank verwendet wurde, zeigten, dass die langfristige Einnahme von MTF zwar nicht mit einer Verringerung des Risikos der Gliomentwicklung verbunden ist, jedoch zu einem besseren Überleben von Patienten mit malignen Gliomen beiträgt [10].
Die Antitumoraktivität von Natriumdichloracetat (DCA), einem Nicht-Krebsmedikament, das seit 30 Jahren als Mittel zur Behandlung von Stoffwechselstörungen, insbesondere der Laktatazidose, eingesetzt wird, wurde in vitro und in vivo insbesondere gegen Gliomzellen bestätigt [11-13].
Ziel dieser Arbeit war es, die Antigliom-Aktivität von DCA und MTF im Falle ihrer kombinierten Verwendung in vitro und in vivo zu untersuchen.
MATERIALIEN UND METHODEN
Versuchstiere und Tumorzelllinien. Die Studien wurden an weiblichen Inzucht-Ratten im Alter von 2,5-3 Monaten und einem Gewicht von 100-130 g aus dem Vivarium des R.E. Kavetsky Institute of Experimental Pathology, Oncology and Radiobiology (IEPOR) der National Academy of Sciences of Ukraine (NASU), Kyiv, Ukraine, durchgeführt. Die Tierversuche wurden in Übereinstimmung mit den allgemeinen ethischen Grundsätzen für Tierversuche, die auf dem Ersten Kongress für Bioethik (Kiew, 2001) verabschiedet wurden, und den internationalen Anforderungen gemäß dem Europäischen Übereinkommen zum Schutz der für Versuche und andere Zwecke verwendeten Wirbeltiere (Straßburg, 1986) durchgeführt.
Als experimentelles Tumormodell wurde die Gliomzelllinie C6 verwendet, die aus der Nationalen Bank für Zelllinien und Tumorstämme des IEPOR NASU bezogen wurde.
Die Gliomzellen C6 wurden in vitro in DMEM mit 10 % fetalem Kälberserum (Sigma, USA) und 40 mg/ml Gentamicin bei 37 °С in einer befeuchteten Atmosphäre mit 5 % СО2 gehalten.
Für In-vivo-Experimente wurden die Zellen unter Standardbedingungen in vitro gezüchtet und Ratten unter Vollnarkose durch intrazerebrale Inokulation von 0,6-106 Zellen in 0,05 ml physiologischer Kochsalzlösung in die linke Parietalregion des Gehirns transplantiert.
Wirkstoffe, Dosen und Verabreichungsart. DCA (Sigma, USA) und MTF (Sigma, USA) wurden als untersuchte Substanzen verwendet.
Um die Antitumoraktivität von DCA, MTF und ihrer Kombination bei Ratten nach der Inokulation von Tumorzellen zu bewerten, wurden die Tiere nach Gewicht randomisiert und in 4 Gruppen aufgeteilt: 1) Ratten, denen nur DCA in einer Gesamtdosis von 1.1 g/kg (n = 12); 2) Ratten, denen nur MTF in einer Gesamtdosis von 2,6 g/kg verabreicht wurde (n = 12); 3) Ratten, denen DCA in Kombination mit MTF (n = 13) in den oben genannten Dosen verabreicht wurde; und 4) Ratten, denen Wasser verabreicht wurde (Kontrolle, n = 12).
In allen Fällen wurden die Wirkstoffe in Wasser aufgelöst und ab dem ersten Tag nach der Inokulation der Tumorzellen einmal täglich oral mit einer Sonde verabreicht. Bei der kombinierten Anwendung von DCA und MTF wurde letzterer 3-4 Stunden nach der Verabreichung von DCA verabreicht.
Alle Wirkstoffe wurden ex tempore zubereitet.
Die zytotoxischen/zytostatischen Wirkungen von DCA und MTF allein und in Kombination wurden anhand des Index der halben maximalen Hemmkonzentration (IC50) bewertet, d. h. der Konzentration des Wirkstoffs, die aufgrund seiner zytotoxischen und/oder zytostatischen Wirkung eine 50 %ige Verringerung der Zahl der lebensfähigen Zellen im Vergleich zur Kontrolle bewirkt.
C6-Gliomzellen wurden in einer 35 mm Petrischale in einer Dichte von 0,5-106 Zellen/ml ausgesät. Nach der Vorinkubationszeit (16-18 Stunden) wurde das Medium durch ein frisches Medium ersetzt, dem die Prüfsubstanzen zugesetzt wurden, und die Inkubation wurde einen Tag lang fortgesetzt.
In allen Fällen dienten die Zellen, die unter analogen Bedingungen bebrütet wurden, jedoch ohne Zusatz von Wirkstoffen, als Kontrolle.
Jede Wirkstoffkonzentration und Kombination dieser Wirkstoffe wurde in 3 Wiederholungen (für die IC50-Bestimmung) bzw. 5 Wiederholungen (für die Bestimmung der Wirkungen von 25 mM DCA, 7,8 mM MTF und deren Kombination) untersucht.
Die Anzahl der lebensfähigen Zellen zu Beginn der Inkubation (N0) und nach einem Tag (N24) wurde durch direkte Zählung in einem Hämozytometer unter Verwendung von Trypanblau ermittelt.
DieVerteilung der Zellen auf die Zellzyklusphasen und das Ausmaß der Apoptose wurden mittels Durchflusszytometrie unter Verwendung von Propidiumjodid und RNAase A [14] ermittelt. Die Anzahl der apoptotischen Zellen wurde anhand des Sub-G0/G1-Peaks ermittelt.
DieGeschwindigkeit des Glukoseverbrauchs und der Laktatproduktion durch die Tumorzellen wurde anhand des Gehalts der Substrate im Inkubationsmedium und der Anzahl der lebensfähigen Zellen zu Beginn der Inkubationszeit und nach einem Tag geschätzt.
Der Glukose- und Laktatgehalt wurde in entproteinisierten Überstandsproben mit Hilfe eines biochemischen Analysegeräts und handelsüblicher Bestimmungskits bestimmt.
Das interne Mitochondrien-Membranpotenzial (Δψm) der Tumorzellen wurde mit Hilfe der Durchflusszytometrie und des kationischen Farbstoffs JC-10 (Sigma, USA) anhand des Verhältnisses der Fluoreszenzintensität in den roten (FL2) und grünen (FL1) Bereichen bestimmt.
DieWirksamkeit der Antitumorwirkung der untersuchten Wirkstoffe wurde anhand der Verlängerung der Lebensdauer (LSP) der Tiere in den Versuchsgruppen im Vergleich zur Lebensdauer der Tiere in der Kontrollgruppe bewertet, die nach folgender Formel berechnet wurde:
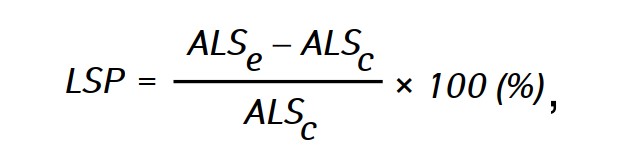
wobei ALSe und ALSc die durchschnittliche Lebensspanne der Ratten in den Versuchs- bzw. Kontrollgruppen ist.
Für die histologische Untersuchung wurden die Tumorgewebeproben der Ratten mit C6-Gliom 24 Stunden lang in 10%iger neutral gepufferter Formalinlösung fixiert, in Alkoholen aufsteigender Konzentrationen dehydriert und in Paraffin eingebettet. Die histologischen Schnitte wurden mit Hämatoxylin-Eosin gefärbt und mit dem AxioStarPlusZeiss Mikroskop analysiert.
Diestatistische Analyse der Daten erfolgte mittels deskriptiver Statistik, Student’s t-test und Mann-Whitney u-test, nichtlinearer Regressionsanalyse mit Microsoft Excel und Microcal Origin Software. Die Daten werden als M ± m angegeben, wobei M der Mittelwert und m der Standardfehler des Mittelwerts ist.
ERGEBNISSE UND DISKUSSION
Wir haben gezeigt, dass MTF die zytotoxische und/oder zytostatische Aktivität von DCA gegen C6-Gliomzellen in vitro erheblich verstärkte. Insbesondere betrug die IC50 von DCA bei alleiniger Verwendung 79,2 ± 2,1 mM, während dieser Index für DCA in Kombination mit MTF selbst bei niedriger nicht-zytotoxischer Konzentration um mehr als das Dreifache abnahm (p < 0,05) (Tabelle 1, Abb. 1). Darüber hinaus war der nekrotische Zelltod aufgrund der Wirkung von DCA und MTF bei getrennter Verwendung in einem breiten Konzentrationsbereich beider Wirkstoffe relativ gering und überstieg selbst bei den untersuchten Höchstkonzentrationen nicht 15 %, während die Verwendung von DCA in Kombination mit 7,8 mM MTF zu einem starken konzentrationsabhängigen Anstieg der Zahl der abgestorbenen Zellen führte, insbesondere in dem Konzentrationsbereich von DCA, der über der IC50 lag (Abb. 1, c).
| Wirkstoff | DCA | MTF | IC50, mM |
| DCA | 10-100 | – | 79.2 ± 2.1 |
| MTF | – | 7.8-80 | 78.4 ± 4.0 |
| DCA + MTF | 10-40 | 7.8 | 24.0 ± 1.2* |
: *p < 0,05 im Vergleich zum entsprechenden Wert im Falle der Einzelanwendung.
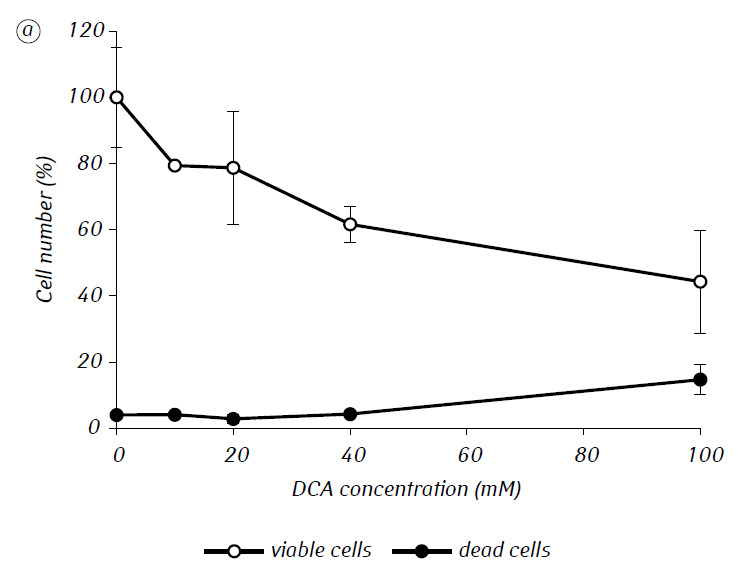
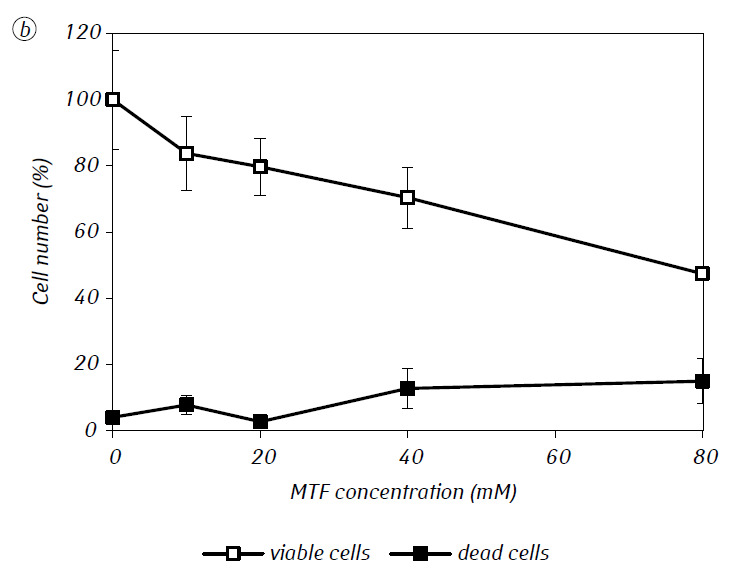
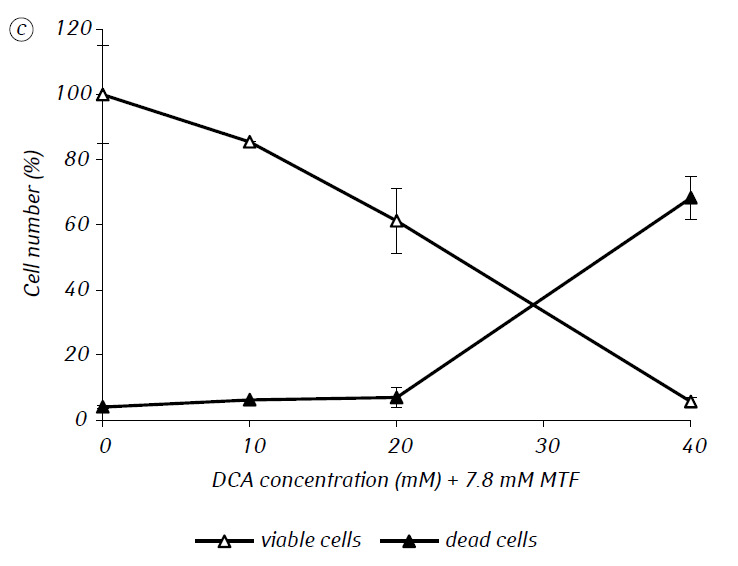
Für eine genauere Bewertung der synergistischen Wirkung der beiden Wirkstoffe wurden die Gliomzellen C6 einen Tag lang mit 25 mM DCA (Konzentration nahe der IC50) und 7,8 mM MTF (Konzentration unter der IC50) in Kombination und einzeln inkubiert. Die erhaltenen Daten über ihren Einfluss auf die Wachstumseigenschaften der C6-Gliomzellen sowie die mit ihrem Energiestoffwechsel verbundenen Eigenschaften sind in Tabelle 2 aufgeführt.
| Index | Kontrolle | 25 mM DCA | 7.8 mM MTF | 25 mM DCA+ 7,8 mM MTF |
| Anzahl der lebensfähigen Zellen, % | 100.0 ± 5.3 | 91.5 ± 2.3 | 85.3 ± 6.7 | 60.2 ± 2.0 |
| N24/N0 | 1.9 ± 0.1 | 1.8 ± 0.04 | 1.7 ± 0.1 | 1.2 ± 0.04* |
| Nekrose, % | 2.6 ± 0.6 | 2.9 ± 0.8 | 5.5 ± 1.6 | 6.9 ± 2.6 |
| Apoptose, % | 5.7 ± 1.3 | 30.2 ± 4.1* | 5.6 ± 2.5 | 18.9 ± 4.4* |
| G0/G1, % | 49.0 ± 2.3 | 49.6 ± 2.2 | 46.2 ± 3.3 | 60.8 ± 1.3* |
| G2/M, % | 30.7 ± 4.3 | 27.5 ± 1.7 | 29.7 ± 2.8 | 28.2 ± 3.07 |
| S, % | 20.3 ± 2.7 | 22.9 ± 1.0 | 21.1 ± 3.3 | 11.0 ± 1.8* |
| Δψm (FL2/FL1) | 0.85 ± 0.15 | 0.97 ± 0.01 | 0.81 ± 0.04 | 0.96 ± 0.01 |
| Die Glukoseverbrauchsrate, µmol/106 Zellen-h | 0.91 ± 0.12 | 0.16 ± 0.02* | 0.46 ± 0.07* | 0.23 ± 0.05* |
| Die Laktatproduktionsrate, µmol/106 Zellen-h | 0.53 ± 0.03 | 0.42 ± 0.01* | 1.1 ± 0.02* | 1.06 ± 0.03* |
| ATP-Spiegel, pmol/106 Zellen | 9835 ± 357 | 9819 ± 292 | – | 9379 ± 191 |
: *p < 0,05 im Vergleich zum entsprechenden Index in der Kontrolle.
Wie aus Tabelle 2 ersichtlich, wurde die synergistische Wirkung von DCA in Kombination mit MTF gegen Gliomzellen C6 durch einen starken Rückgang der Anzahl lebensfähiger Zellen um fast 40 % (p < 0,05) im Vergleich zum entsprechenden Index in der Kontrolle bestätigt, während im Falle ihrer unabhängigen Verwendung die Anzahl lebensfähiger Zellen nicht signifikant beeinflusst wurde. Gleichzeitig war die Zahl der abgestorbenen Zellen in allen Fällen gering und unterschied sich praktisch nicht von der der Kontrolle.
Ebenso wurde kein signifikanter Effekt von DCA in Kombination mit MTF auf die Induktion der Apoptose bei Gliomzellen C6 festgestellt. Der starke Anstieg der Zahl der apoptotischen Zellen um mehr als das Dreifache (p < 0,05) im Falle der kombinierten Anwendung von DCA und MTF war nur auf die Wirkung von DCA selbst zurückzuführen. Letzteres wurde durch das hohe Niveau der DCA-induzierten Apoptose bestätigt, die im Falle der separaten Anwendung um das 5,3-fache (p < 0,05) über dem entsprechenden Wert in der Kontrolle lag (Tabelle 2).
Im Gegensatz zu DCA erhöhte 7,8 mM MTF bei alleiniger Verwendung die Apoptose in diesen Zellen nicht und verringerte sogar die Empfindlichkeit der Zellen gegenüber der proapoptotischen Wirkung von DCA, wenn es in Kombination verwendet wurde. Insbesondere war die Zahl der durch die Kombination von DCA und MTF induzierten apoptotischen Zellen fast 1,5 Mal niedriger (p < 0,05) als die durch DCA induzierte Zahl.
Die synergistische Anti-Gliom-Wirkung von DCA und MTF wurde auch durch einen fast 24%igen Anstieg (p < 0,05) des Prozentsatzes der Zellen in der G0/G1-Phase und einen signifikanten Rückgang ihres Anteils (um fast 46%, p < 0,05) in der S-Phase bestätigt, während DCA und MTF bei getrennter Anwendung die Verteilung der Zellzyklusphasen nicht signifikant beeinflussten (Tabelle 2).
Es wird darauf hingewiesen, dass die Zugabe von DCA und MTF, sowohl einzeln als auch in Kombination, die Rate des Glukoseverbrauchs deutlich reduzierte. Im Gegensatz dazu war die Laktatproduktionsrate in den mit DCA behandelten Zellen stark reduziert, während dieser Index in den mit MTF behandelten Zellen, sowohl allein als auch in der Kombination, deutlich anstieg.
Insbesondere wurde bei den mit DCA behandelten Zellen ein starker Rückgang des Glukoseverbrauchs um 82 % (p < 0,05) und eine Abnahme der Laktatproduktion um 21 % (p < 0,05) im Vergleich zu ähnlichen Kontrollparametern beobachtet. Im Gegensatz zu DCA steigerte der MTF die Laktatproduktion der Tumorzellen stark, sowohl bei separater Anwendung als auch in Kombination mit DCA. Die Laktatproduktionsrate stieg um fast 108 % (p < 0,05) bzw. um 100 % (p < 0,05) bei Zellen, die mit MTF allein bzw. in Kombination mit DCA behandelt wurden, im Vergleich zur Kontrolle. Interessanterweise haben DCA und MTF trotz ihrer signifikanten Wirkung auf den Stoffwechsel der Tumorzellen den ATP-Spiegel in den Tumorzellen praktisch nicht verringert. Wie aus Tabelle 2 hervorgeht, unterschied sich der Gehalt an intrazellulärem ATP in Zellen, die mit DCA und MTF allein oder in Kombination behandelt wurden, nicht signifikant von dem der Kontrollgruppe.
In In-vivo-Experimenten verstärkte MTF die antitumorale Wirkung von DCA signifikant, was zu einer Synergie der beiden Wirkungen führte. Die Überlebenskurven der Versuchstiere sind in Abb. 2 dargestellt. Die durchschnittliche Lebensdauer von Ratten mit einem intrakraniellen transplantierten Gliom C6, die nur mit DCA behandelt wurden, unterschied sich praktisch nicht von der der Kontrolltiere, während die Verabreichung von MTF die Lebensdauer der Ratten mit Tumoren um fast 20 % (p < 0,01) deutlich verlängerte. Die kombinierte Anwendung von DCA und MTF führte zu einer signifikanten Steigerung ihrer Anti-Gliom-Wirkung, was durch eine signifikante Verlängerung der Lebensdauer der Tiere um 50 % (p < 0,001) bzw. um mehr als 26 % (p < 0,05) im Vergleich zu diesem Index in der Kontrollgruppe bzw. in der Gruppe der Ratten, denen nur MTF verabreicht wurde, bestätigt wurde.
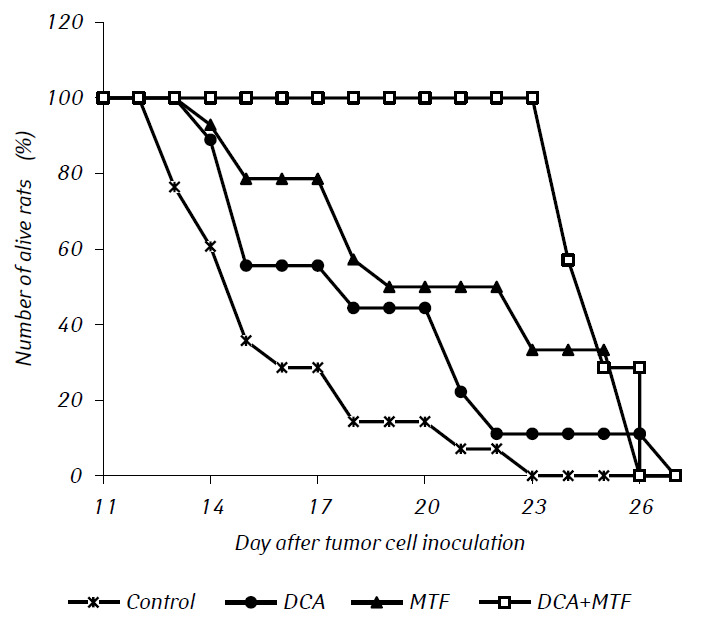
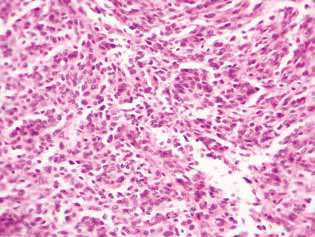
Bei der histologischen Untersuchung des Tumorgewebes von Ratten mit Gliom C6 wurden einige Veränderungen in seiner Struktur festgestellt, die mit der hohen Effizienz der Antigliomwirkung der untersuchten Wirkstoffe zusammenhängen. Bei den Kontrolltieren entwickelte sich der Tumor gewöhnlich in den molekularen oder unteren Schichten der Großhirnrinde. Morphologisch war die Neoplasiezone durch eine Ansammlung großer Zellen und Kerne unterschiedlicher Form, hyperchrom oder mit mäßigem Chromatingehalt gekennzeichnet. In den untersuchten Proben waren zellulärer Polymorphismus und das Vorhandensein von großen Zellen mit mehreren Kernen typisch. Die Tumorzellen haben in der Regel eine längliche Form mit Zytoplasma, faserigen Strukturen und gut ausgeprägten Kernen. Einige Zellen waren kleiner, rundlich, mit dichten hyperchromen Kernen (Abb. 3).
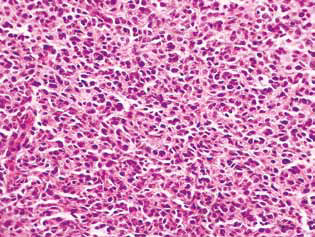
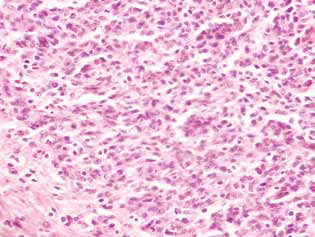
Bei Ratten, die mit DCA und MTF allein oder in Kombination behandelt wurden, wurde im Tumorgewebe eine Anhäufung von apoptotischen Zellen oder Zellen mit hyperchromen ringförmigen Strukturen an der Kernperipherie als Beweis für die Aktivierung der Apoptose beobachtet. Es ist anzumerken, dass diese Phänomene im Falle der kombinierten Anwendung der Wirkstoffe viel stärker ausgeprägt waren (Abb. 4).
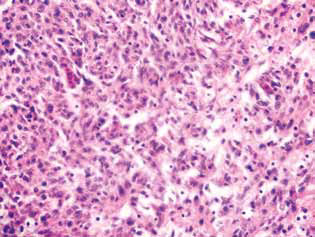
Ein deutlicher Ausdruck der Anti-Gliom-Wirkung von DCA in Kombination mit MTF war eine signifikante Abnahme der Satellitenregionen im Hirngewebe (Abb. 5). Bei den Tieren der Kontrollgruppe befanden sich die Satellitenstrukturen in der Nähe des Hauptknotens des Tumors und waren relativ häufig. Um die verschiedenen bösartigen Zellen, die aus dem Haupttumorgewebe eingewandert waren, wurde offensichtlich der Prozess der neoplastischen Angiogenese in Gang gesetzt, der zur Bildung eines Blutgefäßes und zur Bildung eines mehrschichtigen Rands aus den bösartigen Zellen um dieses herum führte, was dann mit der Verschmelzung solcher Strukturen mit der Hauptläsion und einer Zunahme der Tumorgröße einherging (Abb. 5, a).
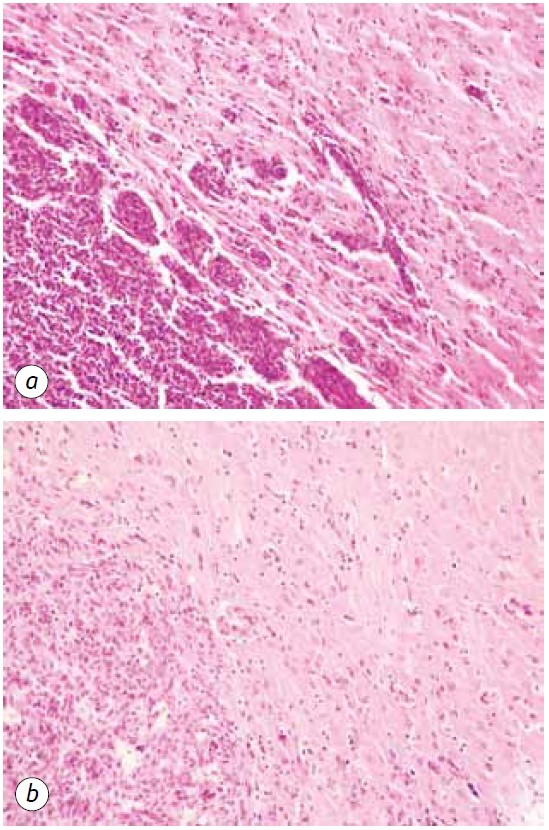
Stattdessen wurde bei Tieren, die DCA in Kombination mit MTF erhielten, ein starker Rückgang der Bildung von Satellitentumorläsionen beobachtet, was auf die Unterdrückung der Neoangiogenese und die Unfähigkeit zur Bildung neuer neoplastischer Wachstumsherde zurückzuführen sein könnte (Abb. 5, b). Darüber hinaus zeigte sich die Pathomorphose des Tumors bei den Tieren, die DCA in Kombination mit MTF erhielten, durch das Vorhandensein von deutlich zerstörten Tumorläsionen (Abb. 6) und einer ausreichend großen Anzahl zerstörter und zerstörter Blutgefäße im Tumorgewebe (Abb. 7).
Die signifikante Hemmung der Proliferation von Gliom-C6-Zellen in vitro durch die kombinierte Anwendung von 25 mM DCA und 7,8 mM MTF, die mit einem geringen Zelltod einherging, war also hauptsächlich auf ihre zytostatische Wirkung zurückzuführen. Die zytostatische Komponente der synergistischen Wirkung von DCA und MTF in Bezug auf die C6-Gliomzellen wurde auch durch die signifikante Anhäufung von Zellen in der G0/G1-Phase und die Abnahme ihrer Fraktion in der S-Phase bestätigt.
Offensichtlich wurde die Verstärkung der Anti-Gliom-Wirkung von DCA und MTF aufgrund ihrer Kombination durch ihre multidirektionalen Auswirkungen auf den Energiestoffwechsel der Tumorzellen verursacht. Insbesondere war die Laktatproduktionsrate in C6-Gliomzellen ohne Zusatz von Wirkstoffen (Kontrolle) fast doppelt so hoch wie die Rate des Glukoseverbrauchs. Eine solche Korrelation zwischen diesen Indizes deutet darauf hin, dass in diesen Zellen nicht nur die glykolytische Umwandlung von Glukose in Laktat stattfindet, sondern auch eine relativ hohe Aktivität der oxidativen Phosphorylierung und anabole Prozesse der Synthese von Biomolekülen.
In DCA-behandelten Zellen deutete ein starker Rückgang des Glukoseverbrauchs bei gleichzeitiger Abnahme der Laktatproduktionsrate darauf hin, dass DCA in einer Konzentration von 25 mM in der Lage war, sein Potenzial als Kinase-Pyruvat-Dehydrogenase-Inhibitor auszuschöpfen und die Intensität der mitochondrialen Atmung zu erhöhen und die Glykolyse in diesen Zellen indirekt zu unterdrücken.
Ein starker Rückgang der Rate des Glukoseverbrauchs in Gliomzellen aufgrund der Wirkung von DCA war mit seiner ausgeprägten Apoptose-induzierenden Aktivität verbunden. Trotz der signifikanten pro-apoptotischen Wirkung von DCA und der Verlagerung des zellulären Stoffwechsels auf die mitochondriale Atmung wurden keine offensichtlichen Veränderungen des Membranpotenzials der inneren Membran der Mitochondrien in den C6-Gliomzellen festgestellt.
Im Gegensatz zu DCA wurde bei Tumorzellen, die mit MTF behandelt wurden, ein signifikanter Anstieg der Laktatproduktion festgestellt, und zwar sowohl im Falle seiner separaten Anwendung als auch in Kombination mit DCA. Offensichtlich geschah dies über die Hemmung des Komplexes I der Elektronentransportkette der Mitochondrien durch MTF [15], selbst in niedrigen, nicht toxischen Konzentrationen. In Anbetracht der Tatsache, dass die Aktivierung der Glykolyse in der Regel die Resistenz der Tumorzellen gegen pro-apoptotische Stimuli fördert [16], kann der mehr als 1,5-fache Rückgang der DCA-induzierten Apoptose bei kombinierter Anwendung der Wirkstoffe zumindest teilweise auf die MTF-induzierte Aktivierung der aeroben Glykolyse in den C6-Gliomzellen zurückgeführt werden.
Im Falle der Kombination von DCA und MTF wurde die MTF-induzierte Veränderung des Energiestoffwechsels in größerem Umfang umgesetzt. In Anbetracht der hohen Laktatproduktionsrate bei Zellen, die mit MTF allein oder in Kombination mit DCA behandelt wurden, kann der Schluss gezogen werden, dass im letzteren Fall die MTF-induzierte Glykolyse gegenüber dem DCA-induzierten mitochondrialen Stoffwechsel in Tumorzellen dominierte.
Es ist anzumerken, dass trotz der signifikanten Wirkung von DCA und MTF auf den Tumorstoffwechsel, ob einzeln oder in Kombination angewendet, sie den ATP-Gehalt in den Tumorzellen praktisch nicht verringerten. Das Fehlen von Veränderungen des ATP-Spiegels in den Tumorzellen aufgrund der Wirkung von DCA und MTF allein und in Kombination deutet auf die Umsetzung kompensatorischer Reaktionen in den Zellen zur Aufrechterhaltung der Energieversorgung der Zellen und eine ausreichend hohe metabolische Plastizität dieser Zellen hin.
Wir haben bereits früher gezeigt, dass die Antitumorwirkung von Energiestoffwechselmodifikatoren, insbesondere von MTF, wesentlich von der Mikroumgebung der Tumorzellen abhängt und sich radikal von den In-vitro-Effekten unterscheiden kann [17]. In diesen Studien wurde der Synergismus der Anti-Gliom-Aktivität von DCA in Kombination mit MTF nicht nur in vitro, sondern auch in vivo nachgewiesen.
Unter In-vivo-Bedingungen führte die hohe Anti-Tumor-Wirksamkeit der Kombination von DCA und MTF zu einer signifikanten Verlängerung der durchschnittlichen Lebensspanne von Ratten mit Tumoren. Die histologische Untersuchung von Tumorgewebe von Ratten mit C6-Gliom ergab, dass die Fähigkeit von DCA und MTF, bei kombinierter Anwendung Apoptose auszulösen, einen wesentlichen Beitrag zur Anti-Gliom-Wirkung leistet. Obwohl in vitro keine Verstärkung der pro-apoptotischen Wirkung der Kombination von DCA und MTF beobachtet wurde (was offenbar mit der eher geringen untersuchten Konzentration des letzteren zusammenhing), deuteten histologische Daten auf ihre Fähigkeit hin, die Apoptose in den Tumoren synergistisch zu induzieren. In der Arbeit [18] wurde der Synergismus der pro-apoptotischen Wirkung dieser beiden Mittel auch in Bezug auf Ovarialtumorzellen gezeigt.
Neben der pro-apoptotischen Wirkung wurde die hohe Effizienz der Anti-Gliom-Wirkung von DCA in Kombination mit MTF mit einer Verringerung des Grades der Tumorinvasion und der Zerstörung der Blutgefäße im Tumor in Verbindung gebracht. Letzteres kann zu einem Mangel an Nährstoffen, insbesondere an Glukose, in der Mikroumgebung des Tumors führen, wodurch das Tumorwachstum unterdrückt wird.
Die höhere antitumorale Wirksamkeit der Kombination von DCA und MTF kann auch auf die Beteiligung zusätzlicher Wirkmechanismen zurückzuführen sein, einschließlich ihrer Wirkung auf normale Körperzellen, die den Gehalt an Nährstoffsubstraten in der Mikroumgebung des Tumors, insbesondere im Blut, erheblich verändern können. Dies gilt für MTF, das durch die Aktivierung der AMP-aktivierten Proteinkinase den Glukose- und Lipidstoffwechsel von Hepatozyten und Skelettmuskeln beeinflussen kann [19], und für DCA, das als universell wirksam bei der Senkung des Laktatspiegels bekannt ist [20]. Insbesondere haben wir bereits gezeigt, dass DCA in Kombination mit MTF die Laktat- und Glukosespiegel im Blut von Ratten senkt, was mit ihrer Antitumoraktivität korreliert [21]. Es ist auch möglich, dass ein gewisser Beitrag zur Anti-Gliom-Wirkung der Kombination aus DCA und MTF darin besteht, dass sie in der Lage sind, Anämie und Thrombozytopenie zu korrigieren, die sich vor dem Hintergrund des Wachstums des C6-Glioms bei Ratten entwickeln [21].
Die vorgelegten Daten weisen also auf den Synergismus der Anti-Gliom-Wirkung von DCA und MTF im Falle ihrer kombinierten Verwendung sowohl in vitro als auch in vivo hin und können als Ausgangspunkt für die Entwicklung wirksamer Behandlungsschemata für bösartige Hirntumore auf der Grundlage der kombinierten Verwendung von DCA und MTF betrachtet werden.
REFERENZEN
1 1. Taal W, Bromberg JE, van den Bent MJ. Chemotherapy in glioma. CNS Oncol 2015; 4: 179-92.
2 Chowdhary MM, Ene CI, Silbergeld DL. Treatment of gliomas: how did we get here? Surg Neurol Int 2015; 6: S85-8.
3 Wang Y, Xing D, Zhao M, et al. The role of a single angiogenesis inhibitor in the treatment of recurrent glioblastoma multiforme: a meta-analysis and systematic review. PLoS One 2016; 11: e0152170.
4 Ameratunga M, Pavlakis N, Wheeler H, et al. Antiangiogenic therapy for high-grade glioma. Cochrane Database Syst Rev 2018; 11: CD008218.
5 Agnihotri S, Zadeh G. Metabolic reprogramming in glioblastoma: the influence of cancer metabolism on epigenetics and unanswered questions. Neuro-Oncol 2016; 18: 160-72.
6 Weber GF. Zeit und Umstände: Krebszellmetabolismus in verschiedenen Stadien der Krankheitsprogression. Front Oncol 2016; 6: 257.
7 Seyfried TN, Sanderson TM, El-Abbadi MM, et al. Role of glucose and ketone bodies in the metabolic control of experimental brain cancer. Br J Cancer 2003; 89: 1375-82.
8 Seliger C, Meyer A-L, Renner K, et al. Metformin hemmt die Proliferation und Migration von Glioblastomzellen unabhängig von TGF-β2. Cell Cycle 2016; 15: 1755-66.
9 Sesen J, Dahan P, Scotland SJ, et al.Metformin hemmt das Wachstum von menschlichen Glioblastomzellen und verbessert das therapeutische Ansprechen. PLoS One 2015; 10: e0123721.
10 Seliger C, Renner K. P08.52 Metformin als adjuvante Therapie bei Gliomen. Neuro-Oncology 2017; 19: iii65.
11 Michelakis ED, Sutendra G, Dromparis P, et al. Metabolic modulation of glioblastoma with dichloroacetate. Sci Transl Med 2010; 2: 31ra34.
12 Duan Y, Zhao X, Ren W, et al. Antitumor-Aktivität von Dichloracetat auf C6-Gliomzellen: in vitro- und in vivo-Bewertung. Onco Targets Ther 2013; 6: 189-98.
13 Fedorchuk AG, Pyaskovskaya ON, Gorbik GV, et al. Effectiveness of sodium dichloroacetate against glioma C6 depends on administration schedule and dosage. Exp Oncol 2016; 38: 80-3.
14 Nicoletti I, Migliorati G, Pagliacci MC, et al. A rapid and simple method for measuring thymocyte apoptosis by propidium iodide staining and flow cytometry. J Immunol Methods 1991; 139: 271-80.
15 Wheaton WW, Weinberg SE, Hamanaka RB, et al. Metformin hemmt den mitochondrialen Komplex I von Krebszellen und reduziert so die Tumorigenese. eLife 2014; 3: e02242.
16 Michelakis ЕD, Websterl L, Mackey JR. Dichloracetat (DCA) als potenzielle metabolische zielgerichtete Therapie für Krebs. Br J Cancer 2008; 99: 989-94.
17 Pyaskovskaya ON, Kolesnik DL, Fedorchuk AG, et al. Cytotoxic activity of metformin in vitro does not correlate with its antitumor action in vivo. Exp Oncol 2017; 39: 264-8.
18 Bo Li, Xinzhe Li, Zhenhong Ni, et al. Dichloroacetat und Metformin unterdrücken synergistisch das Wachstum von Eierstockkrebszellen. Oncotarget 2016; 7: 59458-90.
19 Zhou G, Myers R, Li Y, et al. Role of AMP-activated protein kinase in mechanism of metformin action. J Clin Invest 2001; 108: 1167-74.
20 Abdelmalak M, Lew A, Ramezani R, et al. Long-term safety of dichloroacetate in congenital lactic acidosis. Mol Genet Metab 2013; 109: 139-43.
21 Prokhorova IV, Pyaskovskaya ON, Kolesnik DL, Solyanik GI. Einfluss von Metformin, Natriumdichloracetat und deren Kombination auf die hämatologischen und biochemischen Blutparameter von Ratten mit Gliom C6. Exp Oncol 2018; 40: 205-10.