Dana Flavin
Fondazione per la medicina collaborativa e la ricerca, Greenwich, CT, USA e AMC/co Klinik im Alpenpark, Ringsee, Germania
Corrispondenza a: Dott.ssa Dana Flavin, Fondazione per la Medicina Collaborativa e la Ricerca, 24 Midwood Drive, Greenwich, CT, USA E-mail: [email protected]
Ricevuto: 7 aprile 2010
Accettato: 15 giugno 2010
DOI: 10.3892/ol_00000158
Abstract
Un paziente maschio di 51 anni a cui è stato diagnosticato un carcinoma midollare della tiroide (MTC) nel 2001, con progressione a metastasi polmonari dopo la terapia con adriamicina, è stato trattato con successo con dimetiltriazenoimidazolo carbossimide. È rimasto in remissione parziale per 7 anni dopo numerosi tentativi di chemioterapia per indurre una remissione parziale. Nell’ottobre 2008, il paziente, allora 58enne, ha avuto una ricaduta con numerosi tumori in tutto il corpo centrale. Il 1° dicembre 2008, il marcatore tumorale della MTC, la calcitonina, era a 38.611 pg/ml, cioè molto più alto della norma di <20 pg/ml. Poiché tutti gli altri tentativi di chemioterapia erano falliti, il paziente non era ammissibile a nuovi studi. Di conseguenza, il paziente è stato immediatamente sottoposto a 10 mg/kg di dicloroacetato (DCA). Nell’aprile 2009, il livello di calcitonina si è ridotto a 2.000 pg/ml. Nel maggio 2009, una nuova tomografia a emissione di positroni ha mostrato una drastica riduzione di tutte le sedi tumorali. Attualmente il paziente rimane in remissione e continua a ricevere lo stesso dosaggio di DCA, con il marcatore tumorale stabile nei dati di laboratorio dal novembre 2009.
Parole chiave: dicloroacetato, carcinoma midollare della tiroide
INTRODUZIONE
Il carcinoma midollare della tiroide (MTC) è un raro tumore neuroendocrino produttore di calcitonina che origina dalle cellule parafollicolari C (cellule produttrici di calcitonina) della ghiandola tiroidea (1), componente della neoplasia endocrina multipla di tipo 2 o sindrome MEN2 (2), che rappresenta circa il 4% di tutti i tumori della tiroide. Sebbene il 25-30% dei casi di MTC siano disturbi ereditari, i restanti casi consistono in forme sporadiche della malattia (3). Il tasso di sopravvivenza a 3 anni dei pazienti con carcinoma tiroideo differenziato e resistenza allo iodio radioattivo è inferiore al 50%, con una scarsa risposta ottenuta con le chemioterapie citotossiche standard (4). Nei tumori maligni endocrini, come il carcinoma tiroideo, il trattamento di scelta è la chirurgia; tuttavia, questo approccio ha successo solo nella malattia in fase iniziale. L’MTC è una malattia incurabile quando le metastasi diventano non resecabili (5). Le opzioni terapeutiche per i tumori endocrini avanzati rimangono insoddisfacenti e sono associate a prognosi sfavorevoli per i pazienti. La chemioterapia citotossica e la radioterapia, che sono associate a una tossicità significativa, spesso mostrano solo un’efficacia limitata e transitoria (6). Gli inibitori delle tirosin-chinasi, che agiscono in particolare sull’attività di guadagno di funzione del proto-oncogene RET (riarrangiato durante la trasfezione), come vandetanib, sorafenib e sunitinib, sembrano essere promettenti. Tuttavia, il basso tasso di risposte parziali e l’assenza di risposte complete in tutti i vari studi di monoterapia sottolineano la necessità di nuovi e più efficaci agenti singoli o in combinazione con una tossicità accettabile (3).
Caso clinico
Questo studio presenta un paziente maschio affetto da MTC con metastasi polmonari, che ha sviluppato un nuovo tumore sette anni dopo l’intervento chirurgico e il successo della chemioterapia con dimetiltriazenoimidazolo carbossimide (DTIC) e 5-fluorouracile. Diagnosticato inizialmente nel 2001, il paziente di 51 anni con MTC e coinvolgimento linfonodale aveva una forma sporadica della malattia, mentre il suo fratello gemello, anch’esso negativo per qualsiasi fattore genetico, era libero dalla malattia. Il paziente è stato trattato nuovamente nel 2004 con un regime di carboplatino e daunoxome e, più tardi, con un depot di sandostatina (carbo-iressasomatostatina) ed etoposide più carboplatino, per ridurre i livelli di calcitonina da 13.280 pg/ml; tuttavia, sono aumentati a 20.074 pg/ml. Nel 2005, il regime è stato modificato in carboplatino, Iressa, Sandostatina e Zometa. Nell’autunno 2005, gli è stato somministrato samarian-153 per il dolore causato dalle metastasi ossee. Nel 2006 è stata somministrata un’ulteriore chemioterapia a base di mitomicina C e cisplatino, mentre ha continuato a prendere Tarceva e Sandostatin. I livelli di calcitonina sono rimasti elevati.
Nell’ottobre 2008, il paziente ha iniziato a lamentare diarrea e i suoi marcatori tumorali hanno mostrato un aumento della calcitonina a 25.843 pg/ml (norma <20 pg/ml). Una tomografia a emissione di positroni (PET; Siemens Ecat Exact 47) ordinata lo stesso ottobre ha mostrato nuove metastasi multiple nell’area toracica e nel mediastino. La cavità toracica centrale comprendeva più di cinque tumori multipli del mediastino e un grande tumore anteriore al pericardio nell’area mediastinica destra con valore di captazione standardizzato (SUV >5). Inoltre, sono stati notati tumori molto piccoli nelle vertebre, tra cui la T4 toracica e la 3, 4 e 5 lombare. Sono stati rilevati altri tumori con un SUV di 5 nell’os ileo e nella regione para-iliosacrale dorsale. Piccoli tumori con un SUV di 3 sono stati rilevati nell’os acetabolo e nell’ischio ascendente. Inoltre, sono stati rilevati piccoli tumori con un SUV di 2 nelle aree retroclaveari e altri piccoli tumori dietro lo sternocleidomastoideo. A dicembre 2008, il marcatore tumorale calcitonina era aumentato a 38.611 pg/ml.
Il paziente non era eleggibile per nessuno dei nuovi studi sugli inibitori della tirosin-chinasi previsti e gli era stata assegnata una prognosi infausta, poiché tutte le chemioterapie conosciute avevano fallito. Il 1° dicembre 2008, il paziente è stato sottoposto a 10 mg/kg di dicloroacetato (DCA) nel tentativo di inibire la crescita del tumore e potenzialmente ottenere un’inversione. Sono state aggiunte capsule di tiamina a 750 mg per ridurre l’eventuale tossicità nervosa riportata dal trattamento con DCA (7).
Nel febbraio 2009 è stata osservata per la prima volta una diminuzione del marcatore tumorale della calcitonina a 8.655 pg/ml (norma <20 pg/ml). Due mesi dopo è stata osservata un’ulteriore riduzione della calcitonina a 2.000 pg/ml. Nel maggio 2009, dopo 5 mesi di somministrazione di DCA, la PET ha mostrato una notevole riduzione del numero e delle dimensioni del tumore. Le metastasi lombari e i tumori nell’area pelvica erano nettamente ridotti rispetto all’ottobre 2008, così come i tumori dell’area toracica, con solo una piccola ombra nella regione T4 che accennava alla posizione della metastasi originariamente rilevata nella PET iniziale del 2008. Le metastasi linfonodali erano molto ridotte rispetto all’esame precedente e la necrosi centrale era aumentata nel tumore mediastinico.
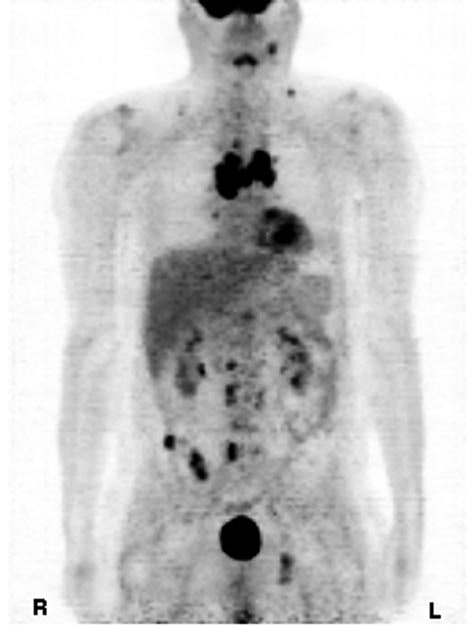
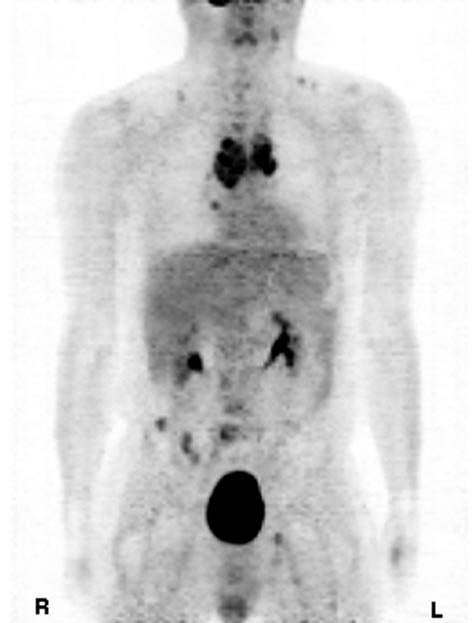
Discussione
L’MTC è una neoplasia rara, ma impegnativa (8). I fattori prognostici sfavorevoli includono l’età superiore ai 50 anni, il sesso maschile e la diffusione a distanza (metastasi). La sopravvivenza a 10 anni è solo del 20% per i pazienti con metastasi a distanza. I livelli di calcitonina nel sangue vengono misurati per determinare la crescita dell’MTC nei pazienti con un test positivo definito come una calcitonina sierica basale superiore o uguale a 50 pg/ml (9). In questo caso, il paziente aveva una prognosi sfavorevole poiché aveva più di 50 anni, era di sesso maschile e presentava metastasi a distanza. Nel 2001, il paziente è stato diagnosticato e trattato per la prima volta con DTIC, dopo che l’adriamicina aveva provocato una diffusione del tumore con metastasi polmonari. Dopo la remissione delle metastasi polmonari, i livelli di calcitonina oscillavano tra 7.000 e 13.000 pg/ml (norma <20 pg/ml). Dal 2004 al 2007, i livelli di calcitonina sono aumentati gradualmente fino a superare i 20.000 pg/ml, nonostante i numerosi tentativi di ridurre i livelli con vari chemioterapici, dimostrando un effetto minimo sull’inibizione della progressione del cancro. Nell’ottobre 2008, i tumori si erano diffusi in tutte le aree ossee e mediastiniche e il livello del marcatore tumorale calcitonina aveva raggiunto oltre 38.000 pg/ml. Le scansioni PET erano correlate ai livelli di calcitonina in eccesso, indicando una prognosi molto infausta. Nel nostro caso di MTC, l’uso di DCA combinato con 750 mg di tiamina per contrastare l’eventuale tossicità nervosa ha determinato una marcata inversione dei tumori e dei livelli di marcatori tumorali in un periodo di 5 mesi. Sebbene il sistema gastrointestinale della paziente sia tornato alla normalità nelle prime settimane di terapia con DCA, sono trascorsi alcuni mesi prima che si notasse una riduzione dei livelli di calcitonina e della sensazione di affaticamento generale. Figura 1. Tomografia a emissione di positroni del tumore midollare della tiroide, ottobre 2008. Figura 2. Tomografia a emissione di positroni del tumore midollare della tiroide dopo il trattamento con dicloroacetato, maggio 2009. L’elevato numero di tumori, gli elevati livelli di calcitonina, l’aumento dei sintomi avversi associati alle modalità di trattamento, la mancanza di risposte alla chemioterapia e l’inammissibilità agli studi sugli inibitori della tirosin-chinasi sperimentali hanno giustificato l’uso del DCA. Il DCA è stato utilizzato con successo nei bambini affetti da acidosi lattica congenita fin dal 1988 (10) ed è una sostanza chimica attualmente testata a livello oncologico in Canada. In particolare, numerose cellule tumorali presentano un aumento dell’acido lattico dovuto all’uso preferenziale della glicolisi invece dell’ossidazione del glucosio per generare adenosina trifosfato (ATP) anche in presenza di ossigeno. Questo fenomeno è noto come glicolisi aerobica o “effetto Warburg” (11), che fa sì che il piruvato venga indirizzato all’acido lattico invece che ai mitocondri per la generazione di ATP nel ciclo degli acidi tricarbossilici (TCA). Il DCA consente la riattivazione della piruvato deidrogenasi, un enzima che mantiene l’ingresso del piruvato nel TCA mitocondriale, bloccando la piruvato deidrogenasi chinasi (12). Questo blocco della glicolisi riporta le cellule tumorali all’utilizzo dell’ossidazione del glucosio, il normale metabolismo aerobico delle cellule sane che porta all’apoptosi (13).
Il successo del trattamento di questo paziente con MTC è solo un risultato preliminare e ulteriori ricerche dovrebbero essere condotte per confermare i risultati ottenuti in altri pazienti con MTC che hanno esaurito le modalità di trattamento chemioterapico. I risultati ottenuti in questo caso possono anche indicare una potenziale applicazione del DCA in questa forma di tumore quando le altre terapie falliscono, almeno fino a quando non saranno sviluppate nuove terapie per i pazienti che hanno solo il 20% di possibilità di sopravvivenza in un periodo di 10 anni.
In conclusione, abbiamo presentato un paziente con MTC con metastasi multiple e prognosi molto sfavorevole dopo sette anni di chemioterapia, la cui ricaduta è stata annullata con il trattamento con DCA. Questo propone un meccanismo che potrebbe aprire nuove porte per lo sviluppo futuro di nuove terapie antitumorali.
Il paziente viene attualmente mantenuto in terapia con DCA per un periodo indefinito, visti i risultati positivi della remissione. A novembre 2009, secondo i livelli dei marcatori tumorali, il paziente è in remissione. Qualsiasi variazione del livello dei marcatori tumorali indicherà una resistenza a questa terapia. Altri pazienti affetti da MTC potranno essere presi in considerazione per questo approccio terapeutico in futuro, se lo si riterrà necessario. In conclusione, il DCA ha inibito la progressione del tumore e i livelli dei marcatori tumorali. Inoltre, il meccanismo del DCA, che prevede l’inversione della glicolisi, sembra essere un importante bersaglio da studiare come futuro approccio terapeutico.
Ringraziamenti
Desidero ringraziare Marc Ramos e Jimmy Xu per l’assistenza alla ricerca scientifica. Questo studio non ha ricevuto alcuna sovvenzione specifica da alcuna agenzia di finanziamento nel settore pubblico, commerciale o no-profit.
RIFERIMENTI
1 1. Santarpia L, Ye L e Gagel RF: Beyond RET: potential therapeutic approaches for advanced and metastatic medullary thyroid carcinoma. J Intern Med 266: 99-113, 2009.
2 Cuccuru G: Effetti cellulari e attività antitumorale dell’inibitore di RET RPI-1 sul carcinoma midollare della tiroide associato a MEN2A. J Natl Cancer Inst 96: 1006-1014, 2004.
3 Cakir M e Grossman A: Carcinoma midollare della tiroide: biologia molecolare e nuove terapie molecolari. Neuroendocrinology 90: 323-348, 2009.
4 Higgins MJ, Forastiere A e Marur S: Nuovi orientamenti nel trattamento sistemico del carcinoma tiroideo metastatico. Oncologia 23: 768-775, 2009.
5 Sugawara M, Geffner DL, Martinez D e Hershman JM: Nuovi trattamenti del carcinoma midollare della tiroide. Curr Opin Endocrinol Diabetes Obes 16: 367-372, 2009.
6 Fassnacht M, Kreissl MC, Weissmann D e Allolio B: Nuovi bersagli e approcci terapeutici per le neoplasie endocrine. Pharmacol Ther 123: 117-141, 2009.
7 Spruijt L, Naviaux R, McGowan KA, et al: Cambiamenti nella conduzione nervosa in pazienti con malattie mitocondriali trattati con dicloroacetato. Muscle Nerve 24: 916-924, 2001.
8 Task force delle linee guida dell’American Thyroid Association: Carcinoma midollare della tiroide: Linee guida di gestione dell’American Thyroid Association. Thyroid 19: 565-612, 2009.
9 Cheung K: La misurazione della calcitonina nella valutazione dei noduli tiroidei negli Stati Uniti: un’analisi costo-efficacia e decisionale. Clin Endocrinol Metab 93: 2173-2180, 2008.
10 Stacpoole PW, Lorenz A, Thomas R e Harman E: Il dicloroacetato nel trattamento dell’acidosi lattica. Ann Intern Med 108: 58-63, 1988.
11 Warburg O, Wind F e Negelein E: Uber den stoffwechsel von Tumoren im Korper. Klin Woch 5: 829-832, 1926.
12 Stacpoole PW, Henderson GN, Yan Z e James MO: Farmacologia clinica e tossicologia del dicloroacetato. Environ Health Perspect 106: 989-994, 1998.
13 Bonnet S, Archer SL, Allalunis-Turner J, et al: A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth. Cancer Cell 11: 37-57, 2007.