Dana Flavin
Foundation for Collaborative Medicine and Research, Greenwich, CT, USA und AMC/co Klinik im Alpenpark, Ringsee, Deutschland
Korrespondenz an: Dr. Dana Flavin, Foundation for Collaborative Medicine and Research, 24 Midwood Drive, Greenwich, CT, USA E-Mail: [email protected]
Eingereicht: 7. April 2010Akzeptiert
: Juni 15, 2010DOI
: 10.3892/ol_00000158
Zusammenfassung
Ein 51-jähriger Patient, bei dem 2001 ein medulläres Schilddrüsenkarzinom (MTC) diagnostiziert wurde und der nach einer Adriamycin-Therapie Lungenmetastasen entwickelte, wurde erfolgreich mit Dimethyltriazenoimidazolcarboximid behandelt. Nach zahlreichen Chemotherapieversuchen zur Herbeiführung einer Teilremission blieb er 7 Jahre lang in Teilremission. Im Oktober 2008 erlitt der damals 58-jährige Patient einen Rückfall mit zahlreichen Tumoren in der Körpermitte. Am 1. Dezember 2008 lag der Tumormarker für MTC, Calcitonin, bei 38.611 pg/ml, d. h. weit über der Norm von <20 pg/ml. Da alle anderen Chemotherapieversuche fehlgeschlagen waren, kam er für keine neuen Studien in Frage. Daraufhin wurde der Patient sofort mit 10 mg/kg Dichloracetat (DCA) behandelt. Im April 2009 war der Calcitoninspiegel auf 2.000 pg/ml gesunken. Im Mai 2009 zeigte eine erneute Positronen-Emissions-Tomographie einen dramatischen Rückgang an allen Tumorstellen. Der Patient befindet sich derzeit in Remission und erhält weiterhin die gleiche Dosierung von DCA, wobei sein Tumormarker in den Labordaten seit November 2009 stabil bleibt.
Schlüsselwörter: Dichloracetat, medulläres Schilddrüsenkarzinom
EINLEITUNG
Das medulläre Schilddrüsenkarzinom (MTC) ist ein seltener Calcitonin-produzierender neuroendokriner Tumor, der sich aus parafollikulären C-Zellen (Calcitonin-produzierenden Zellen) der Schilddrüse entwickelt, die von der Neuralleiste abstammen (1)eine Komponente der multiplen endokrinen Neoplasie Typ 2 oder MEN2-Syndrome (2)und macht etwa 4 % aller Schilddrüsenkrebsfälle aus. Bei 25-30 % der MTC-Fälle handelt es sich um vererbte Erkrankungen, die übrigen Fälle sind sporadische Formen der Krankheit (3). Die 3-Jahres-Überlebensrate von Patienten mit differenziertem Schilddrüsenkrebs und Resistenz gegen radioaktives Jod beträgt weniger als 50 %, wobei die zytotoxischen Standard-Chemotherapien kaum ansprechen (4). Bei endokrinen Malignomen, wie dem Schilddrüsenkarzinom, ist die Behandlung der Wahl die Operation, die jedoch nur im Frühstadium der Erkrankung erfolgreich ist. MTC ist eine unheilbare Krankheit, wenn die Metastasen nicht mehr entfernt werden können (5). Die Behandlungsmöglichkeiten für fortgeschrittene endokrine Malignome sind nach wie vor unbefriedigend und gehen mit einer schlechten Prognose für die Patienten einher. Zytotoxische Chemo- und Strahlentherapien, die mit erheblicher Toxizität verbunden sind, zeigen oft nur eine begrenzte und vorübergehende Wirksamkeit (6). Tyrosinkinaseinhibitoren, die vor allem auf die Aktivität des Proto-Onkogens RET (Rearrangement während der Transfektion) einwirken, wie z. B. Vandetanib, Sorafenib und Sunitinib, scheinen vielversprechend zu sein. Die niedrige Rate partieller Reaktionen und das Fehlen vollständiger Reaktionen in den verschiedenen Studien zur Monotherapie machen jedoch deutlich, dass neue und wirksamere Einzelwirkstoffe oder Kombinationen von Wirkstoffen mit akzeptabler Toxizität benötigt werden (3).
Fallbericht
In dieser Studie wird ein männlicher MTC-Patient mit Lungenmetastasen vorgestellt, der sieben Jahre nach einem chirurgischen Eingriff und einer erfolgreichen Chemotherapie mit Dimethyltriazenoimidazolcarboximid (DTIC) und 5-Fluorouracil neue Tumore entwickelte. Der 51-jährige Patient mit MTC und Lymphknotenbefall, bei dem 2001 die Erstdiagnose gestellt wurde, hatte eine sporadische Form der Krankheit, während sein Zwillingsbruder, bei dem ebenfalls kein genetischer Faktor festgestellt wurde, krankheitsfrei war. Der Patient wurde 2004 erneut mit einem Regime aus Carboplatin und Daunoxom und später im selben Jahr mit einem Depot aus Sandostatin (Carbo-Iressasomatostatin) und Etoposid plus Carboplatin behandelt, um seine Calcitoninwerte von 13 280 pg/ml zu senken; sie stiegen jedoch auf 20 074 pg/ml. Im Jahr 2005 wurde das Behandlungsschema auf Carboplatin, Iressa, Sandostatin und Zometa umgestellt. Im Herbst 2005 wurde ihm Samarian-153 gegen die durch die Knochenmetastasen verursachten Schmerzen verabreicht. Im Jahr 2006 wurde eine weitere Chemotherapie mit Mitomycin C und Cisplatin verabreicht, während er weiterhin Tarceva und Sandostatin einnahm. Die Calcitoninwerte blieben erhöht.
Im Oktober 2008 begann der Patient über Durchfall zu klagen, und seine Tumormarker zeigten einen Anstieg des Calcitonins auf 25.843 pg/ml (Norm <20 pg/ml). Eine im Oktober desselben Jahres in Auftrag gegebene Positronen-Emissions-Tomographie (PET; Siemens Ecat Exact 47) zeigte mehrere neue Metastasen im Thoraxbereich und im Mediastinum. In der zentralen Brusthöhle befanden sich mehr als fünf Mediastinum-Multitumoren und ein großer Tumor anterior des Herzbeutels im rechten Mediastinalbereich mit einem standardisierten Aufnahmewert (SUV >5). Außerdem wurden sehr kleine Tumore in den Wirbeln, einschließlich T4 im Brustbereich und 3, 4 und 5 in der Lendenwirbelsäule, festgestellt. Weitere Tumore mit einem SUV von 5 wurden im Os ileum und in der dorsalen para-iliosakralen Region festgestellt. Kleine Tumore mit einem SUV von 3 wurden im Os acetabulum und dem aufsteigenden Sitzbein festgestellt. Darüber hinaus wurden kleine Tumore mit einem SUV von 2 in den retroklavikulären Bereichen sowie weitere kleine Tumore hinter dem Sternocleidomastoideus festgestellt. Bis Dezember 2008 war der Tumormarker Calcitonin auf 38.611 pg/ml angestiegen.
Der Patient kam für keine der neuen Tyrosinkinase-Inhibitor-Studien in Frage und hatte eine schlechte Prognose, da alle bekannten Chemotherapien versagt hatten. Am 1. Dezember 2008 wurde die Patientin mit 10 mg/kg Dichloracetat (DCA) behandelt, um das Wachstum der Tumore zu hemmen und möglicherweise eine Rückbildung zu erreichen. Thiamin-Kapseln mit 750 mg wurden zusätzlich verabreicht, um die von der DCA-Behandlung berichtete Nerventoxizität zu verringern (7).
Im Februar 2009 wurde erstmals ein Rückgang des Calcitonin-Tumormarkers auf 8.655 pg/ml (Norm <20 pg/ml) festgestellt. Zwei Monate später wurde ein weiterer Rückgang von Calcitonin auf 2.000 pg/ml festgestellt. Im Mai 2009, nach 5-monatiger DCA-Gabe, zeigte der PET-Scan eine bemerkenswerte Verringerung der Tumorzahl und -größe. Die lumbalen Metastasen und die Tumoren im Beckenbereich waren im Vergleich zum Oktober 2008 deutlich zurückgegangen, ebenso wie die Tumoren im Brustbereich, wobei nur ein kleiner Schatten in der T4-Region auf die Lage der Metastase hindeutete, die ursprünglich bei der ersten PET-Untersuchung im Jahr 2008 festgestellt worden war. Die Lymphknotenmetastasen waren im Vergleich zur früheren Untersuchung sehr klein, und die zentrale Nekrose hatte im Mediastinaltumor zugenommen.
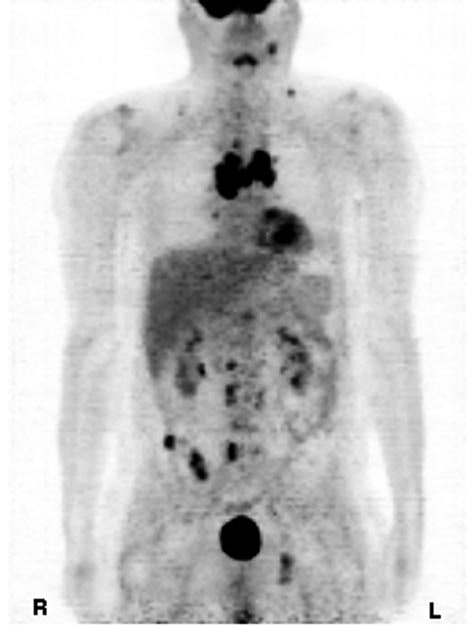
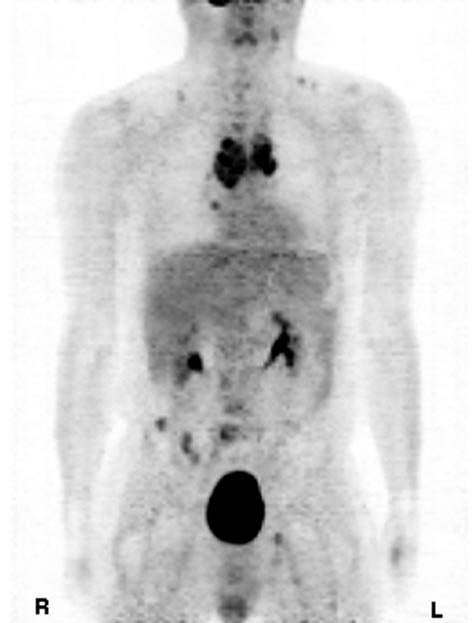
Diskussion
MTC ist eine seltene, aber schwierige bösartige Erkrankung (8). Zu den prognostisch ungünstigen Faktoren gehören ein Alter von über 50 Jahren, das männliche Geschlecht und die Fernausbreitung (Metastasierung). Die 10-Jahres-Überlebensrate beträgt nur 20 % bei Patienten mit Fernmetastasen. Der Calcitoninspiegel im Blut wird gemessen, um das Wachstum des MTC bei Patienten mit einem positiven Test zu bestimmen, der als basales Serumcalcitonin von 50 pg/ml oder mehr definiert ist (9). In diesem Fall hatte der Patient eine schlechte Prognose, da er über 50 Jahre alt, männlich und mit Fernmetastasen behaftet war. Im Jahr 2001 wurde der Patient diagnostiziert und erstmals mit DTIC behandelt, nachdem Adriamycin zu einer Ausbreitung des Krebses mit Lungenmetastasen geführt hatte. Nach der Remission seiner Lungenmetastasen schwankten seine Calcitoninwerte zwischen 7.000 und 13.000 pg/ml (Norm <20 pg/ml). Von 2004 bis 2007 stiegen die Calcitoninwerte allmählich auf über 20.000 pg/ml an, trotz zahlreicher Versuche, die Werte mit verschiedenen Chemotherapien zu senken, die nur eine minimale Wirkung auf die Hemmung des Krebsfortschritts zeigten. Im Oktober 2008 hatten sich die Tumore im gesamten Knochen- und Mediastinalbereich ausgebreitet, und der Calcitonin-Tumormarker erreichte einen Wert von über 38.000 pg/ml. Die PET-Scans korrelierten mit den überhöhten Calcitonin-Werten, was auf eine sehr schlechte Prognose hindeutete. In unserem Fall von MTC führte der Einsatz von DCA in Kombination mit 750 mg Thiamin, um jeglicher Nerventoxizität entgegenzuwirken, zu einer deutlichen Rückbildung der Tumore und der Tumormarkerwerte über einen Zeitraum von fünf Monaten. Obwohl sich das gastrointestinale System des Patienten innerhalb der ersten Wochen der DCA-Therapie wieder normalisierte, dauerte es einige Monate, bis ein Rückgang der Calcitoninwerte und ein allgemeines Gefühl der Müdigkeit festgestellt wurde. Abbildung 1. Positronen-Emissions-Tomographie des medullären Schilddrüsenkrebses, Oktober 2008. Abbildung 2. Positronen-Emissions-Tomographie des medullären Schilddrüsenkrebses nach der Behandlung mit Dichloracetat, Mai 2009. Die große Anzahl von Tumoren, die erhöhten Calcitoninwerte, die vermehrten unerwünschten Symptome im Zusammenhang mit den Behandlungsmodalitäten, das fehlende Ansprechen auf die Chemotherapie und die Untauglichkeit für experimentelle Tyrosinkinase-Inhibitor-Studien rechtfertigten den Einsatz von DCA. DCA wird seit 1988 erfolgreich bei Kindern mit kongenitaler Laktatazidose eingesetzt (10)und ist eine Chemikalie, die derzeit in Kanada onkologisch getestet wird. Zahlreiche Tumorzellen weisen einen Anstieg der Milchsäure auf, der darauf zurückzuführen ist, dass sie die Glykolyse der Glukoseoxidation vorziehen, um Adenosintriphosphat (ATP) zu erzeugen, selbst wenn Sauerstoff vorhanden ist. Dieses Phänomen ist als aerobe Glykolyse oder „Warburg-Effekt“ bekannt (11)er führt dazu, dass Pyruvat in Milchsäure umgewandelt wird, anstatt in die Mitochondrien zur ATP-Erzeugung im Tricarbonsäurezyklus (TCA) zu gelangen. DCA ermöglicht die Reaktivierung der Pyruvatdehydrogenase, eines Gatekeeping-Enzyms für den Eintritt von Pyruvat in den mitochondrialen TCA-Zyklus, indem es die Pyruvatdehydrogenase-Kinase blockiert (12). Durch diese Blockade der Glykolyse werden die Tumorzellen wieder auf die Nutzung der Glukoseoxidation umgestellt, dem normalen aeroben Stoffwechsel gesunder Zellen, der zur Apoptose führt (13).
Die erfolgreiche Behandlung dieses MTC-Patienten ist nur ein vorläufiges Ergebnis, und weitere Untersuchungen sollten durchgeführt werden, um unsere Ergebnisse bei anderen MTC-Patienten zu bestätigen, bei denen die chemotherapeutischen Behandlungsmodalitäten ausgeschöpft sind. Die in diesem Fall festgestellten Ergebnisse könnten auch auf eine mögliche Anwendung von DCA bei dieser Krebsart hinweisen, wenn andere Therapien versagen, zumindest bis neue Therapien für Patienten mit einer Überlebenschance von nur 20 % über einen Zeitraum von 10 Jahren entwickelt werden.
Zusammenfassend lässt sich sagen, dass wir einen MTC-Patienten mit multiplen Metastasen und einer sehr schlechten Prognose nach sieben Jahren Chemotherapie vorgestellt haben, dessen Rückfall durch die Behandlung mit DCA rückgängig gemacht werden konnte. Dies deutet auf einen Mechanismus hin, der neue Türen für die künftige Entwicklung neuer Krebstherapien öffnen könnte.
Angesichts der positiven Ergebnisse der Remission wird der Patient derzeit auf unbestimmte Zeit mit DCA behandelt. Im November 2009 befand er sich nach seinen Tumormarkerwerten in Remission. Jede Veränderung der Tumormarkerwerte deutet auf eine Resistenz gegen diese Therapie hin. Falls es sich als notwendig erweisen sollte, könnte dieser Therapieansatz in Zukunft auch bei anderen MTC-Patienten in Betracht gezogen werden. Zusammenfassend lässt sich sagen, dass DCA die Tumorprogression und die Tumormarkerwerte hemmte. Darüber hinaus scheint der Mechanismus von DCA, der die Umkehrung der Glykolyse beinhaltet, ein wichtiges Ziel für die Untersuchung eines zukünftigen therapeutischen Ansatzes zu sein.
Danksagung
Ich möchte Marc Ramos und Jimmy Xu für die wissenschaftliche Unterstützung bei der Recherche danken. Diese Studie erhielt keine spezifischen Zuschüsse von öffentlichen, kommerziellen oder gemeinnützigen Einrichtungen.
REFERENZEN
1 1. Santarpia L, Ye L und Gagel RF: Beyond RET: potential therapeutic approaches for advanced and metastatic medullary thyroid carcinoma. J Intern Med 266: 99-113, 2009.
2 Cuccuru G: Cellular effects and antitumor activity of RET inhibitor RPI-1 on MEN2A-associated medullary thyroid carcinoma. J Natl Cancer Inst 96: 1006-1014, 2004.
3 Cakir M und Grossman A: Medulläres Schilddrüsenkarzinom: Molekularbiologie und neue molekulare Therapien. Neuroendokrinologie 90: 323-348, 2009.
4 Higgins MJ, Forastiere A und Marur S: New directions in the systemic treatment of metastatic thyroid cancer. Onkologie 23: 768-775, 2009.
5 Sugawara M, Geffner DL, Martinez D und Hershman JM: Novel treatment of medullary thyroid cancer. Curr Opin Endocrinol Diabetes Obes 16: 367-372, 2009.
6 Fassnacht M, Kreissl MC, Weissmann D und Allolio B: New targets and therapeutic approaches for endocrine malignancies. Pharmacol Ther 123: 117-141, 2009.
7 Spruijt L, Naviaux R, McGowan KA, et al: Nervenleitungsveränderungen bei Patienten mit mitochondrialen Erkrankungen, die mit Dichloracetat behandelt werden. Muscle Nerve 24: 916-924, 2001.
8 American Thyroid Association Guidelines Task Force: Medulläres Schilddrüsenkarzinom: Behandlungsrichtlinien der Amerikanischen Schilddrüsenvereinigung. Schilddrüse 19: 565-612, 2009.
9 Cheung K: Calcitonin-Messung bei der Beurteilung von Schilddrüsenknoten in den Vereinigten Staaten: eine Kosten-Wirksamkeits- und Entscheidungsanalyse. Clin Endocrinol Metab 93: 2173-2180, 2008.
10 Stacpoole PW, Lorenz A, Thomas R und Harman E: Dichloracetat bei der Behandlung von Laktatazidose. Ann Intern Med 108: 58-63, 1988.
11 Warburg O, Wind F und Negelein E: Über den Stoffwechsel von Tumoren im Korper. Klin Woch 5: 829-832, 1926.
12 Stacpoole PW, Henderson GN, Yan Z und James MO: Clinical pharmacology and toxicology of dichloroacetate. Environ Health Perspect 106: 989-994, 1998.
13 Bonnet S, Archer SL, Allalunis-Turner J, et al: A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth. Krebszelle 11: 37-57, 2007.