Dana Flavin
Fondation pour la médecine et la recherche collaboratives, Greenwich, CT, USA et AMC/co Klinik im Alpenpark, Ringsee, Allemagne
Correspondance à : Dr Dana Flavin, Foundation for Collaborative Medicine and Research, 24 Midwood Drive, Greenwich, CT, USA E-mail : [email protected]
Reçu : 7 avril 2010
Accepté : 15 juin 2010
DOI : 10.3892/ol_00000158
Résumé
Un homme de 51 ans chez qui on a diagnostiqué un carcinome médullaire de la thyroïde (CMT) en 2001, avec une progression vers des métastases pulmonaires après un traitement à l’adriamycine, a ensuite été traité avec succès par le diméthyltriazénoimidazole carboximide. Il est resté en rémission partielle pendant 7 ans après de nombreuses tentatives de chimiothérapie pour induire une rémission partielle. En octobre 2008, le patient, alors âgé de 58 ans, a rechuté avec de nombreuses tumeurs dans tout le corps central. Le 1er décembre 2008, le marqueur tumoral du CTM, la calcitonine, était à 38 611 pg/ml, c’est-à-dire beaucoup plus élevé que la norme de <20 pg/ml. Comme toutes les autres tentatives de chimiothérapie avaient échoué, il était inéligible à toute nouvelle étude. Par la suite, le patient a été immédiatement mis sous 10 mg/kg de dichloroacétate (DCA). En avril 2009, le taux de calcitonine était réduit à 2 000 pg/ml. En mai 2009, une nouvelle tomographie par émission de positrons a montré une réduction spectaculaire de toutes les localisations tumorales. Le patient est actuellement en rémission et continue de recevoir la même dose de DCA, son marqueur tumoral restant stable dans les données de laboratoire depuis novembre 2009.
Mots clés : dichloroacétate, carcinome médullaire de la thyroïde
INTRODUCTION
Le carcinome médullaire de la thyroïde (CMT) est une tumeur neuroendocrine rare, produisant de la calcitonine, qui se développe à partir des cellules C parafolliculaires dérivées de la crête neurale (cellules productrices de calcitonine) de la glande thyroïde (1), un composant des syndromes de néoplasie endocrinienne multiple de type 2 ou MEN2 (2), représentant environ 4 % de tous les cancers de la thyroïde. Bien que 25 à 30 % des cas de CTM soient des troubles héréditaires, les autres cas sont des formes sporadiques de la maladie (3). Le taux de survie à 3 ans des patients atteints d’un cancer différencié de la thyroïde et résistant à l’iode radioactif est inférieur à 50 %, et les chimiothérapies cytotoxiques standard ne donnent que peu de résultats (4). Dans les tumeurs malignes endocriniennes, comme le carcinome thyroïdien, le traitement de choix est la chirurgie ; toutefois, cette approche ne donne de bons résultats qu’au stade précoce de la maladie. Le CTM est une maladie incurable une fois que les métastases deviennent non résécables (5). Les options thérapeutiques pour les tumeurs malignes endocriniennes avancées restent insatisfaisantes et sont associées à de mauvais pronostics pour les patients. La chimiothérapie cytotoxique et la radiothérapie, qui sont associées à une toxicité importante, ne montrent souvent qu’une efficacité limitée et transitoire (6). Les inhibiteurs de la tyrosine kinase agissant en particulier sur l’activité de gain de fonction du proto-oncogène RET (réarrangé pendant la transfection), comme le vandétanib, le sorafénib et le sunitinib, semblent prometteurs. Cependant, le faible taux de réponses partielles et l’absence de réponses complètes dans les différents essais de monothérapie soulignent la nécessité de trouver de nouveaux agents plus efficaces, seuls ou en association, et présentant une toxicité acceptable (3).
Rapport de cas
Cette étude présente un patient de sexe masculin atteint de CTM avec des métastases pulmonaires, qui a développé de nouvelles tumeurs sept ans après une intervention chirurgicale et une chimiothérapie réussie avec le diméthyltriazénoimidazole carboximide (DTIC) et le 5-fluorouracile. Initialement diagnostiqué en 2001, le patient de 51 ans, atteint de MTC et de ganglions lymphatiques, présentait une forme sporadique de la maladie, tandis que son frère jumeau, également négatif pour tout facteur génétique, était indemne. Le patient a été traité une nouvelle fois en 2004 avec un régime de carboplatine et de daunoxome, puis, plus tard dans l’année, avec un dépôt de sandostatine (carbo-Iressasomatostatine) et d’étoposide plus carboplatine, afin de réduire ses taux de calcitonine de 13 280 pg/ml ; toutefois, ils ont augmenté à 20 074 pg/ml. En 2005, le régime a été modifié pour passer au carboplatine, Iressa, Sandostatine et Zometa. À l’automne 2005, on lui a administré du samarian-153 pour les douleurs causées par les métastases osseuses. En 2006, une nouvelle chimiothérapie à base de mitomycine C et de cisplatine a été administrée, tandis qu’il continuait à prendre du Tarceva et du Sandostatin. Les taux de calcitonine sont restés élevés.
En octobre 2008, le patient a commencé à se plaindre de diarrhée, et ses marqueurs tumoraux ont montré une augmentation de la calcitonine à 25 843 pg/ml (norme <20 pg/ml). Une tomographie par émission de positons (TEP ; Siemens Ecat Exact 47) demandée ce même mois d’octobre a montré de multiples nouvelles métastases dans la région thoracique et le médiastin. La cavité thoracique centrale comprenait plus de cinq tumeurs multiples du médiastin et une grande tumeur antérieure au péricarde dans la zone médiastinale droite avec une valeur de captation standardisée (SUV >5). De plus, de très petites tumeurs dans les vertèbres, notamment la T4 thoracique et les 3, 4 et 5 lombaires ont été notées. D’autres tumeurs ont été notées avec un SUV de 5 dans l’os iléal et la région para-iliosacrée dorsale. De petites tumeurs avec un SUV de 3 ont été notées dans l’os acetabulum et l’ischium ascendant. De plus, de petites tumeurs d’un SUV de 2 ont été notées dans les zones rétroclaviculaires ainsi que d’autres petites tumeurs derrière le sternocleidomastoid. En décembre 2008, le marqueur tumoral calcitonine avait augmenté à 38 611 pg/ml.
Le patient n’était éligible à aucune des nouvelles études sur les inhibiteurs de tyrosine kinase et son pronostic était mauvais, toutes les chimiothérapies connues ayant échoué. Le 1er décembre 2008, le patient a été placé sous 10 mg/kg de dichloroacétate (DCA) pour tenter d’inhiber la croissance des tumeurs et éventuellement obtenir une inversion. Des capsules de thiamine à 750 mg ont été complétées pour réduire toute toxicité nerveuse rapportée par le traitement au DCA (7).
En février 2009, une diminution du marqueur tumoral de la calcitonine à 8 655 pg/ml (norme <20 pg/ml) a été notée pour la première fois. Une nouvelle diminution de la calcitonine à 2 000 pg/ml a été constatée deux mois plus tard. En mai 2009, après 5 mois d’administration de DCA, le PET scan a montré une réduction notable du nombre et de la taille des tumeurs. Les métastases lombaires et les tumeurs de la région pelvienne étaient nettement réduites par rapport à octobre 2008, tout comme les tumeurs de la région thoracique, avec seulement une petite ombre dans la région T4 indiquant l’emplacement de la métastase initialement notée dans la TEP initiale en 2008. Les métastases des ganglions lymphatiques étaient très petites par rapport à l’examen précédent, et la nécrose centrale avait augmenté dans la tumeur médiastinale.
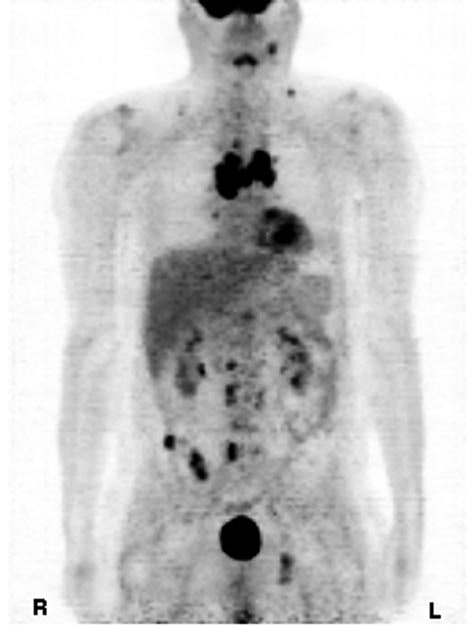
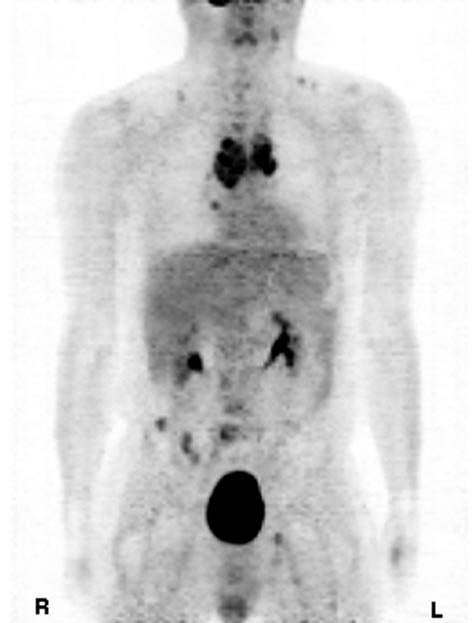
Discussion
Le CTM est une tumeur maligne rare mais difficile à traiter (8). Les facteurs de mauvais pronostic sont l’âge supérieur à 50 ans, le sexe masculin et la propagation à distance (métastases). La survie à 10 ans n’est que de 20 % pour les patients présentant des métastases à distance. Le taux de calcitonine dans le sang est mesuré pour déterminer la croissance du CTM chez les patients dont le test est positif, défini comme une calcitonine sérique basale supérieure ou égale à 50 pg/ml (9). Dans ce cas, le patient avait un mauvais pronostic car il était âgé de plus de 50 ans, de sexe masculin et présentait des métastases à distance. En 2001, le patient a été diagnostiqué et traité pour la première fois par DTIC, après que l’adriamycine ait entraîné une propagation du cancer avec des métastases pulmonaires. Après la rémission de ses métastases pulmonaires, son taux de calcitonine a fluctué entre 7 000 et 13 000 pg/ml (norme <20 pg/ml). De 2004 à 2007, les taux de calcitonine ont progressivement augmenté pour atteindre plus de 20 000 pg/ml, malgré de nombreuses tentatives de réduction des taux à l’aide de diverses chimiothérapies, dont l’effet sur l’inhibition de la progression du cancer était minime. En octobre 2008, les tumeurs s’étaient propagées dans les os et les zones médiastinales, et le taux de marqueur tumoral de calcitonine a atteint plus de 38 000 pg/ml. Les scanners TEP étaient en corrélation avec les niveaux excessifs de calcitonine, indiquant un pronostic très sombre. Dans notre cas de CTM, l’utilisation de DCA associé à 750 mg de thiamine pour contrecarrer toute toxicité nerveuse a entraîné une inversion marquée des tumeurs et des niveaux de marqueurs tumoraux sur une période de 5 mois. Bien que le système gastro-intestinal du patient soit revenu à la normale dès les premières semaines du traitement par DCA, quelques mois se sont écoulés avant que l’on constate une réduction des taux de calcitonine et une sensation de fatigue générale. Figure 1. Tomographie par émission de positrons du cancer médullaire de la thyroïde, octobre 2008. Figure 2. Tomographie par émission de positons du cancer médullaire de la thyroïde après traitement au dichloroacétate, mai 2009. Le nombre important de tumeurs, les taux élevés de calcitonine, l’augmentation des symptômes indésirables associés aux modalités de traitement, l’absence de réponse à la chimiothérapie et l’inéligibilité aux études expérimentales sur les inhibiteurs de la tyrosine kinase ont justifié l’utilisation du DCA. Le DCA est utilisé avec succès chez les enfants atteints d’acidose lactique congénitale depuis 1988 (10), et c’est un produit chimique actuellement testé en oncologie au Canada. Notamment, de nombreuses cellules tumorales présentent une augmentation de l’acide lactique due à l’utilisation préférentielle de la glycolyse au lieu de l’oxydation du glucose pour générer de l’adénosine triphosphate (ATP), même en présence d’oxygène. Ce phénomène est connu sous le nom de glycolyse aérobie ou « effet Warburg » (11), qui fait que le pyruvate est dirigé vers l’acide lactique au lieu d’être dirigé vers la mitochondrie pour la production d’ATP dans le cycle de l’acide tricarboxylique (TCA). Le DCA permet la réactivation de la pyruvate déshydrogénase, une enzyme de maintien de l’entrée du pyruvate dans le TCA mitochondrial, en bloquant la pyruvate déshydrogénase kinase (12). Ce blocage de la glycolyse ramène les cellules tumorales à l’utilisation de l’oxydation du glucose, le métabolisme aérobie normal observé dans les cellules saines qui conduit à l’apoptose (13).
Le succès du traitement de ce patient atteint de MTC n’est qu’un résultat préliminaire, et des recherches supplémentaires doivent être menées pour confirmer nos résultats chez d’autres patients atteints de MTC qui ont épuisé les modalités de traitement chimiothérapeutique. Les résultats constatés dans ce cas peuvent également indiquer une application potentielle du DCA dans cette forme de cancer lorsque les autres thérapies échouent, du moins jusqu’à ce que de nouvelles thérapies soient mises au point pour les patients qui n’ont que 20 % de chances de survie sur une période de 10 ans.
En conclusion, nous avons présenté un patient MTC avec de multiples métastases et un très mauvais pronostic après sept ans de chimiothérapie dont la rechute a été inversée par un traitement au DCA. Ceci propose un mécanisme qui pourrait ouvrir de nouvelles portes pour le développement futur de nouvelles thérapies contre le cancer.
Le patient est actuellement maintenu sous DCA pour une durée indéterminée compte tenu des résultats positifs de sa rémission. En novembre 2009, il est en rémission selon les niveaux de marqueurs tumoraux. Toute modification du niveau des marqueurs tumoraux indique une résistance à cette thérapie. D’autres patients MTC pourraient être envisagés pour cette approche thérapeutique à l’avenir, si cela s’avérait nécessaire. En conclusion, le DCA a inhibé la progression tumorale et les niveaux de marqueurs tumoraux. De plus, le mécanisme du DCA, qui implique l’inversion de la glycolyse, semble être une cible importante à étudier en tant que future approche thérapeutique.
Remerciements
Je tiens à remercier Marc Ramos et Jimmy Xu pour leur aide à la recherche scientifique. Cette étude n’a bénéficié d’aucune subvention spécifique d’un organisme de financement du secteur public, commercial ou à but non lucratif.
RÉFÉRENCES
1 1. Santarpia L, Ye L et Gagel RF : Beyond RET : potential therapeutic approaches for advanced and metastatic medullary thyroid carcinoma. J Intern Med 266 : 99-113, 2009.
2 Cuccuru G : Cellular effects and antitumor activity of RET inhibitor RPI-1 on MEN2A-associated medullary thyroid carcinoma. J Natl Cancer Inst 96 : 1006-1014, 2004.
3 Cakir M et Grossman A : Medullary thyroid cancer : molecular biology and novel molecular therapies. Neuroendocrinology 90 : 323-348, 2009.
4 Higgins MJ, Forastiere A et Marur S : New directions in the systemic treatment of metastatic thyroid cancer. Oncology 23 : 768-775, 2009.
5 Sugawara M, Geffner DL, Martinez D et Hershman JM : Novel treatment of medullary thyroid cancer. Curr Opin Endocrinol Diabetes Obes 16 : 367-372, 2009.
6 Fassnacht M, Kreissl MC, Weissmann D et Allolio B : New targets and therapeutic approaches for endocrine malignancies. Pharmacol Ther 123 : 117-141, 2009.
7 Spruijt L, Naviaux R, McGowan KA, et al : Nerve conduction changes in patients with mitochondrial diseases treated with dichloroacetate. Muscle Nerve 24 : 916-924, 2001.
8 Groupe de travail sur les directives de l’American Thyroid Association : Medullary thyroid cancer : Management Guidelines of the American Thyroid Association. Thyroid 19 : 565-612, 2009.
9 Cheung K : Calcitonin measurement in the evaluation of thyroid nodules in the United States : a cost-effectiveness and decision analysis. Clin Endocrinol Metab 93 : 2173-2180, 2008.
10 Stacpoole PW, Lorenz A, Thomas R et Harman E : Le dichloroacétate dans le traitement de l’acidose lactique. Ann Intern Med 108 : 58-63, 1988.
11 Warburg O, Wind F et Negelein E : Uber den stoffwechsel von Tumoren im Korper. Klin Woch 5 : 829-832, 1926.
12 Stacpoole PW, Henderson GN, Yan Z et James MO : Clinical pharmacology and toxicology of dichloroacetate. Environ Health Perspect 106 : 989-994, 1998.
13 Bonnet S, Archer SL, Allalunis-Turner J, et al : A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth. Cancer Cell 11 : 37-57, 2007.