Minghao Wang a, Cuiwei Liao a,b, Ying Hu a, Wenqin Pan a, Jun Jiang a,#
a Centro de Enfermedades Mamarias, Hospital del Suroeste, Tercera Universidad Médica Militar, Chongqing, 400038, China
b Departamento de Radiología, Hospital Xinqiao, Tercera Universidad Médica Militar, Chongqing, 400038, China
Recibido: 14 de mayo de 2017
Aceptado: Aceptado el 17 de mayo de 2017
Disponible en línea: 19 de mayo de 2017
Resumen
La quimioterapia sigue siendo la principal estrategia adyuvante en el tratamiento del cáncer, sin embargo, la quimiorresistencia también se encuentra con frecuencia. La inhibición de la autofagia ha sido ampliamente aceptada como una estrategia terapéutica prometedora en el cáncer, mientras que la falta de inhibidores de la autofagia eficaces y específicos dificulta su aplicación. Aquí encontramos que el dicloroacetato (DCA), un compuesto de molécula pequeña, podría inhibir significativamente la autofagia inducida por Doxorubicina en células de cáncer de mama. Y el DCA mejora notablemente la muerte celular y la antiproliferación del cáncer de mama inducida por Doxorubicina in vitro. Pero la sensibilización a Dox de DCA se redujo significativamente a través de la inducción de la autofagia por rapamicina. Además, la terapia combinada de Dox y DCA pudo inhibir significativamente el crecimiento tumoral in vivo y prolongar el tiempo de supervivencia de los ratones. En conjunto, demostramos que el DCA podría inhibir la autofagia inducida por doxorrubicina y proporcionar una estrategia novedosa para mejorar la eficacia anticancerígena de la quimioterapia.
Palabras clave: Dicloroacetato; Cáncer de mama; Autofagia; Quimioterapia
Aspectosdestacados:
-Doxorubicina (Dox) induce autofagia en células de cáncer de mama.
-DCA sensibiliza células MDA-MB-231 a Dox mediante la inhibición de la autofagia.
-La inducción de autofagia mediante rapamicina disminuyó los efectos sensibilizadores de DCA a Dox.
-Inhibición sinérgica del crecimiento tumoral en ratones tratados con Dox y DCA.
INTRODUCCIÓN
El cáncer de mama es un importante problema de salud pública en todo el mundo y su universalidad y tasa de aparición han aumentado notablemente en las últimas décadas. En la actualidad, la quimioterapia sigue siendo la principal ayuda para el tratamiento del cáncer de mama. Sin embargo, el cáncer de mama es insensible a la quimioterapia y la radioterapia habituales [1], [2].
La autofagia implica el secuestro de porciones de vesículas de doble membrana de citoplasmina, los autofagosomas, que luego se fusionan con los lisosomas para generar autolisosomas, en los que la carga autofágica es degradada por catabolicodrolasas. La autofagia permite a las células degradar sus propias proteínas y orgánulos para mantener la homeostasis celular necesaria para el crecimiento y desarrollo normales, la adaptación a corto plazo al estrés, así como para la supervivencia a largo plazo de las células en condiciones óptimas [3], [4], [5]. Las desregulaciones de la autofagia se han visto implicadas en múltiples enfermedades degenerativas y en el envejecimiento, incluido el cáncer [6], [7], [8], [9]. En particular, la autofagia es a menudo una respuesta pro-supervivencia al tratamiento quimioterapéutico en células cancerosas, y la supresión de la autofagia durante la quimioterapia se ha propuesto como una nueva estrategia terapéutica [10].
El dicloroacetato (DCA) es un pequeño inhibidor de la piruvato deshidrogenasa cinasa (PDK), que activa la piruvato deshidrogenasa (PDH) y aumenta la oxidación de la glucosa al promover la afluencia de piruvato al ciclo de Krebs. Recientemente se ha demostrado como un prometedor agente antineoplásico no tóxico para promover la apoptosis en células de carcinoma [11], [12]. Sin embargo, se desconocía la correlación entre el DCA y la autofagia en células de cáncer de mama. En el presente estudio, investigamos el efecto del DCA en la modulación de la autofagia en células de cáncer de mama humano. Descubrimos por primera vez que el DCA inhibía potentemente la autofagia en la célula MDB-231. Además, investigamos los efectos de la inhibición de la autofagia por DCA en la potencia anticancerígena de los fármacos quimioterapéuticos. El co-tratamiento de DCA disminuyó notablemente la viabilidad y aumentó la apoptosis en células tratadas con Dox, y la eficacia sensibilizadora del DCA se redujo significativamente por el tratamiento con rapamicina. El efecto sinérgico del DCA y la doxorrubicina se confirmó además in vivo utilizando un modelo de xenoinjerto de ratón. Así pues, nuestros resultados demuestran que la inhibición de la autofagia con DCA potencia la eficacia de la Dox, y que dicha combinación puede representar una estrategia terapéutica novedosa para el tratamiento del cáncer de mama.
Materiales y métodos
Cultivo celular
La línea celular de cáncer de mama humano MDA-MB-231 se obtuvo de la American Type Culture Collection (ATCC, HTB-26) y se mantuvo en medio RPMI1640 (Hyclone). Los medios se complementaron con un 10% de suero bovino fetal (Gibco) y 100 mg/ml de estreptomicina (Gibco). Las células se cultivaron en una incubadora humidificada con un 95% de aire y un 5% deCO2 a 37 °C.
Reactivos
Los anticuerpos monoclonales primarios de conejo contra LC3, P62 y β-actina se adquirieron a Cell Signaling. Los anticuerpos secundarios IgG de cabra anti-conejo se adquirieron a Santa Cruz Biotechnology. Los anticuerpos FITC-Anexina V y PE-PI se obtuvieron de Biolegend. Para la monitorización dinámica de la proteína LC3 relacionada con la autofagia mediante inmunofluorescencia, se utilizó el adenovirus con construcción en tándem EGFP-RFP-LC3. El kit de ensayo de viabilidad celular (MTT) se adquirió a Sangon Biotech (Shanghai). La rapamicina se adquirió a Sigma-Aldrich y la doxorrubicina a Santa Cruz Biotechnology.
Western blot
Las proteínas se extrajeron en tampón de lisis después de la medicación y se separaron mediante electroforesis en gel de poliacrilamida con dodecil sulfato sódico (SDS-PAGE). Las concentraciones de proteínas se midieron mediante el kit de ensayo de proteínas BioRad™. Se electroforizaron cantidades iguales de las muestras de proteínas en minigeles de SDS-PAGE al 7%-12%. Las proteínas se transfirieron a la membrana Immobilon PVDF a 100 V durante 2 h a 4 °C. Las membranas se sondearon con el anticuerpo primario indicado durante toda la noche a 4 °C y luego se incubaron con un anticuerpo secundario acoplado a peroxidasa de rábano caballo. La visualización se realizó incubando durante 3 minutos con un tampón de detección de quimioluminiscencia mejorada (100 mM Tris-HCl pH 8,5, 1,25 mM luminol, 0,2 mM ácido p-cumárico y 0,03% H2O2) y la intensidad de las bandas se cuantificó con el programa informático Image J.
Microscopía de inmunofluorescencia
Lascélulas se sembraron en cubreobjetos en una placa de 24 pocillos. Las células se infectaron con adenovirus GFP-RFP-LC3 antes del experimento. Tras 24 h, se sustituyó el medio y las células se trataron con DCA durante otras 24 h. Para la inmunotinción, las células se fijaron en paraformaldehído al 4% durante 15 min y se lavaron. Las células se incubaron con DAPI durante 5 min y luego se lavaron con PBS. Los cubreobjetos se montaron en portaobjetos con medio de montaje Vectashield. Las imágenes se capturaron con un microscopio confocal LSM780NLO (Carl Zeiss MicroImaging) y se procesaron con el software proporcionado por el fabricante.
Ensayo de viabilidad celular (MTT)
Las célulasse sembraron en placas de 96 pocillos y se trataron como se indica durante 24 h. A continuación, se añadieron 10 μl de MTT (5 mg/ml) por pocillo y se incubaron durante 4 h. Cada pocillo se complementó con 100 μl de DMSO para disolver el formazán antes de medirlo con un lector de microplacas a 490 nm. Las viabilidades celulares se normalizaron con respecto al grupo de control.
Citometría de flujo
El grado de apoptosis se determinó mediante citometría de flujo. Se cosecharon las células, se lavaron y se incubaron con la tinción de Annexin V durante 45 min. Se añadió la tinción con yoduro de propidio antes de analizarlas por citometría de flujo.
Análisis estadístico
Los datos se analizaron mediante el programa estadístico SPSS 21.0. Los datos de medición se expresaron en media ± desviación estándar. Para las comparaciones de distribución normal, se utilizó la prueba t. Para las comparaciones entre grupos se utilizó el análisis de varianza unidireccional (ANOVA). Los datos de recuento se expresaron en porcentaje y se analizaron mediante la prueba de chi-cuadrado. P < 0,05 se consideró estadísticamente significativo.
Resultados
Eltratamiento con Dox indujo la autofagia en células de cáncer de mama
Estudios recientes han demostrado que la autofagia de las células tumorales podría ser inducida durante la quimioterapia [8], [13]. Para determinar si Dox afecta a la autofagia en células de cáncer de mama humano, se detectó la acumulación de autofagosomas con un microscopio confocal de barrido láser tras infectar adenovirus EGFP-RFP-LC3. Como se muestra en la Fig. 1A-B, el tratamiento de las células con Dox durante 24 h produjo un marcado aumento de la formación de puntas RFP-LC3 en las células MDA-MB-231 (p < 0,05). A continuación, examinamos el efecto de Dox sobre la conversión de la proteína clásica de autofagia LC3B y P62 en células MDA-MB-231. El análisis de Western blot mostró que el tratamiento con Dox durante 24 h produjo una acumulación de LC3B-II y una disminución de P62 (proteína receptora de unión a ubiquitina) de forma dependiente de la dosis (Fig. 1C-E) y del tiempo (Fig. 1F-H) (p < 0,05). Estos resultados indican que Dox es capaz de inducir la autofagia en las células MDA-MB-231.
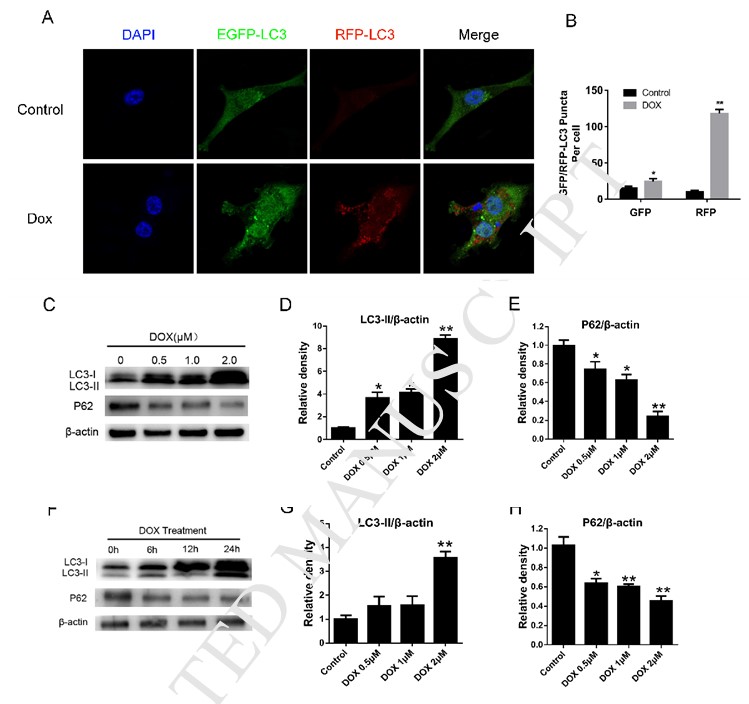
El DCA sensibiliza la muerte celular inducida por doxorrubicina mediante la inhibición de la autofagia
Para explorar la influencia del tratamiento con DCA en la sensibilidad de las células MDA-MB-231 a Dox, detectamos la apoptosis de las células MDA-MB-231 tras el tratamiento de Dox con o sin DCA. Como se muestra en la Fig. 2A-B, el tratamiento de las células MDA-MB-231 con concentraciones variadas de Dox y DCA durante 24 h causó niveles más altos de apoptosis en comparación con el tratamiento de Dox solo, como se muestra por FACS (p < 0,05). Los resultados del experimento de proliferación mostraron que el DCA tenía un efecto sinérgico sobre las acciones antiproliferativas de Dox a partir del punto de tiempo de 24 h (Fig. 2C-D). Se consideró que la inhibición de la autofagia en células tumorales aumentaba la sensibilidad de los fármacos quimioterápicos [8], [13], [14]. A continuación, para determinar si el DCA podría afectar a la autofagia inducida por Dox en células MDA-MB-231, investigamos el cambio en el nivel de proteínas de autofagia mediante un ensayo de inmunofluorescencia indirecta y western blotting. El tratamiento de las células con Dox o rapamicina dio lugar a un marcado aumento de la formación de puntas RFP-LC3 en las células MDA-MB-231, que se redujo significativamente con el co-tratamiento de DCA (Fig. 1A, Fig. 2E-F). Aunque el nivel de LC3-II aumentó tras el tratamiento con Dox, el nivel de LC3-II se debilitó más tras el tratamiento combinado de Dox y DCA, y el nivel de proteína P62 aumentó significativamente tras el co-tratamiento (Fig. 2G-I). Todos estos resultados indican que el DCA aumenta la sensibilidad de las células MDA-MB-231 a Dox mediante la inhibición de la autofagia in vitro.
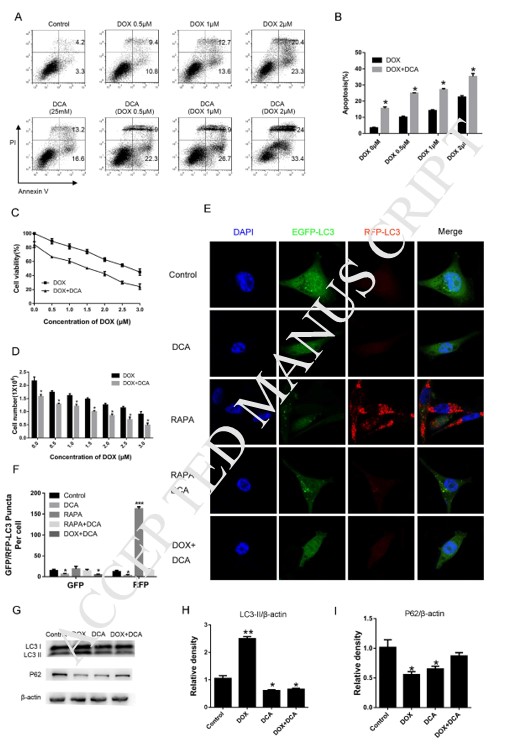
La inducción de la autofagiapor rapamicina redujo la sensibilidad a fármacos del DCA y Dox
Para confirmar aún más que la inhibición de la autofagia por DCA podría mejorar el efecto de la quimioterapia combinada, se utilizó rapamicina, un acelerador clásico de la autofagia, para inducir la autofagia. Como se muestra en la Fig. 3 A-B, aunque el nivel de apoptosis aumentó significativamente después del tratamiento conjunto de Dox y DCA en comparación con el tratamiento de Dox solo, el nivel de apoptosis disminuyó notablemente después del tratamiento combinado con rapamicina (p < 0,05). Los resultados del experimento MTT mostraron que la rapamicina tenía un efecto antagonista sobre las acciones antiproliferativas de Dox y DCA a partir de las 24 h (p < 0,05) (Fig. 3C). Los resultados mostraron que el nivel de LC3-II se incrementó notablemente y la banda p62 se redujo significativamente en el grupo DDR (Dox, DCA y rapamicina) en comparación con el grupo tratado con DD (Dox y DCA) (Fig. 3D-F). Estos resultados confirmaron además que el DCA sensibiliza la apoptosis de las células MDA-MB-231 inducida por doxorrubicina a través de la inhibición de la autofagia.
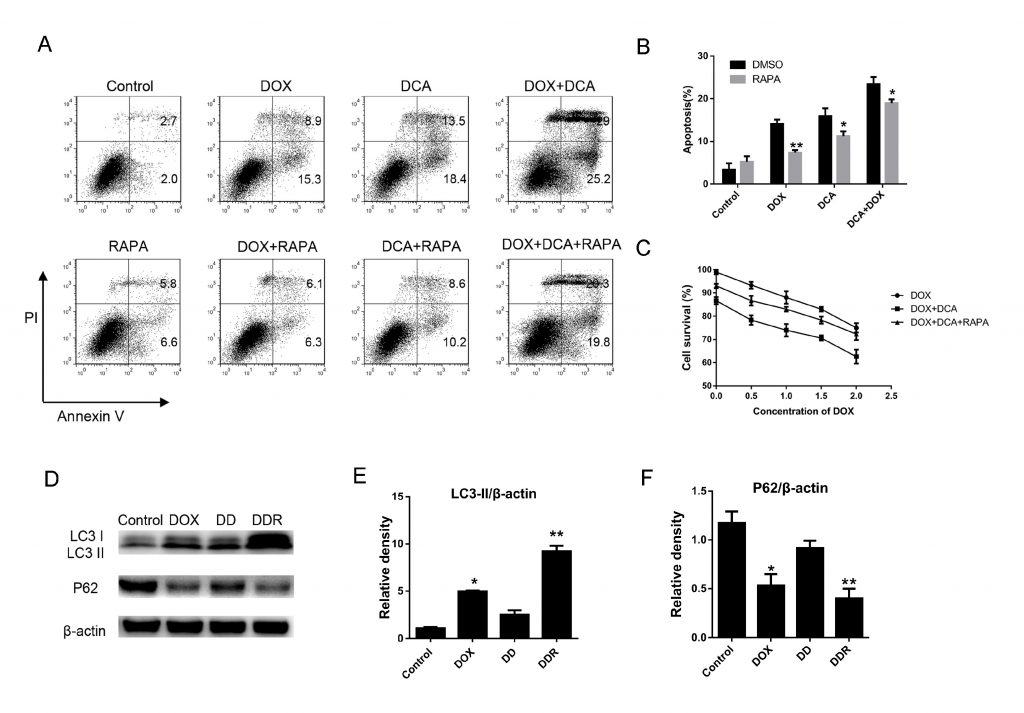
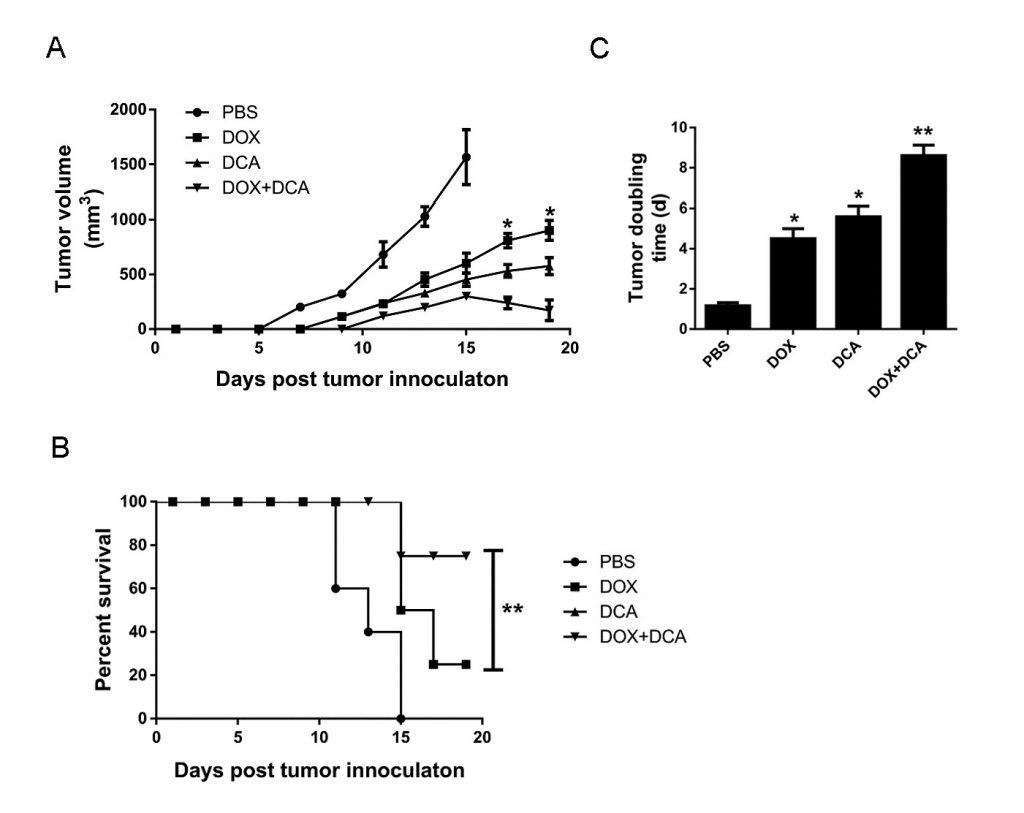
Lainhibición in vivo de la autofagia por DCA potencia la capacidad anticancerígena de Dox
Considerando que Dox induce más muerte celular tras inhibir la autofagia, evaluamos el potencial de la terapia combinada de Dox y DCA in vivo. Cuando el tumor era palpable, los animales fueron tratados con: (1) PBS, (2) Dox, (3) DCA, y (4) Dox más DCA. Como se muestra en la Fig. 4A-B, aunque el tratamiento de Dox o DCA por sí solos mostraron cierto efecto inhibitorio sobre el crecimiento del tumor en comparación con el PBS. Sin embargo, el tratamiento combinado de Dox y DCA inhibió significativamente el crecimiento tumoral y prolongó el tiempo de supervivencia del ratón (p < 0,05). Como se muestra en la Fig. 4C, el tiempo de duplicación del tumor aumentó significativamente de 4,65 d (IC, 4,17-5,85 días) en el grupo Dox a 8,80 d (IC, 7,33-10,3 días) en el grupo Dox más DCA (p < 0,05).
Discusión
La quimioterapia sigue siendo la principal estrategia de tratamiento del cáncer, sin embargo, la tolerancia siempre se desarrolla durante un corto período de tiempo. Por lo tanto, la investigación actual se centra en la búsqueda de nuevas formas de sensibilizar o retrasar la resistencia a los fármacos. En la actualidad, la principal opinión es que la célula cancerosa podría tolerar el estrés del exterior y la hipoxia mediante la regulación de la autofagia.
La autofagia es un comportamiento fisiológico que ayuda a mantener la homeostasis celular, las proteínas seniles o defectuosas, orgánulos y otros componentes celulares son entregados al lisosoma para su degradación y reciclaje a través de este proceso [15], [16]. En los últimos años, numerosos estudios han intentado relacionar la autofagia con el cáncer y su tratamiento [8], [13], [17]. Existen opiniones de que la mayoría de los fármacos contra el cáncer, así como la radiación ionizante o los fármacos dirigidos a dianas específicas, inducen la autofagia de las células tumorales durante el tratamiento [18], [19], [20]. La inhibición de la autofagia en las células tumorales se consideró una estrategia para sensibilizar a la quimioterapia y la radioterapia [8], [21], [22]. Aunque la inhibición de la autofagia en células tumorales ha sido ampliamente aceptada como un prometedor proyecto terapéutico en cáncer, la falta de inhibidores eficaces y específicos de la autofagia dificulta su aplicación. La cloroquina y la hidroxicloroquina son los dos únicos inhibidores de la autofagia aprobados por la FDA. Recientemente se han realizado varios estudios clínicos de fase I/II sobre la inhibición de la autofagia utilizando cloroquina o hidroxicloroquina en combinación con quimioterapia para el tratamiento de diferentes tipos de cáncer, incluido el cáncer de mama [13], [23]. Por lo tanto, el desarrollo de un nuevo tipo de inhibidor de la autofagia para el tratamiento del cáncer tiene un importante significado clínico. DCA es que podría inhibir la enzima crítica piruvato deshidrogenasa quinasa (PDK) conduce a cambiar la respiración mitocondrial de la célula tumoral y la apoptosis [11]. Hasta la fecha, no hay pruebas de si el DCA estaba implicado en la regulación de la autofagia en células de cáncer de mama. En el presente estudio, proporcionamos pruebas de que el DCA exhibe la capacidad de inhibición de la autofagia y mejora notablemente la muerte celular del cáncer de mama inducida por fármacos quimioterapéuticos. Sin embargo, la sensibilización a Dox del DCA se redujo significativamente al tratarlo con rapamicina. Hasta donde sabemos, este es el primer informe que demuestra la eficacia de la inhibición de la autofagia por DCA en combinación con doxorrubicina en células de cáncer de mama in vitro e invivo. Sin embargo, no sabíamos si otros fármacos de quimioterapia inducida por la autofagia podría ser inhibida por DCA, más investigación que participan en la universalidad de DCA necesidad de proceder.
En resumen, los presentes hallazgos demuestran que la inhibición de la autofagia por DCA mejoró la apoptosis mediada por doxorrubicina y proporciona una nueva perspectiva de investigación para encontrar inhibidores de la autofagia para la quimioterapia de combinación. Nuestros hallazgos sugieren que el DCA podría desarrollarse potencialmente como un nuevo inhibidor de la autofagia, y una combinación de DCA con fármacos quimioterapéuticos clásicos podría representar una nueva estrategia terapéutica para el tratamiento del cáncer de mama.
Conflicto de intereses
Los autores declaran que no existe ningún conflicto de intereses.
Agradecimientos
Este trabajo fue apoyado por el Proyecto pertenece al Hospital del Suroeste [cstc2015shms-ztzx10005].
REFERENCIAS
1 Ferlay J, Soerjomataram I, Dikshit R, Eser S, Mathers C, Rebelo M, Parkin DM, Forman D y Bray F. Incidencia y mortalidad por cáncer en todo el mundo: fuentes, métodos y patrones principales en GLOBOCAN 2012. Int J Cancer 2015; 136: E359-386.
2 Siegel RL, Miller KD y Jemal A. Estadísticas sobre el cáncer, 2017. CA Cancer J Clin 2017; 67: 7-30.
3 Jiang X, Overholtzer M y Thompson CB. La autofagia en el metabolismo celular y el cáncer. J Clin Invest 2015; 125: 47-54.
4 Klionsky DJ y Emr SD. La autofagia como vía regulada de degradación celular. Science 2000; 290: 1717-1721.
5 Mizushima N y Komatsu M. Autofagia: renovación de células y tejidos. Cell 2011; 147: 728-741.
6 Hara T, Nakamura K, Matsui M, Yamamoto A, Nakahara Y, Suzuki-Migishima R, Yokoyama M, Mishima K, Saito I, Okano H y Mizushima N. La supresión de la autofagia basal en células neuronales causa enfermedad neurodegenerativa en ratones. Nature 2006; 441: 885-889.
7 Hardie DG. Cell biology. Por qué las células hambrientas se comen a sí mismas. Science 2011; 331: 410-411.
8 Mathew R, Karantza-Wadsworth V y White E. Papel de la autofagia en el cáncer. Nat Rev Cancer 2007; 7: 961-967.
9 Rubinsztein DC, Marino G y Kroemer G. Autofagia y envejecimiento. Cell 2011; 146: 682-695.
10 Rubinsztein DC, Codogno P y Levine B. Autophagy modulation as a potential therapeutic target for diverse diseases. Nat Rev Drug Discov 2012; 11: 709-730.
11 Bonnet S, Archer SL, Allalunis-Turner J, Haromy A, Beaulieu C, Thompson R, Lee CT, Lopaschuk GD, Puttagunta L, Bonnet S, Harry G, Hashimoto K, Porter CJ, Andrade MA, Thebaud B y Michelakis ED. A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth. Cancer Cell 2007; 11: 37-51.
12 Cao W, Yacoub S, Shiverick KT, Namiki K, Sakai Y, Porvasnik S, Urbanek C y Rosser CJ. Dichloroacetate (DCA) sensitizes both wild-type and over expressing Bcl-2 prostate cancer cells in vitro to radiation. Prostate 2008; 68: 1223-1231.
13 Janku F, McConkey DJ, Hong DS y Kurzrock R. Autophagy as a target for anticancer therapy. Nat Rev Clin Oncol 2011; 8: 528-539.
14 Kondo Y, Kanzawa T, Sawaya R y Kondo S. The role of autophagy in cancer development and response to therapy. Nat Rev Cancer 2005; 5: 726-734.
15 Mizushima N. Autofagia: proceso y función. Genes Dev 2007; 21: 2861-2873.
16 Ravikumar B, Sarkar S, Davies JE, Futter M, Garcia-Arencibia M, Green-Thompson ZW, Jimenez-Sanchez M, Korolchuk VI, Lichtenberg M, Luo S, Massey DC, Menzies FM, Moreau K, Narayanan U, Renna M, Siddiqi FH, Underwood BR, Winslow AR y Rubinsztein DC. Regulación de la autofagia de mamíferos en fisiología y fisiopatología. Physiol Rev 2010; 90: 1383-1435.
17 Kondo Y y Kondo S. Autofagia y terapia del cáncer. Autophagy 2006; 2: 85-90.
18 Degenhardt K, Mathew R, Beaudoin B, Bray K, Anderson D, Chen G, Mukherjee C, Shi Y, Gelinas C, Fan Y, Nelson DA, Jin S y White E. Autophagy promotes tumor cell survival and restraints necrosis, inflammation, and tumorigenesis. Cancer Cell 2006; 10: 51-64.
19 Kim DG, Jung KH, Lee DG, Yoon JH, Choi KS, Kwon SW, Shen HM, Morgan MJ, Hong SS y Kim YS. 20(S)-Ginsenoside Rg3 es un nuevo inhibidor de la autofagia y sensibiliza el carcinoma hepatocelular a la doxorrubicina. Oncotarget 2014; 5: 4438-4451.
20 Manov I, Pollak Y, Broneshter R y Iancu TC. Inhibition of doxorubicin-induced autophagy in hepatocellular carcinoma Hep3B cells by sorafenib–the role of extracellular signal-regulated kinase counteraction. FEBS J 2011; 278: 3494-3507.
21 Chen K y Shi W. La autofagia regula la resistencia de las células de cáncer de pulmón no microcítico al paclitaxel. Tumour Biol 2016; 37: 10539-10544.
22 Zhou J, Li G, Zheng Y, Shen HM, Hu X, Ming QL, Huang C, Li P y Gao N. A novel autophagy/mitophagy inhibitor liensinine sensitizes breast cancer cells to chemotherapy through DNM1L-mediated mitochondrial fission. Autophagy 2015; 11: 1259-1279.
23 Kimura T, Takabatake Y, Takahashi A and Isaka Y. Chloroquine in cancer therapy: a double-edged sword of autophagy. Cancer Res 2013; 73: 3-7.
Contenido relacionado: