Minghao Wang a, Cuiwei Liao a, b, Ying Hu a, Wenqin Pan a, Jun Jiang a, #
a Centre des maladies du sein, Hôpital du Sud-Ouest, Troisième université médicale militaire, Chongqing, 400038, Chine
b Département de radiologie, Hôpital Xinqiao, Troisième université médicale militaire, Chongqing, 400038, Chine
Reçu : 14 mai 2017
Accepté : Accepté le 17 mai 2017
Disponible en ligne: 19 mai 2017
Résumé
La chimiothérapie reste la principale stratégie adjuvante dans le traitement du cancer, cependant, la chimiorésistance est également fréquemment rencontrée. L’inhibition de l’autophagie a été largement acceptée comme une stratégie thérapeutique prometteuse dans le cancer, tandis que le manque d’inhibiteurs d’autophagie efficaces et spécifiques entrave son application. Nous avons découvert ici que le dichloroacétate (DCA), une petite molécule, pouvait inhiber de manière significative l’autophagie induite par la doxorubicine dans les cellules de cancer du sein. De plus, le DCA améliore considérablement la mort des cellules cancéreuses du sein et l’antiprolifération induites par la Doxorubicine in vitro. Mais la sensibilisation au Dox du DCA a été considérablement réduite par l’induction de l’autophagie par la rapamycine. En outre, la thérapie combinée de Dox et de DCA pouvait inhiber de manière significative la croissance tumorale in vivo et prolonger la durée de survie des souris. Dans l’ensemble, nous démontrons que le DCA peut inhiber l’autophagie induite par la doxorubicine et fournir une nouvelle stratégie pour améliorer l’efficacité anticancéreuse de la chimiothérapie.
Mots clés : Dichloroacétate ; cancer du sein ; autophagie ; chimiothérapie
Points forts:
– La doxorubicine (Dox) induit l’autophagie dans les cellules du cancer du sein.
– Le DCA sensibilise les cellules MDA-MB-231 au Dox en inhibant l’autophagie.
– L’induction de l’autophagie par la rapamycine altère les effets sensibilisants du DCA sur le Dox.
– Inhibition synergique de la croissance tumorale chez les souris traitées par le Dox et le DCA.
INTRODUCTION
Le cancer du sein est un problème de santé publique majeur dans le monde entier et son universalité et son taux d’occurrence ont nettement augmenté au cours des dernières décennies. Actuellement, la chimiothérapie reste le principal moyen de traitement du cancer du sein. Cependant, le cancer du sein est insensible à la chimiothérapie et à la radiothérapie ordinaires [1], [2].
L’autophagie implique la séquestration de portions de vésicules à double membrane de cytoplasme, les autophagosomes, qui fusionnent ensuite avec les lysosomes pour générer des autolysosomes, dans lesquels la cargaison autophagique est dégradée par des catabolichydrolases. L’autophagie permet aux cellules de dégrader leurs propres protéines et organites afin de maintenir l’homéostasie cellulaire nécessaire à la croissance et au développement normaux, à l’adaptation à court terme au stress ainsi qu’à la survie à long terme des cellules en bonne santé [3], [4], [5]. Les dérégulations de l’autophagie ont été impliquées dans de nombreuses maladies dégénératives, le vieillissement, y compris le cancer [6], [7], [8], [9]. Notamment, l’autophagie est souvent une réponse pro-survie au traitement chimiothérapeutique dans les cellules cancéreuses, et la suppression de l’autophagie pendant la chimiothérapie a été proposée comme une nouvelle stratégie thérapeutique [10].
Le dichloroacétate (DCA) est un petit inhibiteur de la pyruvate déshydrogénase kinase (PDK), qui active la pyruvate déshydrogénase (PDH), et augmente l’oxydation du glucose en favorisant l’afflux de pyruvate dans le cycle de Krebs. Il a été récemment démontré qu’il s’agit d’un agent antinéoplasique non toxique prometteur pour promouvoir l’apoptose dans les cellules de carcinome [11], [12]. Mais la corrélation entre le DCA et l’autophagie dans les cellules de cancer du sein était inconnue. Dans la présente étude, nous avons examiné l’effet du DCA sur la modulation de l’autophagie dans les cellules cancéreuses du sein humain. Nous avons découvert pour la première fois que le DCA inhibait puissamment l’autophagie dans les cellules MDB-231. En outre, nous avons étudié les effets de l’inhibition de l’autophagie par le DCA sur la puissance anticancéreuse des médicaments chimiothérapeutiques. Le co-traitement de DCA a nettement diminué la viabilité et augmenté l’apoptose des cellules traitées par Dox, et l’efficacité de sensibilisation du DCA a été considérablement réduite par le traitement à la rapamycine. L’effet synergique du DCA et de la doxorubicine a été confirmé in vivo à l’aide d’un modèle de xénogreffe de souris. Nos résultats démontrent donc que l’inhibition de l’autophagie par le DCA augmente puissamment l’efficacité de la doxorubicine, et que cette combinaison peut représenter une nouvelle stratégie thérapeutique pour le traitement du cancer du sein.
Matériel et méthodes
Culture cellulaire
La lignée cellulaire humaine de cancer du sein MDA-MB-231 a été obtenue auprès de l’American Type Culture Collection (ATCC, HTB-26) et maintenue dans un milieu RPMI1640 (Hyclone). Les milieux ont été complétés par 10% de sérum bovin fœtal (Gibco) et 100 mg/ml de streptomycine (Gibco). Les cellules ont été cultivées dans un incubateur humidifié avec 95% d’air et 5% deCO2 à 37 °C.
Réactifs
Les anticorps monoclonaux primaires de lapin contre LC3, P62 et β-actine ont été achetés auprès de Cell Signaling. Les anticorps secondaires IgG de chèvre anti-lapin ont été achetés auprès de Santa Cruz Biotechnology. Le FITC-Annexin V et le PE-PI ont été obtenus auprès de Biolegend. Pour le suivi dynamique de la protéine LC3 liée à l’autophagie par immunofluorescence, l’adénovirus avec construction tandem EGFP-RFP-LC3 a été utilisé. Le kit de test de viabilité cellulaire (MTT) a été acheté auprès de Sangon Biotech (Shanghai). La rapamycine a été achetée à Sigma-Aldrich et la doxorubicine à Santa Cruz Biotechnology.
Western blot
Les protéines ont été extraites dans un tampon de lyse après médication et séparées par électrophorèse sur gel de polyacrylamide au dodécylsulfate de sodium (SDS-PAGE). Les concentrations de protéines ont été mesurées par le kit de dosage des protéines BioRad™. Des quantités égales des échantillons de protéines ont été électrophorisées sur mini-gel de SDS-PAGE à 7%-12%. Les protéines ont été transférées sur une membrane Immobilon PVDF à 100 V pendant 2 h à 4 °C. Les membranes ont été sondées avec l’anticorps primaire indiqué pendant une nuit à 4 °C, puis incubées avec un anticorps secondaire couplé à la peroxydase de radis de cheval. La visualisation a été effectuée par incubation pendant 3 min avec un tampon de détection de chimiluminescence améliorée (100 mM Tris-HCl pH 8,5, 1,25 mM luminol, 0,2 mM acide p-coumarique et 0,03% H2O2) et l’intensité de la bande a été quantifiée par le logiciel Image J.
Microscopie par immunofluorescence
Les cellules ont été ensemencées sur des lamelles couvre-objet dans une plaque à 24 puits. Les cellules ont été infectées avec l’adénovirus GFP-RFP-LC3 avant l’expérience. Après 24 heures, le milieu a été remplacé et les cellules ont été traitées avec du DCA pendant 24 heures supplémentaires. Pour l’immunomarquage, les cellules ont été fixées dans du paraformaldéhyde à 4% pendant 15 minutes et lavées. Les cellules ont été incubées avec du DAPI pendant 5 min puis lavées avec du PBS. Les lamelles ont été montées sur des lames avec le milieu de montage Vectashield. Les images ont été capturées à l’aide d’un microscope confocal LSM780NLO (Carl Zeiss MicroImaging), et traitées avec le logiciel fourni par le fabricant.
Test de viabilité cellulaire (MTT)
Les cellules ont été ensemencées dans des plaques à 96 puits et traitées comme indiqué pendant 24 h. Puis 10 μl de MTT (5 mg/ml) ont été ajoutés par puits et incubés pendant 4 h. Chaque puits a été complété par 100 μl de DMSO pour dissoudre le formazan avant d’être mesuré par lecteur de microplaques à 490 nm. Les viabilités cellulaires ont été normalisées par rapport au groupe témoin.
Cytométrie en flux
L’étendue de l’apoptose a été déterminée par cytométrie en flux. Les cellules ont été récoltées, lavées et incubées avec une coloration à l’Annexin V pendant 45 minutes. La coloration à l’iodure de propidium a été ajoutée avant d’être analysée par cytométrie en flux.
Analyse statistique
Les données ont été analysées par le logiciel statistique SPSS 21.0. Les données de mesure ont été exprimées en moyenne ± écart-type. Pour les comparaisons de la distribution normale, le test t a été utilisé. Une analyse de variance à une voie (ANOVA) a été utilisée pour les comparaisons entre les groupes. Les données de comptage ont été exprimées en pourcentage et testées par le test du chi-deux. P < 0,05 a été considéré comme statistiquement significatif.
Résultats
Le traitement par Dox induit l’autophagie dans les cellules de cancer du sein
Des études récentes ont montré que l’autophagie des cellules tumorales pouvait être induite pendant la chimiothérapie [8], [13]. Pour déterminer si le Dox affecte l’autophagie dans les cellules cancéreuses du sein humain, l’accumulation d’autophagosomes a été détectée à l’aide d’un microscope confocal à balayage laser après l’infection par l’adénovirus EGFP-RFP-LC3. Comme le montre la figure 1A-B, le traitement des cellules par Dox pendant 24 h a entraîné une augmentation marquée de la formation de ponctuations RFP-LC3 dans les cellules MDA-MB-231 (p < 0,05). Ensuite, nous avons examiné l’effet du Dox sur la conversion de la protéine classique d’autophagie LC3B et P62 dans les cellules MDA-MB-231. Une analyse Western blot a montré que le traitement par Dox pendant 24 h a entraîné une accumulation de LC3B-II et une diminution de P62 (protéine réceptrice de liaison à l’ubiquitine) de manière dose- (Fig. 1C-E) et temps-dépendante (Fig. 1F-H) (p < 0,05). Ces résultats indiquent que le Dox est capable d’induire l’autophagie dans les cellules MDA-MB-231.
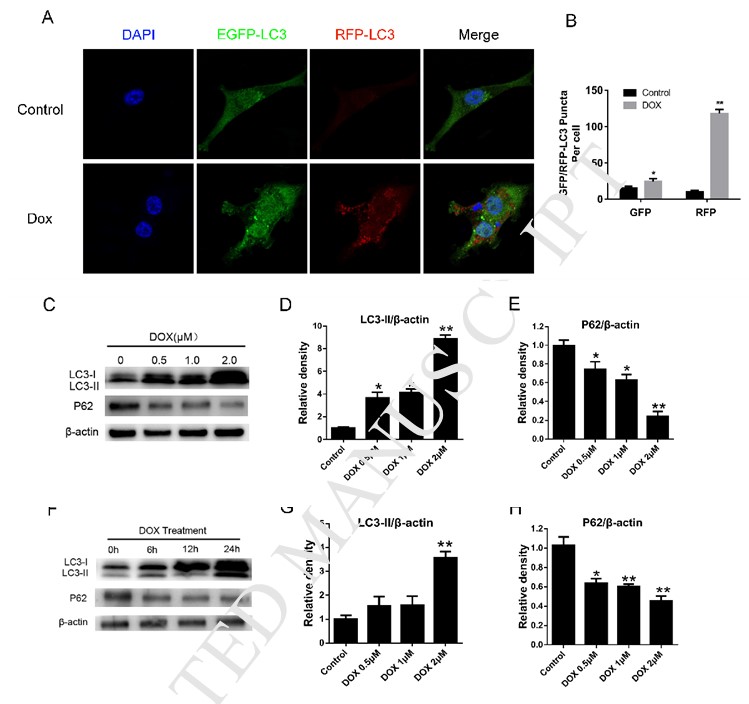
Le DCA sensibilise la mort cellulaire induite par la doxorubicine en inhibant l’autophagie
Pour explorer l’influence du traitement au DCA sur la sensibilité des cellules MDA-MB-231 au Dox, nous avons donc détecté l’apoptose des cellules MDA-MB-231 après traitement au Dox avec ou sans DCA. Comme le montre la figure 2A-B, le traitement des cellules MDA-MB-231 avec des concentrations variées de Dox et de DCA pendant 24 heures a provoqué des niveaux plus élevés d’apoptose par rapport au traitement Dox seul, comme le montre le FACS (p < 0,05). Les résultats de l’expérience de prolifération ont montré que le DCA avait un effet synergique sur les actions antiprolifératives du Dox à partir de 24 h (Fig. 2C-D). On considère que l’inhibition de l’autophagie dans les cellules tumorales augmente la sensibilité des médicaments de chimiothérapie [8], [13], [14]. Ensuite, pour déterminer si le DCA pouvait affecter l’autophagie induite par le Dox dans les cellules MDA-MB-231, nous avons étudié la modification du niveau des protéines d’autophagie par un test immunofluorescent indirect et un transfert de western. Le traitement des cellules avec le Dox ou la rapamycine a entraîné une augmentation marquée de la formation de ponctuations RFP-LC3 dans les cellules MDA-MB-231, qui a été significativement réduite lors du co-traitement avec le DCA (Fig. 1A, Fig. 2E-F). Bien que le niveau de LC3-II ait augmenté après le traitement par Dox, mais le niveau de LC3-II était le plus faible après le traitement combiné de Dox et de DCA, et le niveau de la protéine P62 était significativement augmenté après le co-traitement (Fig. 2G-I). Tous ces résultats indiquent que le DCA augmente la sensibilité des cellules MDA-MB-231 au Dox en inhibant l’autophagie in vitro.
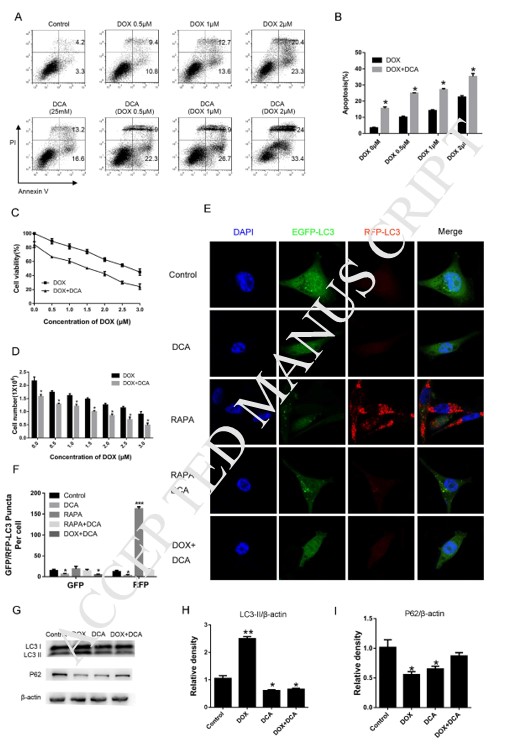
L’induction de l’autophagie par la rapamycine a réduit la sensibilité aux médicaments du DCA et du Dox
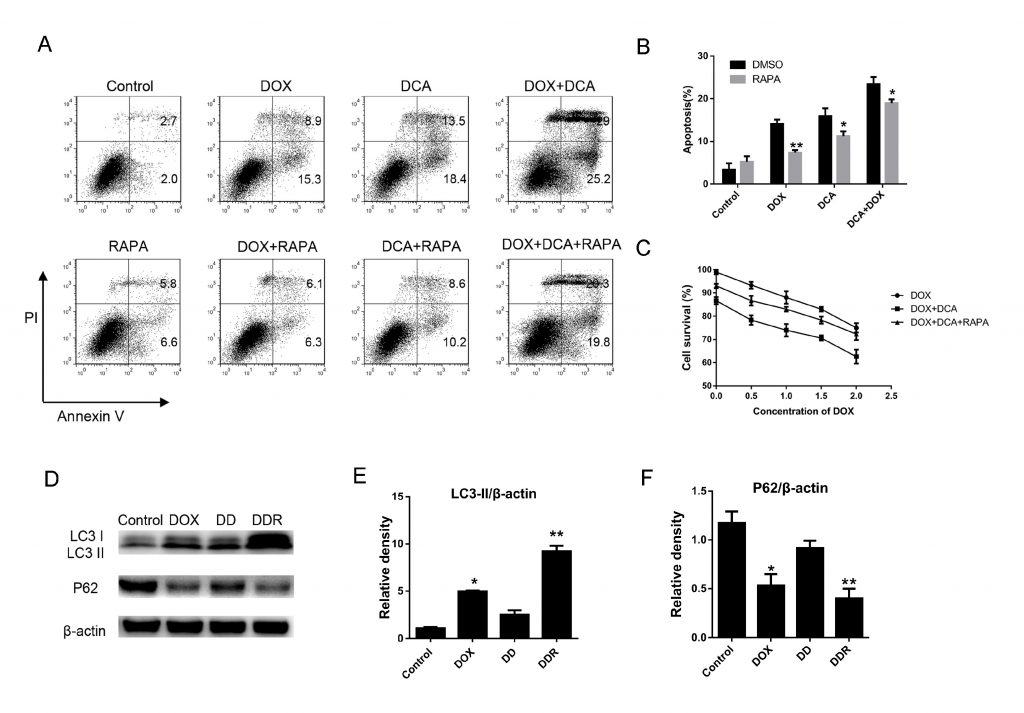
Pour confirmer davantage que l’inhibition de l’autophagie par le DCA pouvait améliorer l’effet de la chimiothérapie combinée, la rapamycine, un accélérateur classique de l’autophagie, a été utilisée pour induire l’autophagie. Comme le montre la figure 3 A-B, bien que le niveau d’apoptose ait augmenté de manière significative après le co-traitement Dox et DCA par rapport au traitement Dox seul, le niveau d’apoptose a été nettement diminué après le traitement combiné à la rapamycine (p < 0,05). Les résultats de l’expérience MTT ont montré que la rapamycine avait un effet anantagoniste sur les actions antiprolifératives du Dox et du DCA à partir de 24 heures (p < 0,05) (Fig. 3C). En outre, nous avons détecté le changement des protéines LC3-II et P62 liées à l’autophagie après le co-traitement par la rapamycine. Les résultats ont montré que le niveau de LC3-II était nettement augmenté et que la bande p62 était significativement réduite dans le groupe DDR (Dox, DCA et rapamycine) par rapport au groupe traité par DD (Dox et DCA) (Fig. 3D-F). Ces résultats ont confirmé que le DCA sensibilise l’apoptose des cellules MDA-MB-231 induite par la doxorubicine en inhibant l’autophagie.
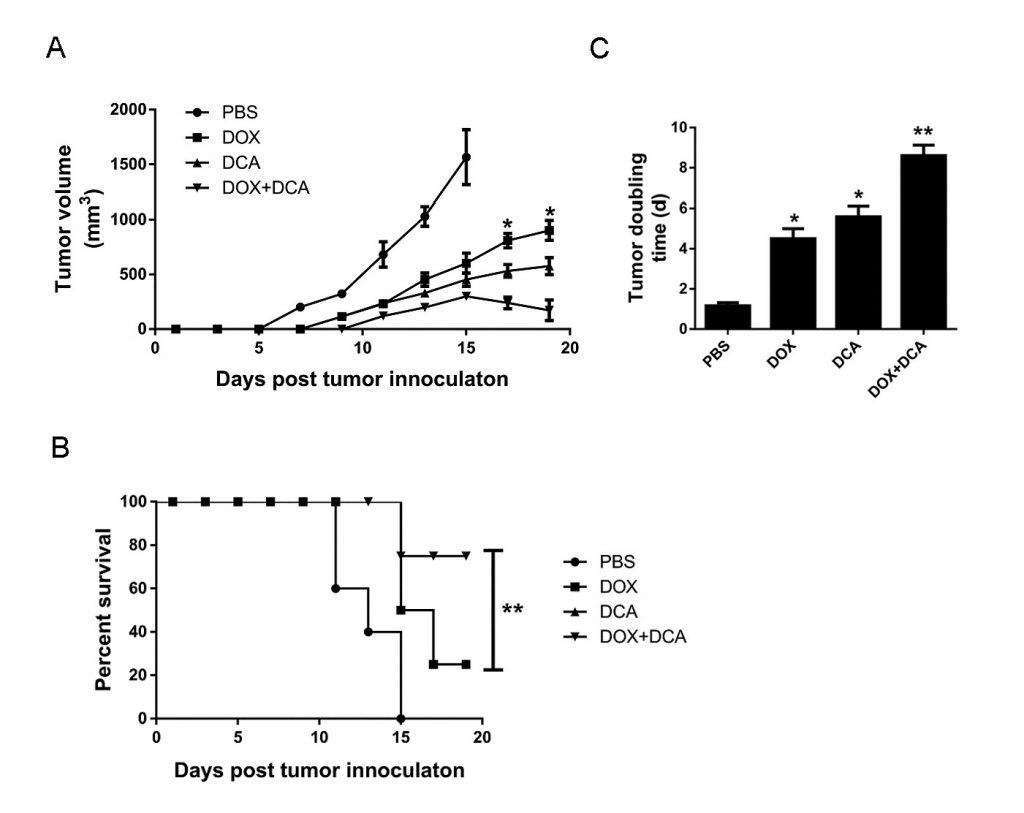
L’inhibition in vivo de l’autophagie par le DCA potentialise la capacité anticancéreuse du Dox
Considérant que le Dox induit une mort cellulaire plus importante après l’inhibition de l’autophagie, nous avons évalué le potentiel de la thérapie combinée du Dox et du DCA in vivo. Lorsque la tumeur était palpable, les animaux ont été traités avec : (1) PBS, (2) Dox, (3) DCA, et (4) Dox plus DCA. Comme le montrent les figures 4A-B, bien que le traitement par Dox ou DCA seul ait montré un certain effet inhibiteur sur la croissance de la tumeur par rapport au PBS. Cependant, le traitement combiné de Dox et de DCA a inhibé de manière significative la croissance tumorale et a prolongé le temps de survie des souris (p < 0,05). Comme le montre la figure 4C, le temps de doublement de la tumeur a significativement augmenté de 4,65 jours (IC, 4,17-5,85 jours) dans le groupe Dox à 8,80 jours (IC, 7,33-10,3 jours) dans le groupe Dox plus DCA (p < 0,05).
Discussion
La chimiothérapie reste la principale stratégie de traitement du cancer, cependant, la tolérance se développe toujours pendant une courte période. Par conséquent, la recherche actuelle se concentre sur la recherche de nouveaux moyens de sensibilisation ou de retardement de la résistance aux médicaments. Actuellement, l’opinion dominante est que les cellules cancéreuses pourraient tolérer le stress extérieur et l’hypoxie en régulant l’autophagie.
L’autophagie est un comportement physiologique qui aide à maintenir l’homéostasie cellulaire. Les protéines séniles ou défectueuses, les organelles et autres composants cellulaires sont acheminés vers le lysosome pour être dégradés et recyclés par ce processus [15], [16]. Ces dernières années, de nombreuses études ont tenté d’établir un lien entre l’autophagie et le cancer et son traitement [8], [13], [17]. Selon certaines opinions, la plupart des médicaments anticancéreux ainsi que les rayonnements ionisants ou les médicaments spécifiques à une cible induisent l’autophagie des cellules tumorales pendant le traitement [18], [19], [20]. L’inhibition de l’autophagie dans les cellules tumorales est considérée comme une stratégie de sensibilisation à la chimiothérapie et à la radiothérapie [8], [21], [22]. Bien que l’inhibition de l’autophagie dans les cellules tumorales ait été largement acceptée comme un projet thérapeutique prometteur dans le cancer, le manque d’inhibiteurs efficaces et spécifiques de l’autophagie entrave son application. La chloroquine et l’hydroxychloroquine sont les deux seuls inhibiteurs d’autophagie approuvés par la FDA. Récemment, plusieurs études cliniques de phase I/II impliquant l’inhibition de l’autophagie en utilisant la chloroquine ou l’hydroxychloroquine en combinaison avec la chimiothérapie pour le traitement de différents cancers, y compris le cancer du sein [13], [23]. Par conséquent, le développement d’un nouveau type d’inhibiteur de l’autophagie pour le traitement du cancer revêt une importance clinique considérable. Le DCA, qui pourrait inhiber l’enzyme critique pyruvate déshydrogénase kinase (PDK), entraîne une modification de la respiration mitochondriale des cellules tumorales et l’apoptose [11]. À ce jour, il n’existe aucune preuve que le DCA soit impliqué dans la régulation de l’autophagie dans les cellules cancéreuses du sein. Dans la présente étude, nous apportons la preuve que le DCA a la capacité d’inhiber l’autophagie et qu’il augmente de manière significative la mort des cellules cancéreuses du sein induite par les médicaments chimiothérapeutiques. Cependant, la sensibilisation au Dox du DCA a été considérablement réduite par le traitement à la rapamycine. À notre connaissance, il s’agit du premier rapport à démontrer l’efficacité de l’inhibition de l’autophagie par le DCA en combinaison avec la doxorubicine dans les cellules cancéreuses du sein in vitro et invivo. Cependant, nous ne savions pas si l’autophagie induite par d’autres médicaments de chimiothérapie pouvait être inhibée par le DCA, d’autres recherches sur l’universalité du DCA doivent être menées.
En résumé, les présents résultats démontrent que l’inhibition de l’autophagie par le DCA renforce l’apoptose médiée par la doxorubicine et offrent une nouvelle perspective de recherche pour trouver des inhibiteurs d’autophagie pour la chimiothérapie combinée. Nos résultats suggèrent que le DCA pourrait potentiellement être développé comme un nouvel inhibiteur d’autophagie, et que l’association du DCA avec des médicaments chimiothérapeutiques classiques pourrait représenter une nouvelle stratégie thérapeutique pour le traitement du cancer du sein.
Conflit d’intérêt
Les auteurs déclarent qu’il n’y a pas de conflit d’intérêts.
Remerciements
Ce travail a été soutenu par le projet appartenant à l’hôpital du Sud-Ouest [cstc2015shms-ztzx10005].
RÉFÉRENCES
1 Ferlay J, Soerjomataram I, Dikshit R, Eser S, Mathers C, Rebelo M, Parkin DM, Forman D et Bray F. Incidence du cancer et mortalité dans le monde : sources, méthodes et principaux modèles dans GLOBOCAN 2012. Int J Cancer 2015 ; 136 : E359-386.
2 Siegel RL, Miller KD et Jemal A. Statistiques sur le cancer, 2017. CA Cancer J Clin 2017 ; 67 : 7-30.
3 Jiang X, Overholtzer M et Thompson CB. Autophagie dans le métabolisme cellulaire et le cancer. J Clin Invest 2015 ; 125 : 47-54.
4 Klionsky DJ et Emr SD. L’autophagie comme une voie régulée de dégradation cellulaire. Science 2000 ; 290 : 1717-1721.
5 Mizushima N et Komatsu M. Autophagy : renovation of cells and tissues. Cell 2011 ; 147 : 728-741.
6 Hara T, Nakamura K, Matsui M, Yamamoto A, Nakahara Y, Suzuki-Migishima R, Yokoyama M, Mishima K, Saito I, Okano H et Mizushima N. La suppression de l’autophagie basale dans les cellules neurales provoque une maladie neurodégénérative chez la souris. Nature 2006 ; 441 : 885-889.
7 Hardie DG. Cell biology. Pourquoi les cellules affamées se mangent elles-mêmes. Science 2011 ; 331 : 410-411.
8 Mathew R, Karantza-Wadsworth V et White E. Role of autophagy in cancer. Nat Rev Cancer 2007 ; 7 : 961-967.
9 Rubinsztein DC, Marino G et Kroemer G. Autophagy and aging. Cell 2011 ; 146 : 682-695.
10 Rubinsztein DC, Codogno P et Levine B. Autophagy modulation as a potential therapeutic target for diverse diseases. Nat Rev Drug Discov 2012 ; 11 : 709-730.
11 Bonnet S, Archer SL, Allalunis-Turner J, Haromy A, Beaulieu C, Thompson R, Lee CT, Lopaschuk GD, Puttagunta L, Bonnet S, Harry G, Hashimoto K, Porter CJ, Andrade MA, Thebaud B et Michelakis ED. A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth. Cancer Cell 2007 ; 11 : 37-51.
12 Cao W, Yacoub S, Shiverick KT, Namiki K, Sakai Y, Porvasnik S, Urbanek C et Rosser CJ. Le dichloroacétate (DCA) sensibilise in vitro les cellules cancéreuses de la prostate de type sauvage et sur-exprimant Bcl-2 aux radiations. Prostate 2008 ; 68 : 1223-1231.
13 Janku F, McConkey DJ, Hong DS et Kurzrock R. Autophagy as a target for anticancer therapy. Nat Rev Clin Oncol 2011 ; 8 : 528-539.
14 Kondo Y, Kanzawa T, Sawaya R et Kondo S. The role of autophagy in cancer development and response to therapy. Nat Rev Cancer 2005 ; 5 : 726-734.
15 Mizushima N. Autophagy : process and function. Genes Dev 2007 ; 21 : 2861-2873.
16 Ravikumar B, Sarkar S, Davies JE, Futter M, Garcia-Arencibia M, Green-Thompson ZW, Jimenez-Sanchez M, Korolchuk VI, Lichtenberg M, Luo S, Massey DC, Menzies FM, Moreau K, Narayanan U, Renna M, Siddiqi FH, Underwood BR, Winslow AR et Rubinsztein DC. Régulation de l’autophagie chez les mammifères en physiologie et en physiopathologie. Physiol Rev 2010 ; 90 : 1383-1435.
17 Kondo Y et Kondo S. Autophagy and cancer therapy. Autophagy 2006 ; 2 : 85-90.
18 Degenhardt K, Mathew R, Beaudoin B, Bray K, Anderson D, Chen G, Mukherjee C, Shi Y, Gelinas C, Fan Y, Nelson DA, Jin S et White E. Autophagy promotes tumor cell survival and restricts necrosis, inflammation, and tumorigenesis. Cancer Cell 2006 ; 10 : 51-64.
19 Kim DG, Jung KH, Lee DG, Yoon JH, Choi KS, Kwon SW, Shen HM, Morgan MJ, Hong SS et Kim YS. le 20(S)-Ginsenoside Rg3 est un nouvel inhibiteur de l’autophagie et sensibilise le carcinome hépatocellulaire à la doxorubicine. Oncotarget 2014 ; 5 : 4438-4451.
20 Manov I, Pollak Y, Broneshter R et Iancu TC. Inhibition de l’autophagie induite par la doxorubicine dans les cellules Hep3B de carcinome hépatocellulaire par le sorafenib- le rôle de la contre-action de la kinase régulée par le signal extracellulaire. FEBS J 2011 ; 278 : 3494-3507.
21 Chen K et Shi W. L’autophagie régule la résistance des cellules cancéreuses pulmonaires non à petites cellules au paclitaxel. Tumour Biol 2016 ; 37 : 10539-10544.
22 Zhou J, Li G, Zheng Y, Shen HM, Hu X, Ming QL, Huang C, Li P et Gao N. Un nouvel inhibiteur d’autophagie/mitophagie, la liensinine, sensibilise les cellules cancéreuses du sein à la chimiothérapie par le biais de la fission mitochondriale médiée par DNM1L. Autophagy 2015 ; 11 : 1259-1279.
23 Kimura T, Takabatake Y, Takahashi A et Isaka Y. La chloroquine dans la thérapie du cancer : une épée à double tranchant de l’autophagie. Cancer Res 2013 ; 73 : 3-7.
Contenu connexe :