Minghao Wang a, Cuiwei Liao a,b, Ying Hu a, Wenqin Pan a, Jun Jiang a,#
a Centro di malattie della mammella, Southwest Hospital, Terza Università Medica Militare, Chongqing, 400038, Cina
b Dipartimento di radiologia, Xinqiao Hospital, Terza Università Medica Militare, Chongqing, 400038, Cina
Ricevuto: 14 maggio 2017
Accettato: Accettato 17 maggio 2017
Disponibile online: 19 maggio 2017
Abstract
La chemioterapia è ancora la principale strategia adiuvante nel trattamento del cancro, tuttavia si riscontra spesso anche la chemioresistenza. L’inibizione dell’autofagia è stata ampiamente accettata come una promettente strategia terapeutica nel cancro, ma la mancanza di inibitori dell’autofagia efficaci e specifici ne ostacola l’applicazione. Abbiamo scoperto che il dicloroacetato (DCA), un composto di piccole dimensioni, è in grado di inibire significativamente l’autofagia indotta dalla doxorubicina nelle cellule di cancro al seno. Il DCA aumenta notevolmente la morte e l’antiproliferazione delle cellule di cancro al seno indotte dalla Doxorubicina in vitro. Ma la sensibilizzazione alla Dox del DCA è stata significativamente ridotta attraverso l’induzione dell’autofagia da parte della rapamicina. Inoltre, la terapia combinata di Dox e DCA poteva inibire significativamente la crescita tumorale in vivo e prolungare il tempo di sopravvivenza dei topi. Nel complesso, abbiamo dimostrato che il DCA può inibire l’autofagia indotta dalla doxorubicina e fornire una nuova strategia per migliorare l’efficacia antitumorale della chemioterapia.
Parole chiave: Dicloroacetato; Cancro al seno; Autofagia; Chemioterapia
Highlights:
– La doxorubicina (Dox) induce l’autofagia nelle cellule di cancro al seno.
– Il DCA sensibilizza le cellule MDA-MB-231 alla Dox attraverso l’inibizione dell’autofagia.
– L’induzione dell’autofagia da parte della rapamicina ha compromesso gli effetti sensibilizzanti del DCA sulla Dox.
– Inibizione sinergica della crescita tumorale nei topi trattati con Dox e DCA.
INTRODUZIONE
Il tumore al seno è uno dei principali problemi di salute pubblica a livello mondiale e il suo universalismo e tasso di insorgenza sono aumentati notevolmente negli ultimi decenni. Attualmente, la chemioterapia è ancora il principale ausilio per il trattamento del cancro al seno. Nel frattempo, il cancro al seno è insensibile alla chemioterapia e alla radioterapia [1], [2].
L’autofagia comporta il sequestro di porzioni di vescicole a doppia membrana citoplasmatica, gli autofagosomi, che poi si fondono con i lisosomi per generare autolisosomi, in cui il carico autofagico viene degradato dalle catabolicoidrolasi. L’autofagia consente alle cellule di degradare le proprie proteine e i propri organelli per mantenere l’omeostasi cellulare necessaria per la crescita e lo sviluppo normali, per l’adattamento a breve termine allo stress e per la sopravvivenza a lungo termine di cellule in forma ottimale [3], [4], [5]. Deregolazioni dell’autofagia sono state coinvolte in numerose malattie degenerative, nell’invecchiamento e nel cancro [6], [7], [8], [9]. In particolare, l’autofagia è spesso una risposta pro-sopravvivenza al trattamento chemioterapico nelle cellule tumorali e la soppressione dell’autofagia durante la chemioterapia è stata proposta come una nuova strategia terapeutica [10].
Il dicloroacetato (DCA) è un piccolo inibitore della piruvato deidrogenasi chinasi (PDK), che attiva la piruvato deidrogenasi (PDH) e aumenta l’ossidazione del glucosio promuovendo l’afflusso di piruvato nel ciclo di Krebs. Recentemente è stato dimostrato che il DCA è un promettente agente antineoplastico non tossico in grado di promuovere l’apoptosi nelle cellule di carcinoma [11], [12]. Tuttavia, la correlazione tra DCA e autofagia nelle cellule di carcinoma mammario era sconosciuta. Nel presente studio, abbiamo analizzato l’effetto del DCA sulla modulazione dell’autofagia nelle cellule di cancro al seno umano. Abbiamo scoperto per la prima volta che il DCA inibisce in modo potente l’autofagia nelle cellule MDB-231. Inoltre, abbiamo studiato gli effetti dell’inibizione dell’autofagia da parte del DCA sulla potenza antitumorale dei farmaci chemioterapici. Il co-trattamento di DCA ha ridotto notevolmente la vitalità e aumentato l’apoptosi nelle cellule trattate con Dox e l’efficacia sensibilizzante di DCA è stata significativamente ridotta dal trattamento con rapamicina. L’effetto sinergico di DCA e doxorubicina è stato ulteriormente confermato in vivo utilizzando un modello di xenotrapianto di topo. I nostri risultati dimostrano quindi che l’inibizione dell’autofagia con il DCA potenzia l’efficacia della Dox e che tale combinazione può rappresentare una nuova strategia terapeutica per il trattamento del tumore al seno.
Materiali e metodi
Coltura cellulare
La linea cellulare di cancro al seno umano MDA-MB-231 è stata ottenuta dall’American Type Culture Collection (ATCC, HTB-26) e mantenuta in terreno RPMI1640 (Hyclone). I terreni sono stati integrati con il 10% di siero fetale bovino (Gibco) e 100 mg/ml di streptomicina (Gibco). Le cellule sono state coltivate in un incubatore umidificato con il 95% di aria e il 5% diCO2 a 37°C.
Reagenti
Gli anticorpi monoclonali primari di coniglio contro LC3, P62 e β-actina sono stati acquistati da Cell Signaling. Gli anticorpi secondari di capra anti-rabbit IgG sono stati acquistati da Santa Cruz Biotechnology. Gli anticorpi FITC-Annexin V e PE-PI sono stati acquistati da Biolegend. Per il monitoraggio dinamico della proteina LC3 correlata all’autofagia mediante immunofluorescenza, è stato utilizzato un adenovirus con costruzione tandem EGFP-RFP-LC3. Il kit per il test di vitalità cellulare (MTT) è stato acquistato da Sangon Biotech (Shanghai). La rapamicina è stata acquistata da Sigma-Aldrich e la doxorubicina da Santa Cruz Biotechnology.
Western blot
Le proteine sono state estratte in tampone di lisi dopo la medicazione e separate mediante elettroforesi su gel di poliacrilammide sodio dodecil solfato (SDS-PAGE). Le concentrazioni di proteine sono state misurate con il kit BioRad™ per il dosaggio delle proteine. Quantità uguali di campioni proteici sono stati elettroforesi su mini-gel SDS-PAGE al 7%-12%. Le proteine sono state trasferite su membrana Immobilon PVDF a 100 V per 2 ore a 4 °C. Le membrane sono state testate con l’anticorpo primario indicato per una notte a 4 °C e quindi incubate con un anticorpo secondario accoppiato a perossidasi di rafano. La visualizzazione è stata eseguita mediante incubazione per 3 minuti con il tampone di rivelazione a chemiluminescenza potenziata (100 mM Tris-HCl pH 8,5, 1,25 mM di luminolo, 0,2 mM di acido p-cumarico e 0,03% di H2O2) e l’intensità delle bande è stata quantificata mediante il software Image J.
Microscopia di immunofluorescenza
Le cellule sono state seminate su vetrini coprioggetto in una piastra a 24 pozzetti. Le cellule sono state infettate con adenovirus GFP-RFP-LC3 prima dell’esperimento. Dopo 24 ore, il terreno è stato sostituito e le cellule sono state trattate con DCA per altre 24 ore. Per l’immunocolorazione, le cellule sono state fissate in paraformaldeide al 4% per 15 minuti e lavate. Le cellule sono state incubate con DAPI per 5 minuti e poi lavate con PBS. I coprioggetti sono stati montati su vetrini con il mezzo di montaggio Vectashield. Le immagini sono state acquisite con un microscopio confocale LSM780NLO (Carl Zeiss MicroImaging) ed elaborate con il software fornito dal produttore.
Saggio di vitalità cellulare (MTT)
Le cellule sono state seminate in piastre da 96 pozzetti e trattate come indicato per 24 ore. Quindi sono stati aggiunti 10 μl di MTT (5 mg/ml) per pozzetto e incubati per 4 ore. Ogni pozzetto è stato integrato con 100 μl di DMSO per dissolvere la formazana prima di essere misurato con un lettore di micropiastre a 490 nm. La vitalità cellulare è stata normalizzata rispetto al gruppo di controllo.
Citometria a flusso
L’entità dell’apoptosi è stata determinata mediante citometria a flusso. Le cellule sono state raccolte, lavate e incubate con la colorazione di Annexin V per 45 minuti. La colorazione con ioduro di propidio è stata aggiunta prima di essere analizzata con la citometria a flusso.
Analisi statistica
I dati sono stati analizzati con il software statistico SPSS 21.0. I
I dati di misurazione sono stati espressi in media ± deviazione standard. Per il confronto della distribuzione normale, è stato utilizzato il t-test. Per il confronto tra i gruppi è stata utilizzata l’analisi della varianza a una via (ANOVA). I dati di conteggio sono stati espressi in percentuale e testati con il test del chi-quadro. P < 0,05 è stato considerato statisticamente significativo.
Risultati
Iltrattamento con Dox ha indotto l’autofagia nelle cellule di cancro al seno
Recenti studi hanno dimostrato che l’autofagia delle cellule tumorali può essere indotta durante la chemioterapia [8], [13]. Per determinare se la Dox influisce sull’autofagia nelle cellule di cancro al seno umano, l’accumulo di autofagosomi è stato rilevato con un microscopio confocale a scansione laser dopo aver infettato l’adenovirus EGFP-RFP-LC3. Come mostrato nella Fig. 1A-B, il trattamento delle cellule con Dox per 24 ore ha determinato un marcato aumento della formazione di punti RFP-LC3 nelle cellule MDA-MB-231 (p < 0,05). Poi, abbiamo esaminato l’effetto della Dox sulla conversione della proteina classica dell’autofagia LC3B e sulla P62 nelle cellule MDA-MB-231. L’analisi Western blot ha mostrato che il trattamento con Dox per 24 ore ha determinato l’accumulo di LC3B-II e la diminuzione di P62 (proteina recettore legante l’ubiquitina) in modo dose- (Fig. 1C-E) e tempo-dipendente (Fig. 1F-H) (p < 0,05). Questi risultati indicano che la Dox è in grado di indurre l’autofagia nelle cellule MDA-MB-231.
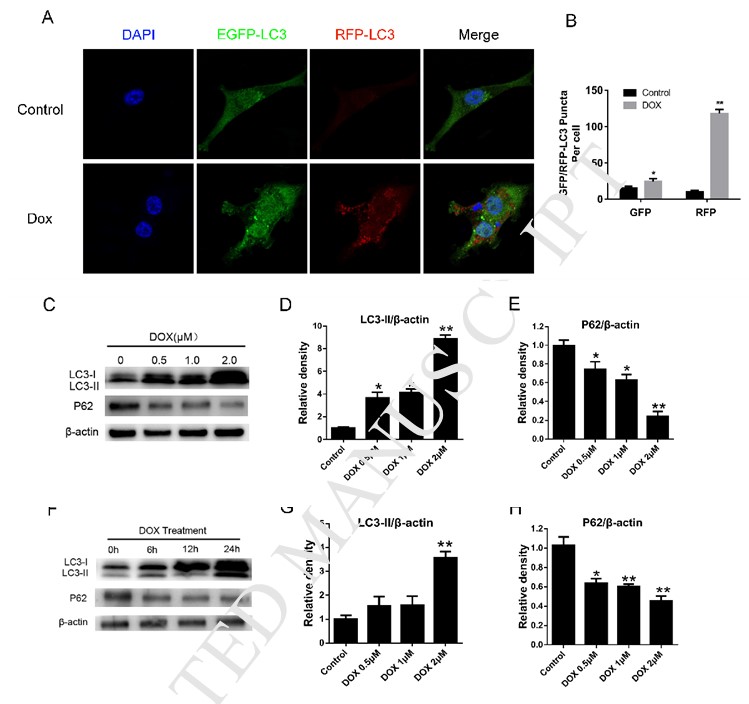
IlDCA sensibilizza la morte cellulare indotta dalla doxorubicina attraverso l’inibizione dell’autofagia
Per esplorare l’influenza del trattamento con DCA sulla sensibilità alla Dox delle cellule MDA-MB-231, abbiamo quindi rilevato l’apoptosi delle cellule MDA-MB-231 dopo il trattamento della Dox con o senza DCA. Come mostrato nella Fig. 2A-B, il trattamento delle cellule MDA-MB-231 con diverse concentrazioni di Dox e DCA per 24 ore ha provocato livelli più elevati di apoptosi rispetto al solo trattamento con Dox, come dimostrato dal FACS (p < 0,05). I risultati dell’esperimento di proliferazione hanno mostrato che il DCA ha avuto un effetto sinergico sulle azioni antiproliferative della Dox a partire dalle 24 ore (Fig. 2C-D). Si ritiene che l’inibizione dell’autofagia nelle cellule tumorali aumenti la sensibilità dei farmaci chemioterapici [8], [13], [14]. Successivamente, per determinare se il DCA potesse influenzare l’autofagia indotta dalla Dox nelle cellule MDA-MB-231, abbiamo analizzato la variazione del livello delle proteine dell’autofagia attraverso un saggio di immunofluorescenza indiretta e il western blotting. Il trattamento delle cellule con Dox o rapamicina ha determinato un marcato aumento della formazione di puncta RFP-LC3 nelle cellule MDA-MB-231, che è diminuita significativamente con il co-trattamento di DCA (Fig. 1A, Fig. 2E-F). Sebbene il livello di LC3-II sia aumentato dopo il trattamento con Dox, il livello di LC3-II si è indebolito maggiormente dopo il trattamento combinato di Dox e DCA, mentre il livello della proteina P62 è aumentato significativamente dopo il co-trattamento (Fig. 2G-I). Tutti questi risultati indicano che il DCA aumenta la sensibilità delle cellule MDA-MB-231 alla Dox attraverso l’inibizione dell’autofagia in vitro.
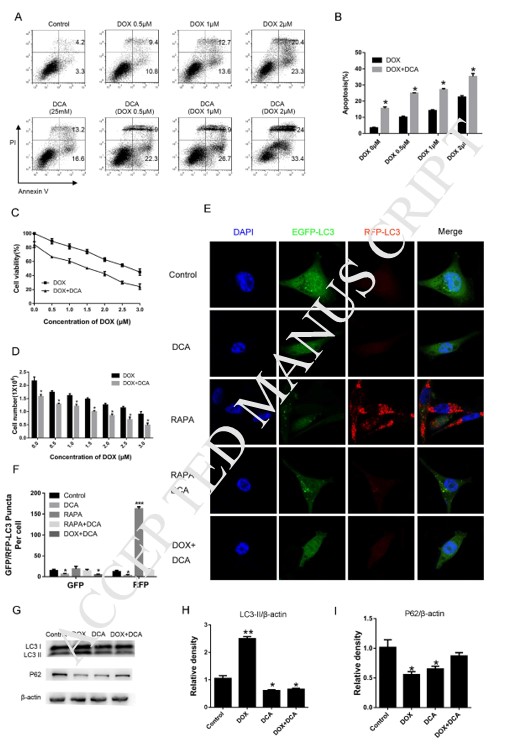
L’induzione dell’autofagia con la rapamicina ha ridotto la sensibilità ai farmaci di DCA e Dox
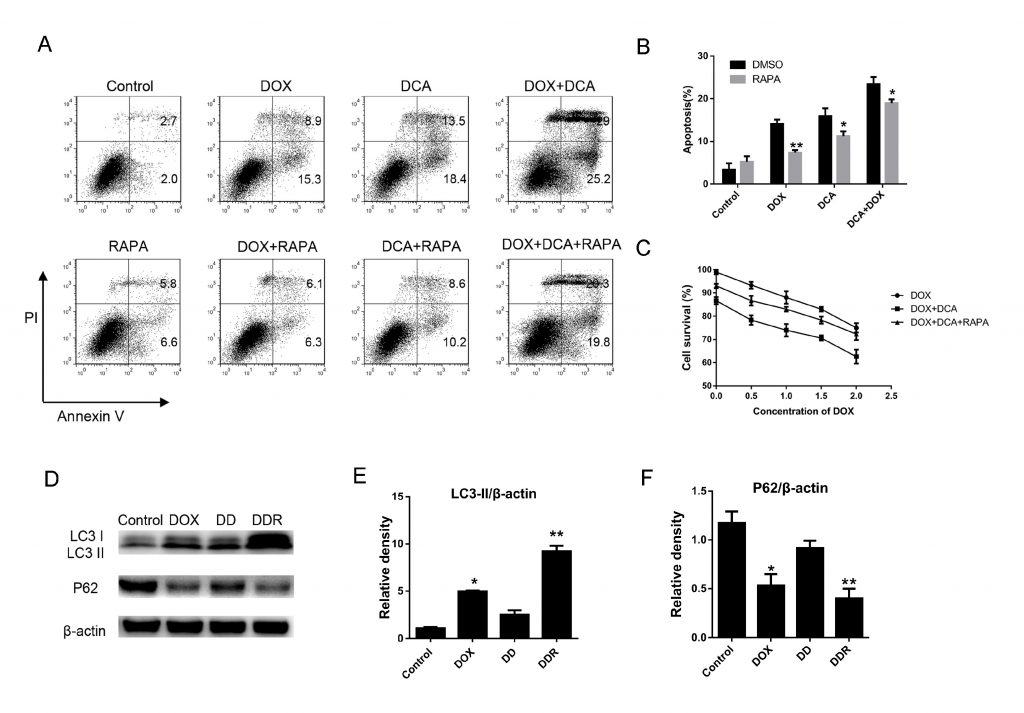
Per confermare ulteriormente che l’inibizione dell’autofagia da parte di DCA potrebbe migliorare l’effetto della chemioterapia combinata, è stata utilizzata la rapamicina, un classico acceleratore dell’autofagia, per indurre l’autofagia. Come mostra la Fig. 3 A-B, sebbene il livello di apoptosi sia aumentato significativamente dopo il co-trattamento con Dox e DCA rispetto al solo trattamento con Dox, il livello di apoptosi è diminuito notevolmente dopo il trattamento combinato con rapamicina (p < 0,05). I risultati dell’esperimento MTT hanno mostrato che la rapamicina aveva un effetto antagonista sulle azioni antiproliferative di Dox e DCA a partire dalle 24 ore (p < 0,05) (Fig. 3C). I risultati hanno mostrato che il livello di LC3-II era notevolmente aumentato e la banda p62 era significativamente ridotta nel gruppo DDR (Dox, DCA e rapamicina) rispetto al gruppo trattato con DD (Dox e DCA) (Fig. 3D-F). Questi risultati hanno ulteriormente confermato che il DCA sensibilizza l’apoptosi delle cellule MDA-MB-231 indotta dalla doxorubicina attraverso l’inibizione dell’autofagia.
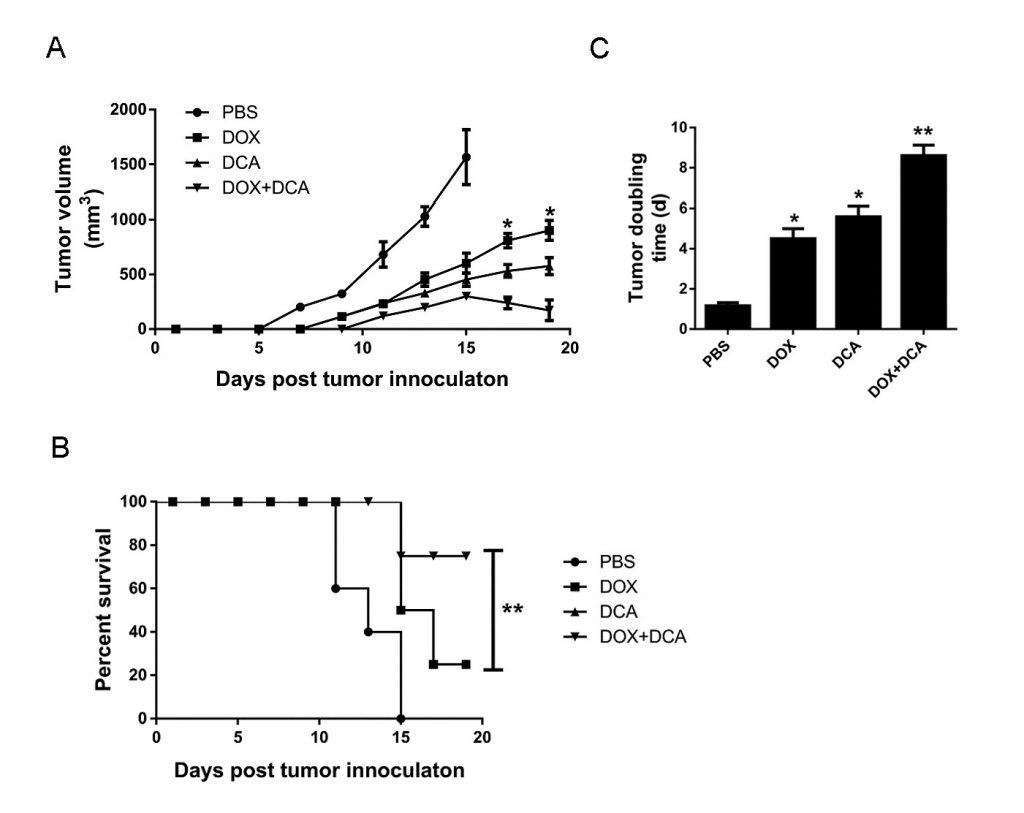
L’inibizione in vivo dell’autofagia da parte del DCA potenzia la capacità antitumorale della Dox
Considerando che la Dox induce una maggiore morte cellulare dopo aver inibito l’autofagia, abbiamo valutato il potenziale della terapia combinata di Dox e DCA in vivo. Quando il tumore era palpabile, gli animali sono stati trattati con: (1) PBS, (2) Dox, (3) DCA e (4) Dox più DCA. Come mostrato nella Fig. 4A-B, sebbene il trattamento con Dox o DCA da solo abbia mostrato un certo effetto inibitorio sulla crescita del tumore rispetto al PBS. Tuttavia, il trattamento combinato di Dox e DCA ha inibito significativamente la crescita del tumore e prolungato il tempo di sopravvivenza del topo (p < 0,05). Come mostrato nella Fig. 4C, il tempo di raddoppiamento del tumore è aumentato significativamente da 4,65 d (CI, 4,17-5,85 giorni) nel gruppo Dox a 8,80 d (CI, 7,33-10,3 giorni) nel gruppo Dox più DCA (p < 0,05).
Discussione
La chemioterapia è ancora la principale strategia di trattamento del cancro, tuttavia la tolleranza si sviluppa sempre per un breve periodo di tempo. Pertanto, la ricerca attuale si concentra sulla ricerca di nuovi modi per sensibilizzare o ritardare la resistenza ai farmaci. Attualmente si ritiene che le cellule tumorali possano tollerare lo stress esterno e l’ipossia attraverso la regolazione dell’autofagia.
L’autofagia è un comportamento fisiologico che aiuta a mantenere l’omeostasi cellulare; le proteine senili o difettose, gli organelli e altri componenti cellulari vengono consegnati al lisosoma per essere degradati e riciclati attraverso questo processo [15], [16]. Negli ultimi anni numerosi studi hanno cercato di collegare l’autofagia al cancro e alla terapia antitumorale [8], [13], [17]. Si ritiene che la maggior parte dei farmaci antitumorali, così come le radiazioni ionizzanti o i farmaci specifici per il bersaglio, inducano l’autofagia delle cellule tumorali durante il trattamento [18], [19], [20]. L’inibizione dell’autofagia nelle cellule tumorali è stata considerata una strategia per sensibilizzare la chemioterapia e la radioterapia [8], [21], [22]. Sebbene l’inibizione dell’autofagia nelle cellule tumorali sia stata ampiamente accettata come un promettente progetto terapeutico nel cancro, la mancanza di inibitori dell’autofagia efficaci e specifici ne ostacola l’applicazione. La clorochina e l’idrossiclorochina sono gli unici due inibitori dell’autofagia approvati dalla FDA. Recentemente sono stati condotti diversi studi clinici di fase I/II che prevedevano l’inibizione dell’autofagia mediante l’uso di clorochina o idrossiclorochina in combinazione con la chemioterapia per il trattamento di diversi tipi di cancro, tra cui il cancro al seno [13], [23]. Pertanto, lo sviluppo di un nuovo tipo di inibitore dell’autofagia per il trattamento del cancro ha un importante significato clinico. Il DCA, in grado di inibire l’enzima critico piruvato deidrogenasi chinasi (PDK), porta a un’alterazione della respirazione mitocondriale delle cellule tumorali e all’apoptosi [11]. Ad oggi, non è stato dimostrato se il DCA sia coinvolto nella regolazione dell’autofagia nelle cellule di cancro al seno. Nel presente studio, abbiamo dimostrato che il DCA ha la capacità di inibire l’autofagia e di aumentare notevolmente la morte delle cellule di cancro al seno indotta da farmaci chemioterapici. Tuttavia, la sensibilizzazione alla Dox del DCA è stata significativamente ridotta dal trattamento con rapamicina. Per quanto ne sappiamo, questo è il primo rapporto che dimostra l’efficacia dell’inibizione dell’autofagia da parte del DCA in combinazione con la doxorubicina nelle cellule di cancro al seno in vitro e in vivo. Tuttavia, non sappiamo se l’autofagia indotta da altri farmaci chemioterapici possa essere inibita dal DCA; è necessario procedere con ulteriori ricerche sull’universalità del DCA.
In sintesi, i presenti risultati dimostrano che l’inibizione dell’autofagia da parte del DCA ha potenziato l’apoptosi mediata dalla doxorubicina e forniscono una nuova prospettiva di ricerca per trovare inibitori dell’autofagia per la chemioterapia combinata. I nostri risultati suggeriscono che il DCA potrebbe essere ulteriormente sviluppato come inibitore dell’autofagia e che la combinazione di DCA con i classici farmaci chemioterapici potrebbe rappresentare una nuova strategia terapeutica per il trattamento del cancro al seno.
Conflitto di interessi
Gli autori dichiarano che non vi è alcun conflitto di interessi.
Riconoscimenti
Questo lavoro è stato sostenuto dal Progetto appartiene all’Ospedale del Sud-Ovest [cstc2015shms-ztzx10005].
RIFERIMENTI
1 Ferlay J, Soerjomataram I, Dikshit R, Eser S, Mathers C, Rebelo M, Parkin DM, Forman D e Bray F. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer 2015; 136: E359-386.
2 Siegel RL, Miller KD e Jemal A. Statistiche sul cancro, 2017. CA Cancer J Clin 2017; 67: 7-30.
3 Jiang X, Overholtzer M e Thompson CB. L’autofagia nel metabolismo cellulare e nel cancro. J Clin Invest 2015; 125: 47-54.
4 Klionsky DJ e Emr SD. L’autofagia come via regolata di degradazione cellulare. Science 2000; 290: 1717-1721.
5 Mizushima N e Komatsu M. Autofagia: rinnovamento di cellule e tessuti. Cell 2011; 147: 728-741.
6 Hara T, Nakamura K, Matsui M, Yamamoto A, Nakahara Y, Suzuki-Migishima R, Yokoyama M, Mishima K, Saito I, Okano H e Mizushima N. La soppressione dell’autofagia basale nelle cellule neurali causa la malattia neurodegenerativa nei topi. Nature 2006; 441: 885-889.
7 Hardie DG. Biologia cellulare. Perché le cellule affamate si mangiano da sole. Science 2011; 331: 410-411.
8 Mathew R, Karantza-Wadsworth V e White E. Ruolo dell’autofagia nel cancro. Nat Rev Cancer 2007; 7: 961-967.
9 Rubinsztein DC, Marino G e Kroemer G. Autofagia e invecchiamento. Cell 2011; 146: 682-695.
10 Rubinsztein DC, Codogno P e Levine B. La modulazione dell’autofagia come potenziale bersaglio terapeutico per diverse malattie. Nat Rev Drug Discov 2012; 11: 709-730.
11 Bonnet S, Archer SL, Allalunis-Turner J, Haromy A, Beaulieu C, Thompson R, Lee CT, Lopaschuk GD, Puttagunta L, Bonnet S, Harry G, Hashimoto K, Porter CJ, Andrade MA, Thebaud B e Michelakis ED. L’asse mitocondrio-canale K+ è soppresso nel cancro e la sua normalizzazione promuove l’apoptosi e inibisce la crescita del tumore. Cancer Cell 2007; 11: 37-51.
12 Cao W, Yacoub S, Shiverick KT, Namiki K, Sakai Y, Porvasnik S, Urbanek C e Rosser CJ. Il dicloroacetato (DCA) sensibilizza alle radiazioni sia le cellule di cancro alla prostata wild-type che quelle che esprimono Bcl-2 in vitro. Prostate 2008; 68: 1223-1231.
13 Janku F, McConkey DJ, Hong DS e Kurzrock R. L’autofagia come bersaglio per la terapia antitumorale. Nat Rev Clin Oncol 2011; 8: 528-539.
14 Kondo Y, Kanzawa T, Sawaya R e Kondo S. Il ruolo dell’autofagia nello sviluppo del cancro e nella risposta alla terapia. Nat Rev Cancer 2005; 5: 726-734.
15 Mizushima N. Autofagia: processo e funzione. Genes Dev 2007; 21: 2861-2873.
16 Ravikumar B, Sarkar S, Davies JE, Futter M, Garcia-Arencibia M, Green-Thompson ZW, Jimenez-Sanchez M, Korolchuk VI, Lichtenberg M, Luo S, Massey DC, Menzies FM, Moreau K, Narayanan U, Renna M, Siddiqi FH, Underwood BR, Winslow AR e Rubinsztein DC. Regolazione dell’autofagia nei mammiferi in fisiologia e fisiopatologia. Physiol Rev 2010; 90: 1383-1435.
17 Kondo Y e Kondo S. Autofagia e terapia del cancro. Autophagy 2006; 2: 85-90.
18 Degenhardt K, Mathew R, Beaudoin B, Bray K, Anderson D, Chen G, Mukherjee C, Shi Y, Gelinas C, Fan Y, Nelson DA, Jin S e White E. L’autofagia promuove la sopravvivenza delle cellule tumorali e limita necrosi, infiammazione e tumorigenesi. Cancer Cell 2006; 10: 51-64.
19 Kim DG, Jung KH, Lee DG, Yoon JH, Choi KS, Kwon SW, Shen HM, Morgan MJ, Hong SS e Kim YS. il 20(S)-ginsenoside Rg3 è un nuovo inibitore dell’autofagia e sensibilizza il carcinoma epatocellulare alla doxorubicina. Oncotarget 2014; 5: 4438-4451.
20 Manov I, Pollak Y, Broneshter R e Iancu TC. Inibizione dell’autofagia indotta dalla doxorubicina nelle cellule di carcinoma epatocellulare Hep3B da parte di sorafenib – il ruolo della reazione della chinasi regolata dal segnale extracellulare. FEBS J 2011; 278: 3494-3507.
21 Chen K e Shi W. L’autofagia regola la resistenza delle cellule di carcinoma polmonare non a piccole cellule al paclitaxel. Tumour Biol 2016; 37: 10539-10544.
22 Zhou J, Li G, Zheng Y, Shen HM, Hu X, Ming QL, Huang C, Li P e Gao N. Un nuovo inibitore dell’autofagia/mitofagia, la liensinina, sensibilizza le cellule di cancro al seno alla chemioterapia attraverso la fissione mitocondriale mediata da DNM1L. Autophagy 2015; 11: 1259-1279.
23 Kimura T, Takabatake Y, Takahashi A e Isaka Y. Chloroquine in cancer therapy: a double-edged sword of autophagy. Cancer Res 2013; 73: 3-7.
Contenuti correlati: