¿Desde cuándo padece cáncer la humanidad? La respuesta podría sorprenderle. Parece que nuestros antepasados se enfrentaron a los mismos retos que nosotros en el sigloXXI.
Algunas de las primeras pruebas del cáncer se encuentran en las antiguas momias de Egipto. Las pruebas arqueológicas sugieren que la gente del pasado sufría los mismos tipos de tumores que hoy en día.
Sin embargo, los antiguos egipcios no tenían una idea clara de lo que era el cáncer y, por tanto, no existían terapias eficaces. La causa y la cura de la temida enfermedad siempre han sido un misterio. (Referencia)
Afortunadamente, en el último siglo los avances en la comprensión de las enfermedades oncológicas han sido enormes. Cuando se dispuso de anestesia, los cirujanos desarrollaron rápidamente operaciones que extirpaban todo el tumor junto con los ganglios linfáticos cancerosos. (Ref.)
Durante la Segunda Guerra Mundial aparecieron compuestos que bloqueaban las reacciones químicas críticas para la replicación del ADN. El desarrollo posterior de estos agentes citotóxicos condujo a la aparición de la quimioterapia. Lamentablemente, estos fármacos se dirigían tanto a las células normales como a las cancerosas, por lo que seguían siendo necesarias alternativas más seguras pero eficaces. (Referencia)
Al poco tiempo, la oncología empezó a disponer de tratamientos más sofisticados, como la inmunoterapia y la terapia dirigida. La mejor comprensión de la biología del cáncer dio lugar a medicamentos de la nueva era. Estos medicamentos podían potenciar la respuesta del sistema inmunitario para atacar a las células malignas e impedir el crecimiento, la división y la metástasis del cáncer. (Ref.1), (Ref.2)
Curiosamente, todo el proceso de exploración condujo a descubrimientos inesperados. Se reconoció que los cambios metabólicos significativos eran una característica de muchos tipos de cáncer. Junto con la emergente ola de reutilización de fármacos, estos descubrimientos abrieron la puerta al tratamiento metabólico del cáncer y pronto el dicloroacetato de sodio se convirtió en el ejemplo más destacado de esta estrategia. (Referencia)
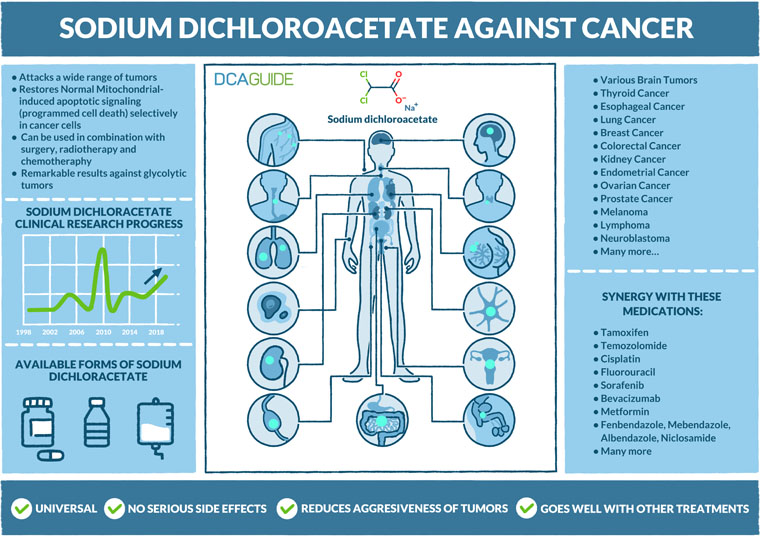
Metabolismo del cáncer
En 1923, un bioquímico, médico y Premio Nobel alemán, Otto Heinrich Warburg, hizo un descubrimiento pionero vital para comprender el metabolismo energético de las células cancerosas. Este fenómeno identificado se reconoce ahora como el sello distintivo del cáncer y se denomina efecto Warburg.
Otto Warburg observó las células de un tumor de rata y se dio cuenta de que su crecimiento se alimentaba de cantidades extremas de glucosa (azúcar) sin un mayor uso de oxígeno. Esto no tenía sentido, ya que el uso de oxígeno para producir energía a partir de nutrientes es una forma mucho más eficiente. Hace más de cien años, tales hallazgos suscitaban más preguntas que respuestas.
Ahora se sabe que el enorme hambre de glucosa y el menor consumo de oxígeno otorgan a las células cancerosas un conjunto único de ventajas evolutivas. (Ref.)
Una de las formas en que las células cancerosas se benefician del efecto Warburg es cambiando a una rápida producción de biomasa. El aumento de la absorción de glucosa proporciona al tejido canceroso más componentes para fabricar nuevo material genético y proteínas, lo que en última instancia conduce a una mayor proliferación y crecimiento del cáncer. (Ref.)
Además, es bien sabido que a las células normales de los mamíferos se les suministra constantemente oxígeno, ya que de lo contrario morirían rápidamente. Sin embargo, las células malignas actúan de forma totalmente diferente. A medida que los tumores crecen rápidamente, a menudo superan su suministro de oxígeno. Al no necesitar oxígeno para alimentar su crecimiento y prosperar, el cáncer no se asfixia.
Pronto las células tumorales cambian su metabolismo a la glucólisis aeróbica. Comienza a producir y excretar cantidades excesivas de ácido láctico fuera de las células, lo que acaba provocando un aumento de la acidez del microentorno tumoral. (Ref.)
Un microambiente tumoral ácido promueve una mayor invasión y metástasis al romper la matriz extracelular entre nuestras células. Una vez elevado el nivel de acidez, también ayuda al desarrollo del cáncer a evitar nuestro sistema inmunitario, el mecanismo de defensa natural contra las neoplasias malignas. Esta es una de las razones por las que el efecto de la inmunoterapia a menudo puede empezar a disminuir cuando se trata un cáncer avanzado. (Ref.)
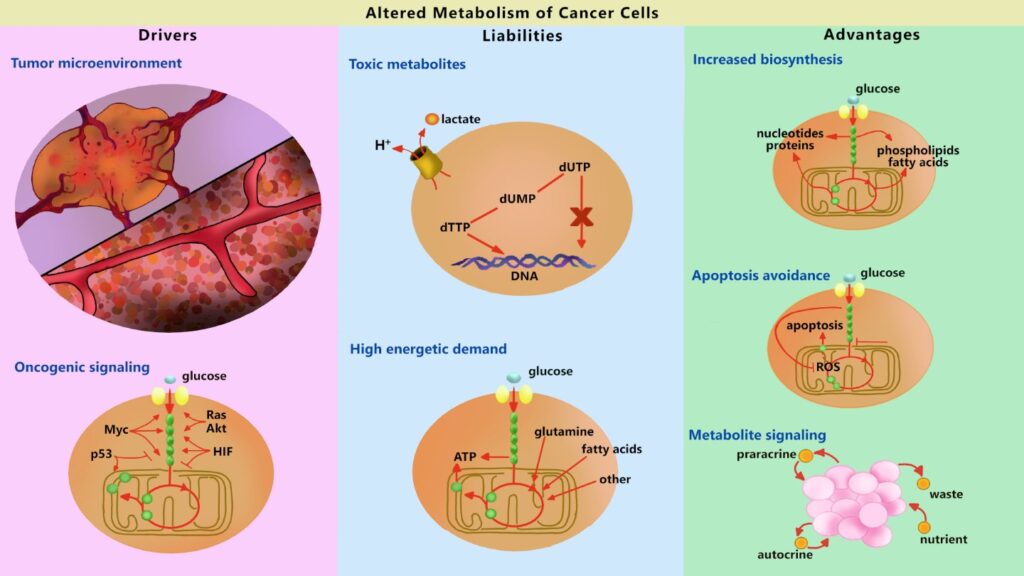
Al mismo tiempo, las células tumorales utilizan menos oxígeno, las mitocondrias del interior de las células empiezan a generar menos especies reactivas de oxígeno que desempeñan un papel importante en la prevención así como en la eliminación de las células cancerosas. El cáncer comienza a evitar un mecanismo conocido como apoptosis. (Ref.1) (Ref.2)
La apoptosis es un proceso normal que ocurre en nuestro organismo como una forma conveniente de eliminar células que ya no deberían formar parte del cuerpo. Es una forma de muerte celular programada natural que impide que los tumores se desarrollen y expandan en primer lugar. Como consecuencia de evitar la apoptosis, las células cancerosas se vuelven inmortales. (Ref.1), (Ref.2)
Estas son las principales ventajas metabólicas que permiten a los tumores prosperar. Cabe destacar que la evolución de las células tumorales es un proceso bastante complejo, lo que la convierte en una enfermedad difícil de tratar. Sin embargo, ésta es sólo una cara de la moneda. Por otro lado, el efecto Warburg puede explotarse contra el propio cáncer.
En el diagnóstico, la humanidad utilizó este fenómeno del metabolismo del cáncer para el diagnóstico. La tomografía por emisión de positrones (PET) revela los tejidos y órganos que presentan una actividad metabólica anormal.
Como las células cancerosas tienen activo el efecto Warburg, absorben glucosa radiactiva un par de cientos de veces más rápido que el tejido normal circundante. Como resultado, los tumores se iluminan en las imágenes y pueden rastrearse cómodamente en todo el cuerpo. (Ref.)
En el tratamiento, el efecto Warburg podría ser el «talón de Aquiles» del cáncer que se ignoró durante casi un siglo, ya que prácticamente toda la terapéutica del cáncer en el pasado se centraba en un enfoque centrado en los genes. El compuesto dicloroacetato de sodio actúa de forma completamente diferente y, en su lugar, corrige el metabolismo anormal de la célula cancerosa.
¿Cómo trata el DCA el cáncer?
Interrumpe las reacciones químicas que los tumores utilizan para su rápido crecimiento, privando a las células cancerosas de nutrientes. Además, restaura el metabolismo «malo» de las células cancerosas. El DCA es un activador de las mitocondrias dañadas.
Como consecuencia de la estimulación de las mitocondrias, el DCA aumenta la producción de especies reactivas de oxígeno en la célula. Estos cambios inducen otros mecanismos celulares que conducen a la apoptosis, que en otras palabras es la muerte selectiva de las células tumorales. El resultado es una menor proliferación de las células cancerosas, una disminución del tamaño del tumor, un alivio de los síntomas y una mayor supervivencia del huésped. (Ref.)
El tratamiento con DCA transforma las células cancerosas más agresivas en otras menos agresivas. Dado que el efecto Warburg sólo está presente en las células malignas, las células sanas no se ven afectadas por el dicloroacetato de sodio.
¿Qué mejoras positivas cabe esperar?
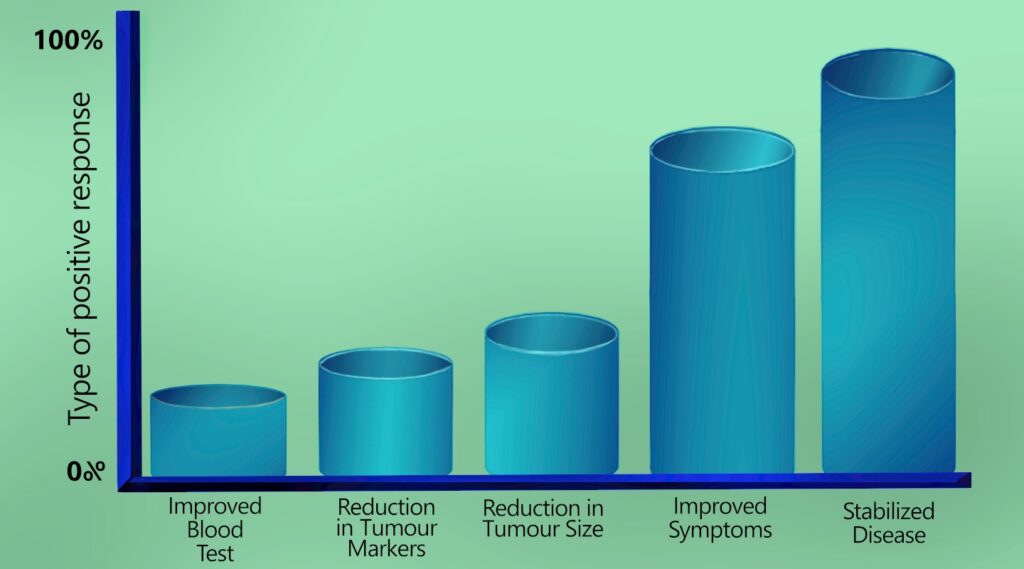
El DCA es excelente para estabilizar los tumores, lo que significa que dejan de crecer y expandirse. Esto también conlleva una mejora del bienestar y una reducción de los marcadores tumorales del paciente.
Las personas pueden esperar recuperar el apetito, la fuerza y el peso. El DCA también trata el dolor crónico que suele presentarse como complicación del desarrollo del cáncer.
Además, el dicloroacetato de sodio también es una opción para las personas con tumores cerebrales, ya que atraviesa la barrera hematoencefálica.
El Dr. A. Khan explica los beneficios del DCA en su excelente conferencia.
¿Cómo utilizar el DCA contra el cáncer?
El DCA debe utilizarse como agente único o en combinación con otros regímenes hasta que no haya evidencia de enfermedad (NED) en los pacientes con cáncer.
Incluso cuando el cáncer haya desaparecido, es aconsejable seguir utilizando el DCA para el cáncer durante al menos 5 años en dosis más bajas y realizar un cribado profiláctico una vez cada 3-6 meses. Si el cáncer desaparece incluso después de 5 años, el tratamiento con DCA puede utilizarse ocasionalmente en dosis bajas como profilaxis para asegurar que los tumores no reaparecen.
Terminaremos esta página lo antes posible. Mientras tanto, por favor utilice nuestra Dosis y uso del DCA (Guía rápida) o Dosis y uso del DCA (Guía larga).
Células cancerosas y resistencia al DCA. ¿Cómo superar este problema?
La molécula de dicloroacetato de sodio entra en la célula cancerosa a través de los transportadores SMCT1 (SLC5A8).
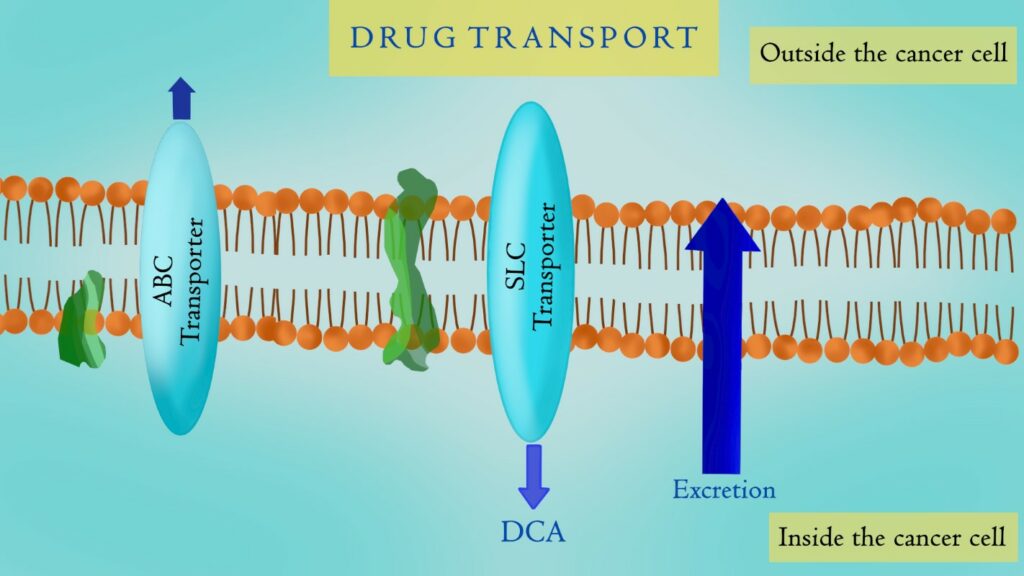
Por desgracia, a medida que el tejido tumoral se vuelve más maligno y desarrolla más mutaciones, la expresión del transportador SMCT1 disminuye. Por consiguiente, el DCA tiene más dificultades para penetrar en las células y producir su máximo efecto anticancerígeno. (Referencia)
Si se ha experimentado una mejora espectacular al principio del tratamiento del cáncer con DCA y después de algún tiempo el efecto ha disminuido, podría significar que el tumor ha desarrollado cierta resistencia farmacológica al DCA. Sin embargo, podría haber una solución práctica a este problema. (Ref.1), (Ref.2)
Diclofenaco 25 o 50 mg comprimidos por vía oral 1-2 veces al día puede conducir a la re-expresión de los transportadores de DCA. También sirve como fármaco antiinflamatorio y analgésico, lo que podría ayudar a los pacientes oncológicos a controlar el dolor físico.
El problema del Diclofenaco es que también suprime la barrera de la mucosa gástrica, lo que podría provocar que el ácido del estómago cause quemaduras o pequeñas erosiones. En casos más graves, puede provocar úlceras pépticas y hemorragias si se utiliza durante periodos prolongados.
La solución a este problema es el uso adicional de inhibidores de la bomba de protones como Omeprazol (Prisolec), Pantoprozol (Protonix), Lasonprazol (Prevacid) o Esomeprozol (Nexium) 20 mg una vez al día, 30 minutos antes del desayuno. Estos medicamentos reducen la secreción de ácido estomacal y previenen así los efectos secundarios más comunes asociados al Diclofenaco. (Ref.)
Además, existen pruebas que sugieren que el Omeprazol potencia el efecto del DCA. (Ref.)
El protocolo para superar la resistencia al DCA en tumores:
- Diclofenaco 25 ó 50 mg un comprimido una o dos veces al día, al menos 30 minutos antes del desayuno y/o la cena (total 25-100 mg al día). Cinco días a la semana, dos días de descanso. Reanudar.
- Omeprazol (idealmente), o Pantoprozol, o Lasonprazol, o Esomeprozol 40 mg una vez al día, al menos 30 minutos antes del desayuno, diariamente, sin descansos.
Ejemplos: A) Una persona de 160 lb sin dolor asociado al cáncer y con respuesta disminuida al tratamiento con DCA debe tomar Diclofenac 25 mg dos veces al día con Omeprazol 40 mg por la mañana. B) Una persona de 220 libras con dolor moderado asociado al cáncer y respuesta disminuida al tratamiento con DCA debe tomar Diclofenac 50 mg dos veces al día con Omeprazol 40 mg por la mañana.
*No debe utilizarse Diclofenaco si se tiene una función renal gravemente alterada, enfermedad hepática, antecedentes de erosiones o úlceras en el tracto gastrointestinal superior, hemorragias debidas a trastornos de la coagulación o asma.
*El omeprazol u otros inhibidores de la bomba de protones deben evitarse si la persona padece osteoporosis, una fractura ósea o lupus sistémico.
El ibuprofeno, el ketoprofeno, el fenoprofeno, el naproxeno, la indometacina, el resveratrol y la quercetina no se recomiendan con el protocolo DCA contra el cáncer, ya que tienden a empeorar el transporte de la molécula de DCA a las células cancerosas a través de la desactivación de los transportadores SMCT1. (Ref.1), (Ref.2)
La evidencia sugiere que tomar suplementos de vitamina E podría en realidad socavar los efectos anticancerígenos del DCA. (Ref.)
Esto se debe a que la procaína, cuyo uso no se recomienda para restaurar el SMCT1, tiene una escasa biodisponibilidad y sólo puede funcionar teóricamente en cultivos celulares de laboratorio. (Ref.1), (Ref.2)
Invalid slider ID or alias.