Минхао Ванг a, Куйвэй Ляо a,b, Ин Ху a, Вэньцинь Пан a, Цзюнь Цзян a,#
a Центр заболеваний молочной железы, Юго-западная больница, Третий военный медицинский университет, Чунцин, 400038, Китай
b Отделение радиологии, больница Синьцяо, Третий военный медицинский университет, Чунцин, 400038, Китай
Получено: 14 мая 2017 г.
Принято: Принято 17 мая 2017 г.
Доступно онлайн: 19 мая 2017 г
Аннотация
Химиотерапия по-прежнему является основной адъювантной стратегией в лечении рака, однако часто встречается и химиорезистентность. Ингибирование аутофагии было широко признано в качестве перспективной терапевтической стратегии при раке, однако отсутствие эффективных и специфических ингибиторов аутофагии препятствует ее применению. Здесь мы обнаружили, что дихлорацетат (DCA), небольшое молекулярное соединение, может значительно ингибировать аутофагию, индуцированную доксорубицином в клетках рака молочной железы. Кроме того, DCA заметно усиливает вызванную доксорубицином гибель клеток рака молочной железы и антипролиферацию in vitro. Но сенсибилизация к Dox от DCA была значительно снижена за счет индукции аутофагии рапамицином. Более того, комбинированная терапия Dox и DCA могла значительно подавить рост опухоли in vivo и продлить время выживания мышей. В целом, мы продемонстрировали, что DCA может ингибировать вызываемую доксорубицином аутофагию и предложить новую стратегию для повышения противораковой эффективности химиотерапии.
Ключевые слова: Дихлорацетат; рак молочной железы; аутофагия; химиотерапия
Основные сведения:
-Доксорубицин (Dox) индуцирует аутофагию в клетках рака молочной железы.
-DCA сенсибилизирует клетки MDA-MB-231 к Dox через ингибирование аутофагии.
-Индукция аутофагии рапамицином ослабляет сенсибилизирующее действие DCA на Dox.
-Синергетическое ингибирование роста опухоли у мышей, получавших Dox и DCA.
ВВЕДЕНИЕ
Рак молочной железы является одной из основных проблем здравоохранения во всем мире, а его распространенность и частота встречаемости заметно возросли за последние десятилетия. В настоящее время химиотерапия по-прежнему является основным методом лечения рака молочной железы. Между тем, рак молочной железы нечувствителен к обычной химиотерапии и лучевой терапии [1], [2].
Аутофагия включает в себя секвестрацию части цитоплазмина двухмембранных везикул — аутофагосом, которые затем сливаются с лизосомами для образования аутолизосом, в которых аутофагический груз деградирует под действием катаболических гидролаз. Аутофагия позволяет клеткам разрушать собственные белки и органеллы для поддержания клеточного гомеостаза, необходимого для нормального роста и развития, краткосрочной адаптации к стрессу, а также для долгосрочного выживания оптимально приспособленных клеток [3], [4], [5]. Нарушения аутофагии вовлечены в развитие многочисленных дегенеративных заболеваний, старения, включая рак [6], [7], [8], [9]. Примечательно, что аутофагия часто является про-выживательным ответом на химиотерапевтическое лечение в раковых клетках, и подавление аутофагии во время химиотерапии было предложено в качестве новой терапевтической стратегии [10].
Дихлорацетат (DCA) является небольшим ингибитором киназы пируватдегидрогеназы (PDK), которая активирует пируватдегидрогеназу (PDH) и увеличивает окисление глюкозы, способствуя притоку пирувата в цикл Кребса. Недавно он был продемонстрирован как перспективный нетоксичный антинеопластический агент, способствующий апоптозу клеток карциномы [11], [12]. Однако корреляция DCA и аутофагии в клетках рака молочной железы была неизвестна. В настоящем исследовании мы изучили влияние DCA на модуляцию аутофагии в клетках рака молочной железы человека. Мы впервые обнаружили, что DCA мощно ингибирует аутофагию в клетках MDB-231. Кроме того, мы исследовали влияние ингибирования аутофагии с помощью DCA на противораковую эффективность химиотерапевтических препаратов. Совместная обработка DCA заметно снижала жизнеспособность и увеличивала апоптоз в клетках, обработанных Dox, а сенсибилизирующая эффективность DCA значительно снижалась при обработке рапамицином. Синергетический эффект DCA и доксорубицина был дополнительно подтвержден in vivo на модели ксенотрансплантата мыши. Таким образом, наши результаты показывают, что ингибирование аутофагии с помощью DCA мощно усиливает эффективность Dox, и что такая комбинация может представлять собой новую терапевтическую стратегию для лечения рака молочной железы.
Материалы и методы
Культура клеток
Клеточная линия рака молочной железы человека MDA-MB-231 была получена из Американской коллекции типовых культур (ATCC, HTB-26) и поддерживалась в среде RPMI1640 (Hyclone). Среда была дополнена 10% фетальной бычьей сывороткой (Gibco) и 100 мг/мл стрептомицина (Gibco). Клетки культивировали в увлажненном инкубаторе с 95% воздуха и 5%CO2 при 37 °C.
Реагенты
Первичные кроличьи моноклональные антитела против LC3, P62 и β-актина были приобретены у компании Cell Signaling. Козьи анти-кроличьи IgG вторичные антитела были приобретены у Santa Cruz Biotechnology. FITC-аннексин V и PE-PI были получены от Biolegend. Для динамического мониторинга связанного с аутофагией белка LC3 методом иммунофлуоресценции использовали аденовирус с тандемной конструкцией EGFP-RFP-LC3. Набор для определения жизнеспособности клеток (МТТ) был приобретен у компании Sangon Biotech (Шанхай). Рапамицин был приобретен у Sigma-Aldrich, а доксорубицин — у Santa Cruz Biotechnology.
Вестерн-блот
Белки экстрагировали в буфере для лизиса после обработки препаратами и разделяли с помощью гель-электрофореза полиакриламидного сульфата натрия додецилсульфата (SDS-PAGE). Концентрацию белка измеряли с помощью набора для анализа белка BioRad™. Равные количества образцов белка электрофорезировали на 7%-12% SDS-PAGE мини-геле. Белки переносили на мембрану Immobilon PVDF при 100 В в течение 2 ч при 4 °C. Мембраны зондировали указанными первичными антителами в течение ночи при 4 °C, а затем инкубировали со вторичными антителами, связанными с пероксидазой редьки. Визуализация проводилась путем инкубации в течение 3 мин с буфером для обнаружения усиленной хемилюминесценции (100 мМ Трис-HCl pH 8,5, 1,25 мМ люминола, 0,2 мМ п-кумаровой кислоты и 0,03% H2O2), а интенсивность полос оценивалась с помощью программного обеспечения Image J.
Иммунофлуоресцентная микроскопия
Клетки высевали на покровные стекла в 24-луночный планшет. Перед экспериментом клетки инфицировали аденовирусом GFP-RFP-LC3. Через 24 ч среду заменяли, и клетки обрабатывали DCA еще 24 ч. Для иммуноокрашивания клетки фиксировали в 4% параформальдегиде в течение 15 мин и промывали. Клетки инкубировали с DAPI в течение 5 мин, затем промывали PBS. Покровные пластины монтировали на предметные стекла с помощью монтажной среды Vectashield. Изображения получали с помощью конфокального микроскопа LSM780NLO (Carl Zeiss MicroImaging) и обрабатывали с помощью программного обеспечения, предоставленного производителем.
Анализ жизнеспособности клеток (МТТ)
Клетки высевали в 96-луночные планшеты и обрабатывали, как указано, в течение 24 ч. Затем добавляли 10 мкл МТТ (5 мг/мл) на лунку и инкубировали в течение 4 ч. В каждую лунку добавляли 100
ДМСО для растворения формазана перед измерением с помощью микропланшетного ридера при 490 нм. Жизнеспособность клеток была нормализована по отношению к контрольной группе.
Проточная цитометрия
Степень апоптоза определяли методом проточнойцитометрии. Клетки собирали, промывали и инкубировали с окрашиванием аннексином V в течение 45 мин. Перед анализом методом проточной цитометрии добавляли окрашивание йодистым пропидием.
Статистический анализ
Данные анализировали с помощью статистического программного обеспечения SPSS 21.0. Данные измерений выражали в среднем ± стандартное отклонение. Для сравнения нормального распределения использовался t-тест. Односторонний дисперсионный анализ (ANOVA) использовался для сравнения между группами. Данные подсчета были выражены в процентах и проверены с помощью теста хи-квадрат. P < 0,05 считалось статистически значимым.
Результаты
Лечение Dox индуцировало аутофагию в клетках рака молочной железы
Недавние исследования показали, что аутофагия опухолевых клеток может быть индуцирована во время химиотерапии [8], [13]. Чтобы определить, влияет ли Dox на аутофагию в клетках рака молочной железы человека, накопление аутофагосом после инфицирования аденовирусом EGFP-RFP-LC3 было обнаружено с помощью конфокального лазерного сканирующего микроскопа. Как показано на рис. 1A-B, обработка клеток препаратом Dox в течение 24 ч приводила к заметному увеличению образования пунктов RFP-LC3 в клетках MDA-MB-231 (p < 0,05). Затем мы исследовали влияние Dox на конверсию классического белка аутофагии LC3B и P62 в клетках MDA-MB-231. Вестерн-блот анализ показал, что обработка Dox в течение 24 ч привела к накоплению LC3B-II и снижению P62 (белок рецептора связывания убиквитина) в дозо- (рис. 1С-Е) и время-зависимой манере (рис. 1F-H) (p < 0,05). Эти результаты показали, что Dox способен индуцировать аутофагию в клетках MDA-MB-231.
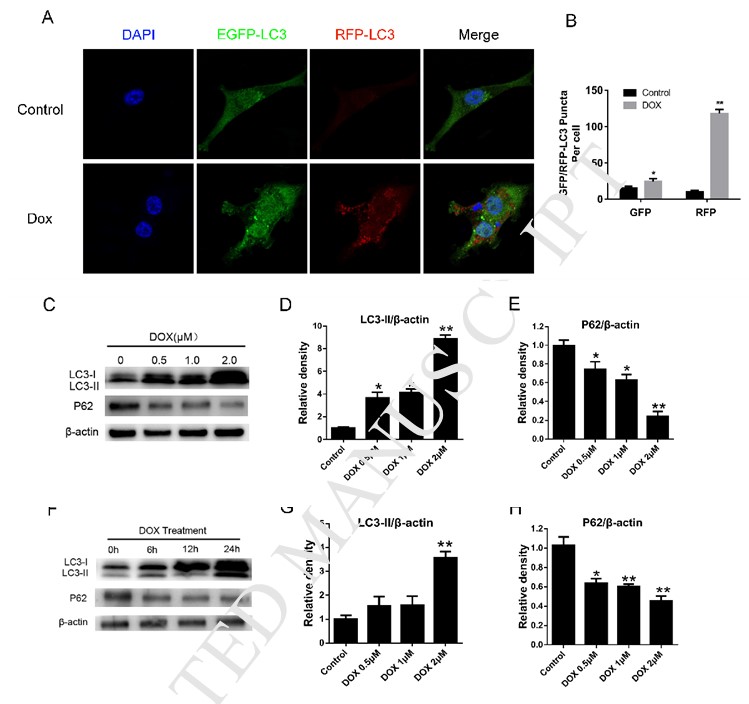
DCA сенсибилизирует вызванную доксорубицином гибель клеток через ингибирование аутофагии
Чтобы изучить влияние обработки DCA на лекарственную чувствительность клеток MDA-MB-231 к Dox, мы определили апоптоз клеток MDA-MB-231 после обработки Dox с или без DCA. Как показано на рис. 2A-B, обработка клеток MDA-MB-231 различными концентрациями Dox и DCA в течение 24 ч вызывала более высокий уровень апоптоза по сравнению с обработкой только Dox, как показано с помощью FACS (p < 0,05). Результаты эксперимента по пролиферации показали, что DCA оказывал синергетический эффект на антипролиферативное действие Dox с временной точки 24 ч (рис. 2C-D). Считается, что ингибирование аутофагии в опухолевых клетках повышает чувствительность химиотерапевтических препаратов [8], [13], [14]. Далее, чтобы определить, может ли DCA влиять на аутофагию, индуцированную Dox в клетках MDA-MB-231, мы исследовали изменение уровня белков аутофагии с помощью непрямого иммунофлуоресцентного анализа и вестерн-блоттинга. Обработка клеток Dox или рапамицином приводила к заметному увеличению образования RFP-LC3-пунктов в клетках MDA-MB-231, которое значительно снижалось при совместной обработке DCA (рис. 1A, рис. 2E-F). Хотя уровень LC3-II повышался после лечения Dox, но уровень LC3-II был наиболее ослаблен после комбинированного лечения Dox и DCA, а уровень белка P62 значительно повышался после совместного лечения (рис. 2G-I). Все эти результаты показали, что DCA повышает лекарственную чувствительность клеток MDA-MB-231 к Dox через ингибирование аутофагии in vitro.
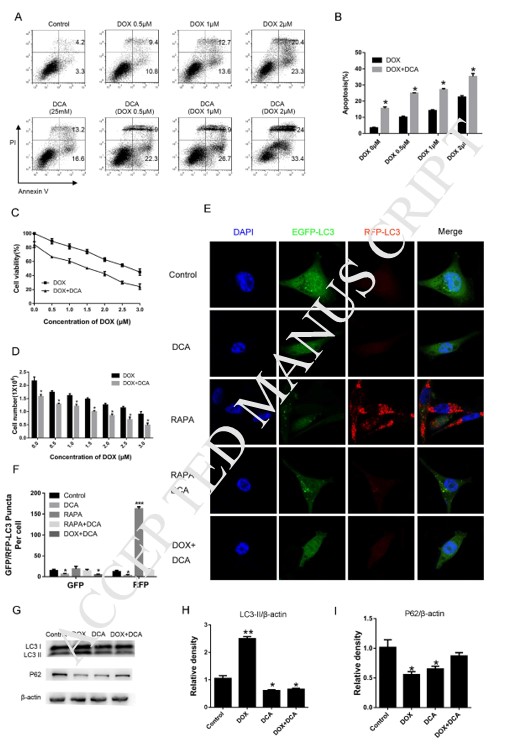
Индуцирование аутофагии рапамицином снижало лекарственную чувствительность DCA и Dox
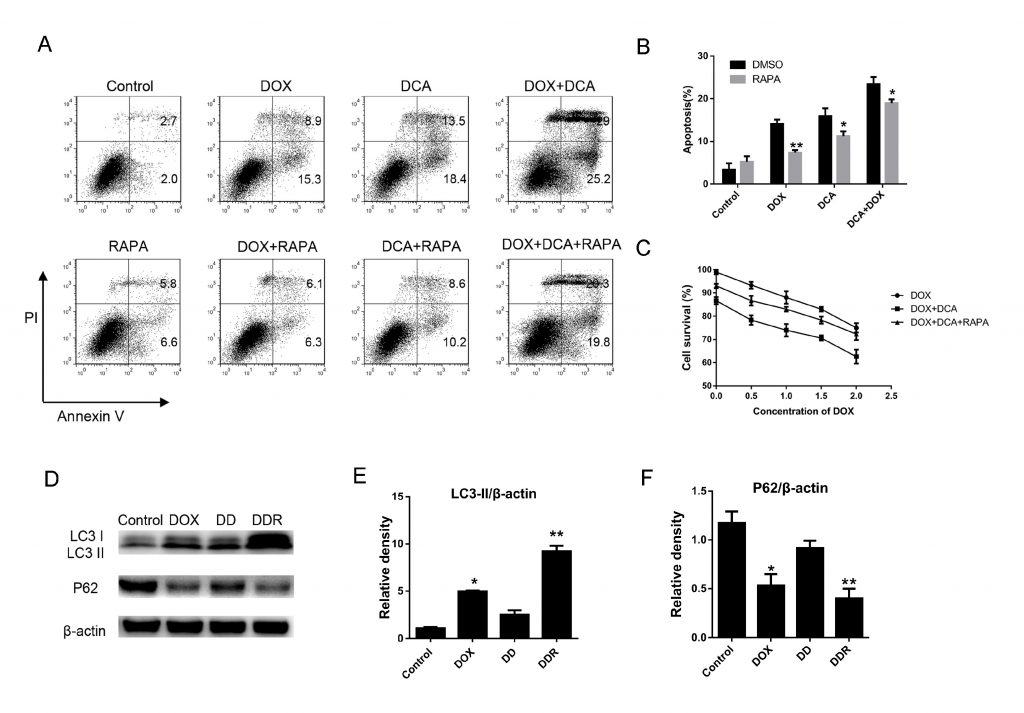
Для дальнейшего подтверждения того, что ингибирование аутофагии DCA может улучшить эффект комбинированной химиотерапии, для индукции аутофагии использовали рапамицин, классический ускоритель аутофагии. Как показано на рис. 3 A-B, хотя уровень апоптоза значительно увеличился после совместного лечения Dox и DCA по сравнению с лечением только Dox, но уровень апоптоза заметно снизился после комбинированного лечения рапамицином (p < 0,05). Результаты МТТ-эксперимента показали, что рапамицин оказывает антагонистическое действие на антипролиферативное действие Dox и DCA с 24-часовой временной точки (p < 0,05) (рис. 3C). Результаты показали, что уровень LC3-II был заметно повышен, а полоса p62 была значительно снижена в группе DDR (Докс, ДКА и рапамицин) по сравнению с группой, получавшей ДД (Докс и ДКА) (рис. 3D-F). Эти результаты дополнительно подтвердили, что DCA сенсибилизирует вызванный доксорубицином апоптоз клеток MDA-MB-231 через ингибирование аутофагии.
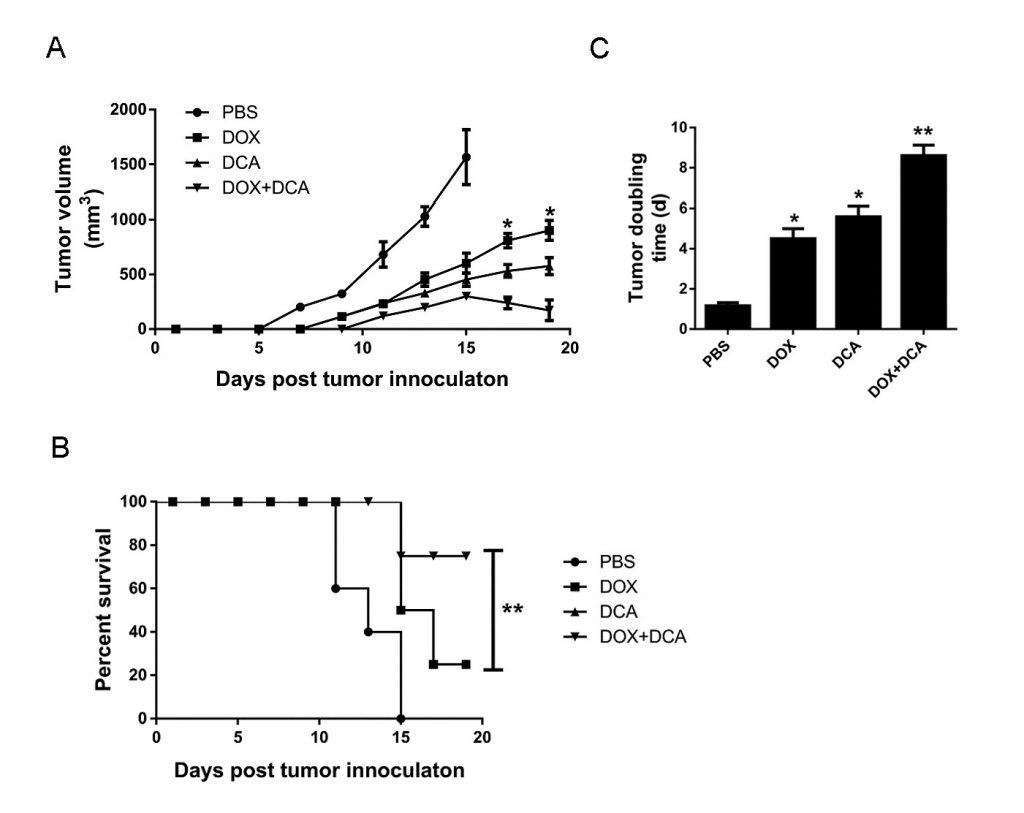
In vivo ингибирование аутофагии с помощью DCA потенцирует противораковую способность Dox
Учитывая, что Dox вызывает больше клеточной гибели после ингибирования аутофагии, мы оценили потенциал комбинированной терапии Dox и DCA in vivo. Когда опухоль была пальпируемой, животные получали: (1) PBS, (2) Dox, (3) DCA и (4) Dox плюс DCA. Как показано на рис. 4A-B, хотя лечение только Dox или DCA показало некоторое ингибирующее действие на рост опухоли по сравнению с PBS. Однако комбинированное лечение Dox и DCA значительно подавляло рост опухоли и увеличивало время выживания мышей (p < 0,05). Как показано на рис. 4C, время удвоения опухоли значительно увеличилось с 4,65 дней (ДИ, 4,17-5,85 дней) в группе Dox до 8,80 дней (ДИ, 7,33-10,3 дней) в группе Dox плюс DCA (p < 0,05).
Обсуждение
Химиотерапия по-прежнему является основной стратегией лечения рака, однако толерантность к ней всегда развивается в течение короткого периода времени. Поэтому современные исследования направлены на поиск новых способов сенсибилизации или отсрочки лекарственной устойчивости. В настоящее время ведущим является мнение, что раковая клетка может переносить стресс извне и гипоксию путем регуляции аутофагии.
Аутофагия — это физиологическое поведение, направленное на поддержание клеточного гомеостаза, в ходе которого старые или дефектные белки, органеллы и другие клеточные компоненты доставляются в лизосому для деградации и переработки [15], [16]. За последние несколько лет было проведено множество исследований, в которых предпринимались попытки связать аутофагию с раком и терапией рака [8], [13], [17]. Высказывались мнения, что большинство противораковых препаратов, а также ионизирующее излучение или таргетные препараты индуцируют аутофагию опухолевых клеток во время лечения [18], [19], [20]. Ингибирование аутофагии в опухолевой клетке рассматривалось как стратегия сенсибилизации химиотерапии и радиотерапии [8], [21], [22]. Хотя ингибирование аутофагии в опухолевой клетке было широко признано в качестве перспективного терапевтического проекта при раке, отсутствие эффективных и специфических ингибиторов аутофагии препятствует его применению. Хлорохин и гидроксихлорохин являются единственными двумя ингибиторами аутофагии, одобренными FDA. Недавно было проведено несколько клинических исследований I/II фазы с применением ингибирования аутофагии с использованием хлорохина или гидроксихлорохина в комбинации с химиотерапией для лечения различных онкологических заболеваний, включая рак молочной железы [13], [23]. Поэтому разработка нового типа ингибитора аутофагии для лечения рака имеет важное клиническое значение. DCA, способный ингибировать критический фермент киназу пируватдегидрогеназы (PDK), приводит к изменению митохондриального дыхания опухолевой клетки и апоптозу [11]. На сегодняшний день нет данных о том, участвует ли DCA в регуляции аутофагии в клетках рака молочной железы. В настоящем исследовании мы приводим доказательства того, что DCA обладает способностью ингибировать аутофагию и заметно усиливает гибель клеток рака молочной железы, вызванную химиотерапевтическими препаратами. Однако сенсибилизация к Dox, вызванная DCA, была значительно снижена при обработке рапамицином. Насколько нам известно, это первое сообщение, демонстрирующее эффективность ингибирования аутофагии с помощью DCA в сочетании с доксорубицином в клетках рака молочной железы in vitro и invivo. Однако мы не знали, может ли DCA ингибировать аутофагию, вызванную другими химиотерапевтическими препаратами, поэтому необходимо продолжить исследования, связанные с универсальностью DCA.
В целом, настоящие результаты показывают, что ингибирование аутофагии с помощью DCA усиливает апоптоз, опосредованный доксорубицином, и открывает новые перспективы для поиска ингибиторов аутофагии для комбинированной химиотерапии. Наши результаты показывают, что DCA потенциально может быть разработан в качестве ингибитора аутофагии, а комбинация DCA с классическими химиотерапевтическими препаратами может представлять собой новую терапевтическую стратегию для лечения рака молочной железы.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Благодарность
Эта работа была поддержана проектом, принадлежащим Юго-Западной больнице [cstc2015shms-ztzx10005].
ССЫЛКИ
1 Ferlay J, Soerjomataram I, Dikshit R, Eser S, Mathers C, Rebelo M, Parkin DM, Forman D and Bray F. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer 2015; 136: E359-386.
2 Siegel RL, Miller KD and Jemal A. Cancer Statistics, 2017. CA Cancer J Clin 2017; 67: 7-30.
3 Jiang X, Overholtzer M and Thompson CB. Autophagy in cellular metabolism and cancer. J Clin Invest 2015; 125: 47-54.
4 Klionsky DJ and Emr SD. Аутофагия как регулируемый путь клеточной деградации. Science 2000; 290: 1717-1721.
5 Mizushima N и Komatsu M. Аутофагия: обновление клеток и тканей. Cell 2011; 147: 728-741.
6 Hara T, Nakamura K, Matsui M, Yamamoto A, Nakahara Y, Suzuki-Migishima R, Yokoyama M, Mishima K, Saito I, Okano H and Mizushima N. Suppression of basal autophagy in neural cells causes neurodegenerative disease in mice. Nature 2006; 441: 885-889.
7 Hardie DG. Клеточная биология. Почему голодающие клетки едят сами себя. Science 2011; 331: 410-411.
8 Mathew R, Karantza-Wadsworth V and White E. Role of autophagy in cancer. Nat Rev Cancer 2007; 7: 961-967.
9 Rubinsztein DC, Marino G and Kroemer G. Autophagy and aging. Cell 2011; 146: 682-695.
10 Rubinsztein DC, Codogno P и Levine B. Модуляция аутофагии как потенциальная терапевтическая мишень для различных заболеваний. Nat Rev Drug Discov 2012; 11: 709-730.
11 Bonnet S, Archer SL, Allalunis-Turner J, Haromy A, Beaulieu C, Thompson R, Lee CT, Lopaschuk GD, Puttagunta L, Bonnet S, Harry G, Hashimoto K, Porter CJ, Andrade MA, Thebaud B and Michelakis ED. Ось митохондрий-K+ каналов подавляется при раке, и ее нормализация способствует апоптозу и подавляет рост рака. Cancer Cell 2007; 11: 37-51.
12 Cao W, Yacoub S, Shiverick KT, Namiki K, Sakai Y, Porvasnik S, Urbanek C and Rosser CJ. Дихлорацетат (DCA) сенсибилизирует клетки рака простаты как дикого типа, так и экспрессирующие Bcl-2 in vitro к радиации. Prostate 2008; 68: 1223-1231.
13 Janku F, McConkey DJ, Hong DS и Kurzrock R. Autophagy as a target for anticancer therapy. Nat Rev Clin Oncol 2011; 8: 528-539.
14 Kondo Y, Kanzawa T, Sawaya R and Kondo S. The role of autophagy in cancer development and response to therapy. Nat Rev Cancer 2005; 5: 726-734.
15 Mizushima N. Аутофагия: процесс и функция. Genes Dev 2007; 21: 2861-2873.
16 Ravikumar B, Sarkar S, Davies JE, Futter M, Garcia-Arencibia M, Green-Thompson ZW, Jimenez-Sanchez M, Korolchuk VI, Lichtenberg M, Luo S, Massey DC, Menzies FM, Moreau K, Narayanan U, Renna M, Siddiqi FH, Underwood BR, Winslow AR and Rubinsztein DC. Регуляция аутофагии млекопитающих в физиологии и патофизиологии. Physiol Rev 2010; 90: 1383-1435.
17 Kondo Y and Kondo S. Autophagy and cancer therapy. Autophagy 2006; 2: 85-90.
18 Degenhardt K, Mathew R, Beaudoin B, Bray K, Anderson D, Chen G, Mukherjee C, Shi Y, Gelinas C, Fan Y, Nelson DA, Jin S and White E. Autophagy promotes tumor cell survival and restricts necrosis, inflammation, and tumorigenesis. Cancer Cell 2006; 10: 51-64.
19 Kim DG, Jung KH, Lee DG, Yoon JH, Choi KS, Kwon SW, Shen HM, Morgan MJ, Hong SS and Kim YS. 20(S)-Гинзенозид Rg3 является новым ингибитором аутофагии и сенсибилизирует гепатоцеллюлярную карциному к доксорубицину. Oncotarget 2014; 5: 4438-4451.
20 Manov I, Pollak Y, Broneshter R and Iancu TC. Ингибирование индуцированной доксорубицином аутофагии в клетках гепатоцеллюлярной карциномы Hep3B сорафенибом — роль противодействия внеклеточной сигнал-регулируемой киназы. FEBS J 2011; 278: 3494-3507.
21 Chen K and Shi W. Autophagy regulates resistance of non-small cell lung cancer cells to paclitaxel. Tumour Biol 2016; 37: 10539-10544.
22 Zhou J, Li G, Zheng Y, Shen HM, Hu X, Ming QL, Huang C, Li P and Gao N. A novel autophagy/mitophagy inhibitor liensinine sensitizes breast cancer cells to chemotherapy through DNM1L-mediated mitochondrial fission. Autophagy 2015; 11: 1259-1279.
23 Kimura T, Takabatake Y, Takahashi A and Isaka Y. Chloroquine in cancer therapy: a double-edged sword of autophagy. Cancer Res 2013; 73: 3-7.
Связанный контент: