Akbar Khan, Doug Andrews, Jill Shainhouse, Anneke C Blackburn
Akbar Khan, Douglas Andrews, Medicor Cancer Centres Inc., Toronto, ON M2N 6N4, Canadá
Jill Shainhouse, Insight Naturopathic Clinic, Toronto, ON M4P 1N9, Canadá
Anneke C Blackburn, The John Curtin School of Medical Research, The Australian National University, Canberra, ACT 2601, Australia
Contribución de los autores: Khan A trató al paciente y redactó la mayor parte del informe del caso; Andrews D colaboró en el desarrollo del protocolo de medicación natural para la reducción de los efectos secundarios del DCA, y redactó una parte del informe del caso; Shainhouse J trató al paciente con terapia natural; Blackburn AC interpretó el informe del caso en el contexto de la literatura sobre la investigación del DCA in vitro e in vivo, redactó partes de la introducción y la discusión, y revisó el manuscrito en general.
Declaración de consentimiento informado: La paciente descrita en este manuscrito ha dado su consentimiento para publicar su caso de forma anónima.
Declaración de conflicto de intereses: Uno de los autores (Khan) administra la terapia con dicloroacetato a pacientes con cáncer a través de Medicor Cancer Centres a coste cero y sin ánimo de lucro. La clínica es propiedad de un familiar de este autor. Los demás autores no tienen nada que revelar.
Acceso abierto: Este artículo es un artículo de acceso abierto que fue seleccionado por un editor interno y revisado en su totalidad por revisores externos. Se distribuye de acuerdo con la licencia Creative Commons Reconocimiento No Comercial (CC BY-NC 4.0), que permite a otros distribuir, remezclar, adaptar, construir sobre esta obra sin fines comerciales, y licenciar sus obras derivadas en diferentes términos, siempre que la obra original se cite adecuadamente y el uso sea no comercial. Véase: http://creativecommons.org/licenses/by-nc/4.0/
Fuente del manuscrito: Manuscrito invitado
Correspondencia a: Akbar Khan, MD, Director Médico,
Medicor Cancer Centres Inc., 4576 Yonge St., Suite 301, Toronto,
ON M2N 6N4, Canadá. [email protected]
Teléfono: +1-416-2270037
Fax: +1-416-2271915
Recibido: 30 de enero de 2017
Revisión por pares iniciada: 12 de febrero de 2017
Primera decisión: 28 de marzo de 2017
Revisado: 5 de mayo de 2017
Aceptado: 30 de mayo de 2017
Artículo en prensa: 31 de mayo de 2017
Publicado en línea: 10 de agosto de 2017
Resumen
El dicloroacetato de sodio (DCA) se ha estudiado como terapia metabólica contra el cáncer desde 2007, a partir de una publicación de Bonnet et al que demostró que el DCA puede inducir apoptosis (muerte celular programada) en células humanas de cáncer de mama, pulmón y cerebro. Clásicamente, la respuesta del cáncer a una terapia médica en la investigación humana se mide por las definiciones del Criterio de Evaluación de la Respuesta para Tumores Sólidos, que definen la «respuesta» por el grado de reducción del tumor, o la desaparición del tumor en las imágenes, sin embargo, la estabilización de la enfermedad es también un resultado clínico beneficioso. Se ha demostrado que el DCA puede funcionar como agente citostático in vitro e in vivo, sin causar apoptosis. Se presenta el caso de un varón de 32 años en el que la terapia con DCA, sin terapia convencional concurrente, produjo la regresión y estabilización del melanoma metastásico recurrente durante más de 4 años, con efectos secundarios triviales. Este caso demuestra que el DCA puede utilizarse para reducir el volumen de la enfermedad y mantener la estabilidad a largo plazo en pacientes con melanoma avanzado.
Palabras clave: Dicloroacetato; Cáncer; BRAF; Melanoma; Citostático
© El autor (es) 2017. Publicado por Baishideng Publishing Group Inc. Todos los derechos reservados.
Consejo básico: El dicloroacetato de sodio (DCA) se ha estudiado como terapia metabólica contra el cáncer desde 2007. Se ha demostrado que la terapia con DCA puede dar lugar a una respuesta clásica que se mide por la reducción o desaparición de tumores en las imágenes. Sin embargo, el DCA también puede detener el crecimiento de las células cancerosas sin causar apoptosis (efecto citostático). Esto puede dar lugar a una estabilización a largo plazo del cáncer metastásico. Presentamos un caso de terapia oral con DCA que resultó en la reducción y estabilización del melanoma metastásico en un varón de 32 años durante más de 4 años, con sólo efectos secundarios menores….
Khan A, Andrews D, Shainhouse J, Blackburn AC. Estabilización a largo plazo del melanoma metastásico con dicloroacetato de sodio.
World J Clin Oncol 2017; 8(4): 371-377
Disponible en: URL: http://www.wjgnet.com/2218-4333/full/v8/i4/371.htm
DOI: http://dx.doi.org/10.5306/wjco.v8.i4.371
INTRODUCCIÓN
El dicloroacetato sódico (DCA) llamó la atención de la comunidad médica en 2007, cuando Bonnet et al[ 1] publicaron el primer estudio in vitro e in vivo que ilustraba el valor del DCA como terapia metabólica del cáncer, a través de su acción inhibidora sobre la enzima mitocondrial piruvato deshidrogenasa quinasa. Anteriormente, Stacpoole et al[2-4] habían publicado varios estudios sobre el DCA para el tratamiento de la acidosis láctica congénita en enfermedades mitocondriales[2-5]. Estos estudios demostraron que el DCA oral es un fármaco seguro para uso humano. Se observó que el DCA carecía de toxicidad renal, pulmonar, de médula ósea y cardiaca[4]. La mayoría de los efectos secundarios del DCA fueron moderados, siendo el más grave la neuropatía periférica reversible[6]. También se ha notificado delirio reversible[7]. Se ha observado una elevación de las enzimas hepáticas (asintomática y reversible) en un pequeño porcentaje de pacientes[3]. La investigación previa en humanos sobre trastornos mitocondriales ha permitido la rápida traslación del DCA al uso humano como terapia contra el cáncer fuera de indicación. En la actualidad se han publicado varios informes de ensayos clínicos con DCA como terapia contra el cáncer, que confirman su perfil de seguridad e indican un reconocimiento cada vez mayor de la utilidad potencial del DCA en la clínica del cáncer[8-11]. Una limitación de estos estudios con pacientes en estadios avanzados es que sólo han informado sobre el tratamiento durante periodos cortos de tiempo.
En la publicación de Bonnet de 2007[1], se demostró que el tratamiento con DCA reducía el potencial de membrana mitocondrial, lo que promovía la apoptosis de forma selectiva en células cancerosas humanas. La inhibición de la glucólisis aeróbica (el efecto Warburg) y la activación del canal iónico de potasio mitocondrial se identificaron como los mecanismos de acción del DCA. Otras investigaciones del DCA in vitro han confirmado la actividad anticancerígena contra una amplia gama de tipos de cáncer, que han sido revisados recientemente por Kankotia y Stacpoole[12]. Además, el DCA también es capaz de potenciar la apoptosis cuando se combina con otros agentes[13-15]. También se han sugerido otras acciones anticancerígenas del DCA, incluyendo la inhibición de la angiogénesis[16], la alteración de la expresión de HIF1-α[17], la alteración de los reguladores del pH celular V-ATPasa y MCT1, y otros reguladores de la supervivencia celular como p53 y PUMA[18]. Sin embargo, muchos estudios in vitro utilizan concentraciones irrazonablemente altas de DCA que no son clínicamente alcanzables, en un esfuerzo por mostrar actividad citotóxica[12]. En otros estudios, se utilizaron concentraciones de DCA más modestas, demostrando que el DCA podría ser citostático. El segundo informe en 2010 sobre su actividad anticancerígena in vivo descubrió que el DCA solo era citostático en un modelo metastásico de cáncer de mama[19], inhibiendo la proliferación sin desencadenar la apoptosis. Esto sugiere un papel del DCA como estabilizador del cáncer, similar al de los inhibidores de la angiogénesis.
En respuesta al informe de 2007 sobre las acciones anticancerígenas del DCA, Khan empezó a utilizar DCA para el tratamiento de pacientes con cáncer de pronóstico corto o que habían dejado de responder a las terapias convencionales contra el cáncer. Se desarrolló un protocolo de medicación natural en colaboración con un médico naturópata (Andrews) para tratar la toxicidad neurológica del DCA que limitaba la dosis. Constaba de 3 medicamentos: Acetil L-carnitina[20-22], ácido R-alfa lipoico[23-25] y benfotiamina[26-28], para la prevención de la neuropatía y la encefalopatía. En más de 300 pacientes con cáncer en estadio avanzado, los datos observacionales revelaron que la terapia con DCA benefició al 60%-70% de los casos. El riesgo de neuropatía cuando se combinaron medicamentos neuroprotectores naturales con DCA fue de aproximadamente el 20% utilizando una dosis de 20-25 mg/kg al día en un ciclo de 2 semanas de inicio/1 semana de finalización (datos de observación clínica publicados en línea en www.medicorcancer.com). Aquí se presenta el caso de un paciente que ilustra los efectos apoptóticos y antiproliferativos del tratamiento crónico con DCA durante un periodo de más de cuatro años.
CASO CLÍNICO
Un varón de 32 años, previamente sano y de piel clara, notó inicialmente que un lunar en su pantorrilla izquierda empezó a cambiar en 2006. Consultó a un médico y se le extirpó el lunar. Se realizó un diagnóstico patológico de melanoma. Se realizó una disección del ganglio centinela, que resultó negativa para enfermedad metastásica. En 2007, el paciente notó un aumento de tamaño de los ganglios linfáticos inguinales izquierdos y pequeñas lesiones melanocíticas en la piel de la pierna izquierda. Fue tratado con interferón alfa en el marco de un ensayo clínico en un hospital oncológico regional, con reducción de los ganglios y resolución de las metástasis cutáneas. El interferón se suspendió al cabo de 9 meses debido a los efectos secundarios.
La paciente permaneció bien hasta 2010, cuando apareció una nueva metástasis cutánea en la pierna izquierda. Se extirpó quirúrgicamente. A finales de 2011, se identificó otra nueva metástasis cutánea en la pierna izquierda, dentro de la cicatriz de la cirugía original del melanoma. Se realizó una biopsia y se confirmó el diagnóstico de melanoma recurrente. Se le trató con una escisión amplia e injerto de piel.
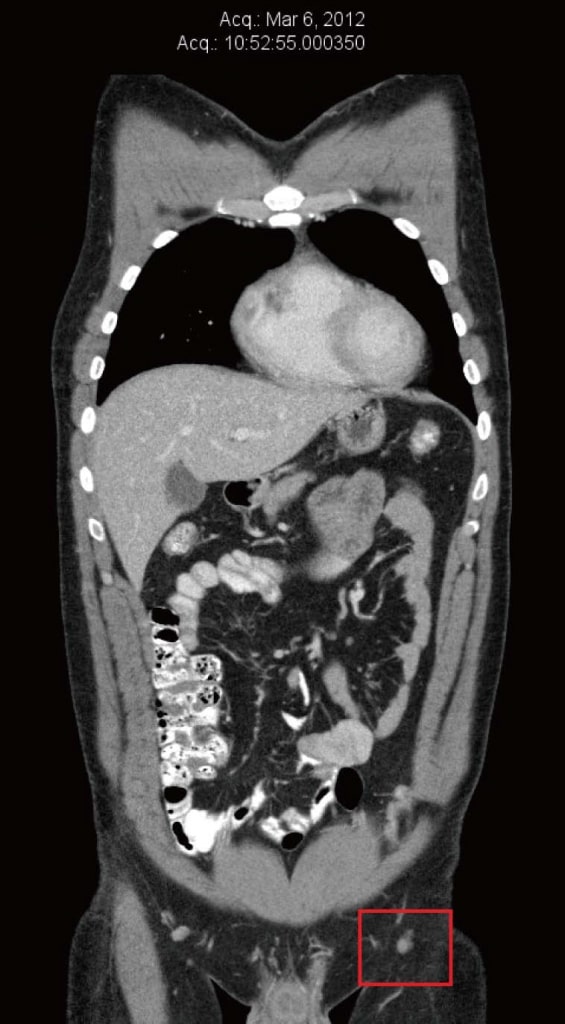
En marzo de 2012, se le diagnosticó una recidiva en el injerto de piel de la pierna izquierda. Se extirpó y se realizó un nuevo injerto cutáneo. La anatomía patológica reveló márgenes positivos de la metástasis extirpada, por lo que se realizó una nueva escisión, de nuevo con márgenes positivos. Al mismo tiempo, la biopsia con aguja de un ganglio linfático inguinal izquierdo confirmó la presencia de un melanoma metastásico BRAF positivo. Una tomografía computarizada (TC) realizada en marzo de 2012 no reveló indicios de metástasis a distancia. El ganglio inguinal izquierdo de mayor tamaño tenía 8 mm de diámetro, que se notificó como «insignificante según criterios de tamaño» (figura 1).
En abril de 2012, la paciente consultó a un médico naturópata (Shainhouse) y comenzó una terapia con los siguientes agentes anticancerígenos naturales orales: Compuesto correlacionado de hexosa activa o AHCC (extracto de hongo)[29], raíz de diente de león[30], curcumina[31] y raíz de astrágalo[32]. También se inició una terapia parenteral, que consistía en vitamina C intravenosa dos veces por semana[33] y extracto de muérdago europeo subcutáneo[34]. La paciente también cambió a una dieta vegana.
En mayo de 2012, el paciente acudió a la clínica del autor (Khan) en busca de terapias no tradicionales adicionales. Se habló de la terapia con DCA, pero el paciente decidió probar primero las terapias naturales contra el cáncer (prescritas por Shainhouse). En mayo de 2012 se volvió a realizar un TAC (tras solo 1 mes de terapia natural) que indicó un crecimiento leve de múltiples ganglios inguinales e ilíacos externos, con tamaños que oscilaban entre 10 mm × 11 mm y 14 mm × 15 mm.
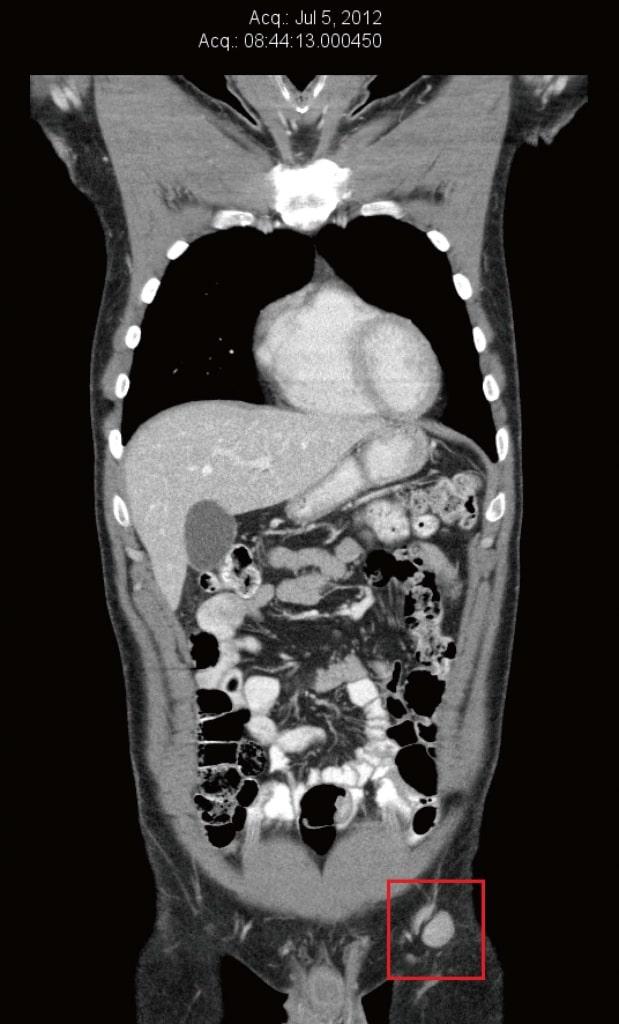
En julio de 2012, se repitió la tomografía computarizada para evaluar las terapias naturales contra el cáncer de la paciente. En ese momento, los ganglios inguinales y ilíacos externos izquierdos habían vuelto a aumentar de tamaño, y oscilaban entre 13 mm × 16 mm y 22 mm × 20 mm (figura 2). También se realizó una PET como preparación para entrar en un ensayo clínico en Boston, MA (Estados Unidos), y confirmó el aumento de la captación de glucosa en los ganglios inguinales izquierdos. Había un nuevo dolor de baja intensidad (2/10) en la región inguinal izquierda. La exploración reveló un ganglio linfático inguinal izquierdo no sensible de 20 mm y dos pequeñas metástasis cutáneas en el injerto de piel de la pantorrilla izquierda.
El paciente fue diagnosticado de progresión de la enfermedad. En ese momento decidió iniciar la terapia con DCA. Comenzó con DCA oral 500 mg 3 veces al día, lo que equivalía a 17 mg/kg al día (fabricante: Tokyo Chemical Industry, Estados Unidos) además de mantener las otras terapias naturales. El ciclo de tratamiento con DCA fue de 2 semanas sí y 1 semana no. Para minimizar la aparición de efectos secundarios del DCA, se prescribieron 3 medicamentos naturales adicionales: Acetil L-carnitina oral 500 mg 3 veces al día, benfotiamina oral 80 mg 2 veces al día y ácido R-alfa lipoico oral 150 mg 3 veces al día. Estos suplementos se tomaron a diario (sin ciclo). Se realizaron análisis de sangre basales rutinarios (Tabla 1). Todos eran normales, excepto un nivel bajo de creatinina que se consideró insignificante.
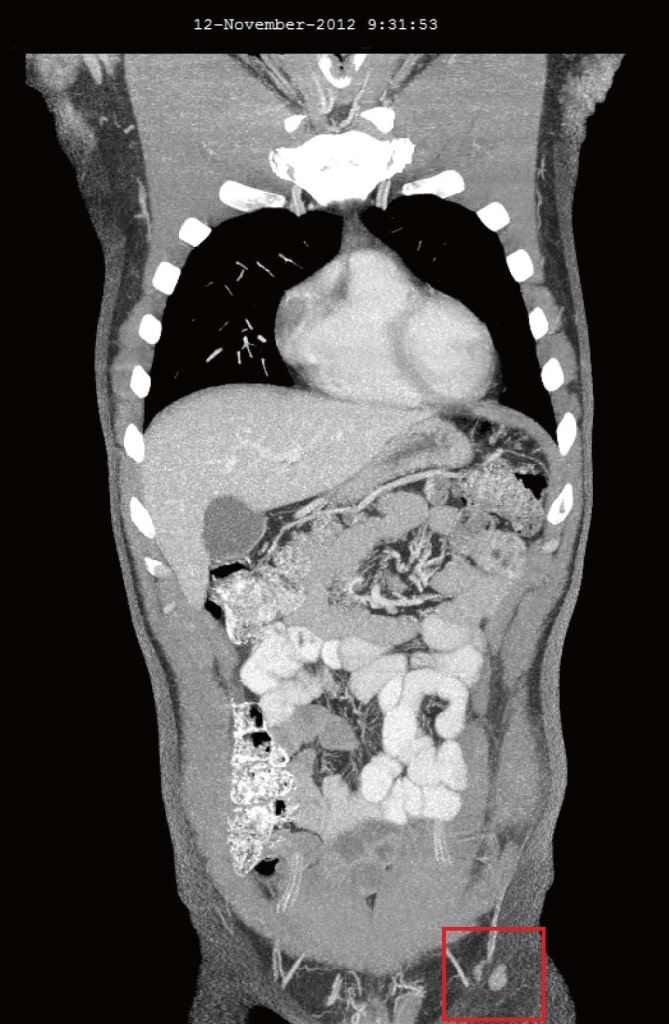
En noviembre de 2012, 4 meses después de la adición de DCA a sus terapias anticancerígenas naturales originales, se volvió a evaluar al paciente. Se sentía bien en general. Se informó de dos nuevos síntomas que habían comenzado sólo después del inicio de la terapia con DCA: Leve disminución de la sensibilidad en las puntas de los dedos de las manos y de los pies, y leve disminución de la capacidad de concentración durante las 2 semanas en las que estuvo tomando DCA. La pérdida sensorial leve no empeoraba y se consideraba una neuropatía leve relacionada con el DCA. Tanto el entumecimiento como la disminución de la concentración se resolvieron durante las semanas en las que el paciente dejó de tomar DCA. El análisis de sangre de octubre de 2012 no mostró cambios significativos (Tabla 1). Las tomografías computarizadas de agosto de 2012 y noviembre de 2012 revelaron una regresión significativa de todos los ganglios linfáticos previamente agrandados. El ganglio más grande era de 10 mm, y no había evidencia de enfermedad intratorácica o intraabdominal, ni metástasis óseas (Figura 3).
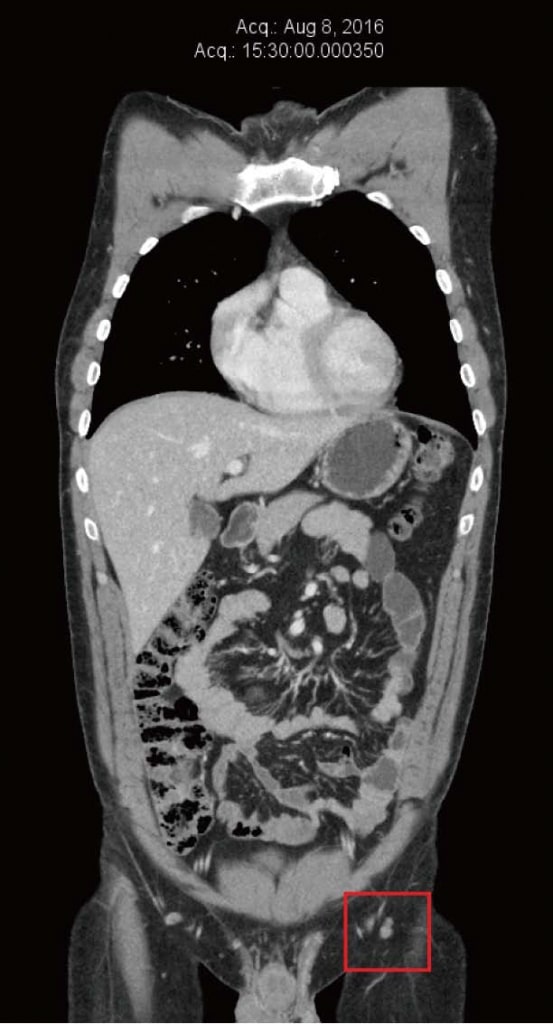
El paciente continuó sintiéndose bien con la terapia de DCA, y no notó nuevas metástasis cutáneas ni nuevo agrandamiento de los ganglios inguinales. Siguió teniendo un control clínico frecuente con su médico naturópata (Shainhouse), y un seguimiento anual con su médico (Khan). Las terapias naturales anticancerígenas enumeradas (prescritas por Shainhouse) y la terapia con DCA se mantuvieron en 2016. Los resultados de los análisis de sangre en junio de 2016 siguieron siendo normales (Tabla 1). Se repitió la tomografía computarizada en agosto de 2016, que no mostró evidencia de melanoma metastásico, después de 4 años de terapia continua con DCA, combinada con terapia natural contra el cáncer (Figura 4). En diciembre de 2016, el paciente informó de un aumento del estrés relacionado con el trabajo y una reducción del cumplimiento de sus medicamentos. En ese momento, notó una nueva masa inguinal izquierda. Se obtuvo una ecografía, que reveló un nuevo conglomerado de ganglios linfáticos agrandados de 40 mm × 25 mm × 23 mm, con Doppler color que mostraba flujo sanguíneo dentro de la masa. Esto se interpretó como un nuevo crecimiento del melanoma, tras aproximadamente cuatro años y medio de terapia continua con DCA. Se realizaron más pruebas, incluida una PET/TC, que confirmó la recidiva de la enfermedad en 3 ganglios inguinales izquierdos (SUVmáx entre 13 y 17,8).
En resumen, la paciente recibió terapia convencional para el melanoma recurrente en estadio 3 durante un periodo de 6 años, consistente en escisión quirúrgica primaria con disección de ganglios linfáticos, interferón alfa y escisiones quirúrgicas para metástasis cutáneas recurrentes en 5 ocasiones. A continuación, la paciente recibió terapia anticancerosa natural sola (prescrita por Shainhouse) durante 3 meses sin respuesta, evidenciada por la progresión constante de la enfermedad en tomografías computarizadas seriadas. Finalmente, el paciente añadió la terapia oral con DCA a la terapia natural contra el cáncer, con 3 medicamentos neuroprotectores concurrentes (ácido lipoico, acetil L-carnitina y benfotiamina) y sin terapias convencionales contra el cáncer concurrentes. El resultado fue una remisión radiológica completa que duró más de 4 años, seguida de una recidiva. Durante el curso de la terapia con DCA, la paciente experimentó efectos secundarios triviales consistentes en una ligera neuropatía y una ligera reducción de la concentración. El paciente mantuvo el nivel 0 de función ECOG y pudo trabajar a tiempo completo.
Tabla 1 Análisis de sangre antes del tratamiento con dicloroacetato sódico
| Análisis de sangre | Julio 12 pre-DCA | Octubre 12 3 meses DCA | 16 de junio 4 años DCA | Unidades | Rango normal |
|---|---|---|---|---|---|
| Hemoglobina | 154 | 150 | 157 | g/L | 135-175 |
| Recuento de glóbulos blancos | 4.5 | 4.1 | 5 | ×109/L | 4.0-11.0 |
| Plaquetas | 220 | 214 | 229 | ×109/L | 150-400 |
| Glucosa | – | 4.6 | 4.9 | mmol/L | 3.6-7.7 |
| Urea | 3.9 | 3.2 | 3.9 | mmol/L | 2.5-8.0 |
| Creatinina | 491 | 501 | 551 | μmol/L | 62-115 |
| Calcio | 2.47 | 2.41 | 2.47 | mmol/L | 2.15-2.60 |
| Albúmina | 48 | 45 | 47 | g/L | 35-50 |
| Bilirrubina | 8 | 10 | 13 | μmol/L | < 22 |
| Sodio | 139 | 141 | 140 | mmol/L | 135-147 |
| Potasio | 4 | 4.3 | 3.9 | mmol/L | 3.5-5.5 |
| Cloruro | 106 | 107 | 105 | mmol/L | 100-110 |
| Fosfatasa alcalina | 77 | 69 | 71 | U/L | 45-129 |
| LDH | 139 | 135 | 144 | U/L | 120-246 |
| GGT | 18 | 19 | 20 | U/L | 15-73 |
| AST | 18 | 25 | 21 | U/L | 7-37 |
| ALT | 18 | 28 | 19 | U/L | 12-49 |
DISCUSIÓN
El uso de DCA oral en el paciente con melanoma metastásico aquí descrito demuestra la reducción del tumor y la estabilidad de la enfermedad a largo plazo según el estado clínico y las imágenes de TC. La estabilidad de la enfermedad se mantuvo durante más de 4 años mientras tomaba DCA en ausencia de cualquier terapia convencional concurrente, con un tiempo de supervivencia desde el diagnóstico inicial de 10 años. Según las estadísticas de cáncer SEER del Instituto Nacional del Cáncer, la supervivencia de este paciente que no mostraba indicios de metástasis a distancia no es destacable (62,9% de tasa de supervivencia a 5 años para melanoma con diseminación a ganglios linfáticos regionales, https://seer.cancer. gov/statfacts/html/melan.html). Lo que sí es destacable es que, en una situación en la que los ganglios linfáticos afectados estaban claramente agrandados, la adición del tratamiento con DCA oral fue eficaz para reducir el tamaño de los ganglios agrandados (figuras 2 y 3) y lograr una remisión que duró más de 4 años. Es posible que las terapias naturales contra el cáncer que recibió la paciente hicieran sinergia con el DCA, pero también está claro que estas terapias naturales por sí solas no pueden explicar la regresión de la enfermedad. Se ha descrito que el DCA tiene efectos tanto apoptóticos como citostáticos[14,17,19,35,36], lo que concuerda con el curso clínico de regresión (apoptótico) y remisión prolongada (citostático) de esta paciente. La recurrencia al cabo de 4 años coincidió con una reducción del cumplimiento, lo que sugiere que este método de tratamiento del cáncer con DCA requiere que la presión metabólica se mantenga de forma continua. A pesar de la recidiva, el paciente seguía clínicamente bien y tenía previsto iniciar nuevos medicamentos de inmunoterapia. Queda por ver si un cambio en la terapia puede lograr de nuevo la regresión o la estabilidad de la enfermedad.
Además del mantenimiento de la remisión durante más de 4 años, este caso ilustra que el DCA puede ser bien tolerado en un paciente con cáncer durante un periodo de tiempo prolongado, en comparación con todos los ensayos clínicos publicados sobre el cáncer con DCA. En particular, este paciente fue capaz de tolerar 17 mg/kg al día en un régimen de 2 semanas sí/1 semana no durante 4 años con efectos secundarios mínimos. Esto es similar a nuestro anterior caso clínico de uso crónico de DCA en cáncer de colon[37], donde el paciente fue capaz de tolerar 16 mg/kg al día (pero no 25 mg/kg al día) en el mismo régimen, pero contrasta con los ensayos clínicos de DCA, que recomiendan una dosis más baja de 10-12,5 mg/kg al día administrada de forma continua[9,11]. El descanso de 1 semana o los suplementos neuroprotectores pueden contribuir a la capacidad de los pacientes de los informes de casos para tolerar la dosis más alta. Los polimorfismos genéticos en GSTZ1, la enzima hepática que metaboliza el DCA, también pueden contribuir a la dosis de DCA que se puede tolerar[9,38]. En los ensayos se han notificado niveles variables del fármaco, pero no en todos ellos se ha tenido en cuenta este aspecto farmacogenético del tratamiento con DCA[9,11], y se necesitan más estudios para aclarar si esto contribuye de forma significativa a la tolerancia al DCA. En el momento de escribir estas líneas, se está llevando a cabo un ensayo en humanos sobre mieloma múltiple con DCA, en el que se están examinando tanto los genotipos de GSTZ1 como los niveles de fármaco para contribuir a nuestra comprensión de estas cuestiones (Australia New Zealand Clinical Trials Register #ACTRN12615000226505, http://www.anzctr. org.au).
Este informe de caso muestra que la terapia crónica con DCA puede utilizarse sin reducir la calidad de vida, en comparación con las terapias convencionales para el melanoma, como el interferón. Para determinar el protocolo óptimo para un tratamiento agudo o crónico máximo tolerable con DCA, se necesitan ensayos en humanos. Pero lo más importante es que aún no se ha aclarado qué dosis es necesaria para que los efectos sobre el objetivo sean eficaces contra el cáncer. Esta información es necesaria antes de invertir en estudios más amplios y a largo plazo sobre los resultados en los pacientes. El DCA merece una mayor investigación en ensayos clínicos como terapia no tóxica contra el cáncer debido a su modesto coste y baja toxicidad, y merece ser considerado como una terapia contra el cáncer fuera de indicación.
AGRADECIMIENTOS
Los autores desean dar las gracias a la Dra. Humaira Khan por su ayuda, y también a la paciente por su apoyo y consentimiento para publicar su caso.
COMENTARIOS
Características del caso
El paciente, varón de 32 años, se presentó con una lesión pigmentada en la pierna.
Diagnóstico clínico
El paciente fue diagnosticado de un melanoma.
Diagnóstico de laboratorio
Melanoma confirmado por biopsia excisional.
Diagnósticopor imagen
Se confirma la presencia de melanoma en el ganglio inguinal agrandado (biopsia con aguja).
Diagnósticopatológico
Melanoma, BRAF positivo
Tratamiento
Escisión de la lesión primaria con injerto de piel, disección del ganglio centinela, escisiones múltiples de metástasis cutáneas recidivantes. Interrupción de la terapia tradicional e inicio de terapias naturales contra el cáncer (AHCC, raíz de diente de león, curcumina, raíz de astrágalo, vitamina C i.v., muérdago europeo s.c.). Progresión al cabo de 3 meses, adición de dicloroacetato (DCA). Regresión y remisión tras la adición de DCA durante más de 4 años.
Informes relacionados
Los informes de tomografía computarizada muestran la evolución de la enfermedad y la respuesta a las terapias.
Explicación del término
DCA: Dicloroacetato sódico; RECIST: Criterios de evaluación de la respuesta para tumores sólidos; ECOG: Eastern cooperative oncology group; SEER: Surveillance, epidemiology and end results.
Experiencias y enseñanzas
El DCA puede actuar como fármaco proapoptótico y citostático, con lo que puede lograr la regresión y la estabilización a largo plazo del cáncer metastásico sin efectos secundarios graves, como ilustra este caso de melanoma.
Peer-review
El Dr. Khan describió a un hombre de 32 años que recibió terapia con DCA, junto con otros medicamentos de terapeutas naturales y se mantuvo en estado de estabilización (melanoma metastásico) durante más de 4 años. Es un caso interesante.
REFERENCIAS
1 Bonnet S, Archer SL, Allalunis-Turner J, Haromy A, Beaulieu C, Thompson R, Lee CT, Lopaschuk GD, Puttagunta L, Bonnet S, Harry G, Hashimoto K, Porter CJ, Andrade MA, Thebaud B, Michelakis ED. A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth. Cancer Cell 2007; 11: 37-51 [PMID: 17222789 DOI: 10.1016/ j.ccr.2006.10.020]
2 Stacpoole PW, Kurtz TL, Han Z, Langaee T. Papel del dicloroacetato en el tratamiento de enfermedades mitocondriales genéticas. Adv Drug Deliv Rev 2008; 60: 1478-1487 [PMID: 18647626 DOI: 10.1016/ j.addr.2008.02.014]
3 Stacpoole PW, Gilbert LR, Neiberger RE, Carney PR, Valenstein E, Theriaque DW, Shuster JJ. Evaluación del tratamiento a largo plazo de niños con acidosis láctica congénita con dicloroacetato. Pediatrics 2008; 121: e1223-e1228 [PMID: 18411236 DOI: 10.1542/ peds.2007-2062]
4 Stacpoole PW, Kerr DS, Barnes C, Bunch ST, Carney PR, Fennell EM, Felitsyn NM, Gilmore RL, Greer M, Henderson GN, Hutson AD, Neiberger RE, O’Brien RG, Perkins LA, Quisling RG, Shroads AL, Shuster JJ, Silverstein JH, Theriaque DW, Valenstein E. Controlled clinical trial of dichloroacetate for treatment of congenital lactic acidosis in children. Pediatrics 2006; 117: 1519-1531 [PMID: 16651305 DOI: 10.1542/peds.2005-1226]
5 Berendzen K, Theriaque DW, Shuster J, Stacpoole PW. Potencial terapéutico del dicloroacetato para la deficiencia del complejo piruvato deshidrogenasa. Mitochondrion 2006; 6: 126-135 [PMID: 16725381 DOI: 10.1016/j.mito.2006.04.001]
6 Kaufmann P, Engelstad K, Wei Y, Jhung S, Sano MC, Shungu DC, Millar WS, Hong X, Gooch CL, Mao X, Pascual JM, Hirano M, Stacpoole PW, DiMauro S, De Vivo DC. El dicloroacetato causa neuropatía tóxica en MELAS: un ensayo clínico aleatorizado y controlado. Neurology 2006; 66: 324-330 [PMID: 16476929 DOI: 10.1212/01. wnl.0000196641.05913.27]
7 Brandsma D, Dorlo TP, Haanen JH, Beijnen JH, Boogerd W. Encefalopatía grave y polineuropatía inducida por dicloroacetato. J Neurol 2010; 257: 2099-2100 [PMID: 20632025 DOI: 10.1007/ s00415-010-5654-9]
8 Michelakis ED, Sutendra G, Dromparis P, Webster L, Haromy A, Niven E, Maguire C, Gammer TL, Mackey JR, Fulton D, Abdulkarim B, McMurtry MS, Petruk KC. Modulación metabólica del glioblastoma con dicloroacetato. Sci Transl Med 2010; 2: 31ra34 [PMID: 20463368 DOI: 10.1126/scitranslmed.3000677]
9 Dunbar EM, Coats BS, Shroads AL, Langaee T, Lew A, Forder JR, Shuster JJ, Wagner DA, Stacpoole PW. Ensayo de fase 1 de dicloroacetato (DCA) en adultos con tumores cerebrales malignos recurrentes. Invest New Drugs2014; 32: 452-464 [PMID: 24297161 DOI: 10.1007/ s10637-013-0047-4]
10 Garon EB, Christofk HR, Hosmer W, Britten CD, Bahng A, Crabtree MJ, Hong CS, Kamranpour N, Pitts S, Kabbinavar F, Patel C, von Euw E, Black A, Michelakis ED, Dubinett SM, Slamon DJ. El dicloroacetato debe considerarse con quimioterapia basada en platino en tumores hipóxicos en lugar de como agente único en el cáncer de pulmón de células no pequeñas avanzado. J Cancer Res Clin Oncol 2014; 140: 443-452 [PMID: 24442098 DOI: 10.1007/s00432-014-1583-9]
11 Chu QS, Sangha R, Spratlin J, Vos LJ, Mackey JR, McEwan AJ, Venner P, Michelakis ED. A phase I open-labeled, single-arm, doseescalation, study of dichloroacetate (DCA) in patients with advanced solid tumors. Invest New Drugs 2015; 33: 603-610 [PMID: 25762000 DOI: 10.1007/s10637-015-0221-y]
12 Kankotia S, Stacpoole PW. Dicloroacetato y cáncer: ¿nuevo hogar para un medicamento huérfano? Biochim Biophys Acta 2014; 1846: 617-629 [PMID: 25157892 DOI: 10.1016/j.bbcan.2014.08.005]
13 Sun RC, Board PG, Blackburn AC. Targeting metabolism with arsenic trioxide and dichloroacetate in breast cancer cells. Mol Cancer 2011; 10: 142 [PMID: 22093145 DOI: 10.1186/1476-4598-10-142]
14 Stockwin LH, Yu SX, Borgel S, Hancock C, Wolfe TL, Phillips LR, Hollingshead MG, Newton DL. Sodium dichloroacetate selectively targets cells with defects in the mitochondrial ETC. Int J Cancer 2010; 127: 2510-2519 [PMID: 20533281 DOI: 10.1002/ijc.25499]
15 Gang BP, Dilda PJ, Hogg PJ, Blackburn AC. Targeting of two aspects of metabolism in breast cancer treatment. Cancer Biol Ther 2014; 15: 1533-1541 [PMID: 25482950 DOI: 10.4161/15384047.2014.955992]
16 Sutendra G, Dromparis P, Kinnaird A, Stenson TH, Haromy A, Parker JM, McMurtry MS, Michelakis ED. Mitochondrial activation by inhibition of PDKII suppresses HIF1a signaling and angiogenesis in cancer.Oncogene 2013; 32: 1638-1650 [PMID: 22614004 DOI: 10.1038/onc.2012.198]
17 Cairns RA, Bennewith KL, Graves EE, Giaccia AJ, Chang DT, Denko NC. Pharmacologically increased tumour hypoxia can be measured by 18F-Fluoroazomycin arabinoside positron emission tomography and enhances tumour response to hypoxic cytotoxin PR-104. Clin Cancer Res 2009; 15: 7170-7174 [PMID: 19920111 DOI: 10.1158/1078-0432.CCR-09-1676]
18 Anderson KM, Jajeh J, Guinan P, Rubenstein M. In vitro effects of dichloroacetate and CO2 on hypoxic HeLa cells. Anticancer Res 2009; 29: 4579-4588 [PMID: 20032407]
19 Sun RC, Fadia M, Dahlstrom JE, Parish CR, Board PG, Blackburn AC. La reversión del fenotipo glucolítico por dicloroacetato inhibe el crecimiento de células de cáncer de mama metastásico in vitro e in vivo. Breast Cancer Res Treat 2010; 120: 253-260 [PMID: 19543830 DOI: 10.1007/ s10549-009-0435-9]
20 De Grandis D. Acetil-L-carnitina para el tratamiento de la neuropatía periférica inducida por la quimioterapia: una breve revisión. CNS Drugs 2007; 21 Suppl 1: 39-43; discusión 45-46 [PMID: 17696592]
21 Maestri A, De Pasquale Ceratti A, Cundari S, Zanna C, Cortesi E, Crinò L. A pilot study on the effect of acetyl-L-carnitine in paclitaxeland cisplatin-induced peripheral neuropathy. Tumori 2005; 91: 135-138 [PMID: 15948540]
22 Evans JD, Jacobs TF, Evans EW. Role of acetyl-L-carnitine in the treatment of diabetic peripheral neuropathy. Ann Pharmacother 2008; 42: 1686-1691 [PMID: 18940920 DOI: 10.1345/aph.1L201]
23 Mijnhout GS, Kollen BJ, Alkhalaf A, Kleefstra N, Bilo HJ. Ácido alfa lipoico para la neuropatía periférica sintomática en pacientes con diabetes: un meta-análisis de ensayos controlados aleatorios. Int J Endocrinol 2012; 2012: 456279 [PMID: 22331979 DOI: 10.1155/2012/456279]
24 Liu F, Zhang Y, Yang M, Liu B, Shen YD, Jia WP, Xiang KS. [Efecto curativo del ácido alfa-lipoico sobre la neuropatía periférica en la diabetes tipo 2: un estudio clínico]. Zhonghua Yixue Zazhi 2007; 87: 2706-2709 [PMID: 18167250]
25 Ziegler D, Hanefeld M, Ruhnau KJ, Meissner HP, Lobisch M, Schütte K, Gries FA. Tratamiento de la neuropatía periférica diabética sintomática con el antioxidante ácido alfa-lipoico. A 3-week multicentre randomized controlled trial (ALADIN Study). Diabetologia 1995; 38: 1425-1433 [PMID: 8786016]
26 Winkler G, Kempler P. [Patomecanismo de la neuropatía diabética: antecedentes de la terapia orientada a la patogénesis]. Orv Hetil 2010; 151: 971-981 [PMID: 20519180 DOI: 10.1556/OH.2010.28898]
27 Ang CD, Alviar MJ, Dans AL, Bautista-Velez GG, Villaruz-Sulit MV, Tan JJ, Co HU, Bautista MR, Roxas AA. Vitamina B para el tratamiento de la neuropatía periférica (Revisión Cochrane traducida). Cochrane Database Syst Rev 2008; (3): CD004573 [PMID: 18646107 DOI: 10.1002/14651858.CD004573. pub3]
28 Winkler G, Pál B, Nagybéganyi E, Ory I, Porochnavec M, Kempler P. Effectiveness of different benfotiamine dosage regimens in the treatment of painful diabetic neuropathy. Arzneimittelforschung 1999; 49: 220-224 [PMID: 10219465 DOI: 10.1055/s-0031-1300405]
29 Ignacio RM, Kim CS, Kim YD, Lee HM, Qi XF, Kim SK. Efecto terapéutico de Active Hexose-Correlated Compound (AHCC) combinado con CpG-ODN (oligodeoxinucleótido) en modelo murino de melanoma B16. Cytokine 2015; 76: 131-137 [PMID: 26082022 DOI: 10.1016/j.cyto.2015.06.002]
30 Chatterjee SJ, Ovadje P, Mousa M, Hamm C, Pandey S. La eficacia del extracto de raíz de diente de león en la inducción de la apoptosis en células de melanoma humano resistentes a los medicamentos. Evid Based Complement Alternat Med 2011; 2011: 129045 [PMID: 21234313 DOI: 10.1155/2011/129045]
31 Mirzaei H, Naseri G, Rezaee R, Mohammadi M, Banikazemi Z, Mirzaei HR, Salehi H, Peyvandi M, Pawelek JM, Sahebkar A. Curcumin: ¿Un nuevo candidato para la terapia del melanoma? Int J Cancer 2016; 139: 1683-1695 [PMID: 27280688 DOI: 10.1002/ijc.30224]
32 Huang XY, Zhang SZ, Wang WX. Eficacia antitumoral mejorada con la administración combinada de astrágalo y pterostilbeno para el melanoma. Asian Pac J Cancer Prev 2014; 15: 1163-1169 [PMID: 24606435]
33 Wagner SC, Markosian B, Ajili N, Dolan BR, Kim AJ, Alexandrescu DT, Dasanu CA, Minev B, Koropatnick J, Marincola FM, Riordan NH. Ácido ascórbico intravenoso como adyuvante de la inmunoterapia con interleucina-2. J Transl Med 2014; 12: 127 [PMID: 24884532 DOI:10.1186/1479-5876-12-127]
34 Horneber MA, Bueschel G, Huber R, Linde K, Rostock M. Terapia con muérdago en oncología. Cochrane Database Syst Rev 2008; (2): CD003297 [PMID: 18425885 DOI: 10.1002/14651858.CD003297.pub2]
35 Delaney LM, Ho N, Morrison J, Farias NR, Mosser DD, Coomber BL. El dicloroacetato afecta a la proliferación pero no a la supervivencia de las células de cáncer colorrectal humano. Apoptosis 2015; 20: 63-74 [PMID: 25344893 DOI: 10.1007/s10495-014-1046-4]
36 Abildgaard C, Dahl C, Basse AL, Ma T, Guldberg P. La modulación bioenergética con dicloroacetato reduce el crecimiento de células de melanoma y potencia su respuesta a la inhibición de BRAFV600E. J Transl Med 2014; 12: 247 [PMID: 25182332 DOI: 10.1186/s12967-014-0247-5]
37 Khan A, Andrews D, Blackburn AC. Estabilización a largo plazo del cáncer de colon en estadio 4 mediante terapia con dicloroacetato de sodio. World J Clin Cases 2016; 4: 336-343 [PMID: 27803917]
38 Tzeng HF, Blackburn AC, Board PG, Anders MW. Polymorphismand species-dependent inactivation of glutathione transferase zeta by dichloroacetate. Chem Res Toxicol 2000; 13: 231-236 [PMID: 10775321]