Akbar Khan, Doug Andrews, Jill Shainhouse, Anneke C Blackburn
Akbar Khan, Douglas Andrews, Medicor Cancer Centres Inc, Toronto, ON M2N 6N4, Canada
Jill Shainhouse, Insight Naturopathic Clinic, Toronto, ON M4P 1N9, Canada
Anneke C Blackburn, The John Curtin School of Medical Research, The Australian National University, Canberra, ACT 2601, Australie
Contributions des auteurs : Khan A a traité le patient et rédigé la majeure partie du rapport de cas ; Andrews D a participé à l’élaboration du protocole de médication naturelle pour la réduction des effets secondaires du DCA et a rédigé une partie du rapport de cas ; Shainhouse J a traité le patient avec une thérapie naturelle ; Blackburn AC a interprété le rapport de cas dans le contexte de la littérature sur la recherche in vitro et in vivo sur le DCA, a rédigé une partie de l’introduction et de la discussion et a revu l’ensemble du manuscrit.
Déclaration de consentement éclairé : La patiente décrite dans ce manuscrit a donné son accord pour que son cas soit publié de manière anonyme.
Déclaration de conflit d’intérêts : L’un des auteurs (Khan) administre le traitement au dichloroacétate pour les patients atteints de cancer par le biais des centres anticancéreux Medicor, à titre onéreux et sans profit. La clinique appartient à un membre de la famille de cet auteur. Les autres auteurs n’ont rien à divulguer.
Accès libre : Cet article est un article en accès libre qui a été sélectionné par un rédacteur interne et entièrement révisé par des examinateurs externes. Il est distribué conformément à la licence Creative Commons Attribution Non Commercial (CC BY-NC 4.0), qui permet à d’autres personnes de distribuer, remixer, adapter, construire sur cette œuvre de manière non commerciale, et d’accorder une licence à leurs œuvres dérivées selon des termes différents, à condition que l’œuvre originale soit correctement citée et que l’utilisation soit non commerciale. Voir : http://creativecommons.org/licenses/by-nc/4.0/
Source du manuscrit : Manuscrit invité
Correspondance à : Akbar Khan, MD, Directeur médical,
Medicor Cancer Centres Inc., 4576 Yonge St., Suite 301, Toronto,
ON M2N 6N4, Canada. [email protected]
Téléphone : +1-416-2270037
Fax : +1-416-2271915
Reçu : 30 janvier 2017
Début de l’examen par les pairs : 12 février 2017
Première décision : 28 mars 2017
Révisé : 5 mai 2017
Accepté : 30 mai 2017
Article sous presse : 31 mai 2017
Publié en ligne : 10 août 2017
Résumé
Le dichloroacétate (DCA) de sodium est étudié comme thérapie métabolique du cancer depuis 2007, sur la base d’une publication de Bonnet et al démontrant que le DCA peut induire l’apoptose (mort cellulaire programmée) dans les cellules cancéreuses humaines du sein, du poumon et du cerveau. Classiquement, la réponse du cancer à un traitement médical dans la recherche humaine est mesurée par les définitions du critère d’évaluation de la réponse pour les tumeurs solides, qui définissent la « réponse » par le degré de réduction de la tumeur ou sa disparition à l’imagerie, mais la stabilisation de la maladie est également un résultat clinique bénéfique. Il a été démontré que le DCA peut fonctionner comme un agent cytostatique in vitro et in vivo, sans provoquer d’apoptose. Nous présentons le cas d’un homme de 32 ans chez qui le traitement au DCA, sans traitement conventionnel concomitant, a entraîné la régression et la stabilisation d’un mélanome métastatique récurrent pendant plus de 4 ans, avec des effets secondaires insignifiants. Ce cas démontre que le DCA peut être utilisé pour réduire le volume de la maladie et maintenir une stabilité à long terme chez les patients atteints de mélanome avancé.
Mots clés : Dichloroacétate ; Cancer ; BRAF ; Mélanome ; Cytostatique
© Le(s) auteur(s) 2017. Publié par Baishideng Publishing Group Inc. Tous droits réservés.
Conseil principal : Le dichloroacétate de sodium (DCA) est étudié comme thérapie métabolique du cancer depuis 2007. Il a été démontré que le traitement par DCA peut entraîner une réponse classique qui se mesure par la réduction ou la disparition des tumeurs à l’imagerie. Cependant, le DCA peut également arrêter la croissance des cellules cancéreuses sans provoquer d’apoptose (effet cytostatique). Cela peut entraîner une stabilisation à long terme du cancer métastatique. Nous présentons un cas de traitement oral au DCA ayant entraîné une réduction et une stabilisation du mélanome métastatique chez un homme de 32 ans pendant plus de 4 ans, avec seulement des effets secondaires mineurs….
Khan A, Andrews D, Shainhouse J, Blackburn AC. Stabilisation à long terme d’un mélanome métastatique avec le dichloroacétate de sodium.
World J Clin Oncol 2017 ; 8(4) : 371-377
Disponible sur : URL : http://www.wjgnet.com/2218-4333/full/v8/i4/371.htm
DOI : http://dx.doi.org/10.5306/wjco.v8.i4.371
INTRODUCTION
Le dichloroacétate (DCA) de sodium a attiré l’attention de la communauté médicale en 2007, lorsque Bonnet et al[1] ont publié la première étude in vitro et in vivo illustrant l’intérêt du DCA en tant que thérapie métabolique du cancer, grâce à son action inhibitrice sur l’enzyme mitochondriale pyruvate déshydrogénase kinase. Auparavant, Stacpoole et al[2-4] avaient publié plusieurs études sur le DCA pour le traitement de l’acidose lactique congénitale dans les maladies mitochondriales[2-5]. Ces études ont démontré que le DCA oral est un médicament sûr pour l’utilisation humaine. On a noté l’absence de toxicité rénale, pulmonaire, médullaire et cardiaque du DCA[4]. La plupart des effets secondaires du DCA étaient modestes, le plus grave étant la neuropathie périphérique réversible[6]. Un délire réversible a également été signalé[7]. Une élévation des enzymes hépatiques (asymptomatique et réversible) a été notée chez un petit pourcentage de patients[3]. Les recherches antérieures sur les troubles mitochondriaux chez l’homme ont permis de transposer rapidement le DCA à l’usage humain en tant que thérapie anticancéreuse non indiquée sur l’étiquette. Plusieurs rapports d’essais cliniques utilisant le DCA comme thérapie anticancéreuse ont maintenant été publiés, confirmant son profil de sécurité et indiquant une reconnaissance croissante de l’utilité potentielle du DCA dans la clinique du cancer[8-11]. L’une des limites de ces études portant sur des patients en phase avancée est qu’elles n’ont fait état que de traitements de courte durée.
Dans la publication de Bonnet en 2007[1], il a été démontré que le traitement au DCA réduisait le potentiel de la membrane mitochondriale, ce qui favorisait l’apoptose de manière sélective dans les cellules cancéreuses humaines. L’inhibition de la glycolyse aérobie (l’effet Warburg) et l’activation des canaux ioniques de potassium mitochondrial ont été identifiés comme les mécanismes d’action du DCA. D’autres recherches sur le DCA in vitro ont confirmé l’activité anticancéreuse contre un large éventail de types de cancer, qui a été examinée récemment par Kankotia et Stacpoole[12]. En outre, le DCA est également capable de renforcer l’apoptose lorsqu’il est associé à d’autres agents[13-15]. D’autres actions anticancéreuses du DCA ont également été suggérées, notamment l’inhibition de l’angiogenèse[16], l’altération de l’expression de HIF1-α[17], l’altération des régulateurs du pH cellulaire que sont la V-ATPase et la MCT1, et d’autres régulateurs de la survie cellulaire tels que p53 et PUMA[18]. Cependant, de nombreuses études in vitro utilisent des concentrations déraisonnablement élevées de DCA, qui ne sont pas cliniquement réalisables, dans le but de montrer une activité cytotoxique[12]. Dans d’autres études, des concentrations de DCA plus modestes ont été utilisées, démontrant que le DCA pouvait être cytostatique. Le deuxième rapport en 2010 sur son activité anticancéreuse in vivo a révélé que le DCA seul était cytostatique dans un modèle métastatique de cancer du sein[19], inhibant la prolifération sans déclencher l’apoptose. Cela suggère un rôle pour le DCA en tant que stabilisateur du cancer, similaire à celui des inhibiteurs de l’angiogenèse.
En réponse au rapport de 2007 sur les actions anticancéreuses du DCA, Khan a commencé à utiliser le DCA pour le traitement des patients atteints de cancer dont le pronostic est court ou qui ont cessé de répondre aux thérapies conventionnelles contre le cancer. Un protocole de médication naturelle a été mis au point en collaboration avec un médecin naturopathe (Andrews) pour remédier à la toxicité neurologique du DCA, qui limite les doses. Il se composait de 3 médicaments : Acetyl L-carnitine[20-22], acide R-alpha lipoïque[23-25] et benfotiamine[26-28], pour la prévention de la neuropathie et de l’encéphalopathie. Chez plus de 300 patients atteints de cancer à un stade avancé, des données d’observation ont révélé que le traitement par DCA était bénéfique dans 60 à 70 % des cas. Le risque de neuropathie lorsque des médicaments neuroprotecteurs naturels étaient associés au DCA était d’environ 20 % en utilisant une posologie de 20-25 mg/kg par jour selon un cycle de 2 semaines on/1 semaine off (données d’observation clinique publiées en ligne sur www.medicorcancer.com). Nous présentons ici le cas d’un patient illustrant les effets apoptotiques et antiprolifératifs d’un traitement chronique au DCA sur une période de plus de quatre ans.
RAPPORT DE CAS
Un homme de 32 ans, en bonne santé et à la peau claire, a remarqué qu’un grain de beauté sur son mollet gauche avait commencé à changer en 2006. Il a consulté un médecin et le grain de beauté a été excisé. Un diagnostic pathologique de mélanome a été posé. Un curage du ganglion sentinelle a été effectué et s’est révélé négatif pour la maladie métastatique. En 2007, le patient a constaté une hypertrophie des ganglions inguinaux gauches et de petites lésions mélanocytaires sur la peau de sa jambe gauche. Il a été traité par interféron alpha dans le cadre d’un essai clinique dans un hôpital régional de cancérologie, avec une réduction des ganglions et une résolution des métastases cutanées. L’interféron a été arrêté après 9 mois en raison d’effets secondaires.
Le patient est resté en bonne santé jusqu’en 2010, date à laquelle une nouvelle métastase cutanée de la jambe gauche est apparue. Celle-ci a été excisée chirurgicalement. Fin 2011, une autre nouvelle métastase cutanée a été identifiée sur la jambe gauche, à l’intérieur de la cicatrice de l’opération initiale du mélanome. Elle a été biopsiée et le diagnostic de mélanome récurrent a été confirmé. Il a alors été traité par une excision large et une greffe de peau.
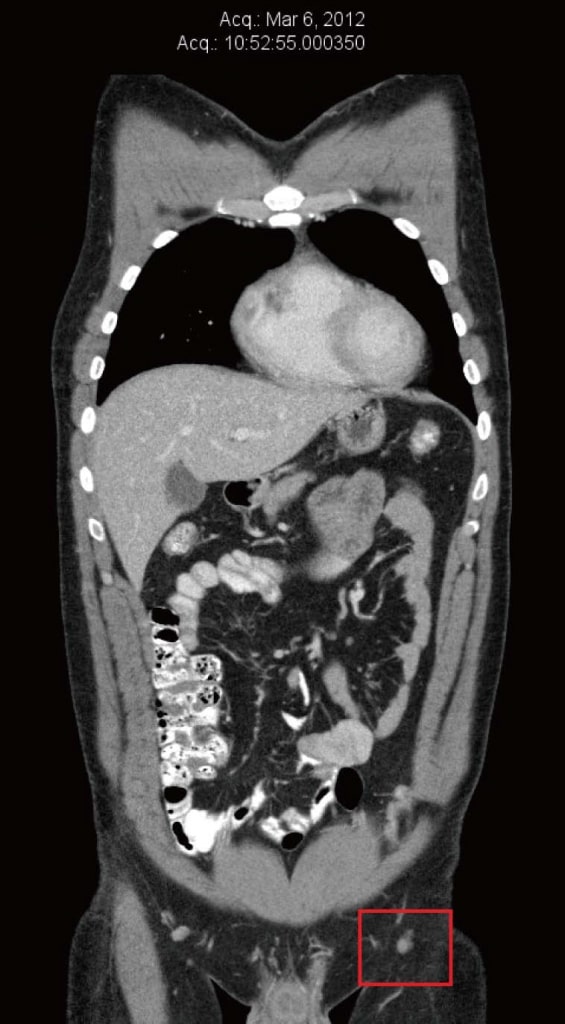
En mars 2012, le patient a été diagnostiqué avec une récidive dans la greffe de peau de la jambe gauche. Celle-ci a été excisée et une nouvelle procédure de greffe de peau a été effectuée. La pathologie a révélé des marges positives de la métastase excisée, de sorte qu’une réexcision a été effectuée, avec de nouveau des marges positives. Au même moment, une biopsie à l’aiguille d’un ganglion inguinal gauche a confirmé la présence d’un mélanome métastatique BRAF-positif. Une tomodensitométrie (CT) réalisée en mars 2012 n’a révélé aucun signe de métastases à distance. Le plus gros ganglion inguinal gauche mesurait 8 mm de diamètre, ce qui a été signalé comme » insignifiant selon les critères de taille » (figure 1).
En avril 2012, le patient a consulté un naturopathe (Shainhouse) et a commencé un traitement avec les agents anticancéreux naturels oraux suivants : Composé actif corrélé à l’hexose ou AHCC (extrait de champignon)[29], racine de pissenlit[30], curcumine[31] et racine d’astragale[32]. Un traitement parentéral a également été instauré, qui consistait en l’administration de vitamine C par voie intraveineuse deux fois par semaine[33] et d’un extrait de gui européen par voie sous-cutanée[34]. Le patient est également passé à un régime végétalien.
En mai 2012, le patient s’est rendu à la clinique de l’auteur (Khan) en cherchant à poursuivre d’autres thérapies non traditionnelles. La thérapie DCA a été discutée, mais le patient a décidé de faire d’abord un essai adéquat des thérapies anticancéreuses naturelles (prescrites par Shainhouse). Un scanner a été réalisé à nouveau en mai 2012 (après seulement 1 mois de thérapie naturelle) et a indiqué une légère croissance de plusieurs ganglions inguinaux et iliaques externes, avec des tailles allant de 10 mm × 11 mm à 14 mm × 15 mm.
En juillet 2012, le scanner a été répété pour évaluer les thérapies naturelles anticancéreuses du patient. À ce moment-là, les ganglions inguinaux et iliaques externes gauches avaient à nouveau augmenté de volume, et leur taille variait de 13 mm × 16 mm à 22 mm × 20 mm (figure 2). Une TEP a également été réalisée en vue de la préparation d’un essai clinique à Boston, MA (États-Unis), et a confirmé une augmentation de la captation du glucose dans les ganglions inguinaux gauches. Il y avait une nouvelle douleur douloureuse de faible intensité (2/10) dans la région inguinale gauche. L’examen a révélé un ganglion inguinal gauche non sensible de 20 mm, et deux petites métastases cutanées dans la greffe de peau du mollet gauche.
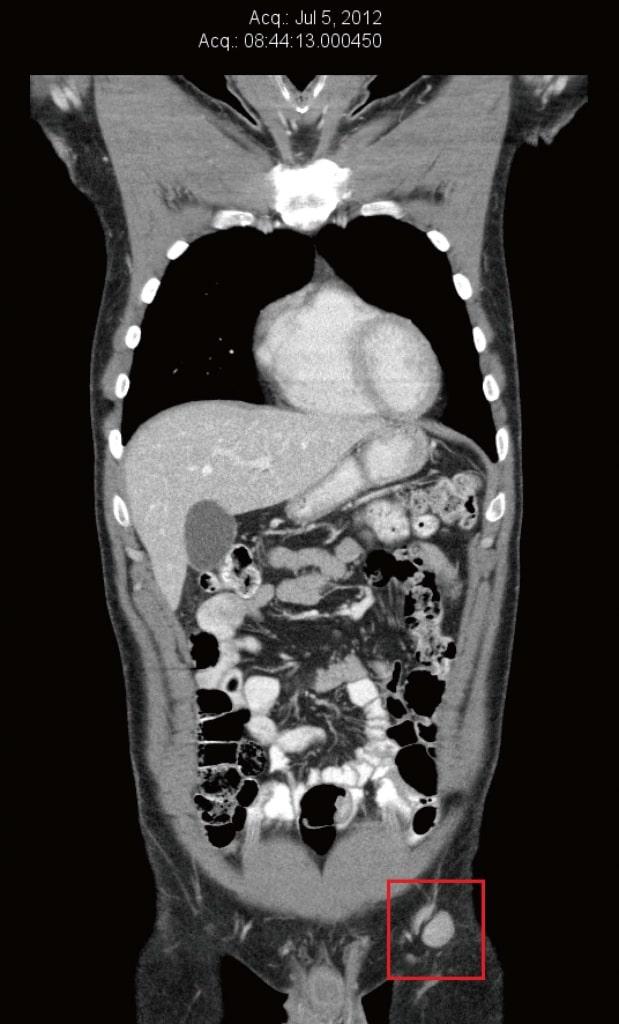
Le patient a donc reçu un diagnostic de progression de la maladie. Il a alors décidé de commencer un traitement au DCA. Il a commencé à prendre du DCA par voie orale à raison de 500 mg 3 fois par jour, ce qui équivalait à 17 mg/kg par jour (fabricant : Tokyo Chemical Industry, États-Unis) en plus de maintenir les autres thérapies naturelles. Le cycle de traitement au DCA était de 2 semaines de traitement et 1 semaine de repos. Pour minimiser l’apparition d’effets secondaires du DCA, 3 médicaments naturels supplémentaires ont été prescrits : Acétyl L-carnitine orale 500 mg 3 fois par jour, benfotiamine orale 80 mg 2 fois par jour et acide R-alpha lipoïque oral 150 mg 3 fois par jour. Ces suppléments ont été pris quotidiennement (pas de cycle). Des analyses sanguines de base ont été effectuées (tableau 1). Elles étaient toutes normales, à l’exception d’une créatinine basse jugée non significative.
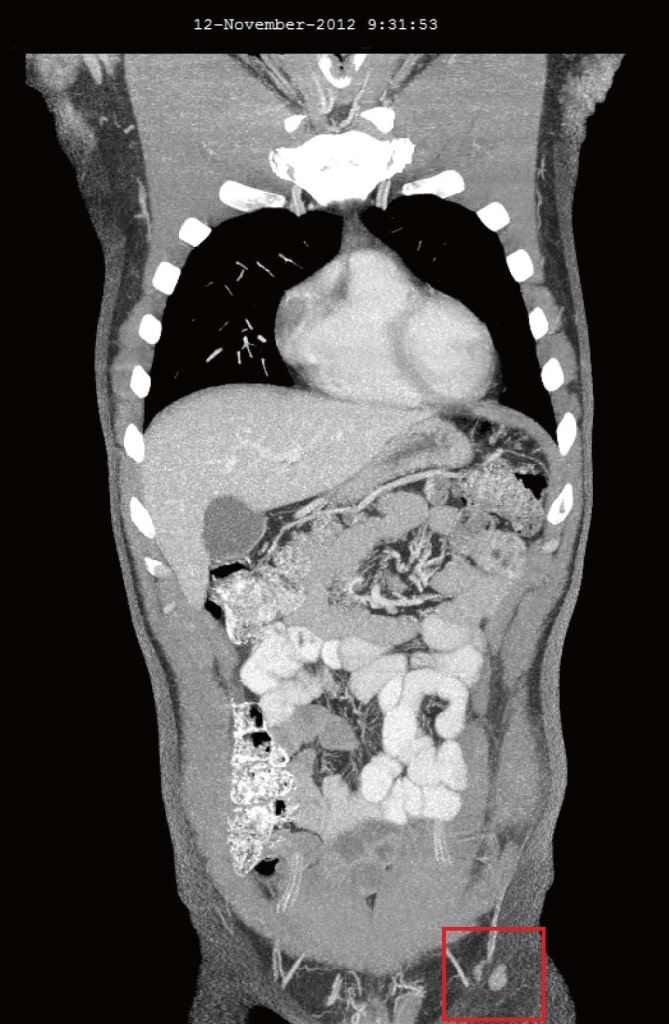
En novembre 2012, 4 mois après l’ajout du DCA à ses thérapies anticancéreuses naturelles initiales, le patient a été réévalué. Il se sentait généralement bien. Deux nouveaux symptômes ont été signalés comme n’ayant commencé qu’après le début du traitement au DCA : Une légère diminution de la sensation du bout des doigts et des orteils, et une légère diminution de la capacité de concentration pendant les 2 semaines où il a pris du DCA. La légère perte sensorielle ne s’est pas aggravée et on a estimé qu’il s’agissait d’une neuropathie légère liée au DCA. L’engourdissement et la baisse de concentration se sont résorbés pendant les semaines où le patient n’a pas pris de DCA. L’analyse sanguine d’octobre 2012 n’a montré aucun changement significatif (tableau 1). Les tomodensitométries d’août 2012 et de novembre 2012 ont révélé une régression significative de tous les ganglions lymphatiques précédemment hypertrophiés. Le plus gros ganglion mesurait 10 mm, et il n’y avait aucun signe de maladie intra-thoracique ou intra-abdominale, ni de métastases osseuses (figure 3).
Le patient a continué à se sentir bien sous traitement DCA, et n’a pas remarqué de nouvelles métastases cutanées ni de nouvelle hypertrophie des ganglions inguinaux. Il a continué à bénéficier d’un suivi clinique fréquent avec son naturopathe (Shainhouse) et d’un suivi annuel avec son médecin (Khan). Les thérapies naturelles anticancéreuses énumérées (prescrites par Shainhouse) et la thérapie DCA ont été maintenues en 2016. Les résultats des analyses de sang en juin 2016 sont restés normaux (tableau 1). La tomodensitométrie a été répétée en août 2016, ne montrant aucun signe de mélanome métastatique, après 4 années complètes de thérapie DCA en cours, associée à une thérapie anticancéreuse naturelle (Figure 4). En décembre 2016, le patient a signalé une augmentation du stress lié au travail et une réduction de l’observance de ses médicaments. À cette époque, il a noté une nouvelle masse inguinale gauche. Une échographie a été obtenue, qui a révélé un nouveau conglomérat de ganglions lymphatiques hypertrophiés mesurant 40 mm × 25 mm × 23 mm, avec un Doppler couleur montrant un flux sanguin au sein de la masse. Ceci a été interprété comme une nouvelle croissance du mélanome, après environ quatre ans et demi de traitement continu par DCA. D’autres examens ont été effectués, notamment une TEP/TDM, qui a confirmé la récurrence de la maladie dans trois ganglions inguinaux gauches (SUVmax compris entre 13 et 17,8).
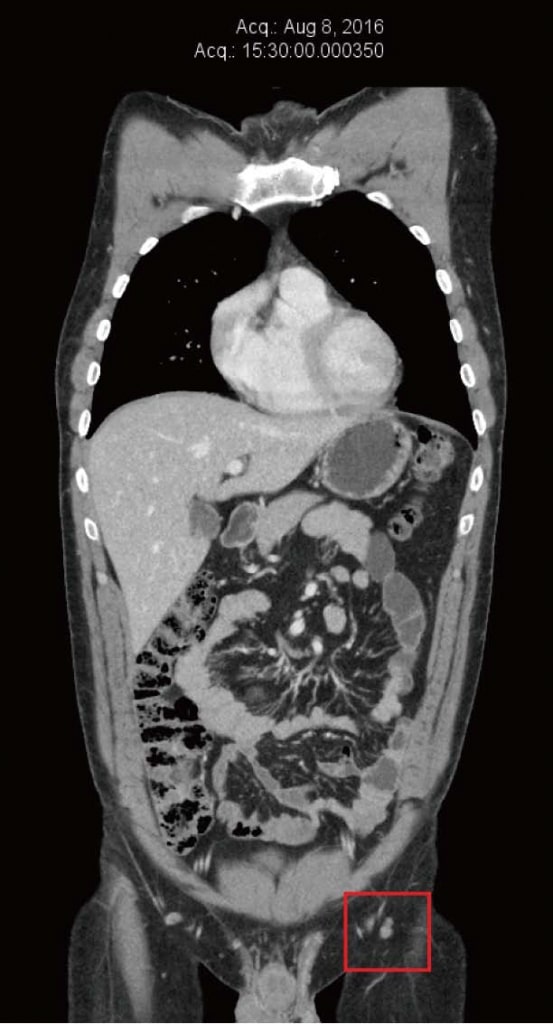
En résumé, le patient a reçu un traitement conventionnel pour un mélanome récurrent de stade 3 sur une période de 6 ans, consistant en une excision chirurgicale primaire avec dissection des ganglions lymphatiques, de l’interféron alpha et des excisions chirurgicales pour des métastases cutanées récurrentes à 5 occasions. Le patient a ensuite reçu une thérapie anticancéreuse naturelle seule (prescrite par Shainhouse) pendant 3 mois, sans réponse, comme en témoigne la progression constante de la maladie sur les scanners en série. Enfin, le patient a ajouté une thérapie DCA orale à la thérapie anticancéreuse naturelle, avec 3 médicaments neuroprotecteurs simultanés (acide lipoïque, acétyl L-carnitine et benfotiamine) et aucun traitement anticancéreux conventionnel simultané. Le résultat a été une rémission radiologique complète pendant plus de 4 ans, suivie d’une récidive. Au cours du traitement par DCA, le patient a présenté des effets secondaires insignifiants consistant en une légère neuropathie et une légère diminution de la concentration. Le patient a conservé une fonction ECOG de niveau 0, et il a pu travailler à temps plein.
Tableau 1 Bilan sanguin avant le traitement par dichloroacétate de sodium
| Analyse sanguine | 12 juillet avant DCA | 12 octobre 3 mois DCA | 16 juin 4 ans DCA | Unités | Plage normale |
|---|---|---|---|---|---|
| Hémoglobine | 154 | 150 | 157 | g/L | 135-175 |
| Taux de globules blancs | 4.5 | 4.1 | 5 | ×109/L | 4.0-11.0 |
| Plaquettes | 220 | 214 | 229 | ×109/L | 150-400 |
| Glucose | – | 4.6 | 4.9 | mmol/L | 3.6-7.7 |
| Urée | 3.9 | 3.2 | 3.9 | mmol/L | 2.5-8.0 |
| Créatinine | 491 | 501 | 551 | μmol/L | 62-115 |
| Calcium | 2.47 | 2.41 | 2.47 | mmol/L | 2.15-2.60 |
| Albumine | 48 | 45 | 47 | g/L | 35-50 |
| Bilirubine | 8 | 10 | 13 | μmol/L | < 22 |
| Sodium | 139 | 141 | 140 | mmol/L | 135-147 |
| Potassium | 4 | 4.3 | 3.9 | mmol/L | 3.5-5.5 |
| Chlorure | 106 | 107 | 105 | mmol/L | 100-110 |
| Phosphatase alcaline | 77 | 69 | 71 | U/L | 45-129 |
| LDH | 139 | 135 | 144 | U/L | 120-246 |
| GGT | 18 | 19 | 20 | U/L | 15-73 |
| AST | 18 | 25 | 21 | U/L | 7-37 |
| ALT | 18 | 28 | 19 | U/L | 12-49 |
DISCUSSION
L’utilisation du DCA par voie orale chez le patient atteint d’un mélanome métastatique décrit ici a permis de constater une réduction de la tumeur et une stabilité de la maladie à long terme selon l’état clinique et l’imagerie par tomodensitométrie. La stabilité de la maladie a été maintenue pendant plus de 4 ans lors de la prise de DCA en l’absence de tout traitement conventionnel concomitant, avec une durée de survie depuis le diagnostic initial de 10 ans. Selon les statistiques sur le cancer du SEER de l’Institut national du cancer, la survie de ce patient qui ne présentait aucun signe de métastases à distance n’est pas remarquable (taux de survie à 5 ans de 62,9 % pour le mélanome avec propagation aux ganglions lymphatiques régionaux, https://seer.cancer. gov/statfacts/html/melan.html). Ce qui est remarquable, c’est que dans une situation où les ganglions lymphatiques impliqués étaient clairement en expansion, l’ajout d’un traitement oral au DCA a été efficace pour réduire les ganglions en expansion (Figures 2 et 3) et pour obtenir une rémission de plus de 4 ans. Il est possible que les thérapies anticancéreuses naturelles que le patient a reçues aient été synergiques avec le DCA, mais il est également clair que ces thérapies naturelles ne peuvent pas expliquer à elles seules la régression de la maladie. On a signalé que le DCA avait des effets à la fois apoptotiques et cytostatiques[14,17,19,35,36], ce qui est cohérent avec l’évolution clinique de ce patient, à savoir une régression (apoptotique) et une rémission prolongée (cytostatique). La récidive après 4 ans a coïncidé avec une diminution de l’observance, ce qui suggère que cette méthode de traitement du cancer par DCA nécessite le maintien continu de la pression métabolique. Malgré la récidive, le patient est resté cliniquement bien portant et a prévu de commencer de nouveaux médicaments d’immunothérapie. Il reste à voir si un changement de thérapie peut à nouveau permettre de faire régresser ou de stabiliser la maladie.
Outre le maintien de la rémission pendant plus de 4 ans, ce cas illustre que le DCA peut être bien toléré chez un patient cancéreux pendant une période prolongée, par rapport à tous les essais cliniques publiés sur le DCA pour le cancer. Notamment, ce patient a pu tolérer 17 mg/kg par jour selon un régime de 2 semaines de suite/1 semaine de repos pendant 4 ans avec des effets secondaires minimes. Ceci est similaire à notre précédent rapport de cas d’utilisation chronique de DCA dans le cancer du côlon[37], où le patient a pu tolérer 16 mg/kg par jour (mais pas 25 mg/kg par jour) dans le même régime, mais contraste avec les essais cliniques sur le DCA, qui recommandent une dose plus faible de 10-12,5 mg/kg par jour administrée en continu[9,11]. La pause d’une semaine ou les suppléments neuroprotecteurs peuvent tous deux contribuer à la capacité des patients des rapports de cas à tolérer la dose plus élevée. Les polymorphismes génétiques de la GSTZ1, l’enzyme hépatique qui métabolise le DCA, peuvent également contribuer à la dose de DCA qui peut être tolérée[9,38]. Des niveaux variables de médicament ont été signalés dans les essais, mais tous n’ont pas pris en compte cet aspect pharmacogénétique du traitement par DCA[9,11], et d’autres études sont nécessaires pour préciser si cela contribue de manière significative à la tolérance au DCA. Au moment où nous écrivons ces lignes, un essai humain sur le myélome multiple dû au DCA est en cours, qui examine à la fois les génotypes GSTZ1 et les niveaux de médicament pour contribuer à notre compréhension de ces questions (Australia New Zealand Clinical Trials Register #ACTRN12615000226505, http://www.anzctr. org.au).
Ce rapport de cas montre que le traitement chronique par DCA peut être utilisé sans réduire la qualité de vie, par rapport aux traitements conventionnels du mélanome tels que l’interféron. Afin de déterminer le protocole optimal pour un traitement aigu ou chronique par DCA le plus tolérable possible, des essais sur l’homme sont nécessaires. Mais surtout, il reste à clarifier quelle dose est nécessaire pour obtenir des effets sur la cible qui seront efficaces contre le cancer. Ces informations sont nécessaires avant d’investir dans des études à plus grande échelle et à long terme sur les résultats pour les patients. Le DCA mérite d’être étudié plus avant dans le cadre d’essais cliniques en tant que thérapie non toxique contre le cancer, en raison de son coût modeste et de sa faible toxicité, et mérite d’être considéré comme une thérapie contre le cancer non indiquée sur l’étiquette.
REMERCIEMENTS
Les auteurs souhaitent remercier le Dr Humaira Khan pour son aide, ainsi que la patiente pour son soutien et son consentement à la publication de son cas.
COMMENTAIRES
Caractéristiques du cas
Le patient, un homme de 32 ans, s’est présenté avec une lésion pigmentée sur sa jambe.
Diagnostic clinique
Le patient a été diagnostiqué avec un mélanome.
Diagnostic de laboratoire
Mélanome confirmé par une biopsie d’excision.
Diagnostic d’imagerie
Ganglion inguinal élargi confirmé comme étant impliqué dans le mélanome (biopsie à l’aiguille).
Diagnostic pathologique
Mélanome, BRAF positif.
Traitement
Excision de la lésion primaire avec greffe de peau, dissection du ganglion sentinelle, excisions multiples des métastases cutanées récurrentes. Arrêt de la thérapie traditionnelle et début des thérapies naturelles anticancéreuses (AHCC, racine de pissenlit, curcumine, racine d’astragale, vitamine C i.v., gui européen s.c.). Progression après 3 mois, ajout de dichloroacétate (DCA). Régression et rémission après l’ajout de DCA pendant plus de 4 ans.
Rapports connexes
Les rapports de tomographie assistée par ordinateur montrent l’évolution de la maladie et la réponse aux thérapies.
Explication des termes
DCA : Dichloroacétate de sodium ; RECIST : Response evaluation criteria for solid tumours ; ECOG : Eastern cooperative oncology group ; SEER : Surveillance, epidemiology and end results.
Expériences et enseignements
Le DCA peut agir comme un médicament pro-apoptotique et cytostatique, et peut ainsi obtenir une régression ainsi qu’une stabilisation à long terme du cancer métastatique sans effets secondaires graves, comme l’illustre ce cas de mélanome.
Peer-review
Le Dr Khan a décrit le cas d’un homme de 32 ans qui a reçu un traitement au DCA, avec d’autres médicaments provenant de thérapeutes naturels, et qui a été maintenu dans un état de stabilisation (mélanome métastatique) pendant plus de 4 ans. Il s’agit d’un cas intéressant.
RÉFÉRENCES
1 Bonnet S, Archer SL, Allalunis-Turner J, Haromy A, Beaulieu C, Thompson R, Lee CT, Lopaschuk GD, Puttagunta L, Bonnet S, Harry G, Hashimoto K, Porter CJ, Andrade MA, Thebaud B, Michelakis ED. A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth. Cancer Cell 2007 ; 11 : 37-51 [PMID : 17222789 DOI : 10.1016/ j.ccr.2006.10.020]
2 Stacpoole PW, Kurtz TL, Han Z, Langaee T. Role of dichloroacetate in the treatment of genetic mitochondrial diseases. Adv Drug Deliv Rev 2008 ; 60 : 1478-1487 [PMID : 18647626 DOI : 10.1016/ j.addr.2008.02.014]
3 Stacpoole PW, Gilbert LR, Neiberger RE, Carney PR, Valenstein E, Theriaque DW, Shuster JJ. Évaluation du traitement à long terme des enfants atteints d’acidose lactique congénitale par le dichloroacétate. Pediatrics 2008 ; 121 : e1223-e1228 [PMID : 18411236 DOI : 10.1542/ peds.2007-2062]
4 Stacpoole PW, Kerr DS, Barnes C, Bunch ST, Carney PR, Fennell EM, Felitsyn NM, Gilmore RL, Greer M, Henderson GN, Hutson AD, Neiberger RE, O’Brien RG, Perkins LA, Quisling RG, Shroads AL, Shuster JJ, Silverstein JH, Theriaque DW, Valenstein E. Controlled clinical trial of dichloroacetate for treatment of congenital lactic acidosis in children. Pediatrics 2006 ; 117 : 1519-1531 [PMID : 16651305 DOI : 10.1542/peds.2005-1226]
5 Berendzen K, Theriaque DW, Shuster J, Stacpoole PW. Potentiel thérapeutique du dichloroacétate pour la déficience du complexe pyruvate déshydrogénase. Mitochondrion 2006 ; 6 : 126-135 [PMID : 16725381 DOI : 10.1016/j.mito.2006.04.001]
6 Kaufmann P, Engelstad K, Wei Y, Jhung S, Sano MC, Shungu DC, Millar WS, Hong X, Gooch CL, Mao X, Pascual JM, Hirano M, Stacpoole PW, DiMauro S, De Vivo DC. Le dichloroacétate provoque une neuropathie toxique dans le cadre de MELAS : un essai clinique randomisé et contrôlé. Neurology 2006 ; 66 : 324-330 [PMID : 16476929 DOI : 10.1212/01. wnl.0000196641.05913.27]
7 Brandsma D, Dorlo TP, Haanen JH, Beijnen JH, Boogerd W. Encéphalopathie et polyneuropathie sévères induites par le dichloroacétate. J Neurol 2010 ; 257 : 2099-2100 [PMID : 20632025 DOI : 10.1007/ s00415-010-5654-9]
8 Michelakis ED, Sutendra G, Dromparis P, Webster L, Haromy A, Niven E, Maguire C, Gammer TL, Mackey JR, Fulton D, Abdulkarim B, McMurtry MS, Petruk KC. Modulation métabolique du glioblastome avec le dichloroacétate. Sci Transl Med 2010 ; 2 : 31ra34 [PMID : 20463368 DOI : 10.1126/scitranslmed.3000677]
9 Dunbar EM, Coats BS, Shroads AL, Langaee T, Lew A, Forder JR, Shuster JJ, Wagner DA, Stacpoole PW. Essai de phase 1 du dichloroacétate (DCA) chez les adultes atteints de tumeurs cérébrales malignes récurrentes. Invest New Drugs2014 ; 32 : 452-464 [PMID : 24297161 DOI : 10.1007/ s10637-013-0047-4]
10 Garon EB, Christofk HR, Hosmer W, Britten CD, Bahng A, Crabtree MJ, Hong CS, Kamranpour N, Pitts S, Kabbinavar F, Patel C, von Euw E, Black A, Michelakis ED, Dubinett SM, Slamon DJ. Le dichloroacétate doit être envisagé avec une chimiothérapie à base de platine dans les tumeurs hypoxiques plutôt qu’en tant qu’agent unique dans le cancer du poumon non à petites cellules avancé. J Cancer Res Clin Oncol 2014 ; 140 : 443-452 [PMID : 24442098 DOI : 10.1007/s00432-014-1583-9]
11 Chu QS, Sangha R, Spratlin J, Vos LJ, Mackey JR, McEwan AJ, Venner P, Michelakis ED. Une étude de phase I ouverte, à bras unique et à dose progressive du dichloroacétate (DCA) chez des patients atteints de tumeurs solides avancées. Invest New Drugs 2015 ; 33 : 603-610 [PMID : 25762000 DOI : 10.1007/s10637-015-0221-y]
12 Kankotia S, Stacpoole PW. Le dichloroacétate et le cancer : un nouveau foyer pour un médicament orphelin ? Biochim Biophys Acta 2014 ; 1846 : 617-629 [PMID : 25157892 DOI : 10.1016/j.bbcan.2014.08.005]
13 Sun RC, Board PG, Blackburn AC. Cibler le métabolisme avec le trioxyde d’arsenic et le dichloroacétate dans les cellules du cancer du sein. Mol Cancer 2011 ; 10 : 142 [PMID : 22093145 DOI : 10.1186/1476-4598-10-142]
14 Stockwin LH, Yu SX, Borgel S, Hancock C, Wolfe TL, Phillips LR, Hollingshead MG, Newton DL. Le dichloroacétate de sodium cible sélectivement les cellules présentant des défauts dans l’ETC mitochondrial. Int J Cancer 2010 ; 127 : 2510-2519 [PMID : 20533281 DOI : 10.1002/ijc.25499]
15 Gang BP, Dilda PJ, Hogg PJ, Blackburn AC. Ciblage de deux aspects du métabolisme dans le traitement du cancer du sein. Cancer Biol Ther 2014 ; 15 : 1533-1541 [PMID : 25482950 DOI : 10.4161/15384047.2014.955992]
16 Sutendra G, Dromparis P, Kinnaird A, Stenson TH, Haromy A, Parker JM, McMurtry MS, Michelakis ED. L’activation mitochondriale par l’inhibition de PDKII supprime la signalisation HIF1a et l’angiogenèse dans le cancer.Oncogene 2013 ; 32 : 1638-1650 [PMID : 22614004 DOI : 10.1038/onc.2012.198]
17 Cairns RA, Bennewith KL, Graves EE, Giaccia AJ, Chang DT, Denko NC. L’hypoxie tumorale pharmacologiquement accrue peut être mesurée par la tomographie par émission de positons au 18F-Fluoroazomycine arabinoside et améliore la réponse tumorale à la cytotoxine hypoxique PR-104. Clin Cancer Res 2009 ; 15 : 7170-7174 [PMID : 19920111 DOI : 10.1158/1078-0432.CCR-09-1676]
18 Anderson KM, Jajeh J, Guinan P, Rubenstein M. In vitro effects of dichloroacetate and CO2 on hypoxic HeLa cells. Anticancer Res 2009 ; 29 : 4579-4588 [PMID : 20032407]
19 Sun RC, Fadia M, Dahlstrom JE, Parish CR, Board PG, Blackburn AC. L’inversion du phénotype glycolytique par le dichloroacétate inhibe la croissance des cellules métastatiques du cancer du sein in vitro et in vivo. Breast Cancer Res Treat 2010 ; 120 : 253-260 [PMID : 19543830 DOI : 10.1007/ s10549-009-0435-9]
20 De Grandis D. Acetyl-L-carnitine for the treatment of cheminduced peripheral neuropathy : a short review. CNS Drugs 2007 ; 21 Suppl 1 : 39-43 ; discussion 45-46 [PMID : 17696592]
21 Maestri A, De Pasquale Ceratti A, Cundari S, Zanna C, Cortesi E, Crinò L. A pilot study on the effect of acetyl-L-carnitine in paclitaxeland cisplatin-induced peripheral neuropathy. Tumori 2005 ; 91 : 135-138 [PMID : 15948540]
22 Evans JD, Jacobs TF, Evans EW. Role of acetyl-L-carnitine in the treatment of diabetic peripheral neuropathy. Ann Pharmacother 2008 ; 42 : 1686-1691 [PMID : 18940920 DOI : 10.1345/aph.1L201]
23 Mijnhout GS, Kollen BJ, Alkhalaf A, Kleefstra N, Bilo HJ. L’acide alpha lipoïque pour la neuropathie périphérique symptomatique chez les patients diabétiques : une méta-analyse des essais contrôlés randomisés. Int J Endocrinol 2012 ; 2012 : 456279 [PMID : 22331979 DOI : 10.1155/2012/456279]
24 Liu F, Zhang Y, Yang M, Liu B, Shen YD, Jia WP, Xiang KS. [Effet curatif de l’acide alpha-lipoïque sur la neuropathie périphérique dans le diabète de type 2 : une étude clinique]. Zhonghua Yixue Zazhi 2007 ; 87 : 2706-2709 [PMID : 18167250]
25 Ziegler D, Hanefeld M, Ruhnau KJ, Meissner HP, Lobisch M, Schütte K, Gries FA. Traitement de la neuropathie périphérique diabétique symptomatique avec l’acide alpha-lipoïque, un antioxydant. A 3-week multicentre randomized controlled trial (ALADIN Study). Diabetologia 1995 ; 38 : 1425-1433 [PMID : 8786016]
26 Winkler G, Kempler P. [Pathomechanism of diabetic neuropathy : background of the pathogenesis-oriented therapy]. Orv Hetil 2010 ; 151 : 971-981 [PMID : 20519180 DOI : 10.1556/OH.2010.28898]
27 Ang CD, Alviar MJ, Dans AL, Bautista-Velez GG, Villaruz-Sulit MV, Tan JJ, Co HU, Bautista MR, Roxas AA. Vitamine B pour le traitement de la neuropathie périphérique. Cochrane Database Syst Rev 2008 ; (3) : CD004573 [PMID : 18646107 DOI : 10.1002/14651858.CD004573. pub3]
28 Winkler G, Pál B, Nagybéganyi E, Ory I, Porochnavec M, Kempler P. Effectiveness of different benfotiamine dosage regimens in the treatment of painful diabetic neuropathy. Arzneimittelforschung 1999 ; 49 : 220-224 [PMID : 10219465 DOI : 10.1055/s-0031-1300405]
29 Ignacio RM, Kim CS, Kim YD, Lee HM, Qi XF, Kim SK. Effet thérapeutique du composé actif corrélé à l’hexose (AHCC) combiné au CpG-ODN (oligodéoxynucléotide) dans le modèle murin de mélanome B16. Cytokine 2015 ; 76 : 131-137 [PMID : 26082022 DOI : 10.1016/j.cyto.2015.06.002]
30 Chatterjee SJ, Ovadje P, Mousa M, Hamm C, Pandey S. L’efficacité de l’extrait de racine de pissenlit dans l’induction de l’apoptose dans les cellules de mélanome humain résistantes aux médicaments. Evid Based Complement Alternat Med 2011 ; 2011 : 129045 [PMID : 21234313 DOI : 10.1155/2011/129045]
31 Mirzaei H, Naseri G, Rezaee R, Mohammadi M, Banikazemi Z, Mirzaei HR, Salehi H, Peyvandi M, Pawelek JM, Sahebkar A. Curcumin : Un nouveau candidat pour la thérapie du mélanome ? Int J Cancer 2016 ; 139 : 1683-1695 [PMID : 27280688 DOI : 10.1002/ijc.30224]
32 Huang XY, Zhang SZ, Wang WX. Efficacité antitumorale accrue par l’administration combinée d’astragale et de ptérostilbène pour le mélanome. Asian Pac J Cancer Prev 2014 ; 15 : 1163-1169 [PMID : 24606435]
33 Wagner SC, Markosian B, Ajili N, Dolan BR, Kim AJ, Alexandrescu DT, Dasanu CA, Minev B, Koropatnick J, Marincola FM, Riordan NH. L’acide ascorbique intraveineux comme adjuvant à l’immunothérapie par interleukine-2. J Transl Med 2014 ; 12 : 127 [PMID : 24884532 DOI:10.1186/1479-5876-12-127]
34 Horneber MA, Bueschel G, Huber R, Linde K, Rostock M. Mistletoe therapy in oncology. Cochrane Database Syst Rev 2008 ; (2) : CD003297 [PMID : 18425885 DOI : 10.1002/14651858.CD003297.pub2]
35 Delaney LM, Ho N, Morrison J, Farias NR, Mosser DD, Coomber BL. Le dichloroacétate affecte la prolifération mais pas la survie des cellules cancéreuses colorectales humaines. Apoptosis 2015 ; 20 : 63-74 [PMID : 25344893 DOI : 10.1007/s10495-014-1046-4]
36 Abildgaard C, Dahl C, Basse AL, Ma T, Guldberg P. La modulation bioénergétique avec le dichloroacétate réduit la croissance des cellules de mélanome et potentialise leur réponse à l’inhibition de BRAFV600E. J Transl Med 2014 ; 12 : 247 [PMID : 25182332 DOI : 10.1186/s12967-014-0247-5]
37 Khan A, Andrews D, Blackburn AC. Stabilisation à long terme d’un cancer du côlon de stade 4 à l’aide d’une thérapie au dichloroacétate de sodium. World J Clin Cases 2016 ; 4 : 336-343 [PMID : 27803917]
38 Tzeng HF, Blackburn AC, Board PG, Anders MW. Polymorphismeet inactivation dépendante de l’espèce de la glutathion transférase zeta par le dichloroacétate. Chem Res Toxicol 2000 ; 13 : 231-236 [PMID : 10775321]