Akbar Khan, Doug Andrews, Jill Shainhouse, Anneke C Blackburn
Akbar Khan, Douglas Andrews, Medicor Cancer Centres Inc., Toronto, ON M2N 6N4, Canada
Jill Shainhouse, Insight Naturopathic Clinic, Toronto, ON M4P 1N9, Canada
Anneke C Blackburn, Scuola di Ricerca Medica John Curtin, Università Nazionale Australiana, Canberra, ACT 2601, Australia
Contributi degli autori: Khan A ha curato il paziente e ha scritto la maggior parte del rapporto sul caso; Andrews D ha assistito nello sviluppo del protocollo di farmaci naturali per la riduzione degli effetti collaterali del DCA e ha scritto una parte del rapporto sul caso; Shainhouse J ha trattato il paziente con la terapia naturale; Blackburn AC ha interpretato il rapporto sul caso nel contesto della letteratura sulla ricerca in vitro e in vivo sul DCA, ha scritto parti dell’introduzione e della discussione e ha rivisto il manoscritto nel suo complesso.
Dichiarazione di consenso informato: La paziente descritta in questo manoscritto ha dato il consenso a pubblicare il suo caso in forma anonima.
Dichiarazione di conflitto di interessi: Uno degli autori (Khan) somministra la terapia con dicloroacetato per i pazienti oncologici attraverso i centri oncologici Medicor a titolo oneroso e senza scopo di lucro. La clinica è di proprietà di un membro della famiglia di questo autore. Gli altri autori non hanno nulla da rivelare.
Accesso libero: Questo articolo è un articolo ad accesso aperto che è stato selezionato da un redattore interno e sottoposto a revisione paritaria da parte di revisori esterni. È distribuito in conformità alla licenza Creative Commons Attribuzione Non Commerciale (CC BY-NC 4.0), che consente ad altri di distribuire, remixare, adattare, costruire su quest’opera in modo non commerciale e di concedere in licenza le loro opere derivate a condizioni diverse, a condizione che l’opera originale sia adeguatamente citata e che l’uso sia non commerciale. Vedi: http://creativecommons.org/licenses/by-nc/4.0/
Fonte del manoscritto: Manoscritto su invito
Corrispondenza a: Akbar Khan, MD, Direttore medico,
Medicor Cancer Centres Inc., 4576 Yonge St., Suite 301, Toronto,
ON M2N 6N4, Canada. [email protected]
Telefono: +1-416-2270037
Fax: +1-416-2271915
Ricevuto: 30 gennaio 2017
Inizio revisione paritaria: 12 febbraio 2017
Prima decisione: 28 marzo 2017
Rivisto: 5 maggio 2017
Accettato: 30 maggio 2017
Articolo in stampa: 31 maggio 2017
Pubblicato online: 10 agosto 2017
Abstract
Il dicloroacetato di sodio (DCA) è stato studiato come terapia metabolica del cancro dal 2007, sulla base di una pubblicazione di Bonnet et al che dimostrava che il DCA può indurre l’apoptosi (morte cellulare programmata) in cellule umane di cancro al seno, al polmone e al cervello. Classicamente, la risposta del cancro a una terapia medica nella ricerca sull’uomo viene misurata in base alle definizioni del Response Evaluation Criterial for Solid Tumours, che definiscono la “risposta” in base al grado di riduzione del tumore o di scomparsa del tumore sulla diagnostica per immagini, ma anche la stabilizzazione della malattia è un risultato clinico vantaggioso. È stato dimostrato che il DCA può funzionare come agente citostatico in vitro e in vivo, senza causare apoptosi. Viene presentato il caso di un uomo di 32 anni in cui la terapia con DCA, senza alcuna terapia convenzionale concomitante, ha portato alla regressione e alla stabilizzazione del melanoma metastatico ricorrente per oltre 4 anni, con effetti collaterali trascurabili. Questo caso dimostra che il DCA può essere utilizzato per ridurre il volume della malattia e mantenere la stabilità a lungo termine nei pazienti con melanoma avanzato.
Parole chiave: Dicloroacetato; Cancro; BRAF; Melanoma; Citostatico
© L’autore/i 2017. Pubblicato da Baishideng Publishing Group Inc. Tutti i diritti riservati.
Suggerimento di base: il dicloroacetato di sodio (DCA) è stato studiato come terapia metabolica del cancro dal 2007. È stato dimostrato che la terapia con DCA può determinare una risposta classica, misurata dalla riduzione o dalla scomparsa dei tumori sulla diagnostica per immagini. Tuttavia, il DCA può anche arrestare la crescita delle cellule tumorali senza causare apoptosi (effetto citostatico). Questo può portare a una stabilizzazione a lungo termine del tumore metastatico. Presentiamo un caso di terapia orale con DCA che ha portato alla riduzione e alla stabilizzazione del melanoma metastatico in un uomo di 32 anni per oltre 4 anni, con effetti collaterali minori.
Khan A, Andrews D, Shainhouse J, Blackburn AC. Stabilizzazione a lungo termine del melanoma metastatico con dicloroacetato di sodio.
World J Clin Oncol 2017; 8(4): 371-377
Disponibile da: URL: http://www.wjgnet.com/2218-4333/full/v8/i4/371.htm
DOI: http://dx.doi.org/10.5306/wjco.v8.i4.371
INTRODUZIONE
Il dicloroacetato di sodio (DCA) ha attirato l’attenzione della comunità medica nel 2007, quando Bonnet et al[1] hanno pubblicato il primo studio in vitro e in vivo che illustrava il valore del DCA come terapia metabolica del cancro, attraverso la sua azione inibitoria sull’enzima mitocondriale piruvato deidrogenasi chinasi. In precedenza, Stacpoole et al[2-4] avevano pubblicato diversi studi sul DCA per il trattamento dell’acidosi lattica congenita nelle malattie mitocondriali[2-5]. Questi studi hanno dimostrato che il DCA orale è un farmaco sicuro per l’uso umano. Il DCA è risultato privo di tossicità renale, polmonare, midollare e cardiaca[4]. La maggior parte degli effetti collaterali del DCA sono stati modesti e il più grave è stato la neuropatia periferica reversibile[6]. È stato riportato anche un delirio reversibile[7]. In una piccola percentuale di pazienti è stato osservato un innalzamento degli enzimi epatici (asintomatico e reversibile)[3]. La precedente ricerca sull’uomo nei disturbi mitocondriali ha permesso di tradurre rapidamente il DCA nell’uso umano come terapia antitumorale off-label. Sono stati pubblicati diversi rapporti di studi clinici che utilizzano il DCA come terapia antitumorale, confermando il suo profilo di sicurezza e indicando un crescente riconoscimento della potenziale utilità del DCA nella clinica oncologica[8-11]. Un limite di questi studi, che hanno coinvolto pazienti in fase avanzata, è che hanno riportato solo trattamenti per brevi periodi di tempo.
Nella pubblicazione di Bonnet del 2007[1], è stato dimostrato che il trattamento con DCA riduce il potenziale di membrana mitocondriale, promuovendo l’apoptosi in modo selettivo nelle cellule tumorali umane. L’inibizione della glicolisi aerobica (effetto Warburg) e l’attivazione del canale ionico del potassio mitocondriale sono stati identificati come meccanismi d’azione del DCA. Ulteriori indagini sul DCA in vitro hanno confermato l’attività antitumorale contro un’ampia gamma di tipi di cancro, recentemente esaminata da Kankotia e Stacpoole[12]. Inoltre, il DCA è anche in grado di potenziare l’apoptosi se combinato con altri agenti[13-15]. Sono state suggerite anche altre azioni antitumorali del DCA, tra cui l’inibizione dell’angiogenesi[16], l’alterazione dell’espressione di HIF1-α[17], l’alterazione dei regolatori del pH cellulare V-ATPasi e MCT1 e di altri regolatori della sopravvivenza cellulare come p53 e PUMA[18]. Tuttavia, molti studi in vitro utilizzano concentrazioni irragionevolmente elevate di DCA, non raggiungibili clinicamente, nel tentativo di dimostrare l’attività citotossica[12]. In altri studi sono state utilizzate concentrazioni di DCA più modeste, dimostrando che il DCA può essere citostatico. Il secondo rapporto del 2010 sulla sua attività antitumorale in vivo ha rilevato che il DCA da solo è citostatico in un modello metastatico di cancro al seno[19], inibendo la proliferazione senza innescare l’apoptosi. Ciò suggerisce un ruolo del DCA come stabilizzatore del cancro, simile a quello degli inibitori dell’angiogenesi.
In risposta al rapporto del 2007 sulle azioni antitumorali del DCA, Khan ha iniziato a utilizzare il DCA per il trattamento di pazienti oncologici con prognosi breve o che avevano smesso di rispondere alle terapie oncologiche convenzionali. In collaborazione con un medico naturopata (Andrews) è stato sviluppato un protocollo di farmaci naturali per affrontare la tossicità neurologica del DCA, che limita la dose. Si trattava di 3 farmaci: Acetil L-carnitina[20-22], acido R-alfa lipoico[23-25] e benfotiamina[26-28], per la prevenzione della neuropatia e dell’encefalopatia. In oltre 300 pazienti affetti da cancro in fase avanzata, i dati osservazionali hanno rivelato che la terapia con DCA ha apportato benefici nel 60%-70% dei casi. Il rischio di neuropatia quando i farmaci neuroprotettivi naturali sono stati combinati con il DCA è stato di circa il 20% utilizzando un dosaggio di 20-25 mg/kg al giorno con un ciclo di 2 settimane di assunzione e 1 settimana di sospensione (dati clinici osservazionali pubblicati online su www.medicorcancer.com). Qui viene presentato il caso di un paziente che illustra gli effetti apoptotici e antiproliferativi del trattamento cronico con DCA per un periodo di oltre quattro anni.
RAPPORTO DI CASO
Un uomo di 32 anni, precedentemente sano e di carnagione chiara, ha notato inizialmente che un neo sul polpaccio sinistro ha iniziato a cambiare nel 2006. Ha consultato un medico e il neo è stato asportato. È stata fatta una diagnosi patologica di melanoma. È stata eseguita una dissezione del linfonodo sentinella, che è risultata negativa per la malattia metastatica. Nel 2007, il paziente ha notato un ingrossamento dei linfonodi inguinali di sinistra e piccole lesioni melanocitarie sulla pelle della gamba sinistra. È stato trattato con interferone alfa nell’ambito di uno studio clinico presso un ospedale oncologico regionale, con riduzione dei linfonodi e risoluzione delle metastasi cutanee. L’interferone è stato interrotto dopo 9 mesi a causa degli effetti collaterali.
La paziente è rimasta bene fino al 2010, quando è comparsa una nuova metastasi cutanea alla gamba sinistra. Questa è stata asportata chirurgicamente. Alla fine del 2011, è stata identificata un’altra metastasi cutanea alla gamba sinistra, all’interno della cicatrice dell’intervento chirurgico originale per il melanoma. Questa è stata sottoposta a biopsia e la diagnosi di melanoma ricorrente è stata confermata. Il paziente è stato quindi trattato con un’ampia escissione e un trapianto di pelle.
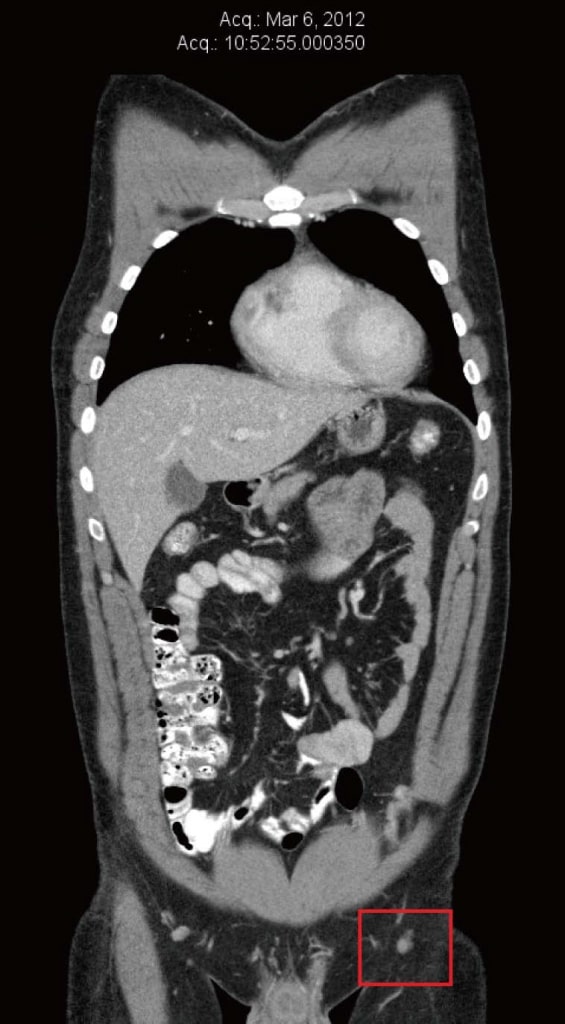
Nel marzo 2012, al paziente è stata diagnosticata una recidiva all’interno dell’innesto cutaneo della gamba sinistra. Questa è stata escissa ed è stata eseguita una nuova procedura di innesto cutaneo. L’esame patologico ha rivelato margini positivi della metastasi escissa, quindi è stata eseguita una nuova escissione, sempre con margini positivi. Contemporaneamente, l’agobiopsia di un linfonodo inguinale sinistro ha confermato la presenza di un melanoma metastatico BRAF-positivo. Una tomografia computerizzata (TC) eseguita nel marzo 2012 non ha rivelato alcuna evidenza di metastasi a distanza. Il linfonodo inguinale sinistro più grande aveva un diametro di 8 mm, che è stato definito “insignificante secondo i criteri dimensionali” (Figura 1).
Nell’aprile 2012, la paziente ha consultato un medico naturopata (Shainhouse) e ha iniziato una terapia con i seguenti agenti antitumorali naturali per via orale: Composto esoso correlato attivo o AHCC (estratto di fungo)[29], radice di tarassaco[30], curcumina[31] e radice di astragalo[32]. È stata inoltre avviata una terapia parenterale, che consisteva nell’assunzione di vitamina C per via endovenosa due volte alla settimana[33] e di estratto di vischio europeo per via sottocutanea[34]. Il paziente è passato anche a una dieta vegana.
Nel maggio 2012, il paziente si è recato presso la clinica dell’autore (Khan) con l’intenzione di intraprendere ulteriori terapie non tradizionali. È stata discussa la terapia con DCA, ma il paziente ha deciso di fare prima una prova adeguata con le terapie antitumorali naturali (prescritte da Shainhouse). La TAC è stata ripetuta nel maggio 2012 (dopo solo 1 mese di terapia naturale) e ha indicato una lieve crescita di più linfonodi inguinali e iliaci esterni, con dimensioni che variavano da 10 mm × 11 mm a 14 mm × 15 mm.
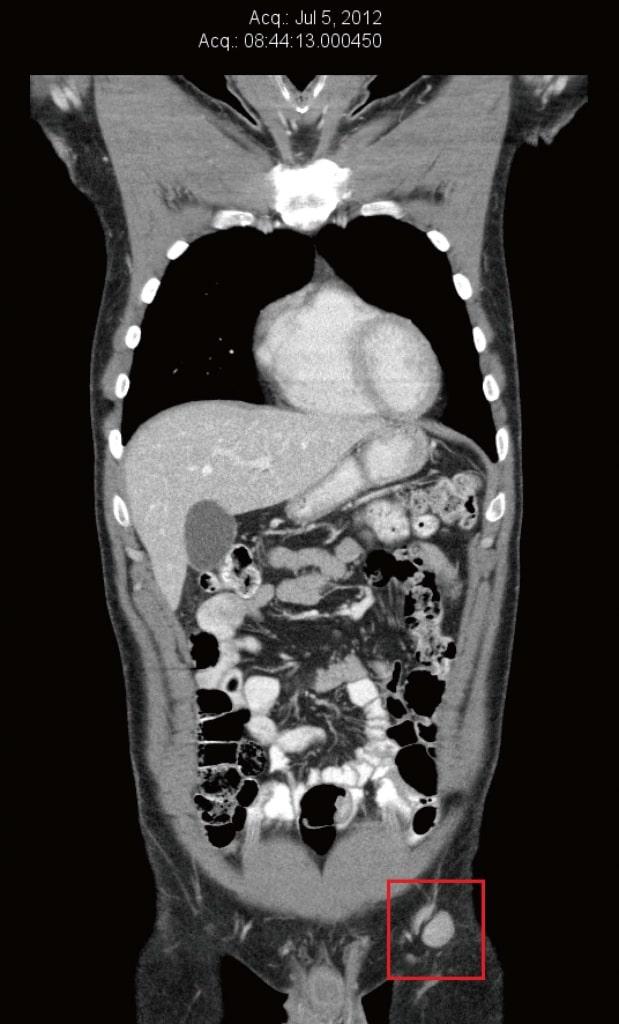
Nel luglio 2012 è stata ripetuta la TC per valutare le terapie naturali antitumorali della paziente. In quell’occasione, i linfonodi inguinali ed iliaci esterni di sinistra si erano nuovamente ingranditi, con dimensioni comprese tra 13 mm × 16 mm e 22 mm × 20 mm (Figura 2). È stata eseguita anche una PET in preparazione all’ingresso in uno studio clinico a Boston, MA (Stati Uniti), che ha confermato un aumento della captazione di glucosio nei linfonodi inguinali di sinistra. È stato riscontrato un nuovo dolore doloroso di bassa intensità (2/10) nella regione inguinale sinistra. L’esame ha rivelato un linfonodo inguinale sinistro di 20 mm non tenace e due piccole metastasi cutanee all’interno dell’innesto cutaneo del polpaccio sinistro.
Al paziente è stata quindi diagnosticata una progressione della malattia. A quel punto ha deciso di iniziare la terapia con DCA. Ha iniziato a somministrare DCA per via orale 500 mg 3 volte al giorno, equivalente a 17 mg/kg al giorno (produttore: Tokyo Chemical Industry, Stati Uniti), oltre a mantenere le altre terapie naturali. Il ciclo di trattamento con DCA era di 2 settimane di assunzione e 1 di sospensione. Per ridurre al minimo gli effetti collaterali del DCA, sono stati prescritti altri 3 farmaci naturali: Acetil L-carnitina orale 500 mg 3 volte al giorno, benfotiamina orale 80 mg due volte al giorno e acido R-alfa lipoico orale 150 mg 3 volte al giorno. Questi integratori sono stati assunti quotidianamente (senza ciclo). Sono stati eseguiti gli esami del sangue di routine (Tabella 1). Erano tutti normali, tranne un basso livello di creatinina che è stato ritenuto insignificante.
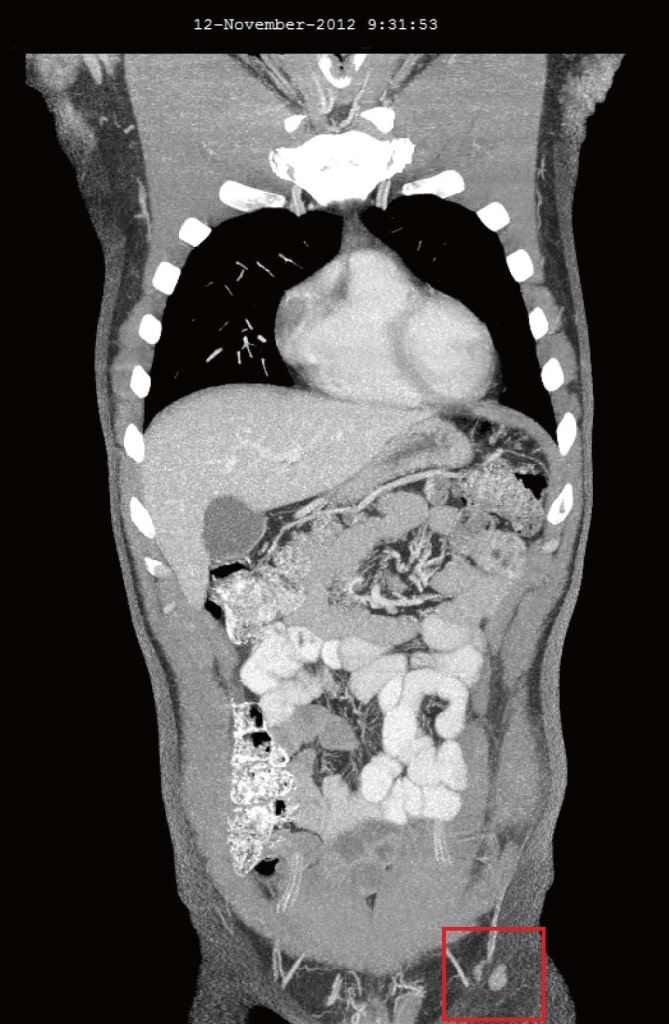
Nel novembre 2012, 4 mesi dopo l’aggiunta del DCA alle terapie antitumorali naturali originali, il paziente è stato rivalutato. Si sentiva generalmente bene. Due nuovi sintomi sono stati riferiti solo dopo l’inizio della terapia con DCA: Una lieve riduzione della sensibilità della punta delle dita delle mani e dei piedi e una lieve riduzione della capacità di concentrazione durante le due settimane di assunzione del DCA. La lieve perdita sensoriale non è peggiorata ed è stata ritenuta una lieve neuropatia legata al DCA. Sia l’intorpidimento che la riduzione della concentrazione si sono risolti nelle settimane in cui il paziente ha sospeso l’assunzione di DCA. L’esame del sangue di ottobre 2012 non ha mostrato cambiamenti significativi (Tabella 1). Le TAC di agosto 2012 e novembre 2012 hanno rivelato una regressione significativa di tutti i linfonodi precedentemente ingrossati. Il linfonodo più grande era di 10 mm, non c’era evidenza di malattia intra-toracica o intra-addominale, né di metastasi ossee (Figura 3).
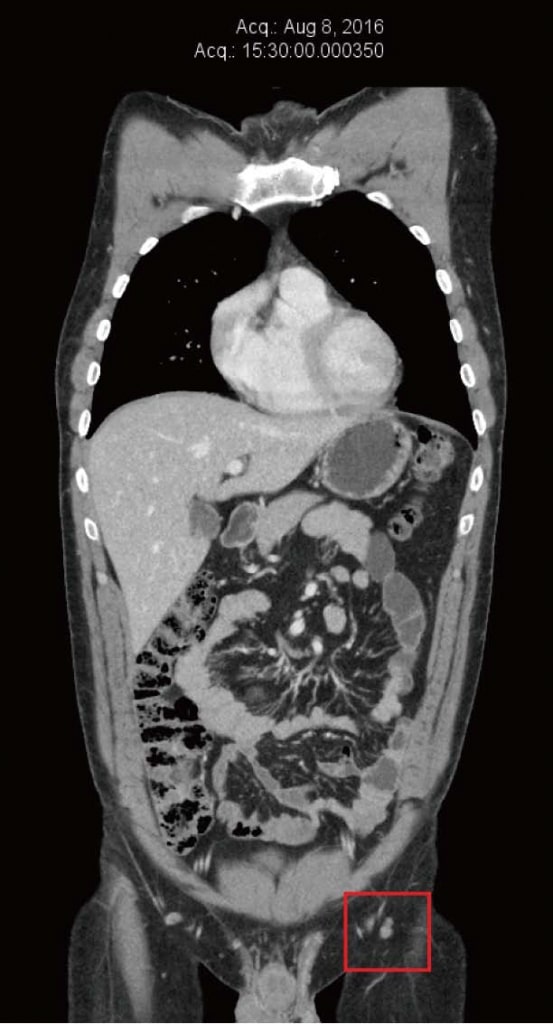
Il paziente ha continuato a sentirsi bene durante la terapia con DCA e non ha notato nuove metastasi cutanee o un nuovo ingrossamento dei linfonodi inguinali. Ha continuato a sottoporsi a frequenti controlli clinici con il suo medico naturopata (Shainhouse) e a controlli annuali con il suo medico (Khan). Le terapie naturali anticancro elencate (prescritte da Shainhouse) e la terapia con DCA sono state mantenute nel 2016. I risultati degli esami del sangue a giugno 2016 continuavano a essere normali (Tabella 1). La TAC è stata ripetuta nell’agosto 2016, non mostrando alcuna evidenza di melanoma metastatico, dopo ben 4 anni di terapia DCA in corso, combinata con una terapia antitumorale naturale (Figura 4). A dicembre 2016, il paziente ha riferito un aumento dello stress legato al lavoro e una riduzione della compliance ai farmaci. In quel periodo ha notato una nuova massa inguinale sinistra. È stata eseguita un’ecografia che ha rivelato un nuovo conglomerato di linfonodi ingrossati di 40 mm × 25 mm × 23 mm, con un color Doppler che mostrava un flusso sanguigno all’interno della massa. Questo dato è stato interpretato come una ricrescita del melanoma, dopo circa quattro anni e mezzo di terapia continua con DCA. Sono stati eseguiti ulteriori accertamenti, tra cui una PET/CT, che ha confermato la recidiva della malattia in 3 linfonodi inguinali di sinistra (SUVmax compreso tra 13 e 17,8).
In sintesi, il paziente ha ricevuto una terapia convenzionale per il melanoma recidivante di stadio 3 per un periodo di 6 anni, consistente nell’escissione chirurgica primaria con dissezione linfonodale, interferone alfa ed escissioni chirurgiche per metastasi cutanee ricorrenti in 5 occasioni. Il paziente ha poi ricevuto la sola terapia antitumorale naturale (prescritta da Shainhouse) per 3 mesi senza ottenere alcuna risposta, evidenziata da una costante progressione della malattia su scansioni TC seriali. Infine, il paziente ha aggiunto alla terapia antitumorale naturale la terapia orale con DCA, con 3 farmaci neuroprotettivi concomitanti (acido lipoico, acetil L-carnitina e benfotiamina) e nessuna terapia antitumorale convenzionale concomitante. Il risultato è stato una remissione radiologica completa durata oltre 4 anni, seguita da una recidiva. Nel corso della terapia con DCA, il paziente ha manifestato effetti collaterali banali, consistenti in una lieve neuropatia e in una leggera riduzione della concentrazione. Il paziente ha mantenuto il livello di funzionalità ECOG 0 ed è stato in grado di lavorare a tempo pieno.
Tabella 1 Pannello ematico prima della terapia con dicloroacetato di sodio
| Esame del sangue | 12 luglio pre-DCA | 12 ottobre 3 mesi DCA | 16 giugno 4 anni DCA | Unità | Intervallo di normalità |
|---|---|---|---|---|---|
| Emoglobina | 154 | 150 | 157 | g/L | 135-175 |
| Conta dei globuli bianchi | 4.5 | 4.1 | 5 | ×109/L | 4.0-11.0 |
| Piastrine | 220 | 214 | 229 | ×109/L | 150-400 |
| Glucosio | – | 4.6 | 4.9 | mmol/L | 3.6-7.7 |
| Urea | 3.9 | 3.2 | 3.9 | mmol/L | 2.5-8.0 |
| Creatinina | 491 | 501 | 551 | μmol/L | 62-115 |
| Calcio | 2.47 | 2.41 | 2.47 | mmol/L | 2.15-2.60 |
| Albumina | 48 | 45 | 47 | g/L | 35-50 |
| Bilirubina | 8 | 10 | 13 | μmol/L | < 22 |
| Sodio | 139 | 141 | 140 | mmol/L | 135-147 |
| Potassio | 4 | 4.3 | 3.9 | mmol/L | 3.5-5.5 |
| Cloruro | 106 | 107 | 105 | mmol/L | 100-110 |
| Fosfatasi alcalina | 77 | 69 | 71 | U/L | 45-129 |
| LDH | 139 | 135 | 144 | U/L | 120-246 |
| GGT | 18 | 19 | 20 | U/L | 15-73 |
| AST | 18 | 25 | 21 | U/L | 7-37 |
| ALT | 18 | 28 | 19 | U/L | 12-49 |
DISCUSSIONE
L’uso di DCA orale nel paziente con melanoma metastatico qui descritto ha dimostrato la contrazione del tumore e la stabilità della malattia a lungo termine in base allo stato clinico e all’imaging TC. La stabilità della malattia è stata mantenuta per oltre 4 anni durante l’assunzione di DCA in assenza di una terapia convenzionale concomitante, con un tempo di sopravvivenza dalla diagnosi iniziale di 10 anni. Secondo le statistiche sul cancro del National Cancer Institute (SEER), la sopravvivenza di questo paziente che non ha mostrato alcuna evidenza di metastasi a distanza non è notevole (62,9% di tasso di sopravvivenza a 5 anni per melanoma con diffusione ai linfonodi regionali, https://seer.cancer. gov/statfacts/html/melan.html). Ciò che è degno di nota è che in una situazione in cui i linfonodi coinvolti si stavano chiaramente ingrandendo, l’aggiunta della terapia orale con DCA è stata efficace nel ridurre l’ingrossamento dei linfonodi (Figure 2 e 3) e nel raggiungere una remissione di oltre 4 anni. È possibile che le terapie naturali antitumorali somministrate al paziente abbiano agito in sinergia con il DCA, ma è anche chiaro che queste terapie naturali da sole non possono spiegare la regressione della malattia. È stato riportato che il DCA ha effetti sia apoptotici che citostatici[14,17,19,35,36], il che è coerente con il decorso clinico di questo paziente, caratterizzato da regressione (apoptotica) e remissione prolungata (citostatica). La recidiva dopo 4 anni ha coinciso con una riduzione della compliance, suggerendo che questo metodo di gestione del cancro con DCA richiede il mantenimento continuo della pressione metabolica. Nonostante la recidiva, il paziente è rimasto clinicamente in buona salute e ha pianificato l’inizio di nuovi farmaci immunoterapici. Resta da vedere se un cambio di terapia possa nuovamente ottenere una regressione o una stabilità della malattia.
Oltre al mantenimento della remissione per oltre 4 anni, questo caso illustra che il DCA può essere ben tollerato in un paziente oncologico per un periodo di tempo prolungato, rispetto a tutti gli studi clinici sul cancro con DCA pubblicati. In particolare, questo paziente è stato in grado di tollerare 17 mg/kg al giorno in un regime di 2 settimane sì e 1 no per 4 anni con effetti collaterali minimi. Questo è simile al nostro precedente caso di utilizzo cronico di DCA nel cancro del colon[37], in cui il paziente è stato in grado di tollerare 16 mg/kg al giorno (ma non 25 mg/kg al giorno) nello stesso regime, ma contrasta con gli studi clinici sul DCA, che raccomandano una dose inferiore di 10-12,5 mg/kg al giorno somministrata in modo continuo[9,11]. L’interruzione di 1 settimana o i supplementi neuroprotettivi possono entrambi contribuire alla capacità dei pazienti nei case report di tollerare la dose più alta. Anche i polimorfismi genetici del GSTZ1, l’enzima epatico che metabolizza il DCA, possono contribuire alla dose di DCA tollerabile[9,38]. Negli studi sono stati riportati livelli variabili di farmaco, ma non tutti hanno preso in considerazione questo aspetto farmacogenetico della terapia con DCA[9,11], e sono necessari ulteriori studi per chiarire se questo aspetto contribuisce in modo significativo alla tolleranza del DCA. Al momento della stesura di questo articolo, è in corso uno studio sul mieloma multiplo da DCA nell’uomo, che sta esaminando sia i genotipi GSTZ1 sia i livelli di farmaco per contribuire alla comprensione di questi aspetti (Australia New Zealand Clinical Trials Register #ACTRN12615000226505, http://www.anzctr. org.au).
Questo case report dimostra che la terapia cronica con DCA può essere utilizzata senza ridurre la qualità della vita, rispetto alle terapie convenzionali per il melanoma come l’interferone. Per determinare il protocollo ottimale per il trattamento acuto o cronico massimo tollerabile con DCA, sono necessari studi sull’uomo. Ma soprattutto, resta ancora da chiarire quale sia la dose necessaria per ottenere effetti on-target efficaci contro il cancro. Queste informazioni sono necessarie prima di investire in studi più ampi e a lungo termine sui risultati dei pazienti. Il DCA merita ulteriori indagini negli studi clinici come terapia antitumorale non tossica, grazie al suo costo modesto e alla bassa tossicità, e merita di essere preso in considerazione come terapia antitumorale off-label.
RICONOSCIMENTI
Gli autori desiderano ringraziare la dottoressa Humaira Khan per la sua assistenza e la paziente per il suo sostegno e il consenso alla pubblicazione del suo caso.
COMMENTI
Caratteristiche del caso
Il paziente maschio di 32 anni si è presentato con una lesione pigmentata sulla gamba.
Diagnosi clinica
Al paziente è stato diagnosticato un melanoma.
Diagnosi di laboratorio
Melanoma confermato dalla biopsia escissionale.
Diagnosi per immagini
L’ingrossamento del linfonodo inguinale ha confermato il coinvolgimento del melanoma (agobiopsia).
Diagnosipatologica
Melanoma, BRAF positivo.
Trattamento
Escissione della lesione primaria con innesto cutaneo, dissezione del linfonodo sentinella, escissioni multiple di metastasi cutanee ricorrenti. Interruzione della terapia tradizionale e avvio di terapie antitumorali naturali (AHCC, radice di tarassaco, curcumina, radice di astragalo, vitamina C i.v., vischio europeo s.c.). Progressione dopo 3 mesi, aggiunta di dicloroacetato (DCA). Regressione e remissione dopo l’aggiunta di DCA per oltre 4 anni.
Rapporti correlati
I rapporti di tomografia computerizzata dimostrano il decorso della malattia e la risposta alle terapie.
Spiegazione dei termini
DCA: dicloroacetato di sodio; RECIST: Criteri di valutazione della risposta per i tumori solidi; ECOG: Eastern cooperative oncology group; SEER: Surveillance, epidemiology and end results.
Esperienze e insegnamenti
Il DCA può agire come farmaco pro-apoptotico e citostatico e può quindi ottenere la regressione e la stabilizzazione a lungo termine del cancro metastatico senza gravi effetti collaterali, come illustrato da questo caso di melanoma.
Peer-review
Il Dr. Khan ha descritto un uomo di 32 anni che ha ricevuto una terapia a base di DCA, con altri farmaci da terapisti naturali, e si è mantenuto in uno stato di stabilizzazione (melanoma metastatico) per oltre 4 anni. È un caso interessante.
RIFERIMENTI
1 Bonnet S, Archer SL, Allalunis-Turner J, Haromy A, Beaulieu C, Thompson R, Lee CT, Lopaschuk GD, Puttagunta L, Bonnet S, Harry G, Hashimoto K, Porter CJ, Andrade MA, Thebaud B, Michelakis ED. L’asse mitocondrio-canale K+ è soppresso nel cancro e la sua normalizzazione promuove l’apoptosi e inibisce la crescita del cancro. Cancer Cell 2007; 11: 37-51 [PMID: 17222789 DOI: 10.1016/ j.ccr.2006.10.020]
2 Stacpoole PW, Kurtz TL, Han Z, Langaee T. Role of dichloroacetate in the treatment of genetic mitochondrial diseases. Adv Drug Deliv Rev 2008; 60: 1478-1487 [PMID: 18647626 DOI: 10.1016/ j.addr.2008.02.014]
3 Stacpoole PW, Gilbert LR, Neiberger RE, Carney PR, Valenstein E, Theriaque DW, Shuster JJ. Valutazione del trattamento a lungo termine di bambini con acidosi lattica congenita con dicloroacetato. Pediatrics 2008; 121: e1223-e1228 [PMID: 18411236 DOI: 10.1542/ peds.2007-2062]
4 Stacpoole PW, Kerr DS, Barnes C, Bunch ST, Carney PR, Fennell EM, Felitsyn NM, Gilmore RL, Greer M, Henderson GN, Hutson AD, Neiberger RE, O’Brien RG, Perkins LA, Quisling RG, Shroads AL, Shuster JJ, Silverstein JH, Theriaque DW, Valenstein E. Studio clinico controllato del dicloroacetato per il trattamento dell’acidosi lattica congenita nei bambini. Pediatrics 2006; 117: 1519-1531 [PMID: 16651305 DOI: 10.1542/peds.2005-1226]
5 Berendzen K, Theriaque DW, Shuster J, Stacpoole PW. Potenziale terapeutico del dicloroacetato per il deficit del complesso della piruvato deidrogenasi. Mitocondrio 2006; 6: 126-135 [PMID: 16725381 DOI: 10.1016/j.mito.2006.04.001]
6 Kaufmann P, Engelstad K, Wei Y, Jhung S, Sano MC, Shungu DC, Millar WS, Hong X, Gooch CL, Mao X, Pascual JM, Hirano M, Stacpoole PW, DiMauro S, De Vivo DC. Il dicloroacetato causa neuropatia tossica nella MELAS: uno studio clinico randomizzato e controllato. Neurology 2006; 66: 324-330 [PMID: 16476929 DOI: 10.1212/01. wnl.0000196641.05913.27]
7 Brandsma D, Dorlo TP, Haanen JH, Beijnen JH, Boogerd W. Grave encefalopatia e polineuropatia indotta dal dicloroacetato. J Neurol 2010; 257: 2099-2100 [PMID: 20632025 DOI: 10.1007/ s00415-010-5654-9]
8 Michelakis ED, Sutendra G, Dromparis P, Webster L, Haromy A, Niven E, Maguire C, Gammer TL, Mackey JR, Fulton D, Abdulkarim B, McMurtry MS, Petruk KC. Modulazione metabolica del glioblastoma con dicloroacetato. Sci Transl Med 2010; 2: 31ra34 [PMID: 20463368 DOI: 10.1126/scitranslmed.3000677]
9 Dunbar EM, Coats BS, Shroads AL, Langaee T, Lew A, Forder JR, Shuster JJ, Wagner DA, Stacpoole PW. Studio di fase 1 sul dicloroacetato (DCA) in adulti con tumori cerebrali maligni ricorrenti. Invest New Drugs2014; 32: 452-464 [PMID: 24297161 DOI: 10.1007/ s10637-013-0047-4]
10 Garon EB, Christofk HR, Hosmer W, Britten CD, Bahng A, Crabtree MJ, Hong CS, Kamranpour N, Pitts S, Kabbinavar F, Patel C, von Euw E, Black A, Michelakis ED, Dubinett SM, Slamon DJ. Il dicloroacetato dovrebbe essere considerato con la chemioterapia a base di platino nei tumori ipossici piuttosto che come agente singolo nel carcinoma polmonare non a piccole cellule avanzato. J Cancer Res Clin Oncol 2014; 140: 443-452 [PMID: 24442098 DOI: 10.1007/s00432-014-1583-9]
11 Chu QS, Sangha R, Spratlin J, Vos LJ, Mackey JR, McEwan AJ, Venner P, Michelakis ED. Studio di fase I in aperto, a braccio singolo, con dose scalare, sul dicloroacetato (DCA) in pazienti con tumori solidi avanzati. Invest New Drugs 2015; 33: 603-610 [PMID: 25762000 DOI: 10.1007/s10637-015-0221-y]
12 Kankotia S, Stacpoole PW. Dicloroacetato e cancro: nuova casa per un farmaco orfano? Biochim Biophys Acta 2014; 1846: 617-629 [PMID: 25157892 DOI: 10.1016/j.bbcan.2014.08.005]
13 Sun RC, Board PG, Blackburn AC. Metabolismo mirato con triossido di arsenico e dicloroacetato nelle cellule di cancro al seno. Mol Cancer 2011; 10: 142 [PMID: 22093145 DOI: 10.1186/1476-4598-10-142]
14 Stockwin LH, Yu SX, Borgel S, Hancock C, Wolfe TL, Phillips LR, Hollingshead MG, Newton DL. Il dicloroacetato di sodio colpisce selettivamente le cellule con difetti nell’ETC mitocondriale. Int J Cancer 2010; 127: 2510-2519 [PMID: 20533281 DOI: 10.1002/ijc.25499]
15 Gang BP, Dilda PJ, Hogg PJ, Blackburn AC. Il target di due aspetti del metabolismo nel trattamento del cancro al seno. Cancer Biol Ther 2014; 15: 1533-1541 [PMID: 25482950 DOI: 10.4161/15384047.2014.955992]
16 Sutendra G, Dromparis P, Kinnaird A, Stenson TH, Haromy A, Parker JM, McMurtry MS, Michelakis ED. L’attivazione mitocondriale mediante l’inibizione di PDKII sopprime la segnalazione di HIF1a e l’angiogenesi nel cancro.Oncogene 2013; 32: 1638-1650 [PMID: 22614004 DOI: 10.1038/onc.2012.198]
17 Cairns RA, Bennewith KL, Graves EE, Giaccia AJ, Chang DT, Denko NC. L’ipossia tumorale aumentata farmacologicamente può essere misurata mediante tomografia a emissione di positroni con 18F-Fluoroazomicina arabinoside e aumenta la risposta tumorale alla citotossina ipossica PR-104. Clin Cancer Res 2009; 15: 7170-7174 [PMID: 19920111 DOI: 10.1158/1078-0432.CCR-09-1676]
18 Anderson KM, Jajeh J, Guinan P, Rubenstein M. Effetti in vitro del dicloroacetato e della CO2 sulle cellule HeLa ipossiche. Anticancer Res 2009; 29: 4579-4588 [PMID: 20032407]
19 Sun RC, Fadia M, Dahlstrom JE, Parish CR, Board PG, Blackburn AC. L’inversione del fenotipo glicolitico mediante dicloroacetato inibisce la crescita delle cellule metastatiche di cancro al seno in vitro e in vivo. Breast Cancer Res Treat 2010; 120: 253-260 [PMID: 19543830 DOI: 10.1007/ s10549-009-0435-9]
20 De Grandis D. Acetil-L-carnitina per il trattamento della neuropatia periferica indotta da chemioterapia: una breve rassegna. CNS Drugs 2007; 21 Suppl 1: 39-43; discussione 45-46 [PMID: 17696592]
21 Maestri A, De Pasquale Ceratti A, Cundari S, Zanna C, Cortesi E, Crinò L. Uno studio pilota sull’effetto dell’acetil-L-carnitina nella neuropatia periferica indotta dal paclitaxeland cisplatino. Tumori 2005; 91: 135-138 [PMID: 15948540]
22 Evans JD, Jacobs TF, Evans EW. Ruolo dell’acetil-L-carnitina nel trattamento della neuropatia periferica diabetica. Ann Pharmacother 2008; 42: 1686-1691 [PMID: 18940920 DOI: 10.1345/aph.1L201]
23 Mijnhout GS, Kollen BJ, Alkhalaf A, Kleefstra N, Bilo HJ. Acido alfa lipoico per la neuropatia periferica sintomatica nei pazienti con diabete: una meta-analisi di studi controllati randomizzati. Int J Endocrinol 2012; 2012: 456279 [PMID: 22331979 DOI: 10.1155/2012/456279]
24 Liu F, Zhang Y, Yang M, Liu B, Shen YD, Jia WP, Xiang KS. [Effetto curativo dell’acido alfa-lipoico sulla neuropatia periferica nel diabete di tipo 2: uno studio clinico]. Zhonghua Yixue Zazhi 2007; 87: 2706-2709 [PMID: 18167250]
25 Ziegler D, Hanefeld M, Ruhnau KJ, Meissner HP, Lobisch M, Schütte K, Gries FA. Trattamento della neuropatia periferica diabetica sintomatica con l’antiossidante acido alfa-lipoico. Uno studio multicentrico randomizzato e controllato di 3 settimane (Studio ALADIN). Diabetologia 1995; 38: 1425-1433 [PMID: 8786016]
26 Winkler G, Kempler P. [Pathomechanism of diabetic neuropathy: background of the pathogenesis-oriented therapy]. Orv Hetil 2010; 151: 971-981 [PMID: 20519180 DOI: 10.1556/OH.2010.28898]
27 Ang CD, Alviar MJ, Dans AL, Bautista-Velez GG, Villaruz-Sulit MV, Tan JJ, Co HU, Bautista MR, Roxas AA. Vitamina B per il trattamento della neuropatia periferica. Cochrane Database Syst Rev 2008; (3): CD004573 [PMID: 18646107 DOI: 10.102/14651858.CD004573. pub3]
28 Winkler G, Pál B, Nagybéganyi E, Ory I, Porochnavec M, Kempler P. Efficacia di diversi regimi di dosaggio di benfotiamina nel trattamento della neuropatia diabetica dolorosa. Arzneimittelforschung 1999; 49: 220-224 [PMID: 10219465 DOI: 10.1055/s-0031-1300405]
29 Ignacio RM, Kim CS, Kim YD, Lee HM, Qi XF, Kim SK. Effetto terapeutico dell’Active Hexose-Correlated Compound (AHCC) combinato con CpG-ODN (oligodeossinucleotide) nel modello murino di melanoma B16. Cytokine 2015; 76: 131-137 [PMID: 26082022 DOI: 10.1016/j.cyto.2015.06.002]
30 Chatterjee SJ, Ovadje P, Mousa M, Hamm C, Pandey S. L’efficacia dell’estratto di radice di tarassaco nell’indurre l’apoptosi in cellule di melanoma umano resistenti ai farmaci. Evid Based Complement Alternat Med 2011; 2011: 129045 [PMID: 21234313 DOI: 10.1155/2011/129045]
31 Mirzaei H, Naseri G, Rezaee R, Mohammadi M, Banikazemi Z, Mirzaei HR, Salehi H, Peyvandi M, Pawelek JM, Sahebkar A. Curcumin: Un nuovo candidato per la terapia del melanoma? Int J Cancer 2016; 139: 1683-1695 [PMID: 27280688 DOI: 10.1002/ijc.30224]
32 Huang XY, Zhang SZ, Wang WX. Maggiore efficacia antitumorale con la somministrazione combinata di astragalo e pterostilbene per il melanoma. Asian Pac J Cancer Prev 2014; 15: 1163-1169 [PMID: 24606435]
33 Wagner SC, Markosian B, Ajili N, Dolan BR, Kim AJ, Alexandrescu DT, Dasanu CA, Minev B, Koropatnick J, Marincola FM, Riordan NH. Acido ascorbico per via endovenosa come coadiuvante dell’immunoterapia con interleuchina-2. J Transl Med 2014; 12: 127 [PMID: 24884532 DOI:10.1186/1479-5876-12-127]
34 Horneber MA, Bueschel G, Huber R, Linde K, Rostock M. Mistletoe therapy in oncology. Cochrane Database Syst Rev 2008; (2): CD003297 [PMID: 18425885 DOI: 10.102/14651858.CD003297.pub2]
35 Delaney LM, Ho N, Morrison J, Farias NR, Mosser DD, Coomber BL. Il dicloroacetato influisce sulla proliferazione ma non sulla sopravvivenza delle cellule di cancro del colon-retto umano. Apoptosis 2015; 20: 63-74 [PMID: 25344893 DOI: 10.1007/s10495-014-1046-4]
36 Abildgaard C, Dahl C, Basse AL, Ma T, Guldberg P. La modulazione bioenergetica con dicloroacetato riduce la crescita delle cellule di melanoma e potenzia la loro risposta all’inibizione di BRAFV600E. J Transl Med 2014; 12: 247 [PMID: 25182332 DOI: 10.1186/s12967-014-0247-5]
37 Khan A, Andrews D, Blackburn AC. Stabilizzazione a lungo termine del cancro al colon in stadio 4 mediante terapia con dicloroacetato di sodio. World J Clin Cases 2016; 4: 336-343 [PMID: 27803917]
38 Tzeng HF, Blackburn AC, Board PG, Anders MW. Polimorfismo e inattivazione specie-dipendente della glutatione transferasi zeta da parte del dicloroacetato. Chem Res Toxicol 2000; 13: 231-236 [PMID: 10775321]