Akbar Khan, Doug Andrews, Jill Shainhouse, Anneke C Blackburn
Akbar Khan, Douglas Andrews, Medicor Cancer Centres Inc., Toronto, ON M2N 6N4, Canada
Jill Shainhouse, Insight Naturopathic Clinic, Toronto, ON M4P 1N9, Canada
Anneke C Blackburn, The John Curtin School of Medical Research, The Australian National University, Canberra, ACT 2601, Australië
Bijdragen van de auteurs: Khan A behandelde de patiënt en schreef het grootste deel van het case report; Andrews D assisteerde bij de ontwikkeling van het natuurlijke medicatie protocol voor vermindering van DCA bijwerkingen, en schreef een deel van het case report; Shainhouse J behandelde de patiënt met natuurlijke therapie; Blackburn AC interpreteerde het case report in de context van de literatuur over in vitro en in vivo DCA onderzoek, schreef delen van de inleiding en discussie, en beoordeelde het manuscript in zijn geheel.
Toestemmingsverklaring: De in dit manuscript beschreven patiënte heeft toestemming gegeven om haar casus anoniem te publiceren.
Belangenverstrengeling verklaring: Een van de auteurs (Khan) geeft dichlooracetaattherapie aan kankerpatiënten via Medicor Cancer Centres tegen kosten en zonder winstoogmerk. De kliniek is eigendom van een familielid van deze auteur. De andere auteurs hebben niets openbaar te maken.
Open-access: Dit artikel is een open-access artikel dat is geselecteerd door een interne redacteur en volledig peer-reviewed door externe beoordelaars. Het wordt verspreid in overeenstemming met de Creative Commons Naamsvermelding Niet Commercieel (CC BY-NC 4.0) licentie, die anderen toestaat om te verspreiden, remixen, aan te passen, voort te bouwen op dit werk niet-commercieel, en licentie hun afgeleide werken op andere voorwaarden, op voorwaarde dat het oorspronkelijke werk naar behoren wordt geciteerd en het gebruik is niet-commercieel. Zie: http://creativecommons.org/licenses/by-nc/4.0/
Bron van het manuscript: Uitgenodigd manuscript
Correspondentie naar: Akbar Khan, MD, Medical Director,
Medicor Cancer Centres Inc., 4576 Yonge St., Suite 301, Toronto,
ON M2N 6N4, Canada. [email protected]
Telefoon: +1-416-2270037
Fax: +1-416-2271915
Ontvangen: 30 januari 2017
Peer-review gestart: 12 februari 2017
Eerste besluit: 28 maart 2017
Herzien: 5 mei 2017
Aanvaard: 30 mei 2017
Artikel in pers: 31 mei 2017
Online gepubliceerd: 10 augustus 2017
Abstract
Natriumdichlooracetaat (DCA) wordt sinds 2007 bestudeerd als metabole kankertherapie, op basis van een publicatie van Bonnet et al die aantoonde dat DCA apoptose (geprogrammeerde celdood) kan induceren in menselijke borst-, long- en hersenkankercellen. Klassiek wordt de respons van kanker op een medische therapie in humaan onderzoek gemeten aan de hand van de definities van Response Evaluation Criterial for Solid Tumours, die “respons” definiëren aan de hand van de mate van tumorreductie, of het verdwijnen van de tumor op beeldvorming, maar ziektestabilisatie is ook een gunstig klinisch resultaat. Er is aangetoond dat DCA als cytostaticum in vitro en in vivo kan werken, zonder apoptose te veroorzaken. Er wordt een geval van een 32-jarige man gepresenteerd waarbij DCA-therapie, zonder gelijktijdige conventionele therapie, resulteerde in regressie en stabilisatie van terugkerend uitgezaaid melanoom gedurende meer dan 4 jaar, met triviale bijwerkingen. Dit geval toont aan dat DCA kan worden gebruikt om het ziektevolume te verminderen en de stabiliteit op lange termijn te handhaven bij patiënten met gevorderd melanoom.
Trefwoorden: Dichlooracetaat; Kanker; BRAF; Melanoom; Cytostaticum
© De auteur(s) 2017. Gepubliceerd door Baishideng Publishing Group Inc. Alle rechten voorbehouden.
Kerntip: Natriumdichlooracetaat (DCA) wordt sinds 2007 bestudeerd als metabole kankertherapie. Het is aangetoond dat DCA-therapie kan resulteren in een klassieke respons die wordt gemeten door vermindering of verdwijning van tumoren op beeldvorming. DCA kan echter ook de groei van kankercellen stoppen zonder apoptose te veroorzaken (cytostatisch effect). Dit kan leiden tot stabilisatie op lange termijn van uitgezaaide kanker. Wij presenteren een geval van orale DCA-therapie die resulteerde in vermindering en stabilisatie van uitgezaaid melanoom bij een 32-jarige man gedurende meer dan 4 jaar, met slechts geringe bijwerkingen.
Khan A, Andrews D, Shainhouse J, Blackburn AC. Langdurige stabilisatie van metastatisch melanoom met natriumdichlooracetaat.
World J Clin Oncol 2017; 8(4): 371-377
Beschikbaar vanaf: URL: http://www.wjgnet.com/2218-4333/full/v8/i4/371.htm
DOI: http://dx.doi.org/10.5306/wjco.v8.i4.371
INLEIDING
Natriumdichlooracetaat (DCA) trok de aandacht van de medische gemeenschap in 2007, toen Bonnet et al[1] de eerste in vitro en in vivo studie publiceerden die de waarde van DCA als metabole kankertherapie illustreerde, door zijn remmende werking op het mitochondriale enzym pyruvaatdehydrogenase kinase. Eerder hadden Stacpoole et al[2-4] verschillende studies gepubliceerd over DCA voor de behandeling van congenitale melkzuurose bij mitochondriale ziekten[2-5]. Deze studies toonden aan dat oraal DCA een veilig geneesmiddel is voor menselijk gebruik. DCA bleek geen nier-, long-, beenmerg- en harttoxiciteit te vertonen[4]. De meeste bijwerkingen van DCA waren bescheiden, met als ernstigste omkeerbare perifere neuropathie[6]. Omkeerbaar delirium is ook gemeld[7]. Verhoging van leverenzymen (asymptomatisch en omkeerbaar) is geconstateerd bij een klein percentage van de patiënten[3]. Het voorafgaande menselijke onderzoek naar mitochondriale aandoeningen heeft de snelle vertaling van DCA naar menselijk gebruik als off-label kankertherapie mogelijk gemaakt. Er zijn nu verschillende verslagen gepubliceerd van klinische onderzoeken met DCA als kankertherapie, die het veiligheidsprofiel bevestigen en wijzen op een toenemende erkenning van het potentiële nut van DCA in de kankerkliniek[8-11]. Een beperking van deze studies met patiënten in een laat stadium is dat ze slechts verslag deden van de behandeling gedurende een korte periode.
In de publicatie van Bonnet uit 2007[1] werd aangetoond dat DCA-behandeling het mitochondriale membraanpotentieel vermindert, wat selectief apoptose bevordert in menselijke kankercellen. Remming van de aërobe glycolyse (het Warburg-effect) en activering van het mitochondriale kaliumionkanaal werden geïdentificeerd als de werkingsmechanismen van DCA. Verder onderzoek van DCA in vitro heeft de antikankeractiviteit tegen een groot aantal kankertypes bevestigd, die onlangs door Kankotia en Stacpoole zijn besproken[12]. Daarnaast is DCA ook in staat om apoptose te versterken wanneer het gecombineerd wordt met andere middelen[13-15]. Er zijn ook andere antikankeracties van DCA gesuggereerd, waaronder angiogeneseremming[16], verandering van HIF1-α expressie[17], verandering van de cel pH regulatoren V-ATPase en MCT1, en andere celoverlevingsregulatoren zoals p53 en PUMA[18]. Veel in vitro studies gebruiken echter onredelijk hoge concentraties DCA die klinisch niet haalbaar zijn, in een poging cytotoxische activiteit aan te tonen. In andere studies werden bescheidener DCA-concentraties gebruikt, waarbij werd aangetoond dat DCA cytostatisch kan zijn. Het tweede rapport uit 2010 over de in vivo antikankeractiviteit van DCA vond dat het alleen cytostatisch was in een metastatisch model van borstkanker[19], waarbij de proliferatie werd geremd zonder apoptose te veroorzaken. Dit suggereert een rol voor DCA als kanker stabilisator, vergelijkbaar met angiogeneseremmers.
In reactie op het rapport uit 2007 over de kankerbestrijdende werking van DCA, begon Khan DCA te gebruiken voor de behandeling van kankerpatiënten met een korte prognose of die niet meer reageerden op conventionele kankertherapieën. In samenwerking met een natuurgeneeskundige arts (Andrews) werd een protocol voor natuurlijke medicijnen ontwikkeld om de dosisbeperkende neurologische toxiciteit van DCA aan te pakken. Dit bestond uit 3 medicijnen: Acetyl L-carnitine[20-22], R-alfa liponzuur[23-25] en benfotiamine[26-28], ter preventie van neuropathie en encefalopathie. Bij meer dan 300 kankerpatiënten in een gevorderd stadium bleek uit observationele gegevens dat DCA-therapie in 60%-70% van de gevallen voordeel opleverde. Het neuropathierisico wanneer natuurlijke neuroprotectieve geneesmiddelen werden gecombineerd met DCA was ongeveer 20% bij een dosering van 20-25 mg/kg per dag in een cyclus van 2 wk op/1 wk af (klinische observatiegegevens online gepubliceerd op www.medicorcancer.com). Hier wordt een verslag van een patiënt gepresenteerd die zowel de apoptotische als de antiproliferatieve effecten van een chronische behandeling met DCA over een periode van meer dan vier jaar illustreert.
GEVAL
Een 32-jarige, voorheen gezonde man met een lichte huid merkte aanvankelijk op dat een moedervlek op zijn linkerkuit in 2006 begon te veranderen. Hij raadpleegde een arts en de moedervlek werd geëxcideerd. De pathologische diagnose melanoom werd gesteld. Een sentinel node dissectie werd uitgevoerd, en was negatief voor metastatische ziekte. In 2007 constateerde de patiënt vergroting van de linker lieslymfeklieren en kleine melanocytaire laesies op de huid van zijn linkerbeen. Hij werd behandeld met interferon alfa in het kader van een klinische proef in een regionaal kankerziekenhuis. Interferon werd na 9 maanden gestopt wegens bijwerkingen.
De patiënt bleef gezond tot 2010, toen een nieuwe huidmetastase in het linkerbeen verscheen. Deze werd operatief geëxcideerd. Eind 2011 werd een nieuwe cutane metastase vastgesteld op het linkerbeen, binnen het litteken van de oorspronkelijke melanoomoperatie. Hierop werd een biopsie verricht en de diagnose recidiverend melanoom werd bevestigd. Hij werd vervolgens behandeld met een brede excisie en huidtransplantatie.
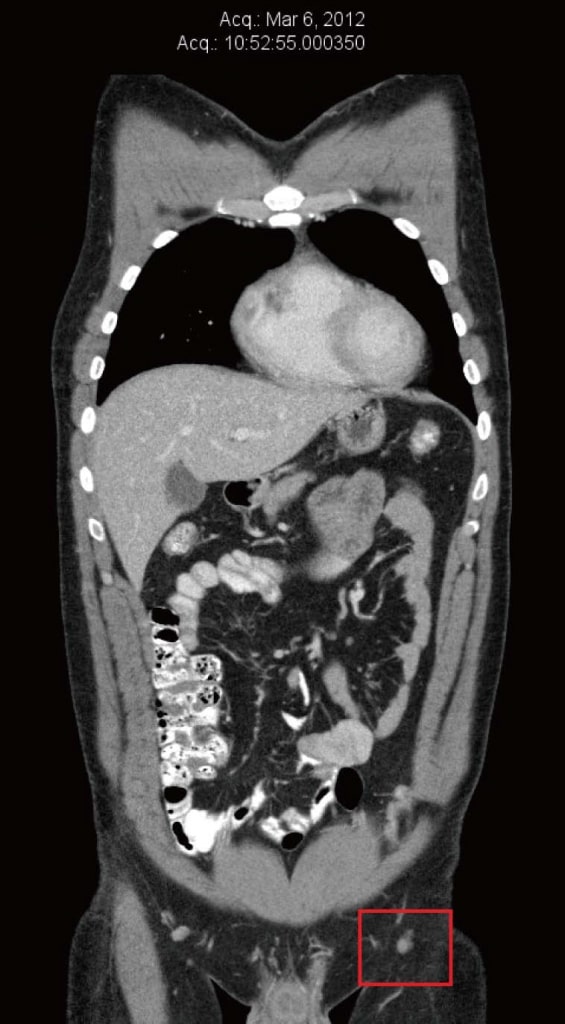
In maart 2012 werd bij de patiënt een recidief vastgesteld in de huidtransplantatie van het linkerbeen. Dit werd geëxcideerd en er werd een nieuwe huidtransplantatie uitgevoerd. Pathologie toonde positieve marges van de geëxcideerde metastase, dus werd een nieuwe excisie uitgevoerd, opnieuw met positieve marges. Tegelijkertijd bevestigde een naaldbiopsie van een linker liesknoop de aanwezigheid van BRAF-positief metastatisch melanoom. Een in maart 2012 uitgevoerde computertomografie (CT-scan) toonde geen aanwijzingen voor verre uitzaaiingen. De grootste linker liesknoop was 8 mm in diameter, die werd gerapporteerd als “onbeduidend volgens groottecriteria” (figuur 1).
In april 2012 raadpleegde de patiënt een natuurgeneeskundige arts (Shainhouse) en begon een therapie met de volgende orale natuurlijke antikankermiddelen: Active hexose correlated compound of AHCC (paddenstoelenextract)[29], paardenbloemwortel[30], curcumine[31], en astragaluswortel[32]. Er werd ook een parenterale therapie gestart, die bestond uit intraveneuze vitamine C tweemaal per week[33] en subcutaan maretak-extract[34]. De patiënt ging ook over op een veganistisch dieet.
In mei 2012 bezocht de patiënt de kliniek van de auteur (Khan) om aanvullende niet-traditionele therapieën te volgen. DCA therapie werd besproken, maar de patiënt besloot eerst de natuurlijke anti-kanker therapieën (voorgeschreven door Shainhouse) goed uit te proberen. In mei 2012 (na slechts 1 maand natuurlijke therapie) werd opnieuw een CT-scan gemaakt, die een lichte groei van meerdere inguinale en externe iliacale knopen aangaf, met afmetingen variërend van 10 mm × 11 mm tot 14 mm × 15 mm.
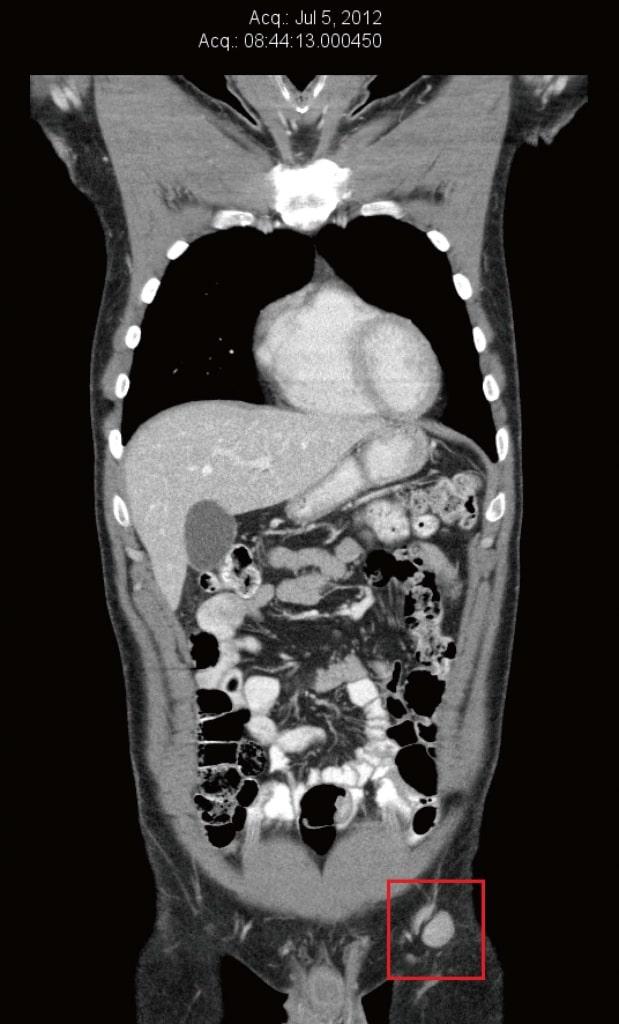
In juli 2012 werd de CT-scan herhaald om de natuurlijke antikankertherapie van de patiënt te beoordelen. Op dat moment waren de linker lies- en externe iliacale knopen opnieuw vergroot, en varieerden in grootte van 13 mm × 16 mm tot 22 mm × 20 mm (figuur 2). Ter voorbereiding op een klinisch onderzoek in Boston, MA (Verenigde Staten) werd ook een PET-scan gemaakt, die een verhoogde glucose-opname in de linker liesknopen bevestigde. Er was nieuwe pijn van lage intensiteit (2/10) in de linker liesstreek. Bij onderzoek werden een niet-gevoelige linker liesknoop van 20 mm en twee kleine huidmetastasen in het huidtransplantaat van de linker kuit gevonden.
Bij de patiënt werd dus ziekteprogressie vastgesteld. Op dat moment besloot hij te starten met DCA-therapie. Hij begon met 3 maal daags DCA 500 mg oraal, wat overeenkwam met 17 mg/kg per dag (fabrikant: Tokyo Chemical Industry, Verenigde Staten), naast het handhaven van de andere natuurlijke therapieën. De DCA behandelingscyclus was 2 weken op en 1 week af. Om het optreden van DCA-bijwerkingen te minimaliseren, werden 3 aanvullende natuurlijke medicijnen voorgeschreven: Oraal acetyl L-carnitine 500 mg 3 keer per dag, oraal benfotiamine 80 mg twee keer per dag en oraal R-alfa liponzuur 150 mg 3 keer per dag. Deze supplementen werden dagelijks ingenomen (geen cyclus). Er werden routinematige baseline bloedtests uitgevoerd (tabel 1). Deze waren allemaal normaal, behalve een lage creatinine die als onbelangrijk werd beschouwd.
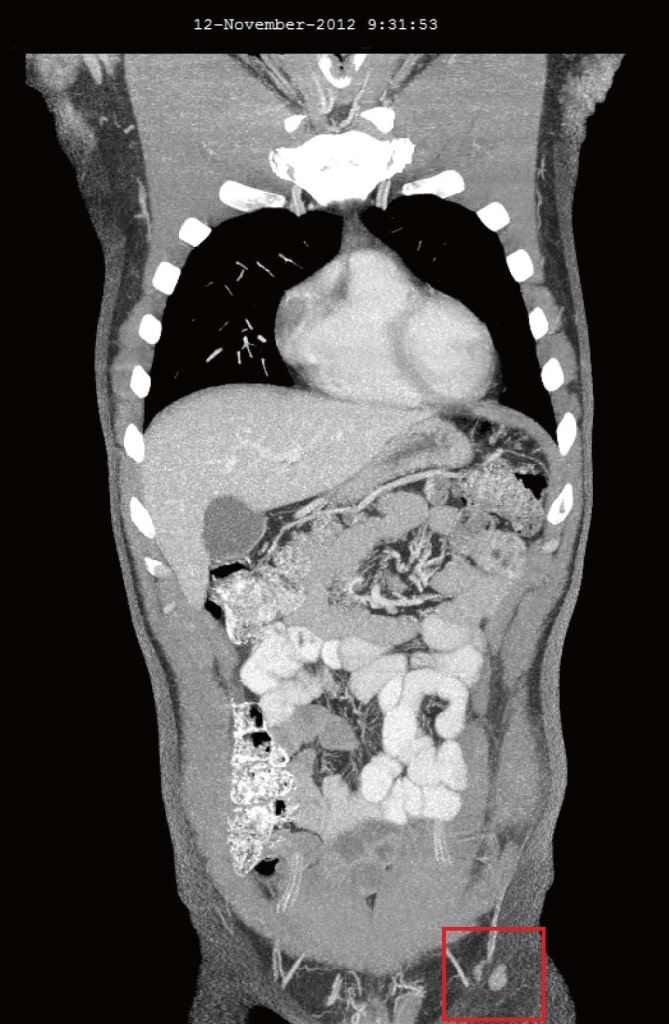
In november 2012, 4 maanden na de toevoeging van DCA aan zijn oorspronkelijke natuurlijke anti-kanker therapieën, werd de patiënt opnieuw beoordeeld. Hij voelde zich over het algemeen goed. Twee nieuwe symptomen werden gemeld die pas begonnen na de start van de DCA-therapie: Licht verminderd gevoel van de vingertoppen en tenen, en een licht verminderd concentratievermogen gedurende de 2 weken dat hij DCA nam. Het lichte gevoelsverlies verergerde niet en werd beschouwd als een milde DCA-gerelateerde neuropathie. Zowel de gevoelloosheid als de verminderde concentratie verdwenen tijdens de weken dat de patiënt geen DCA meer nam. Bloedonderzoek van oktober 2012 toonde geen significante veranderingen (tabel 1). CT-scans van augustus 2012 en november 2012 toonden significante regressie van alle eerder vergrote lymfeklieren. De grootste knoop was 10 mm, en er waren geen aanwijzingen voor intra-thoracale of intra-abdominale ziekte, en geen botmetastasen (figuur 3).
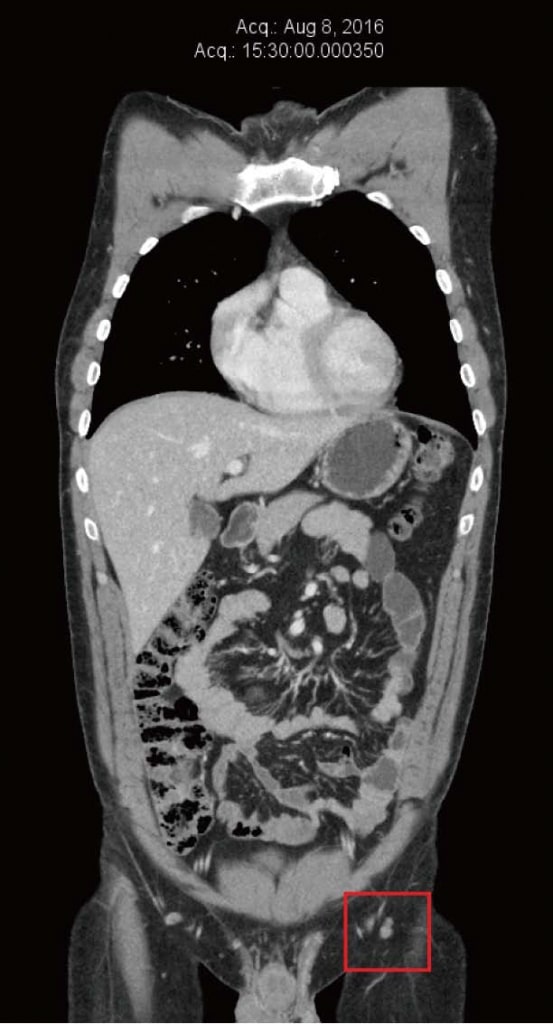
De patiënt bleef zich goed voelen tijdens de DCA-therapie en merkte geen nieuwe huidmetastasen of nieuwe vergroting van de liesknopen op. Hij bleef regelmatige klinische controle houden bij zijn natuurgeneeskundige arts (Shainhouse), en jaarlijkse follow-up bij zijn arts (Khan). De genoemde natuurlijke anti-kanker therapieën (voorgeschreven door Shainhouse) en DCA therapie werden gehandhaafd in 2016. De resultaten van het bloedonderzoek in juni 2016 bleven normaal (tabel 1). De CT-scan werd herhaald in augustus 2016 en toonde geen bewijs van metastatisch melanoom, na 4 jaar DCA-therapie, gecombineerd met natuurlijke antikankertherapie (figuur 4). In december 2016 meldde de patiënt een toename van werkgerelateerde stress en een verminderde naleving van zijn medicijnen. Op dat moment merkte hij een nieuwe linker liesmassa op. Echografie werd verkregen, die onthulde een nieuw conglomeraat van vergrote lymfeklieren van 40 mm × 25 mm × 23 mm, met kleur Doppler tonen bloedstroom binnen de massa. Dit werd geïnterpreteerd als hergroei van het melanoom, na ongeveer vierenhalf jaar continue DCA-therapie. Er werd verder onderzoek gedaan, waaronder een PET/CT-scan, die bevestigde dat de ziekte opnieuw was gegroeid in 3 linker liesknopen (SUVmax variërend van 13 tot 17,8).
Kortom, de patiënt kreeg gedurende een periode van 6 jaar conventionele therapie voor terugkerend stadium 3 melanoom, bestaande uit primaire chirurgische excisie met lymfeklierdissectie, interferon alfa en chirurgische excisies voor terugkerende cutane metastasen bij 5 gelegenheden. De patiënt kreeg vervolgens gedurende 3 maanden alleen natuurlijke antikankertherapie (voorgeschreven door Shainhouse), zonder respons, blijkend uit gestage ziekteprogressie op seriële CT-scans. Uiteindelijk voegde de patiënt orale DCA-therapie toe aan de natuurlijke antikankertherapie, met 3 gelijktijdige neuroprotectieve geneesmiddelen (liponzuur, acetyl-L-carnitine en benfotiamine) en geen gelijktijdige conventionele kankertherapieën. Het resultaat was een volledige radiologische remissie van meer dan 4 jaar, gevolgd door een recidief. Tijdens de DCA-therapie ondervond de patiënt triviale bijwerkingen, bestaande uit lichte neuropathie en lichte concentratievermindering. De patiënt behield zijn ECOG-niveau 0 functie, en hij was in staat voltijds te werken.
Tabel 1 Bloedonderzoek voorafgaand aan de behandeling met dichlooracetaat-natrium
| Bloedonderzoek | 12 juli pre-DCA | 12 oktober 3 mo DCA | 16 juni 4 jr DCA | Eenheden | Normaal bereik |
|---|---|---|---|---|---|
| Hemoglobine | 154 | 150 | 157 | g/L | 135-175 |
| Aantal witte cellen | 4.5 | 4.1 | 5 | ×109/L | 4.0-11.0 |
| Bloedplaatjes | 220 | 214 | 229 | ×109/L | 150-400 |
| Glucose | – | 4.6 | 4.9 | mmol/L | 3.6-7.7 |
| Ureum | 3.9 | 3.2 | 3.9 | mmol/L | 2.5-8.0 |
| Creatinine | 491 | 501 | 551 | μmol/L | 62-115 |
| Calcium | 2.47 | 2.41 | 2.47 | mmol/L | 2.15-2.60 |
| Albumine | 48 | 45 | 47 | g/L | 35-50 |
| Bilirubine | 8 | 10 | 13 | μmol/L | < 22 |
| Natrium | 139 | 141 | 140 | mmol/L | 135-147 |
| Kalium | 4 | 4.3 | 3.9 | mmol/L | 3.5-5.5 |
| Chloride | 106 | 107 | 105 | mmol/L | 100-110 |
| Alkalische fosfatase | 77 | 69 | 71 | U/L | 45-129 |
| LDH | 139 | 135 | 144 | U/L | 120-246 |
| GGT | 18 | 19 | 20 | U/L | 15-73 |
| AST | 18 | 25 | 21 | U/L | 7-37 |
| ALT | 18 | 28 | 19 | U/L | 12-49 |
DISCUSSIE
Het gebruik van orale DCA bij de hier beschreven gemetastaseerde melanoompatiënt toont tumorkrimp en langdurige ziektestabiliteit volgens klinische status en CT-beeldvorming. De ziekte bleef meer dan 4 jaar stabiel tijdens het gebruik van DCA zonder gelijktijdige conventionele therapie, met een overlevingstijd sinds de eerste diagnose van 10 jaar. Volgens de SEER-kankerstatistieken van het National Cancer Institute is de overleving van deze patiënt zonder bewijs van verre uitzaaiingen niet opmerkelijk (62,9% 5-jaarsoverleving voor melanoom met uitzaaiingen naar regionale lymfeklieren, https://seer.cancer. gov/statfacts/html/melan.html). Opmerkelijk is dat in een situatie waarin de betrokken lymfeklieren duidelijk groter werden, de toevoeging van orale DCA-therapie doeltreffend was voor het verkleinen van de vergrote klieren (figuren 2 en 3) en voor het bereiken van een remissie van meer dan 4 jaar. Het is mogelijk dat de natuurlijke antikankertherapieën die de patiënt kreeg samenwerkten met DCA, maar het is ook duidelijk dat deze natuurlijke therapieën alleen niet verantwoordelijk zijn voor de terugval van de ziekte. Van DCA is bekend dat het zowel apoptotische als cytostatische effecten heeft[14,17,19,35,36], wat overeenkomt met het klinische beloop van deze patiënt van regressie (apoptotisch) en langdurige remissie (cytostatisch). Het recidief na 4 jaar viel samen met een verminderde therapietrouw, wat suggereert dat deze methode van kankerbehandeling met DCA vereist dat de metabole druk voortdurend wordt gehandhaafd. Ondanks het recidief bleef de patiënte klinisch gezond en was zij van plan nieuwe immunotherapiemedicatie te starten. Het valt nog te bezien of een verandering van therapie opnieuw tot ziektevermindering of stabiliteit kan leiden.
Naast het behoud van remissie gedurende meer dan 4 jaar, illustreert dit geval dat DCA goed kan worden verdragen bij een kankerpatiënt gedurende een langere periode, in vergelijking met alle gepubliceerde DCA kanker klinische studies. Met name deze patiënt kon 17 mg/kg per dag verdragen in een regime van 2 wk op/1 wk af gedurende 4 jaar met minimale bijwerkingen. Dit is vergelijkbaar met ons eerdere verslag van chronisch gebruik van DCA bij darmkanker[37], waarbij de patiënt 16 mg/kg per dag (maar niet 25 mg/kg per dag) kon verdragen in hetzelfde regime, maar staat in contrast met de klinische studies voor DCA, waarin een lagere dosis van 10-12,5 mg/kg per dag wordt aanbevolen, die continu wordt gegeven[9,11]. De pauze van 1 week of de neuroprotectieve supplementen kunnen beide bijdragen tot het vermogen van de patiënten in de casusverslagen om de hogere dosis te verdragen. Genetische polymorfismen in GSTZ1, het leverenzym dat DCA metaboliseert, kunnen ook bijdragen aan de dosis DCA die kan worden verdragen[9,38]. In de onderzoeken zijn variabele medicijnniveaus gerapporteerd, maar niet in alle onderzoeken is rekening gehouden met dit farmacogenetische aspect van DCA-therapie[9,11], en verdere studies zijn nodig om te verduidelijken of dit een belangrijke bijdrage levert aan de DCA-tolerantie. Op dit moment loopt er een DCA multiple myeloma onderzoek bij mensen, dat zowel GSTZ1 genotypes als medicijnniveaus onderzoekt om bij te dragen aan ons begrip van deze kwesties (Australia New Zealand Clinical Trials Register #ACTRN12615000226505, http://www.anzctr. org.au).
Dit casusverslag toont aan dat chronische DCA-therapie kan worden toegepast zonder de levenskwaliteit te verminderen, in vergelijking met conventionele melanoomtherapieën zoals interferon. Om het optimale protocol voor een maximaal verdraagbare acute of chronische behandeling met DCA te bepalen, zijn proeven op mensen nodig. Maar belangrijker is dat nog moet worden opgehelderd welke dosis nodig is voor on-target effecten die doeltreffend zullen zijn tegen kanker. Deze informatie is nodig alvorens te investeren in grotere, langdurige studies naar de resultaten van patiënten. DCA verdient verder onderzoek in klinische proeven als niet-toxische kankertherapie vanwege de bescheiden kosten en lage toxiciteit, en verdient overweging als off-label kankertherapie.
ERKENNINGEN
De auteurs willen Dr. Humaira Khan bedanken voor haar hulp, en ook de patiënte voor haar steun en toestemming om haar geval te publiceren.
COMMENTAAR
Kenmerken van de casus
De 32-jarige mannelijke patiënt presenteerde zich met een gepigmenteerde laesie op zijn been.
Klinische diagnose
De patiënt werd gediagnosticeerd met een melanoom.
Laboratoriumdiagnose
Melanoom bevestigd door excisiebiopsie.
Beeldvormende diagnose
Vergrote liesknoop bevestigd betrokken te zijn bij melanoom (naaldbiopsie).
Pathologische diagnose
Melanoom, BRAF positief.
Behandeling
Excisie van primaire laesie met huidtransplantatie, sentinel node dissectie, meerdere excisies van terugkerende cutane metastasen. Traditionele therapie gestopt en natuurlijke antikankertherapieën gestart (AHCC, paardenbloemwortel, curcumine, astragaluswortel, i.v. vitamine C, s.c. Europese maretak). Progressie na 3 maanden, toevoeging van dichlooracetaat (DCA). Regressie en remissie na toevoeging van DCA gedurende meer dan 4 jaar.
Gerelateerde rapporten
Computertomografierapporten tonen het verloop van de ziekte en de respons op therapieën.
Term uitleg
DCA: Dichlooracetaat-natrium; RECIST: Response evaluation criteria for solid tumours; ECOG: Eastern cooperative oncology group; SEER: Surveillance, epidemiology and end results.
Ervaringen en lessen
DCA kan werken als een pro-apoptotisch en cytostatisch geneesmiddel, en kan dus zowel regressie als stabilisatie op lange termijn van uitgezaaide kanker bewerkstelligen zonder ernstige bijwerkingen, zoals wordt geïllustreerd door dit melanoomgeval.
Peer-review
Dr. Khan beschreef een 32-jarige man die DCA therapie kreeg, met andere medicijnen van natuurlijke therapeuten en meer dan 4 jaar in een stabilisatietoestand (uitgezaaid melanoom) bleef. Het is een interessant geval.
REFERENTIES
1 Bonnet S, Archer SL, Allalunis-Turner J, Haromy A, Beaulieu C, Thompson R, Lee CT, Lopaschuk GD, Puttagunta L, Bonnet S, Harry G, Hashimoto K, Porter CJ, Andrade MA, Thebaud B, Michelakis ED. A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth. Cancer Cell 2007; 11: 37-51 [PMID: 17222789 DOI: 10.1016/ j.ccr.2006.10.020]
2 Stacpoole PW, Kurtz TL, Han Z, Langaee T. Role of dichloroacetate in the treatment of genetic mitochondrial diseases. Adv Drug Deliv Rev 2008; 60: 1478-1487 [PMID: 18647626 DOI: 10.1016/ j.addr.2008.02.014]
3 Stacpoole PW, Gilbert LR, Neiberger RE, Carney PR, Valenstein E, Theriaque DW, Shuster JJ. Evaluation of long-term treatment of children with congenital lactic acidosis with dichloroacetate. Pediatrics 2008; 121: e1223-e1228 [PMID: 18411236 DOI: 10.1542/ peds.2007-2062]
4 Stacpoole PW, Kerr DS, Barnes C, Bunch ST, Carney PR, Fennell EM, Felitsyn NM, Gilmore RL, Greer M, Henderson GN, Hutson AD, Neiberger RE, O’Brien RG, Perkins LA, Quisling RG, Shroads AL, Shuster JJ, Silverstein JH, Theriaque DW, Valenstein E. Controlled clinical trial of dichloroacetate for treatment of congenital lactic acidosis in children. Pediatrics 2006; 117: 1519-1531 [PMID: 16651305 DOI: 10.1542/peds.2005-1226]
5 Berendzen K, Theriaque DW, Shuster J, Stacpoole PW. Therapeutic potential of dichloroacetate for pyruvate dehydrogenase complex deficiency. Mitochondrion 2006; 6: 126-135 [PMID: 16725381 DOI: 10.1016/j.mito.2006.04.001]
6 Kaufmann P, Engelstad K, Wei Y, Jhung S, Sano MC, Shungu DC, Millar WS, Hong X, Gooch CL, Mao X, Pascual JM, Hirano M, Stacpoole PW, DiMauro S, De Vivo DC. Dichloroacetate causes toxic neuropathy in MELAS: a randomized, controlled clinical trial. Neurology 2006; 66: 324-330 [PMID: 16476929 DOI: 10.1212/01. wnl.0000196641.05913.27]
7 Brandsma D, Dorlo TP, Haanen JH, Beijnen JH, Boogerd W. Severe encephalopathy and polyneuropathy induced by dichloroacetate. J Neurol 2010; 257: 2099-2100 [PMID: 20632025 DOI: 10.1007/ s00415-010-5654-9]
8 Michelakis ED, Sutendra G, Dromparis P, Webster L, Haromy A, Niven E, Maguire C, Gammer TL, Mackey JR, Fulton D, Abdulkarim B, McMurtry MS, Petruk KC. Metabole modulatie van glioblastoom met dichlooracetaat. Sci Transl Med 2010; 2: 31ra34 [PMID: 20463368 DOI: 10.1126/scitranslmed.3000677]
9 Dunbar EM, Coats BS, Shroads AL, Langaee T, Lew A, Forder JR, Shuster JJ, Wagner DA, Stacpoole PW. Fase 1 studie van dichlooracetaat (DCA) bij volwassenen met terugkerende kwaadaardige hersentumoren. Invest New Drugs2014; 32: 452-464 [PMID: 24297161 DOI: 10.1007/ s10637-013-0047-4]
10 Garon EB, Christofk HR, Hosmer W, Britten CD, Bahng A, Crabtree MJ, Hong CS, Kamranpour N, Pitts S, Kabbinavar F, Patel C, von Euw E, Black A, Michelakis ED, Dubinett SM, Slamon DJ. Dichlooracetaat moet worden overwogen met platina-gebaseerde chemotherapie bij hypoxische tumoren in plaats van als single agent bij gevorderde niet-kleincellige longkanker. J Cancer Res Clin Oncol 2014; 140: 443-452 [PMID: 24442098 DOI: 10.1007/s00432-014-1583-9]
11 Chu QS, Sangha R, Spratlin J, Vos LJ, Mackey JR, McEwan AJ, Venner P, Michelakis ED. A phase I open-labeled, single-arm, doseescalation, study of dichloroacetate (DCA) in patients with advanced solid tumors. Invest New Drugs 2015; 33: 603-610 [PMID: 25762000 DOI: 10.1007/s10637-015-0221-y]
12 Kankotia S, Stacpoole PW. Dichloroacetate and cancer: new home for an orphan drug? Biochim Biophys Acta 2014; 1846: 617-629 [PMID: 25157892 DOI: 10.1016/j.bbcan.2014.08.005]
13 Sun RC, Board PG, Blackburn AC. Targeting metabolism with arsenic trioxide and dichloroacetate in breast cancer cells. Mol Cancer 2011; 10: 142 [PMID: 22093145 DOI: 10.1186/1476-4598-10-142]
14 Stockwin LH, Yu SX, Borgel S, Hancock C, Wolfe TL, Phillips LR, Hollingshead MG, Newton DL. Natriumdichlooracetaat richt zich selectief op cellen met defecten in de mitochondriale ETC. Int J Cancer 2010; 127: 2510-2519 [PMID: 20533281 DOI: 10.1002/ijc.25499]
15 Gang BP, Dilda PJ, Hogg PJ, Blackburn AC. Targeting van twee aspecten van het metabolisme bij de behandeling van borstkanker. Cancer Biol Ther 2014; 15: 1533-1541 [PMID: 25482950 DOI: 10.4161/15384047.2014.955992]
16 Sutendra G, Dromparis P, Kinnaird A, Stenson TH, Haromy A, Parker JM, McMurtry MS, Michelakis ED. Mitochondrial activation by inhibition of PDKII suppresses HIF1a signaling and angiogenesis in cancer.Oncogene 2013; 32: 1638-1650 [PMID: 22614004 DOI: 10.1038/onc.2012.198]
17 Cairns RA, Bennewith KL, Graves EE, Giaccia AJ, Chang DT, Denko NC. Pharmacologically increased tumor hypoxia can be measured by 18F-Fluoroazomycin arabinoside positron emission tomography and enhances tumor response to hypoxic cytotoxin PR-104. Clin Cancer Res 2009; 15: 7170-7174 [PMID: 19920111 DOI: 10.1158/1078-0432.CCR-09-1676]
18 Anderson KM, Jajeh J, Guinan P, Rubenstein M. In vitro effects of dichloroacetate and CO2 on hypoxic HeLa cells. Anticancer Res 2009; 29: 4579-4588 [PMID: 20032407]
19 Sun RC, Fadia M, Dahlstrom JE, Parish CR, Board PG, Blackburn AC. Reversal of the glycolytic phenotype by dichloroacetate inhibits metastatic breast cancer cell growth in vitro and in vivo. Breast Cancer Res Treat 2010; 120: 253-260 [PMID: 19543830 DOI: 10.1007/ s10549-009-0435-9]
20 De Grandis D. Acetyl-L-carnitine for the treatment of chemotherapyinduced peripheral neuropathy: a short review. CNS Drugs 2007; 21 Suppl 1: 39-43; discussie 45-46 [PMID: 17696592]
21 Maestri A, De Pasquale Ceratti A, Cundari S, Zanna C, Cortesi E, Crinò L. A pilot study on the effect of acetyl-L-carnitine in paclitaxeland cisplatin-induced peripheral neuropathy. Tumori 2005; 91: 135-138 [PMID: 15948540]
22 Evans JD, Jacobs TF, Evans EW. Role of acetyl-L-carnitine in the treatment of diabetic peripheral neuropathy. Ann Pharmacother 2008; 42: 1686-1691 [PMID: 18940920 DOI: 10.1345/aph.1L201]
23 Mijnhout GS, Kollen BJ, Alkhalaf A, Kleefstra N, Bilo HJ. Alfa liponzuur voor symptomatische perifere neuropathie bij patiënten met diabetes: een meta-analyse van gerandomiseerde gecontroleerde onderzoeken. Int J Endocrinol 2012; 2012: 456279 [PMID: 22331979 DOI: 10.1155/2012/456279]
24 Liu F, Zhang Y, Yang M, Liu B, Shen YD, Jia WP, Xiang KS. [Curatief effect van alfa-liponzuur op perifere neuropathie bij diabetes type 2: een klinische studie]. Zhonghua Yixue Zazhi 2007; 87: 2706-2709 [PMID: 18167250]
25 Ziegler D, Hanefeld M, Ruhnau KJ, Meissner HP, Lobisch M, Schütte K, Gries FA. Treatment of symptomatic diabetic peripheral neuropathy with the anti-oxidant alpha-lipoic acid. Een multicentrisch gerandomiseerd gecontroleerd onderzoek van 3 weken (ALADIN-studie). Diabetologia 1995; 38: 1425-1433 [PMID: 8786016]
26 Winkler G, Kempler P. [Pathomechanisme van diabetische neuropathie: achtergrond van de op pathogenese gerichte therapie]. Orv Hetil 2010; 151: 971-981 [PMID: 20519180 DOI: 10.1556/OH.2010.28898]
27 Ang CD, Alviar MJ, Dans AL, Bautista-Velez GG, Villaruz-Sulit MV, Tan JJ, Co HU, Bautista MR, Roxas AA. Vitamine B voor de behandeling van perifere neuropathie. Cochrane Database Syst Rev 2008; (3): CD004573 [PMID: 18646107 DOI: 10.1002/14651858.CD004573. pub3]
28 Winkler G, Pál B, Nagybéganyi E, Ory I, Porochnavec M, Kempler P. Effectiveness of different benfotiamine dose regimens in the treatment of painful diabetic neuropathy. Arzneimittelforschung 1999; 49: 220-224 [PMID: 10219465 DOI: 10.1055/s-0031-1300405]
29 Ignacio RM, Kim CS, Kim YD, Lee HM, Qi XF, Kim SK. Therapeutisch effect van Active Hexose-Correlated Compound (AHCC) gecombineerd met CpG-ODN (oligodeoxynucleotide) in B16 melanoom muismodel. Cytokine 2015; 76: 131-137 [PMID: 26082022 DOI: 10.1016/j.cyto.2015.06.002]
30 Chatterjee SJ, Ovadje P, Mousa M, Hamm C, Pandey S. The efficacy of dandelion root extract inducing apoptosis in drug-resistant human melanoma cells. Evid Based Complement Alternat Med 2011; 2011: 129045 [PMID: 21234313 DOI: 10.1155/2011/129045]
31 Mirzaei H, Naseri G, Rezaee R, Mohammadi M, Banikazemi Z, Mirzaei HR, Salehi H, Peyvandi M, Pawelek JM, Sahebkar A. Curcumin: Een nieuwe kandidaat voor melanoomtherapie? Int J Cancer 2016; 139: 1683-1695 [PMID: 27280688 DOI: 10.1002/ijc.30224]
32 Huang XY, Zhang SZ, Wang WX. Enhanced antitumor efficacy with combined administration of astragalus and pterostilbene for melanoma. Asian Pac J Cancer Prev 2014; 15: 1163-1169 [PMID: 24606435]
33 Wagner SC, Markosian B, Ajili N, Dolan BR, Kim AJ, Alexandrescu DT, Dasanu CA, Minev B, Koropatnick J, Marincola FM, Riordan NH. Intraveneus ascorbinezuur als adjuvans voor interleukine-2 immuuntherapie. J Transl Med 2014; 12: 127 [PMID: 24884532 DOI:10.1186/1479-5876-12-127]
34 Horneber MA, Bueschel G, Huber R, Linde K, Rostock M. Mistletoe therapy in oncology. Cochrane Database Syst Rev 2008; (2): CD003297 [PMID: 18425885 DOI: 10.1002/14651858.CD003297.pub2]
35 Delaney LM, Ho N, Morrison J, Farias NR, Mosser DD, Coomber BL. Dichloroacetate affects proliferation but not survival of human colorectal cancer cells. Apoptosis 2015; 20: 63-74 [PMID: 25344893 DOI: 10.1007/s10495-014-1046-4]
36 Abildgaard C, Dahl C, Basse AL, Ma T, Guldberg P. Bioenergetische modulatie met dichlooracetaat vermindert de groei van melanoomcellen en versterkt hun respons op BRAFV600E-inhibitie. J Transl Med 2014; 12: 247 [PMID: 25182332 DOI: 10.1186/s12967-014-0247-5]
37 Khan A, Andrews D, Blackburn AC. Langdurige stabilisatie van stadium 4 darmkanker met behulp van natriumdichlooracetaattherapie. World J Clin Cases 2016; 4: 336-343 [PMID: 27803917]
38 Tzeng HF, Blackburn AC, Board PG, Anders MW. Polymorphismand species-dependent inactivation of glutathione transferase zeta by dichloroacetate. Chem Res Toxicol 2000; 13: 231-236 [PMID: 10775321]