Akbar Khan, Doug Andrews, Jill Shainhouse, Anneke C Blackburn
Akbar Khan, Douglas Andrews, Medicor Cancer Centres Inc., Toronto, ON M2N 6N4, Kanada
Jill Shainhouse, Naturheilkundliche Klinik Insight, Toronto, ON M4P 1N9, Kanada
Anneke C Blackburn, John Curtin School of Medical Research, Australische Nationale Universität, Canberra, ACT 2601, Australien
Beiträge der Autoren: Khan A behandelte die Patientin und schrieb den größten Teil des Fallberichts; Andrews D half bei der Entwicklung des natürlichen Medikamentenprotokolls zur Verringerung der DCA-Nebenwirkungen und schrieb einen Teil des Fallberichts; Shainhouse J behandelte die Patientin mit natürlicher Therapie; Blackburn AC interpretierte den Fallbericht im Zusammenhang mit der Literatur zur in vitro- und in vivo-DCA-Forschung, schrieb Teile der Einleitung und Diskussion und überprüfte das Manuskript insgesamt.
Einverständniserklärung nach Aufklärung: Die in diesem Manuskript beschriebene Patientin hat ihr Einverständnis zur anonymen Veröffentlichung ihres Falles gegeben.
Erklärung zu Interessenkonflikten: Einer der Autoren (Khan) führt die Dichloracetat-Therapie für Krebspatienten über die Medicor-Krebszentren auf Kosten und ohne Gewinn durch. Die Klinik ist im Besitz eines Familienmitglieds dieses Autors. Die anderen Autoren haben nichts zu verraten.
Open-Access: Dieser Artikel ist ein Open-Access-Artikel, der von einem internen Redakteur ausgewählt und von externen Gutachtern vollständig begutachtet wurde. Er wird in Übereinstimmung mit der Creative Commons Attribution Non Commercial (CC BY-NC 4.0)-Lizenz verbreitet, die es anderen erlaubt, dieses Werk zu verbreiten, zu remixen, zu adaptieren, auf diesem Werk aufzubauen und ihre abgeleiteten Werke zu anderen Bedingungen zu lizenzieren, vorausgesetzt, das Originalwerk wird ordnungsgemäß zitiert und die Nutzung ist nicht kommerziell. Siehe: http://creativecommons.org/licenses/by-nc/4.0/
Quelle des Manuskripts: Eingeladenes Manuskript
Korrespondenz mit: Akbar Khan, MD, Medizinischer Direktor,
Medicor Cancer Centres Inc., 4576 Yonge St., Suite 301, Toronto,
ON M2N 6N4, Kanada.
[email protected]:
+1-416-2270037Fax: +1-416-2271915
Received: 30. Januar 2017
Peer-Review begonnen: Februar 12, 2017
Erste Entscheidung: March 28, 2017
Revised: May 5, 2017
Accepted: Mai 30, 2017
Artikel im Druck: 31. Mai 2017
Online veröffentlicht: August 10, 2017
Zusammenfassung
Natriumdichloracetat (DCA) wird seit 2007 als metabolische Krebstherapie untersucht, basierend auf einer Publikation von Bonnet et al, die zeigte, dass DCA Apoptose (programmierten Zelltod) in menschlichen Brust-, Lungen- und Gehirnkrebszellen induzieren kann. Klassischerweise wird das Ansprechen von Krebs auf eine medizinische Therapie in der Humanforschung anhand der Definitionen der Response Evaluation Criterial for Solid Tumours (Kriterien für die Beurteilung des Ansprechens auf solide Tumore) gemessen, die „Ansprechen“ durch den Grad der Tumorverkleinerung oder das Verschwinden des Tumors auf bildgebenden Verfahren definieren, aber auch die Stabilisierung der Krankheit ist ein positives klinisches Ergebnis. Es hat sich gezeigt, dass DCA in vitro und in vivo als Zytostatikum wirken kann, ohne Apoptose auszulösen. Es wird der Fall eines 32-jährigen Mannes vorgestellt, bei dem eine DCA-Therapie ohne gleichzeitige konventionelle Therapie zu einer Rückbildung und Stabilisierung eines rezidivierenden metastasierenden Melanoms über einen Zeitraum von mehr als vier Jahren führte, wobei die Nebenwirkungen geringfügig waren. Dieser Fall zeigt, dass DCA zur Verringerung des Krankheitsvolumens und zur Erhaltung der langfristigen Stabilität bei Patienten mit fortgeschrittenem Melanom eingesetzt werden kann.
Schlüsselwörter: Dichloroacetat; Krebs; BRAF; Melanom; Zytostatikum
© The Author(s) 2017. Veröffentlicht von Baishideng Publishing Group Inc. All rights reserved.
Kernaussage: Natriumdichloracetat (DCA) wurde seit 2007 als metabolische Krebstherapie untersucht. Es hat sich gezeigt, dass die DCA-Therapie zu einem klassischen Ansprechen führen kann, das durch die Verkleinerung oder das Verschwinden von Tumoren in der Bildgebung gemessen wird. DCA kann aber auch das Wachstum von Krebszellen stoppen, ohne Apoptose auszulösen (zytostatische Wirkung). Dies kann zu einer langfristigen Stabilisierung von metastasierendem Krebs führen. Wir stellen einen Fall vor, in dem eine orale DCA-Therapie bei einem 32-jährigen Mann zu einer Verringerung und Stabilisierung des metastasierten Melanoms über 4 Jahre hinweg geführt hat, wobei nur geringe Nebenwirkungen aufgetreten sind.
Khan A, Andrews D, Shainhouse J, Blackburn AC. Langfristige Stabilisierung eines metastasierten Melanoms mit Natriumdichloracetat.
World J Clin Oncol 2017; 8(4): 371-377Available
from: URL: http://www.wjgnet.com/2218-4333/full/v8/i4/371.htm
DOI: http://dx.doi.org/10.5306/wjco.v8.i4.371
INTRODUCTION
Natriumdichloracetat (DCA) erregte im Jahr 2007 die Aufmerksamkeit der medizinischen Fachwelt, als Bonnet et al[1] die erste In-vitro- und In-vivo-Studie veröffentlichten, die den Wert von DCA als metabolische Krebstherapie durch seine hemmende Wirkung auf das mitochondriale Enzym Pyruvat-Dehydrogenase-Kinase illustrierte. Zuvor hatten Stacpoole et al[2-4] mehrere Studien mit DCA zur Behandlung der kongenitalen Laktatazidose bei mitochondrialen Erkrankungen veröffentlicht[2-5]. Diese Studien zeigten, dass DCA in oraler Form ein sicheres Medikament für den Menschen ist. Es wurde festgestellt, dass DCA keine Nieren-, Lungen-, Knochenmark- und Herztoxizität aufweist[4]. Die meisten DCA-Nebenwirkungen waren geringfügig, wobei die schwerwiegendste eine reversible periphere Neuropathie war[6]. Es wurde auch über reversible Delirien berichtet[7]. Eine Erhöhung der Leberenzyme (asymptomatisch und reversibel) wurde bei einem kleinen Prozentsatz der Patienten festgestellt[3]. Die vorangegangene Forschung an Menschen mit mitochondrialen Störungen hat die rasche Umsetzung von DCA in die Anwendung beim Menschen als Off-Label-Krebstherapie ermöglicht. Inzwischen wurden mehrere Berichte über klinische Versuche mit DCA als Krebstherapie veröffentlicht, die das Sicherheitsprofil von DCA bestätigen und darauf hindeuten, dass der potenzielle Nutzen von DCA in der Krebsklinik zunehmend anerkannt wird[8-11]. Eine Einschränkung dieser Studien, an denen Patienten im Spätstadium beteiligt waren, besteht darin, dass sie nur über kurze Behandlungszeiträume berichtet haben.
In Bonnets Veröffentlichung von 2007[1]wurde gezeigt, dass eine DCA-Behandlung das mitochondriale Membranpotenzial reduziert, was die Apoptose in menschlichen Krebszellen selektiv fördert. Die Hemmung der aeroben Glykolyse (Warburg-Effekt) und die Aktivierung mitochondrialer Kalium-Ionenkanäle wurden als Wirkmechanismen von DCA identifiziert. Weitere Untersuchungen von DCA in vitro haben die krebshemmende Wirkung gegen eine Vielzahl von Krebsarten bestätigt, die kürzlich von Kankotia und Stacpoole überprüft wurden[12]. Darüber hinaus ist DCA auch in der Lage, die Apoptose zu verstärken, wenn es mit anderen Wirkstoffen kombiniert wird[13-15]. Es wurden auch andere krebshemmende Wirkungen von DCA vorgeschlagen, darunter die Hemmung der Angiogenese[16]veränderung der HIF1-α-Expression[17], die Veränderung der Zell-pH-Regulatoren V-ATPase und MCT1 sowie anderer Zellüberlebensregulatoren wie p53 und PUMA[18]. In vielen In-vitro-Studien werden jedoch unangemessen hohe DCA-Konzentrationen verwendet, die klinisch nicht anwendbar sind, um eine zytotoxische Wirkung zu erzielen[12]. In anderen Studien wurden bescheidenere DCA-Konzentrationen verwendet, die zeigen, dass DCA zytostatisch sein kann. Der zweite Bericht aus dem Jahr 2010 über seine In-vivo-Krebsbekämpfungsaktivität ergab, dass DCA allein in einem Modell für metastasierenden Brustkrebs zytostatisch wirkt[19]und hemmte die Proliferation, ohne die Apoptose auszulösen. Dies deutet auf eine Rolle von DCA als Krebsstabilisator hin, ähnlich wie bei Angiogenesehemmern.
Als Reaktion auf den Bericht aus dem Jahr 2007 über die krebshemmende Wirkung von DCA begann Khan, DCA zur Behandlung von Krebspatienten einzusetzen, deren Prognose schlecht war oder die auf herkömmliche Krebstherapien nicht mehr ansprachen. In Zusammenarbeit mit einem Arzt für Naturheilkunde (Andrews) wurde ein natürliches Medikamentenprotokoll entwickelt, um die dosislimitierende neurologische Toxizität von DCA zu behandeln. Dieses bestand aus 3 Medikamenten: Acetyl-L-Carnitin[20-22], R-Alpha-Liponsäure[23-25] und Benfotiamin[26-28]zur Prävention von Neuropathie und Enzephalopathie. Bei über 300 Krebspatienten im fortgeschrittenen Stadium zeigten die Beobachtungsdaten, dass die DCA-Therapie in 60-70 % der Fälle von Nutzen war. Das Neuropathierisiko bei der Kombination von natürlichen neuroprotektiven Arzneimitteln mit DCA lag bei etwa 20 % bei einer Dosierung von 20-25 mg/kg pro Tag in einem Zyklus von 2 Wochen an/1 Woche aus (klinische Beobachtungsdaten, online veröffentlicht unter www.medicorcancer.com). Hier wird ein Fallbericht eines Patienten vorgestellt, der sowohl die apoptotische als auch die antiproliferative Wirkung einer chronischen DCA-Behandlung über einen Zeitraum von mehr als vier Jahren veranschaulicht.
FALLBERICHT
Ein 32-jähriger, zuvor gesunder, hellhäutiger Mann bemerkte 2006, dass sich ein Muttermal an seiner linken Wade zu verändern begann. Er konsultierte einen Arzt und der Leberfleck wurde entfernt. In der Pathologie wurde ein Melanom diagnostiziert. Es wurde eine Sentinel-Node-Dissektion durchgeführt, die keine Metastasen nachwies. Im Jahr 2007 stellte der Patient eine Vergrößerung der linken Leistenlymphknoten und kleine melanozytäre Läsionen auf der Haut des linken Beins fest. Er wurde im Rahmen einer klinischen Studie in einem regionalen Krebskrankenhaus mit Interferon alpha behandelt, wobei sich die Knoten verkleinerten und die Hautmetastasen zurückbildeten. Interferon wurde nach 9 Monaten aufgrund von Nebenwirkungen abgesetzt.
Dem Patienten ging es bis 2010 gut, als eine neue Hautmetastase am linken Bein auftrat. Diese wurde chirurgisch entfernt. Ende 2011 wurde eine weitere neue Hautmetastase am linken Bein innerhalb der Narbe der ursprünglichen Melanomoperation festgestellt. Diese wurde biopsiert und die Diagnose eines rezidivierenden Melanoms wurde bestätigt. Daraufhin wurde er mit einer großflächigen Exzision und einer Hauttransplantation behandelt.
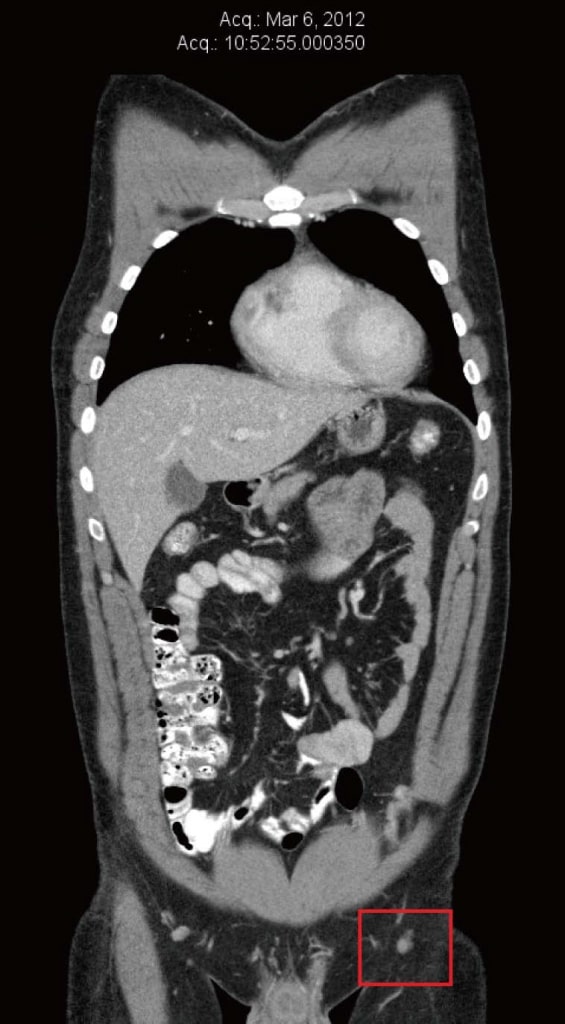
Im März 2012 wurde bei dem Patienten ein Rezidiv innerhalb des Hauttransplantats am linken Bein diagnostiziert. Dieses wurde herausgeschnitten und eine neue Hauttransplantation wurde durchgeführt. Die Pathologie ergab positive Ränder der entfernten Metastase, so dass eine erneute Exzision durchgeführt wurde, ebenfalls mit positiven Rändern. Gleichzeitig bestätigte die Nadelbiopsie eines linken Leistenlymphknotens das Vorhandensein eines BRAF-positiven metastasierenden Melanoms. Eine im März 2012 durchgeführte Computertomographie (CT) ergab keine Hinweise auf Fernmetastasen. Der größte linke Leistenknoten hatte einen Durchmesser von 8 mm und wurde als „unbedeutend nach Größenkriterien“ eingestuft (Abbildung 1).
Im April 2012 konsultierte der Patient einen Arzt für Naturheilkunde (Shainhouse) und begann eine Therapie mit den folgenden oralen natürlichen Krebsmitteln: Active Hexose Correlated Compound oder AHCC (Pilzextrakt)[29], Löwenzahnwurzel[30], Curcumin[31] und Astragaluswurzel[32]. Außerdem wurde eine parenterale Therapie eingeleitet, die aus zweimal wöchentlichem intravenösem Vitamin C[33 ] und subkutanem europäischen Mistelextrakt[34] bestand. Die Patientin stellte außerdem auf eine vegane Ernährung um.
Im Mai 2012 suchte die Patientin die Klinik des Autors (Khan) auf, um weitere nicht-traditionelle Therapien durchzuführen. Es wurde eine DCA-Therapie erörtert, aber die Patientin beschloss, zunächst die natürlichen Anti-Krebs-Therapien (verschrieben von Shainhouse) auszuprobieren. Im Mai 2012 (nach nur einem Monat natürlicher Therapie) wurde erneut eine CT-Untersuchung durchgeführt, die ein leichtes Wachstum mehrerer Leistenknoten und externer Beckenknoten mit einer Größe von 10 mm × 11 mm bis 14 mm × 15 mm zeigte.
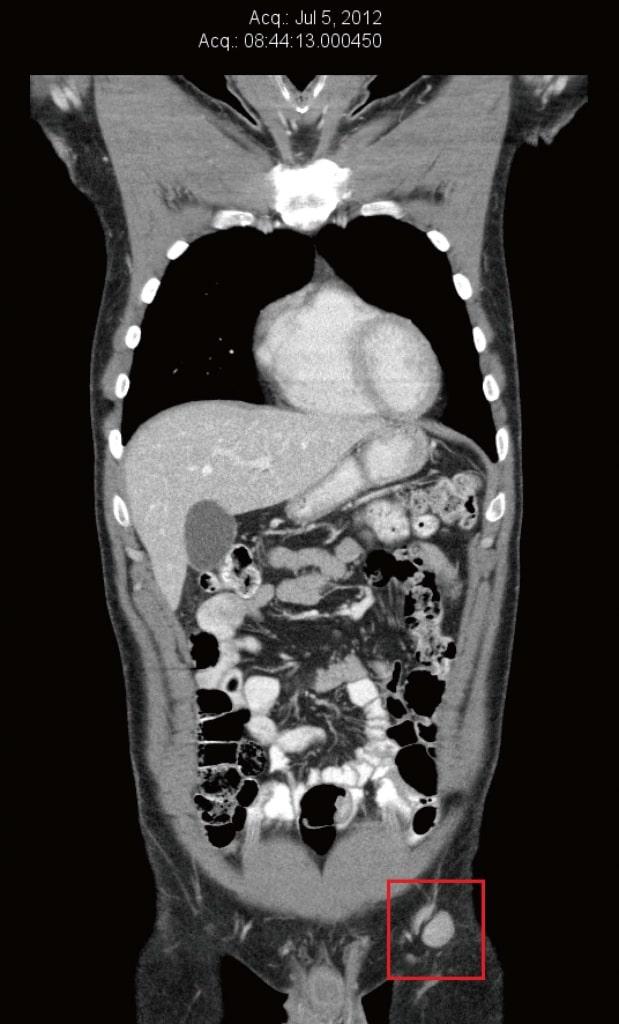
Im Juli 2012 wurde die CT-Untersuchung wiederholt, um die natürliche Krebstherapie des Patienten zu beurteilen. Zu diesem Zeitpunkt hatten sich die linken Leisten- und äußeren Beckenknoten erneut vergrößert und waren zwischen 13 mm × 16 mm und 22 mm × 20 mm groß (Abbildung 2). In Vorbereitung auf die Teilnahme an einer klinischen Studie in Boston, MA (USA), wurde auch ein PET-Scan durchgeführt, der eine erhöhte Glukoseaufnahme in den linken Leistenknoten bestätigte. In der linken Leistengegend traten neue schmerzhafte Schmerzen geringer Intensität (2/10) auf. Bei der Untersuchung wurden ein 20 mm großer, nicht druckempfindlicher linker Leistenlymphknoten und zwei kleine Hautmetastasen innerhalb des Hauttransplantats der linken Wade festgestellt.
Bei dem Patienten wurde also ein Fortschreiten der Krankheit diagnostiziert. Zu diesem Zeitpunkt beschloss er, eine DCA-Therapie einzuleiten. Er begann mit der oralen Einnahme von DCA 500 mg dreimal täglich, was 17 mg/kg pro Tag entsprach (Hersteller: Tokyo Chemical Industry, Vereinigte Staaten), zusätzlich zur Beibehaltung der anderen natürlichen Therapien. Der DCA-Behandlungszyklus betrug 2 Wochen ein und 1 Woche aus. Um das Auftreten von DCA-Nebenwirkungen zu minimieren, wurden 3 zusätzliche natürliche Medikamente verschrieben: Acetyl-L-Carnitin zum Einnehmen 500 mg dreimal täglich, Benfotiamin zum Einnehmen 80 mg zweimal täglich und R-Alpha-Liponsäure zum Einnehmen 150 mg dreimal täglich. Diese Ergänzungsmittel wurden täglich eingenommen (kein Zyklus). Zu Beginn der Studie wurden routinemäßige Blutuntersuchungen durchgeführt (Tabelle 1). Diese waren alle normal, mit Ausnahme eines niedrigen Kreatininwertes, der als unbedeutend angesehen wurde.
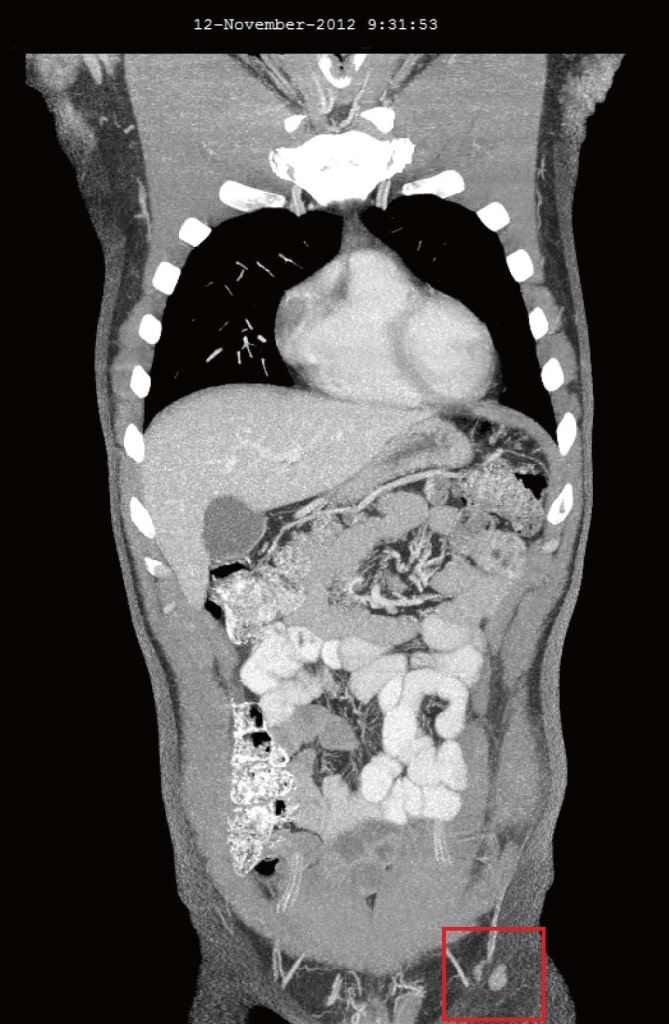
Im November 2012, vier Monate nach der Zugabe von DCA zu seinen ursprünglichen natürlichen Anti-Krebs-Therapien, wurde der Patient erneut untersucht. Er fühlte sich allgemein gut. Es wurde berichtet, dass zwei neue Symptome erst nach Beginn der DCA-Therapie aufgetreten waren: Ein leicht vermindertes Gefühl in den Fingerspitzen und Zehen und eine leicht verminderte Konzentrationsfähigkeit während der zweiwöchigen Einnahme von DCA. Der leichte Gefühlsverlust verschlimmerte sich nicht und wurde als leichte DCA-bedingte Neuropathie angesehen. Sowohl das Taubheitsgefühl als auch die verminderte Konzentrationsfähigkeit waren Berichten zufolge in den Wochen, in denen der Patient kein DCA mehr einnahm, wieder verschwunden. Das Blutbild vom Oktober 2012 zeigte keine signifikanten Veränderungen (Tabelle 1). Die CT-Scans vom August 2012 und November 2012 zeigten eine deutliche Rückbildung aller zuvor vergrößerten Lymphknoten. Der größte Knoten war 10 mm groß, und es gab keine Hinweise auf eine intrathorakale oder intraabdominale Erkrankung und keine Knochenmetastasen (Abbildung 3).
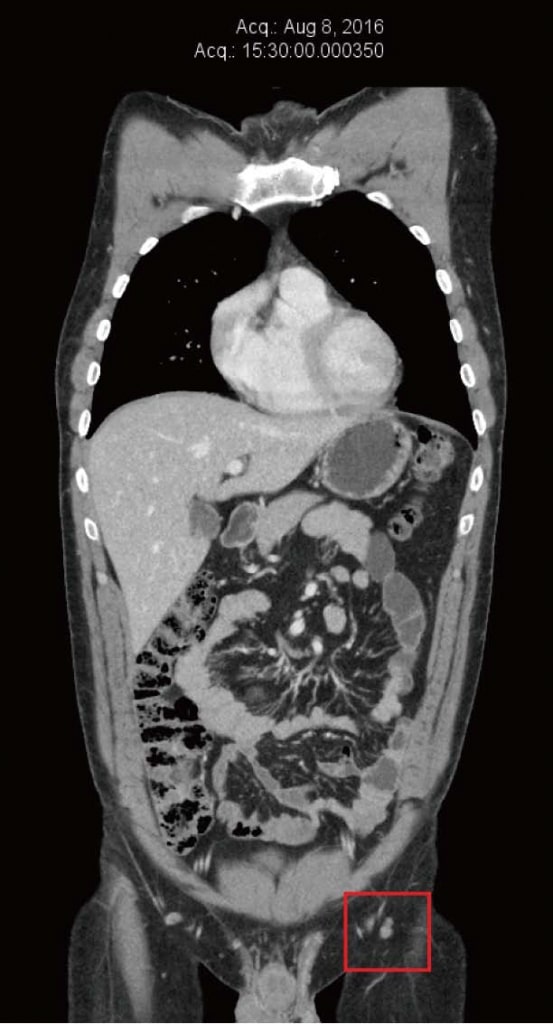
Der Patient fühlte sich unter der DCA-Therapie weiterhin gut, und es wurden keine neuen Hautmetastasen oder eine neue Vergrößerung der Leistenknoten festgestellt. Er unterzog sich weiterhin einer regelmäßigen klinischen Überwachung durch seinen naturheilkundlichen Arzt (Shainhouse) und einer jährlichen Nachuntersuchung durch seinen Arzt (Khan). Die aufgeführten natürlichen Anti-Krebs-Therapien (von Shainhouse verschrieben) und die DCA-Therapie wurden 2016 beibehalten. Die Ergebnisse der Blutuntersuchung im Juni 2016 waren weiterhin normal (Tabelle 1). Im August 2016 wurde ein CT-Scan wiederholt, der keine Anzeichen für ein metastasierendes Melanom zeigte, nachdem die DCA-Therapie in Kombination mit der natürlichen Krebstherapie vier Jahre lang fortgesetzt worden war (Abbildung 4). Im Dezember 2016 berichtete der Patient über eine Zunahme von arbeitsbedingtem Stress und eine Verringerung der Compliance mit seinen Medikamenten. Zu dieser Zeit bemerkte er eine neue linke Leistenmasse. Es wurde eine Ultraschalluntersuchung durchgeführt, die ein neues Konglomerat vergrößerter Lymphknoten mit den Maßen 40 mm × 25 mm × 23 mm ergab, wobei der Farbdoppler einen Blutfluss innerhalb der Masse zeigte. Dies wurde als erneutes Wachstum des Melanoms nach etwa viereinhalb Jahren kontinuierlicher DCA-Therapie interpretiert. Zur weiteren Abklärung wurde eine PET/CT-Untersuchung durchgeführt, die ein Wiederauftreten der Krankheit in drei linken Leistenknoten bestätigte (SUVmax zwischen 13 und 17,8).
Zusammenfassend lässt sich sagen, dass der Patient über einen Zeitraum von 6 Jahren eine konventionelle Therapie für ein rezidivierendes Melanom im Stadium 3 erhielt, die aus einer primären chirurgischen Exzision mit Lymphknotendissektion, Interferon alpha und chirurgischen Exzisionen für rezidivierende kutane Metastasen bei 5 Gelegenheiten bestand. Anschließend erhielt der Patient 3 Monate lang nur eine natürliche Krebstherapie (verschrieben von Shainhouse), auf die er nicht ansprach, was durch ein stetiges Fortschreiten der Krankheit auf den regelmäßigen CT-Scans belegt wurde. Schließlich fügte der Patient der natürlichen Krebstherapie eine orale DCA-Therapie hinzu, mit drei gleichzeitigen neuroprotektiven Medikamenten (Liponsäure, Acetyl-L-Carnitin und Benfotiamin) und ohne gleichzeitige konventionelle Krebstherapien. Das Ergebnis war eine vollständige radiologische Remission, die über 4 Jahre anhielt, gefolgt von einem Rezidiv. Im Verlauf der DCA-Therapie traten bei der Patientin triviale Nebenwirkungen auf, die aus einer leichten Neuropathie und einer leichten Konzentrationsminderung bestanden. Der Patient behielt die ECOG-Stufe 0 bei, und er war in der Lage, voll zu arbeiten.
Tabelle 1 Blutbild vor der Dichloracetat-Natrium-Therapie
| Bluttest | Juli 12 vor DCA | Oktober 12 3 Monate DCA | Juni 16 4 Jahre DCA | Einheiten | Normaler Bereich |
|---|---|---|---|---|---|
| Hämoglobin | 154 | 150 | 157 | g/L | 135-175 |
| Anzahl der weißen Blutkörperchen | 4.5 | 4.1 | 5 | ×109/L | 4.0-11.0 |
| Blutplättchen | 220 | 214 | 229 | ×109/L | 150-400 |
| Glukose | – | 4.6 | 4.9 | mmol/L | 3.6-7.7 |
| Harnstoff | 3.9 | 3.2 | 3.9 | mmol/L | 2.5-8.0 |
| Kreatinin | 491 | 501 | 551 | μmol/L | 62-115 |
| Kalzium | 2.47 | 2.41 | 2.47 | mmol/L | 2.15-2.60 |
| Albumin | 48 | 45 | 47 | g/L | 35-50 |
| Bilirubin | 8 | 10 | 13 | μmol/L | < 22 |
| Natrium | 139 | 141 | 140 | mmol/L | 135-147 |
| Kalium | 4 | 4.3 | 3.9 | mmol/L | 3.5-5.5 |
| Chlorid | 106 | 107 | 105 | mmol/L | 100-110 |
| Alkalische Phosphatase | 77 | 69 | 71 | U/L | 45-129 |
| LDH | 139 | 135 | 144 | U/L | 120-246 |
| GGT | 18 | 19 | 20 | U/L | 15-73 |
| AST | 18 | 25 | 21 | U/L | 7-37 |
| ALT | 18 | 28 | 19 | U/L | 12-49 |
DISKUSSION
Die Anwendung von oralem DCA bei dem hier beschriebenen Patienten mit metastasiertem Melanom zeigt eine Schrumpfung des Tumors und eine langfristige Krankheitsstabilität gemäß dem klinischen Status und der CT-Bildgebung. Die Krankheitsstabilität wurde während der Einnahme von DCA über 4 Jahre aufrechterhalten, ohne dass gleichzeitig eine konventionelle Therapie durchgeführt wurde, wobei die Überlebenszeit seit der Erstdiagnose 10 Jahre betrug. Laut der SEER-Krebsstatistik des National Cancer Institute ist das Überleben dieses Patienten, der keine Anzeichen von Fernmetastasen aufwies, nicht bemerkenswert (62,9 % 5-Jahres-Überlebensrate für Melanome mit Ausbreitung auf regionale Lymphknoten, https://seer.cancer. gov/statfacts/html/melan.html). Bemerkenswert ist, dass in einer Situation, in der sich die betroffenen Lymphknoten deutlich vergrößert hatten, die zusätzliche orale DCA-Therapie die vergrößerten Knoten wirksam schrumpfen ließ (Abbildungen 2 und 3) und eine Remission von über 4 Jahren erreichte. Es ist möglich, dass die natürlichen Anti-Krebs-Therapien, die der Patient erhielt, mit DCA synergierten, aber es ist auch klar, dass diese natürlichen Therapien allein nicht für die Rückbildung der Krankheit verantwortlich sein können. DCA hat Berichten zufolge sowohl apoptotische als auch zytostatische Wirkungen[14,17,19,35,36], was mit dem klinischen Verlauf dieser Patientin mit Rückbildung (apoptotisch) und verlängerter Remission (zytostatisch) übereinstimmt. Das Rezidiv nach 4 Jahren fiel mit einer verminderten Compliance zusammen, was darauf hindeutet, dass bei dieser Methode der Krebsbehandlung mit DCA der metabolische Druck kontinuierlich aufrechterhalten werden muss. Trotz des Rezidivs blieb der Patient klinisch gesund und plante den Beginn einer neuen Immuntherapie. Es bleibt abzuwarten, ob durch eine Umstellung der Therapie erneut eine Krankheitsrückbildung oder -stabilität erreicht werden kann.
Neben der Aufrechterhaltung der Remission über mehr als vier Jahre hinweg zeigt dieser Fall, dass DCA bei Krebspatienten über einen längeren Zeitraum hinweg gut verträglich ist, was im Vergleich zu allen veröffentlichten klinischen DCA-Krebsstudien belegt wird. Insbesondere war dieser Patient in der Lage, 17 mg/kg pro Tag in einem Regime von 2 Wochen an/1 Woche aus für 4 Jahre mit minimalen Nebenwirkungen zu tolerieren. Dies ähnelt unserem früheren Fallbericht über die chronische Anwendung von DCA bei Dickdarmkrebs[37], wo der Patient 16 mg/kg pro Tag (aber nicht 25 mg/kg pro Tag) im gleichen Regime vertragen konnte, steht aber im Gegensatz zu den klinischen Studien für DCA, die eine niedrigere Dosis von 10-12,5 mg/kg pro Tag bei kontinuierlicher Verabreichung empfehlen[9,11]. Die einwöchige Pause oder die neuroprotektiven Ergänzungsmittel könnten beide dazu beitragen, dass die Patienten in den Fallberichten die höhere Dosis vertragen haben. Genetische Polymorphismen in GSTZ1, dem Leberenzym, das DCA verstoffwechselt, können ebenfalls dazu beitragen, dass die DCA-Dosis toleriert werden kann[9,38]. In den Studien wurde über variable Wirkstoffspiegel berichtet, aber nicht alle haben diesen pharmakogenetischen Aspekt der DCA-Therapie berücksichtigt[9,11], und es sind weitere Studien erforderlich, um zu klären, ob dies einen wesentlichen Beitrag zur DCA-Toleranz leistet. Zur Zeit läuft eine DCA-Studie am Menschen zum Multiplen Myelom, in der sowohl der GSTZ1-Genotyp als auch die Medikamentenspiegel untersucht werden, um zu unserem Verständnis dieser Fragen beizutragen (Australia New Zealand Clinical Trials Register #ACTRN12615000226505, http://www.anzctr. org.au).
Dieser Fallbericht zeigt, dass eine chronische DCA-Therapie im Vergleich zu herkömmlichen Melanomtherapien wie Interferon ohne Beeinträchtigung der Lebensqualität durchgeführt werden kann. Um das optimale Protokoll für eine maximal verträgliche akute oder chronische Behandlung mit DCA zu ermitteln, sind Studien am Menschen erforderlich. Vor allem aber muss noch geklärt werden, welche Dosis für eine zielgerichtete und gegen Krebs wirksame Wirkung erforderlich ist. Diese Informationen sind notwendig, bevor in größere Langzeitstudien zu den Ergebnissen bei den Patienten investiert wird. DCA verdient weitere Untersuchungen in klinischen Versuchen als nichttoxische Krebstherapie aufgrund seiner bescheidenen Kosten und geringen Toxizität und verdient es, als Off-Label-Krebstherapie in Betracht gezogen zu werden.
DANKSAGUNG
Die Autoren danken Dr. Humaira Khan für ihre Hilfe und der Patientin für ihre Unterstützung und ihr Einverständnis, ihren Fall zu veröffentlichen.
KOMMENTARE
Merkmale des Falls
Der 32-jährige männliche Patient stellte sich mit einer pigmentierten Läsion an seinem Bein vor.
Klinische Diagnose
Bei dem Patienten wurde ein Melanom diagnostiziert.
Labordiagnose
Das Melanom wurde durch eine Exzisionsbiopsie bestätigt.
Bildgebende Diagnose
Vergrößerter Leistenknoten, bei dem ein Melanom nachgewiesen wurde (Nadelbiopsie).
Pathologische Diagnose
Melanom, BRAF-positiv.
Behandlung
Exzision der primären Läsion mit Hauttransplantation, Sentinel-Node-Dissektion, mehrfache Exzision von rezidivierenden Hautmetastasen. Absetzen der herkömmlichen Therapie und Beginn der natürlichen Anti-Krebs-Therapien (AHCC, Löwenzahnwurzel, Curcumin, Astragaluswurzel, i.v. Vitamin C, s.c. europäische Mistel). Fortschreiten nach 3 Monaten, Dichloracetat (DCA) wurde hinzugefügt. Rückbildung und Remission nach Zugabe von DCA über 4 Jahre lang.
Ähnliche Berichte
Computertomografische Berichte zeigen den Krankheitsverlauf und das Ansprechen auf Therapien.
Begriffserklärung
DCA: Dichloroacetat-Natrium; RECIST: Response evaluation criteria for solid tumours; ECOG: Eastern cooperative oncology group; SEER: Surveillance, epidemiology and end results.
Erfahrungen und Lehren
DCA kann als pro-apoptotisches und zytostatisches Medikament wirken und somit eine Rückbildung sowie eine langfristige Stabilisierung von metastasiertem Krebs ohne schwerwiegende Nebenwirkungen erreichen, wie dieser Melanomfall zeigt.
Peer-Review
Dr. Khan beschrieb einen 32-jährigen Mann, der eine DCA-Therapie zusammen mit anderen Medikamenten von Naturheilkundlern erhielt und über 4 Jahre lang in einem Stabilisierungszustand (metastasierendes Melanom) gehalten wurde. Dies ist ein interessanter Fall.
REFERENZEN
1 Bonnet S, Archer SL, Allalunis-Turner J, Haromy A, Beaulieu C, Thompson R, Lee CT, Lopaschuk GD, Puttagunta L, Bonnet S, Harry G, Hashimoto K, Porter CJ, Andrade MA, Thebaud B, Michelakis ED. Eine Mitochondrien-K+-Kanal-Achse ist bei Krebs unterdrückt und ihre Normalisierung fördert die Apoptose und hemmt das Krebswachstum. Cancer Cell 2007; 11: 37-51 [PMID: 17222789 DOI: 10.1016/ j.ccr.2006.10.020]
2 Stacpoole PW, Kurtz TL, Han Z, Langaee T. Role of dichloroacetate in the treatment of genetic mitochondrial diseases. Adv Drug Deliv Rev 2008; 60: 1478-1487 [PMID: 18647626 DOI: 10.1016/ j.addr.2008.02.014]
3 Stacpoole PW, Gilbert LR, Neiberger RE, Carney PR, Valenstein E, Theriaque DW, Shuster JJ. Bewertung der Langzeitbehandlung von Kindern mit kongenitaler Laktatazidose mit Dichloracetat. Pediatrics 2008; 121: e1223-e1228 [PMID: 18411236 DOI: 10.1542/ peds.2007-2062]
4 Stacpoole PW, Kerr DS, Barnes C, Bunch ST, Carney PR, Fennell EM, Felitsyn NM, Gilmore RL, Greer M, Henderson GN, Hutson AD, Neiberger RE, O’Brien RG, Perkins LA, Quisling RG, Shroads AL, Shuster JJ, Silverstein JH, Theriaque DW, Valenstein E. Controlled clinical trial of dichloroacetate for treatment of congenital lactic acidosis in children. Pädiatrie 2006; 117: 1519-1531 [PMID: 16651305 DOI: 10.1542/peds.2005-1226]
5 Berendzen K, Theriaque DW, Shuster J, Stacpoole PW. Therapeutisches Potenzial von Dichloracetat bei Pyruvatdehydrogenase-Komplex-Mangel. Mitochondrion 2006; 6: 126-135 [PMID: 16725381 DOI: 10.1016/j.mito.2006.04.001]
6 Kaufmann P, Engelstad K, Wei Y, Jhung S, Sano MC, Shungu DC, Millar WS, Hong X, Gooch CL, Mao X, Pascual JM, Hirano M, Stacpoole PW, DiMauro S, De Vivo DC. Dichloracetat verursacht toxische Neuropathie bei MELAS: eine randomisierte, kontrollierte klinische Studie. Neurology 2006; 66: 324-330 [PMID: 16476929 DOI: 10.1212/01. wnl.0000196641.05913.27]
7 Brandsma D, Dorlo TP, Haanen JH, Beijnen JH, Boogerd W. Severe encephalopathy and polyneuropathy induced by dichloroacetate. J Neurol 2010; 257: 2099-2100 [PMID: 20632025 DOI: 10.1007/ s00415-010-5654-9]
8 Michelakis ED, Sutendra G, Dromparis P, Webster L, Haromy A, Niven E, Maguire C, Gammer TL, Mackey JR, Fulton D, Abdulkarim B, McMurtry MS, Petruk KC. Metabolische Modulation von Glioblastomen mit Dichloracetat. Sci Transl Med 2010; 2: 31ra34 [PMID: 20463368 DOI: 10.1126/scitranslmed.3000677]
9 Dunbar EM, Coats BS, Shroads AL, Langaee T, Lew A, Forder JR, Shuster JJ, Wagner DA, Stacpoole PW. Phase-1-Studie mit Dichloracetat (DCA) bei Erwachsenen mit rezidivierenden bösartigen Hirntumoren. Invest New Drugs2014; 32: 452-464 [PMID: 24297161 DOI: 10.1007/ s10637-013-0047-4]
10 Garon EB, Christofk HR, Hosmer W, Britten CD, Bahng A, Crabtree MJ, Hong CS, Kamranpour N, Pitts S, Kabbinavar F, Patel C, von Euw E, Black A, Michelakis ED, Dubinett SM, Slamon DJ. Dichloracetat sollte bei fortgeschrittenem nicht-kleinzelligem Lungenkrebs mit platinbasierter Chemotherapie bei hypoxischen Tumoren und nicht als Einzelwirkstoff in Betracht gezogen werden. J Cancer Res Clin Oncol 2014; 140: 443-452 [PMID: 24442098 DOI: 10.1007/s00432-014-1583-9]
11 Chu QS, Sangha R, Spratlin J, Vos LJ, Mackey JR, McEwan AJ, Venner P, Michelakis ED. Eine offene, einarmige Phase-I-Dosiseskalationsstudie von Dichloracetat (DCA) bei Patienten mit fortgeschrittenen soliden Tumoren. Invest New Drugs 2015; 33: 603-610 [PMID: 25762000 DOI: 10.1007/s10637-015-0221-y]
12 Kankotia S, Stacpoole PW. Dichloracetat und Krebs: neue Heimat für ein Arzneimittel für seltene Leiden? Biochim Biophys Acta 2014; 1846: 617-629 [PMID: 25157892 DOI: 10.1016/j.bbcan.2014.08.005]
13 Sun RC, Board PG, Blackburn AC. Targeting metabolism with arsenic trioxide and dichloroacetate in breast cancer cells. Mol Cancer 2011; 10: 142 [PMID: 22093145 DOI: 10.1186/1476-4598-10-142]
14 Stockwin LH, Yu SX, Borgel S, Hancock C, Wolfe TL, Phillips LR, Hollingshead MG, Newton DL. Natriumdichloracetat greift selektiv Zellen mit Defekten im mitochondrialen ETC an. Int J Cancer 2010; 127: 2510-2519 [PMID: 20533281 DOI: 10.1002/ijc.25499]
15 Gang BP, Dilda PJ, Hogg PJ, Blackburn AC. Targeting von zwei Aspekten des Stoffwechsels in der Brustkrebsbehandlung. Cancer Biol Ther 2014; 15: 1533-1541 [PMID: 25482950 DOI: 10.4161/15384047.2014.955992]
16 Sutendra G, Dromparis P, Kinnaird A, Stenson TH, Haromy A, Parker JM, McMurtry MS, Michelakis ED. Mitochondrial activation by inhibition of PDKII suppresses HIF1a signaling and angiogenesis in cancer.Oncogene 2013; 32: 1638-1650 [PMID: 22614004 DOI: 10.1038/onc.2012.198]
17 Cairns RA, Bennewith KL, Graves EE, Giaccia AJ, Chang DT, Denko NC. Pharmakologisch erhöhte Tumorhypoxie kann durch 18F-Fluoroazomycin-Arabinosid-Positronenemissionstomographie gemessen werden und verstärkt die Tumorantwort auf das hypoxische Zytotoxin PR-104. Clin Cancer Res 2009; 15: 7170-7174 [PMID: 19920111 DOI: 10.1158/1078-0432.CCR-09-1676]
18 Anderson KM, Jajeh J, Guinan P, Rubenstein M. In vitro-Effekte von Dichloracetat und CO2 auf hypoxische HeLa-Zellen. Anticancer Res 2009; 29: 4579-4588 [PMID: 20032407]
19 Sun RC, Fadia M, Dahlstrom JE, Parish CR, Board PG, Blackburn AC. Die Umkehrung des glykolytischen Phänotyps durch Dichloracetat hemmt das Wachstum metastasierender Brustkrebszellen in vitro und in vivo. Breast Cancer Res Treat 2010; 120: 253-260 [PMID: 19543830 DOI: 10.1007/ s10549-009-0435-9]
20 De Grandis D. Acetyl-L-Carnitin zur Behandlung der chemotherapiebedingten peripheren Neuropathie: ein kurzer Überblick. CNS Drugs 2007; 21 Suppl 1: 39-43; Diskussion 45-46 [PMID: 17696592]
21 Maestri A, De Pasquale Ceratti A, Cundari S, Zanna C, Cortesi E, Crinò L. A pilot study on the effect of acetyl-L-carnitine in paclitaxeland cisplatin-induced peripheral neuropathy. Tumori 2005; 91: 135-138 [PMID: 15948540]
22 Evans JD, Jacobs TF, Evans EW. Die Rolle von Acetyl-L-Carnitin bei der Behandlung der diabetischen peripheren Neuropathie. Ann Pharmacother 2008; 42: 1686-1691 [PMID: 18940920 DOI: 10.1345/aph.1L201]
23 Mijnhout GS, Kollen BJ, Alkhalaf A, Kleefstra N, Bilo HJ. Alpha-Liponsäure für symptomatische periphere Neuropathie bei Patienten mit Diabetes: eine Meta-Analyse randomisierter kontrollierter Studien. Int J Endocrinol 2012; 2012: 456279 [PMID: 22331979 DOI: 10.1155/2012/456279]
24 Liu F, Zhang Y, Yang M, Liu B, Shen YD, Jia WP, Xiang KS. [Heilende Wirkung von Alpha-Liponsäure auf periphere Neuropathie bei Typ-2-Diabetes: eine klinische Studie]. Zhonghua Yixue Zazhi 2007; 87: 2706-2709 [PMID: 18167250]
25 Ziegler D, Hanefeld M, Ruhnau KJ, Meissner HP, Lobisch M, Schütte K, Gries FA. Behandlung der symptomatischen diabetischen peripheren Neuropathie mit dem Antioxidans Alpha-Liponsäure. Eine 3-wöchige multizentrische randomisierte kontrollierte Studie (ALADIN-Studie). Diabetologia 1995; 38: 1425-1433 [PMID: 8786016]
26 Winkler G, Kempler P. [Pathomechanismus der diabetischen Neuropathie: Hintergrund der pathogeneseorientierten Therapie]. Orv Hetil 2010; 151: 971-981 [PMID: 20519180 DOI: 10.1556/OH.2010.28898]
27 Ang CD, Alviar MJ, Dans AL, Bautista-Velez GG, Villaruz-Sulit MV, Tan JJ, Co HU, Bautista MR, Roxas AA. Vitamin B zur Behandlung der peripheren Neuropathie. Cochrane Database Syst Rev 2008; (3): CD004573 [PMID: 18646107 DOI: 10.1002/14651858.CD004573. pub3]
28 Winkler G, Pál B, Nagybéganyi E, Ory I, Porochnavec M, Kempler P. Effectiveness of different benfotiamine dosages regimens in the treatment of painful diabetic neuropathy. Arzneimittelforschung 1999; 49: 220-224 [PMID: 10219465 DOI: 10.1055/s-0031-1300405]
29 Ignacio RM, Kim CS, Kim YD, Lee HM, Qi XF, Kim SK. Therapeutische Wirkung von Active Hexose-Correlated Compound (AHCC) in Kombination mit CpG-ODN (Oligodeoxynukleotid) im B16 Melanom-Mausmodell. Cytokine 2015; 76: 131-137 [PMID: 26082022 DOI: 10.1016/j.cyto.2015.06.002]
30 Chatterjee SJ, Ovadje P, Mousa M, Hamm C, Pandey S. The efficacy of dandelion root extract inducing apoptosis in drug-resistant human melanoma cells. Evid Based Complement Alternat Med 2011; 2011: 129045 [PMID: 21234313 DOI: 10.1155/2011/129045]
31 Mirzaei H, Naseri G, Rezaee R, Mohammadi M, Banikazemi Z, Mirzaei HR, Salehi H, Peyvandi M, Pawelek JM, Sahebkar A. Curcumin: Ein neuer Kandidat für die Melanomtherapie? Int J Cancer 2016; 139: 1683-1695 [PMID: 27280688 DOI: 10.1002/ijc.30224]
32 Huang XY, Zhang SZ, Wang WX. Verbesserte Antitumor-Wirksamkeit bei kombinierter Verabreichung von Astragalus und Pterostilbene bei Melanomen. Asian Pac J Cancer Prev 2014; 15: 1163-1169 [PMID: 24606435]
33 Wagner SC, Markosian B, Ajili N, Dolan BR, Kim AJ, Alexandrescu DT, Dasanu CA, Minev B, Koropatnick J, Marincola FM, Riordan NH. Intravenöse Ascorbinsäure als Adjuvans zur Interleukin-2-Immuntherapie. J Transl Med 2014; 12: 127 [PMID: 24884532 DOI:10.1186/1479-5876-12-127]
34 Horneber MA, Bueschel G, Huber R, Linde K, Rostock M. Mistletoe therapy in oncology. Cochrane Database Syst Rev 2008; (2): CD003297 [PMID: 18425885 DOI: 10.1002/14651858.CD003297.pub2]
35 Delaney LM, Ho N, Morrison J, Farias NR, Mosser DD, Coomber BL. Dichloracetat beeinflusst die Proliferation, aber nicht das Überleben von menschlichen Darmkrebszellen. Apoptosis 2015; 20: 63-74 [PMID: 25344893 DOI: 10.1007/s10495-014-1046-4]
36 Abildgaard C, Dahl C, Basse AL, Ma T, Guldberg P. Bioenergetic modulation with dichloroacetate reduces the growth of melanoma cells and potentiates their response to BRAFV600E inhibition. J Transl Med 2014; 12: 247 [PMID: 25182332 DOI: 10.1186/s12967-014-0247-5]
37 Khan A, Andrews D, Blackburn AC. Langfristige Stabilisierung von Dickdarmkrebs im Stadium 4 mit Natriumdichloracetat-Therapie. World J Clin Cases 2016; 4: 336-343 [PMID: 27803917]
38 Tzeng HF, Blackburn AC, Board PG, Anders MW. Polymorphismand species-dependent inactivation of glutathione transferase zeta by dichloroacetate. Chem Res Toxicol 2000; 13: 231-236 [PMID: 10775321]