Zaida Torres-Cavazos1, Moisés Armides Franco-Molina2, Silvia Elena Santana-Krímskaya2, Cristina Rodríguez-Padilla2, Jorge Ramsy Kawas-Garza1, Gustavo Hernández-Vidal1, Gustavo Moreno-Degollado1und Diana Elisa Zamora-Ávila1
1 Posgrado Conjunto de las Facultades de Agronomía y Medicina Veterinaria y Zootecnia, Universidad Autónoma de Nuevo León
,Ave. Universidad S/N, Cd. Universitaria, San Nicolás de los Garza, N. L., CP 66455, Mexico2
Laboratorio de Inmunología y Virología, Unidad C, Facultad de Ciencias Biológicas, Universidad Autónoma de Nuevo León,A
ve
. Universidad S/N, Cd. Universitaria, San Nicolás de los Garza, N. L., CP 66455, Mexiko
Korrespondenz: Moisés Armides Franco-Molina; [email protected]
Eingereicht am: 13 July 2020Revised
: 28 September 2020Accepted
: 14. Oktober 2020Veröffentlicht
: 7. November 2020
Zusammenfassung
Unser Hauptaugenmerk lag auf der Bewertung der Wirksamkeit von Silber und Natriumdichloracetat als Wirkstoffe mit Doppelfunktion, die bei der Behandlung von Melanomen eingesetzt werden sollen. Diese Strategie zielt darauf ab, die Aktivität dieser beiden Verbindungen zu erhöhen, die die DNA-Integrität und die Mitochondrien auf verschiedenen Ebenen beeinflussen. Darüber hinaus haben wir untersucht, ob der durch unsere Behandlungen ausgelöste Zelltodmechanismus ein immunogener Zelltod ist. Zur Bewertung der Antitumor-Wirksamkeit haben wir das Tumorvolumen und die Produktion von Tumor-Nekrose-Faktor-α, Nuklearfaktor κ B (beide mittels ELISA) sowie die Stickoxid-Konzentration (Nitrat/Nitrit-Kolorimetrie-Assay-Kit) ermittelt; für den immunogenen Zelltod haben wir die Freisetzung von gefährdungsassoziierten molekularen Mustern mittels Immunhistochemie und Durchflusszytometrie sowie eine In-vivo-Probe untersucht. Unsere Ergebnisse zeigen, dass die Kombination von kolloidalem Silber und Natriumdichloracetat wirksamer ist als jede Behandlung für sich und dass der Antitumormechanismus nicht auf dem immunogenen Zelltod beruht. Darüber hinaus kann diese Studie einen umfassenden Beitrag zur Entwicklung von dichloracetatbeladenen Silbernanopartikeln und zur Entwicklung gezielter pharmakologischer Formulierungen zur Bekämpfung von Melanomen und anderen Krebsarten leisten.
Akademischer Herausgeber: Yanis Toledaño Magaña
Copyright © 2020 Zaida Torres-Cavazos et al. Dies ist ein Open-Access-Artikel, der unter der Creative-Commons-Attributionslizenz verbreitet wird, die die uneingeschränkte Nutzung, Verbreitung und Vervielfältigung in jedem Medium erlaubt, sofern das Originalwerk ordnungsgemäß zitiert wird.
EINLEITUNG
Zielgerichtete Therapien haben die Überlebenschancen von Menschen mit Melanomen erhöht [1]allerdings bevorzugen die Krebszellen im Tumor unterschiedliche Stoffwechselwege [2]infolgedessen wird der Tumor schließlich resistent gegen zielgerichtete Therapien, insbesondere gegen solche, die gegen ein einziges Ziel gerichtet sind [3].
Die Entwicklung von Therapien auf Silberbasis ist ein vielversprechendes Instrument für die Krebsbehandlung. Silberionen und Silbernanopartikel verursachen oxidativen Stress, eine Dysfunktion der mitochondrialen Membran, DNA-Schäden und eine Hochregulierung von Zytokinen [4]. Der genaue Wirkmechanismus hängt von den physikalischen und chemischen Eigenschaften des Nanopartikels und der Art des Krebses ab [5]. Darüber hinaus beweist die klinische Verwendung von kolloidalem Silber für bakterizide und antivirale Zwecke, dass diese Behandlung sicher ist [6],
7].
Natriumdichloracetat (DCA) ist ein Pyruvat-Analogon, das in die tumorassoziierte Glykolyse eingreift (Warburg-Effekt), die Bösartigkeit von Krebs verringert und die Laktatproduktion reduziert, indem es die Stoffwechselwege der Krebszellen verändert [8]. Ein Rückgang des Laktats wirkt dem sauren Zustand der tumoralen Mikroumgebung entgegen und reduziert das Tumorwachstum und die Metastasierung [8]. WZB117, ein Bis-Hydroxybenzoat, 2-Desoxy-d-Glukose, Metformin und DCA reduzieren die Glykolyse und blockieren die Glukoseaufnahme in Krebszellen. Bei niedrigem intrazellulärem Glukosespiegel werden Biosynthesewege wie die Nukleotid- und Aminosäurenbildung aufgrund eines Mangels an Zwischenmolekülen unterbrochen, wodurch die Zellproliferation unterbrochen wird. Trotz seiner Verwendung als Monotherapie oder in Kombination mit einer Chemotherapie wurden nur wenige oder gar keine unerwünschten Wirkungen gemeldet [9].
Aufgrund dieser Aktivitäten haben wir den immunogenen Zelltod als möglichen Wirkmechanismus untersucht, da immer mehr Studien zeigen, dass zelluläre und mitochondriale gefährdungsassoziierte molekulare Muster (DAMPs) aktiv freigesetzt werden können, wenn sie externen Reizen ausgesetzt sind [10]. Die Freisetzung von Alarminen (Hsp70, HSP90, Calreticulin, HMGB1, ATP, DNA und RNA) und Tumor-Neoantigenen induzieren eine tumorspezifische Immunantwort, die lebende Krebszellen und restliches Tumorgewebe eliminiert und so ein Wiederauftreten des Krebses verhindert [11].
Das Hauptaugenmerk dieser Studie lag auf der Verwendung von Silber und DCA als Wirkstoffe mit Doppelfunktion, die die DNA-Integrität und die Mitochondrienaktivität beeinflussen, um die Antitumorreaktion bei der Melanombehandlung zu erhöhen. Darüber hinaus könnte diese Studie als Ausgangspunkt für die nächste Stufe der Entwicklung von Dichloracetat-beladenen Silbernanopartikeln für eine gezielte pharmakologische Formulierung dienen.
Materialien und Methoden
Reagenzien
Penicillin-Streptomycin-Lösung, Ficoll-Hypaque-Lösung, Trypsin-EDTA-Lösung, RPMI-1640-Medium, Dulbecco’s Modified Eagle’s Medium (DMEM/F-12) und 1%ige antibiotisch-antimykotische Lösung wurden von Life Technologies GIBCO, Grand Island, NY, USA, bezogen. Fötales Rinderserum (FBS) wurde von Sigma-Aldrich (St. Louis, MO) bezogen.
Zellkultur
Die murine MelanomzelllinieB16F10wurde von der American Type Culture Collection (ATCC, Manassas, VA, USA) erworben. Die Zellen wurden in Dulbecco’s Modified Eagle’s Medium, ergänzt mit 10 % fötalem Rinderserum (FBS) und 1 % Penicillin-Streptomycin-Lösung, bei 37 °C und 5 %CO2-Atmosphäre gezüchtet und gehalten.
Zellvitalität
ellen(5 ×103 Zellen/Vertiefung) wurden auf 96 Flachboden-Well-Platten plattiert und 24 Stunden lang bei 37 °C und 5 %CO2-Atmosphäre bebrütet. Nach der Inkubation wurde das Kulturmedium entfernt und Ag (0,8mM bis 6:5 × 10-5mM) oder DCA (75mM/ml bis 750mM/ml) in demselben Medium verdünnt zugegeben. Die Platten wurden dann 4 Stunden lang bei 37°C und 5%CO2-Atmosphäre bebrütet. Danach wurde der Überstand entfernt, und die Zellen wurden zweimal mit DMEM/F-12-Medium gewaschen. Die Lebensfähigkeit der Zellen wurde mit der Resazurin (Alamar Blue)-Methode bestimmt, und die Zytotoxizität wurde als Konzentration der 50%igen Zellwachstumshemmung (LD50) angegeben. Die Ergebnisse wurden als Mittelwert ± Standardabweichung (SD) von drei unabhängigen Experimenten angegeben. Der LD50-Wert jeder Behandlung wurde für weitere Experimente verwendet.
Bestimmung des Zelltods
Für die Bestimmung des Zelltods folgten wir der von Rodríguez-Salazar et al.[12] beschriebenen Methodik. Kurz gesagt: B16F10-Zellen (1 ×105) wurden in 12-Well-Platten ausgesät und über Nacht bei 5 %CO2 und 37 °C kultiviert. Die Zellen wurden 5 Stunden lang mit AgC (LD50) oder DCA (LD50) oder einer Kombination aus AgC (LD25) + DCA (LD25) behandelt. Nach der Behandlung wurden die Zellen gesammelt, mit phosphatgepufferter Kochsalzlösung (PBS) gewaschen und in 100μl1× Bindungspuffer (0,1 M Hepes pH 7,4, 1,4 M NaCl und 25 mM CaCl2; Sigma-Aldrich; Merck KGaA, Darmstadt, Deutschland) mit APC-konjugiertem Annexin V (5μl/Probe) und Propidiumiodid (1μl/Probe) resuspendiert, bei 4 °C inkubiert und 15 Minuten lang im Dunkeln gehalten. Die durchflusszytometrische Analyse wurde mit einem Accuri C6 Zytometer durchgeführt; für die Datenanalyse wurde die BD Accuri C6 Software Version 1.0.264.21 verwendet (beide BD Biosciences, San Jose, CA, USA).
Tiere
Weibliche C57BL/6-Mäuse im Alter von 6 und 10 Wochen mit einem Körpergewicht von etwa 23 (±2) g wurden von den Harlan Laboratories (Mexiko-Stadt, Mexiko) erworben. Die Mäuse wurden bei 25-29°C und einem 12-Stunden-Licht- und 12-Stunden-Dunkel-Zyklus gehalten. Futter und Wasser wurden ad libitum zur Verfügung gestellt. Das Versuchsprotokoll wurde von der Ethikkommission für Tierversuche der Fakultät für Biowissenschaften der Autonomen Universität von Nuevo Leon (San Nicolas de los Garza, Mexiko) genehmigt.
Tumorimplantation und Behandlung
Die Tumoren wurden subkutan durch Injektion von 1 x106 B16F10-Zellen in 200μlphosphatgepufferte Kochsalzlösung (PBS) induziert. Sieben Tage nach der Transplantation von B16F10-Zellen zeigte sich eine deutliche Tumormasse, und die Mäuse wurden nach dem Zufallsprinzip in vier Gruppen aufgeteilt (fünf Mäuse pro Gruppe). Die Kontrollgruppe erhielt nur Kochsalzlösung. Die DCA-Gruppe erhielt 50mg/kg DCA, während die Ag-Gruppe 28mg/kg Ag erhielt. Kochsalzlösung, Ag und DCA wurden 21 Tage lang täglich über den Peritumorweg verabreicht. Die Ag + DCA-Gruppe schließlich erhielt jeden zweiten Tag abwechselnd die gleiche Dosis Ag und DCA über die Peritumorroute. Tumorlänge und -breite wurden wöchentlich gemessen, und das Tumorvolumen wurde anhand der folgenden Gleichung bestimmt: L x W2, wobei L die längste Seite und W die kürzeste Seite ist. Die Tiere wurden am Endpunkt der Studie (21 Tage) eingeschläfert, und die Tumore wurden für weitere Experimente entnommen.
ELISA für die aktive NF-κB p65 Untereinheit
Um die Aktivierung der NF-κB p65 Untereinheit zu messen, wurden Kernextrakte aus 3 x106 Tumorzellen mit einem Kernextrakt-Kit gemäß dem Protokoll des Herstellers hergestellt. Die Konzentrationen von p65 im Zellkern wurden mit einem empfindlichen ELISA-Assay (TRANS-AM, Active Motif, Rixensart, Belgien) bestimmt.
TNF-α- und NO-Produktion
Die Tumoren wurden mit RPMI mazeriert, der Überstand wurde gesammelt, mit BSA auf eine Proteinkonzentration eingestellt und zur Auswertung bei -20°C gelagert. TNF-α wurde im Tumorüberstand mittels Enzymimmunoassay (TNF alpha Mouse ELISA Kit; Invitrogen; Thermo Fisher Scientific; Wien, Österreich) gemessen. Alle Testverfahren wurden nach dem Protokoll des Herstellers durchgeführt.
Zur Messung des NO-Gehalts in den Gewebehomogenaten des Tumors wurde ein Nitrat/Nitrit-Assay-Kit nach dem vom Hersteller festgelegten Protokoll verwendet (Nitrat/Nitrit-Kolorimetrie-Assay-Kit; Cayman Chemical, USA).
Immunzytochemie zur Bestimmung von HMGB1, HSP70 und HSP90
Die Zellen (100 x103 Zellen/Vertiefung) wurden 24 Stunden lang bei 37 °C und 5 %CO2 auf Glasdeckgläsern ausgesät. Danach wurden die Zellen mit Ag LD50 (2,8 x 10-5 mM), DCA LD50 (195 mM) oder Ag + DCA LD50 (2,8 x 10-5 mM bzw. 135 mM) bei 37 °C und 5 %CO2 für 4 Stunden behandelt. Anschließend wurden die Zellen mit Methanol fixiert, 20 Minuten lang mit normalem Pferdeserum (2,5 %) (Vector Laboratories, ABC Kit) blockiert und 4 Stunden lang mit monoklonalen Maus-Antikörpern von Santa Cruz (Santa Cruz, CA, USA) gegen HMGB1 (sc-56698), HSP70 (sc-24) oder HSP90 (sc-7947) inkubiert, die alle in einer Verdünnung von 1 :1000 Verdünnung. Anschließend wurden die Zellen 1 Stunde lang mit HRP-biotinyliertem Anti-Maus/Kaninchen-IgG (Vector Laboratories, ABC Kit) und 30 Minuten lang mit Avidin-DH-Lösung (Vector Laboratories, ABC Kit) inkubiert; anschließend wurde DAB (3,3-Diaminobenzidin) zugegeben. Das DAB-Chromogen erzeugt in Gegenwart von Peroxidase (HRP) eine braune Reaktion. Die Objektträger wurden mit Mayerschem Hämatoxylin gegengefärbt, in einem Alkohol-Xylol-Gradienten dehydriert und mit Entellan® (Kunstharz) auf Glasobjektträger aufgezogen. Unbehandelte B16F10-Zellen wurden als HMGB1-, HSP70- und HSP90-Basalexpressionskontrolle verwendet. Die HMGB1-, HSP70- und HSP90-Expression (DAB-Färbeintensität) wurde mit der Software Fiji (ImageJ) Version 2.0 wie von Patera (2019) beschrieben durchgeführt. Die Daten werden als optische DAB-Dichte (=log (maximale Intensität/mittlere Intensität)) von fünf Schnitten pro Objektträger dargestellt. Es wurden drei unabhängige Experimente durchgeführt.
Durchflusszytometrie zur Calreticulin-Bestimmung
Zellen (50 x103 Zellen/Vertiefung) wurden bei 37 °C und 5 %CO2 auf 24-Well-Platten mit ultraniedrigem Bindungsgrad ausgesät. Danach wurden die Zellen mit Ag LD50 (2,8 x 10-5 mM), DCA LD50 (195 mM) oder Ag + DCA LD50 (2,4 x 10-5 mM bzw. 135 mM) bei 37°C und 5%CO2 für 4 Stunden behandelt. Anschließend wurden die Zellen wiedergewonnen und mit einem polyklonalen Calreticulin-Antikörper, der mit Phycoerythrin konjugiert war, eine Stunde lang bei 37 °C und 5 %CO2 gefärbt. Die Zellen wurden mit PBS+Rinderserumalbumin (BSA) (1 %) gewaschen und in 200 µl PBS resuspendiert. Die Daten wurden mit dem Accouri C6 Durchflusszytometer (BD Biosciences, San Jose, CA, USA) erfasst.
In-vivo-Experimentezur Antitumor-Impfung
Für die Herstellung der Zelllysate folgten wir dem von Rodríguez-Salazar et al. beschriebenen Protokoll. [12] mit geringfügigen Änderungen. Kurz gesagt wurden B16F10-Zellen (5 x106) 5 Stunden lang in vitro mit Ag (LD50) oder DCA (LD50) oder der Kombination Ag (LD25) + DCA (LD25) behandelt. Anschließend wurden die Zellen 10 Minuten lang bei 260 × g zentrifugiert und zweimal mit PBS gewaschen. Schließlich wurden die Zellen in 200μl PBS resuspendiert und subkutan in die linke Flanke der Maus beimpft. Nach 7 Tagen wurden die Mäuse mit 5 x105 lebenden B16F10-Zellen, die in 200μlPBS resuspendiert waren, durch subkutane Injektion in die rechte Flanke herausgefordert. Die Tumorinzidenz und das Tumorwachstum wurden 30 Tage lang täglich an den beiden Injektionsstellen mit einer digitalen Schieblehre gemessen. Das Tumorvolumen wurde nach der folgenden Formel berechnet: V = (L x W2)/2, wobei V das Tumorvolumen, L die Tumorlänge und W die Tumorbreite ist, dieselbe Formel, die zuvor von Rodríguez-Salazar et al. [12].
Statistische Analyse
Die statistische Analyse wurde mit einer Einweg-Varianzanalyse (ANOVA), gefolgt von einem Dunnett-Test, durchgeführt, sofern nicht anders angegeben. Als statistisch signifikanter Unterschied wurde ein Wert von . Alle Experimente wurden in dreifacher Ausführung durchgeführt.
Ergebnisse
DCA-Ag verringerte die zelluläre Lebensfähigkeit von B16F10-Melanomzellen
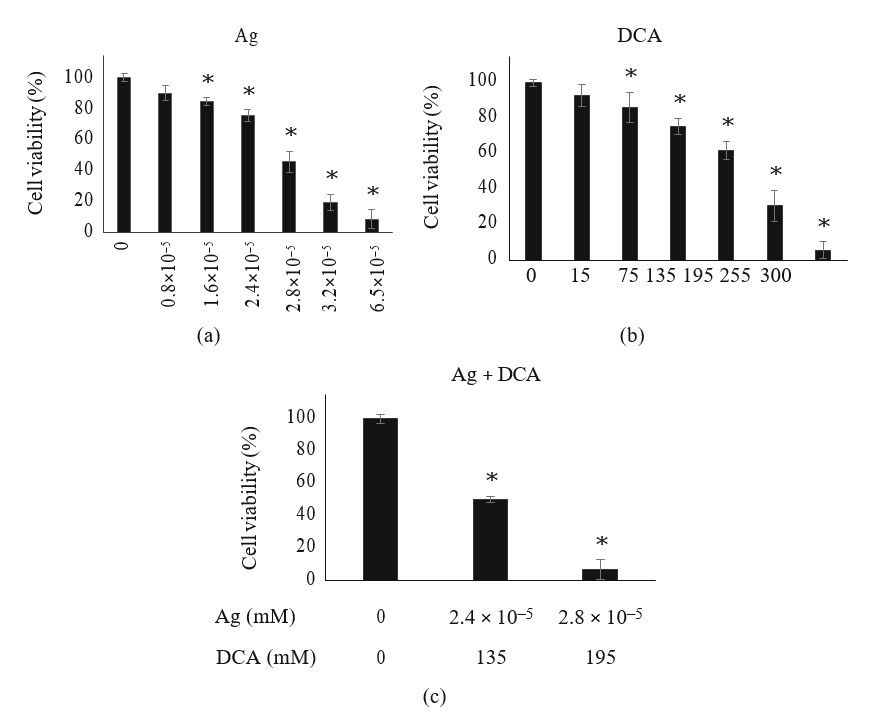
Die Behandlung mit Ag oder DCA bewirkte eine dosisabhängige Verringerung der Zelllebensfähigkeit von B16F10-Zellen im Vergleich zur Kontrolle (p < 0:01) (Abbildungen 1(a) und 1(b)). DL25 (2,4 ×105mM) und DL50 (2,8 ×105) wurden für Ag bestimmt (Abbildung 1(a)); DL25 (135 mM) und DL50 (195 mM) wurden auch für DCA bestimmt (Abbildung 1(b)). In der kombinatorischen Einstellung waren niedrigere Dosen von Ag und DCA erforderlich, um DL25 und DL50 zu erreichen (Abbildung 1(c)).
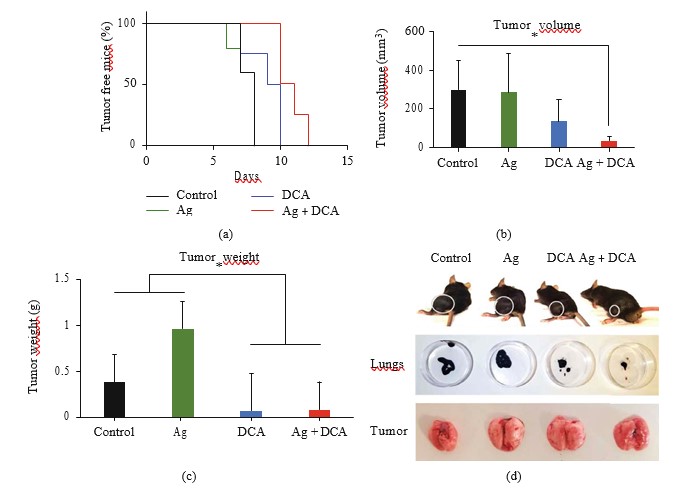
Ag-DCA induzierte Tumorregression
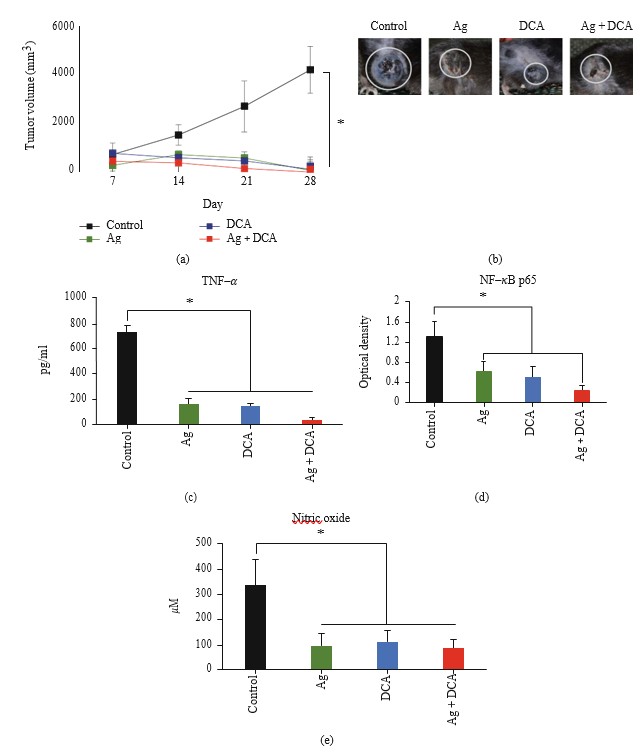
Die Verabreichung von Ag, DCA und Ag + DCA induzierte eine zeitabhängige Rückbildung des Tumorvolumens (p < 0,05), wobei eine bessere Wirkung bei Mäusen beobachtet wurde, die mit Ag + DCA behandelt wurden (Abbildung 2(a)).
Ag-, DCA- und Ag + DCA-Behandlungen verringerten die TNF-α-, NF-κB- und Stickoxidproduktion
Alle Behandlungen verringerten signifikant (p < 0,05) die TNF-α-Produktion (Abbildung 2(c)), die NF-κB-Aktivität (Abbildung 2(d)) und die Stickoxid (NO)-Produktion im Vergleich zur Kontrollgruppe; zwischen den behandelten Gruppen wurde kein signifikanter Unterschied festgestellt (Abbildungen 2(c)-2(e)).
Expression und Lokalisierung von HMGB1, HSP70 und HSP90 in B16F10-Zellen, die mit Ag, DCA oder Ag + DCA behandelt wurden
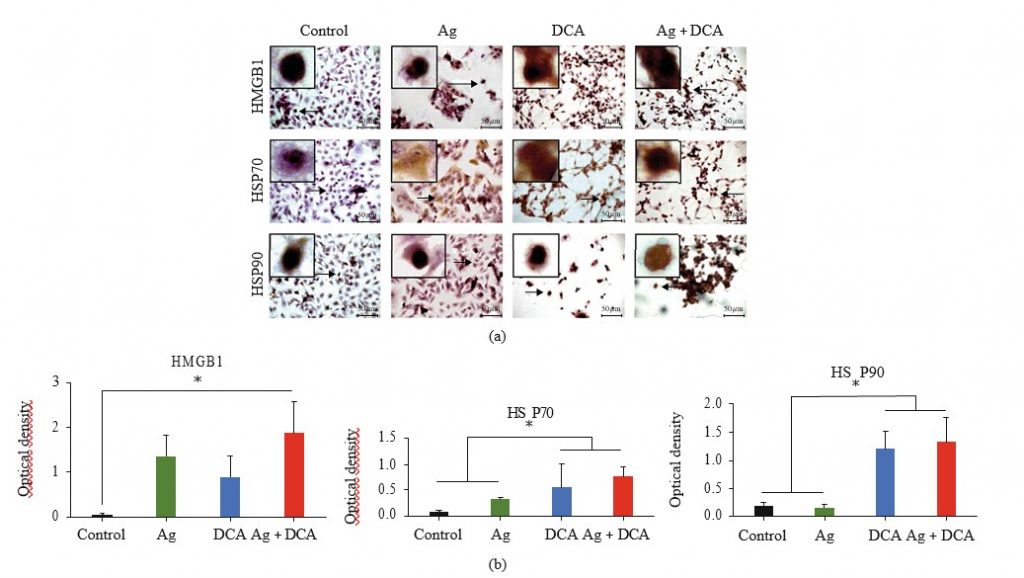
Die Lokalisierung von HMGB1, HSP70 und HSP90 wurde mikroskopisch bestimmt (Abbildung 3(a)). Unter Kontrollbedingungen waren HMGB1, HSP70 und HSP90 nicht nachweisbar oder im Zellkern lokalisiert (Abbildung 3(a)). Die Ag-Behandlung mobilisierte HSP70 in das Zytoplasma und die Zellmembran, die DCA-Behandlung mobilisierte HMGB1 und HSP70 in das Zytoplasma und die Zellmembran, und die kombinierte AgDCA-Behandlung mobilisierte HMGB1, HSP70 und HSP90 in das Zytoplasma und die Zellmembran (Abbildung 3(a)). Alle Behandlungen erhöhten signifikant (p < 0:05) die HMGB1- und HSP70-Expression; jedoch nur DCA und Ag + DCA erhöhten signifikant (p < 0:05) HSP90 im Vergleich zur Kontrolle (unbehandelte B16F10-Zellen) (Abbildung 3(b)).
Calreticulin-Exposition in Ag-, DCA- oder Ag + DCA-behandelten Zellen
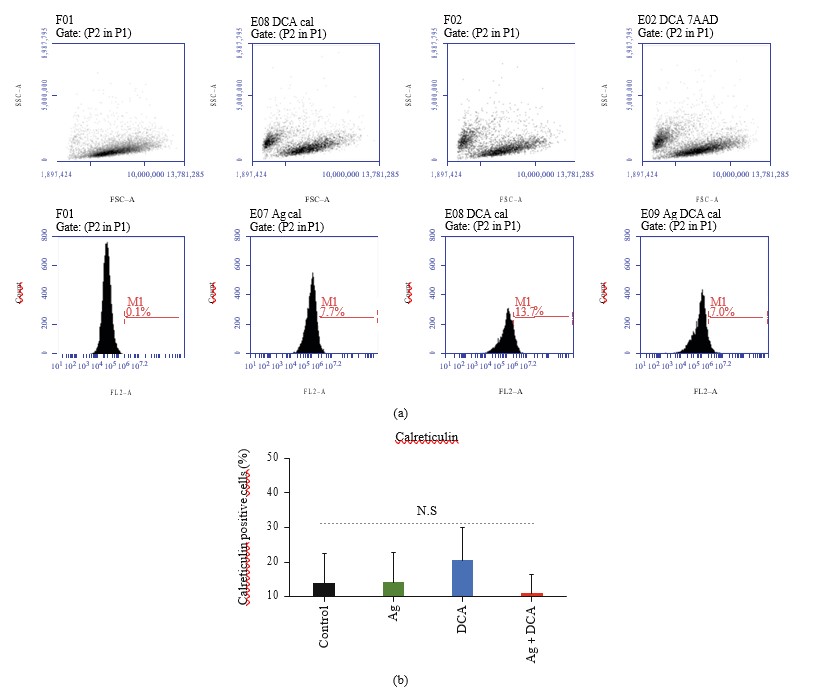
Ag-, DCA- und Ag + DCA-Behandlungen induzieren keine Calreticulin-Oberflächenexposition in B16F10-Zellen im Vergleich zur Kontrolle (unbehandelte B16F10-Zellen) (Abbildungen 4(a) und 4(b)).
Ag, DCA oder Ag + DCA induzieren keinen immunogenen Zelltod
B16F10-Zellen, die mit Ag, DCA und AgDCA lysiert wurden, verhindern die Tumorimplantation in C57BL/6-Mäusen nicht (Abbildungen 5(a)- 5(d)).
Diskussion
Die zytotoxische Wirkung von kolloidalem Silber (Ag), Natriumdichloracetat (DCA) und deren Kombination wurde gegen B16F10-Mausmelanomzellen untersucht. Unsere Ergebnisse zeigen, dass Ag eine antiproliferative Wirkung gegen B16F10-Zellen hat, wie zuvor von unserer Forschungsgruppe berichtet [13]. Weitere Berichte über die zytotoxische Wirkung von Silber gegen Melanomzellen beziehen sich auf Silbernanopartikel, obwohl der vorgeschlagene Toxizitätsmechanismus derselbe bleibt [14]. DCA zeigte ebenfalls eine antiproliferative Wirkung auf Melanomzellen. In ähnlicher Weise berichteten Rivera-Lazarín et al. über eine dosisabhängige Abnahme der Lebensfähigkeit von B16F10-Zellen, die mit DCA [15].
Die zytotoxische Aktivität von Ag und DCA nahm zu, wenn es als kombinierte Behandlung eingesetzt wurde. Dies war zu erwarten, da die Kombination von zwei oder mehr Wirkstoffen ein Eckpfeiler der Krebsbehandlung ist; sie ermöglicht es, gleichzeitig auf wichtige Signalwege einzuwirken und so die Wirksamkeit zu erhöhen [16].
Nachdem wir die erhöhte zytotoxische Wirkung beobachtet hatten, untersuchten wir, ob unsere Ergebnisse mit der Antitumoraktivität in vivo korrelierten. Auf der Tumorebene wurde eine Nekrose festgestellt; erwähnenswert ist, dass die Läsionen in allen Fällen der Tumoreliminierung vollständig abheilten. Hautläsionen können durch die Überexpression von Tumor-Nekrose-Faktor alpha entstehen [17]. Unsere Ergebnisse zeigten höhere TNF-α-Konzentrationen in unbehandelten Melanomen und einen deutlichen Rückgang dieses Faktors als Reaktion auf alle unsere Behandlungen. TNF-α korreliert mit der Aggressivität und dem Metastasierungspotenzial von Melanomen in vivo [18]und seine Überexpression wurde von Rossi et al. bei fortgeschrittenen primären Melanomen festgestellt. [19].
Es ist wichtig zu erwähnen, dass es sich bei TNF-α um ein pleiotropes Zytokin handelt, dessen proapoptotische Wirkung auf Krebszellen vielfach beschrieben worden ist [20]melanomzellen widerstehen jedoch der TNF-α-induzierten Apoptose durch NF-κB und Stickstoffmonoxid [21].
In dieser Studie zeigten unsere Ergebnisse, dass NF-κB und Stickoxid bei Mäusen, die mit Ag, DCA oder einer Kombination aus beidem behandelt wurden, abnahmen, was mit der Rückbildung des Tumors korrelierte. Wang et al. berichteten, dass NF-κB die TNF-α-vermittelte Apoptose durch die Aktivierung der antiapoptotischen Proteine TRAF1, TRAF2, c-IAP1 und c-IAP2 unterdrückt [22]. Andererseits berichteten Salvucci et al. über die Produktion von Stickstoffmonoxid in menschlichen Melanomzellen, und die Blockierung dieser Produktion führt zum Zelltod in menschlichen Melanomen [23]. Insbesondere hemmt Stickstoffmonoxid mindestens sieben Caspasen durch s-Nitrosylierung [24]
.
Trotz unserer Beobachtungen ist es wichtig zu erwähnen, dass TNF-α, NF-κB und NO pleiotrope Wirkungen haben und ihre Rolle beim Melanom nicht gut verstanden ist. Wir betonen jedoch, dass unsere Ergebnisse darauf hindeuten, dass diese Moleküle in Korrelation mit der Rückbildung des Tumors und der Wundheilung abnehmen.
Viele Krebstherapien haben das Potenzial, den Tod von Krebszellen herbeizuführen, wodurch der Tumor beseitigt wird und der Patient frei von Malignität ist. Allerdings können nur immunogene Zelltodinduktoren ein Wiederauftreten von Krebs verhindern. Daher stellen Medikamente, die den immunogenen Zelltod auslösen, eine neue Innovation auf dem Gebiet der Onko-Immuntherapie [25]dies ist der Fall bei der Verwendung des Immunmodulators IMMUNEPOTENT CRP, der diese Fähigkeit kürzlich nachgewiesen hat [12]. Wir wollten herausfinden, ob unsere Behandlungen in der Lage sind, einen immunogenen Zelltod herbeizuführen.
Das Vorhandensein von Alarminen in vitro weist auf das Potenzial hin, einen immunogenen Zelltod auszulösen [26]. Trotz des behandlungsabhängigen Anstiegs von HMGB1, HSP70 und HSP90 (aber nicht von Calreticulin) führte die Impfung von Mäusen mit B16F10-Zellen, die mit Ag, DCA oder der Kombination Ag + DCA lysiert wurden, nicht zu einem immunogenen Zelltod, wie das Auftreten von Tumoren bei allen Mäusen (geimpften und ungeimpften) nach der Infektion mit lebensfähigen B16F10-Zellen zeigt. Das Tumorwachstum deutet darauf hin, dass die Impfstoffe keine spezifische Immunreaktion auslösten. Ein Grund dafür könnte sein, dass DCA, Ag und DCA + Ag die Freisetzung von DAMPs nicht in einem koordinierten räumlich-zeitlichen Muster induzieren; daher fehlt ihnen die Fähigkeit, Zytokine und eine effiziente Antigenpräsentation zu induzieren [27].
Zusammenfassend lässt sich sagen, dass die Kombination von Ag und DCA potenzielle Antitumoreigenschaften gegen Melanomzellen aufweist; der In-vivo-Antitumormechanismus ist jedoch kein immunogener Zelltod. Weitere Studien zur Aufklärung des Zelltodmechanismus sind wichtig, um Strategien und Kombinationen mit klinischer Wirksamkeit gegen Melanome zu entwickeln.
Verfügbare Daten
Die mit dem Manuskript verbundenen Daten sind auf Anfrage erhältlich.
Interessenkonflikte
Die Autoren erklären, dass es keinen Interessenkonflikt gibt.
Danksagung
Diese Studie wurde vom „Fondo Sectorial de Investigación para la Educación“, Zuschuss A1-S-35951, CONACYT, Mexiko, unterstützt. Wir danken MsC. Alejandra Arreola Triana für die Überarbeitung des Manuskripts.
REFERENZEN
1 D. B. Johnson und J. A. Sosman, „Update on the targeted therapy of melanoma“, Current Treatment Options in Oncology, Bd. 14, Nr. 2, S. 280-292, 2013.
2 E. A. Zaal und C. R. Berkers, „The influence of metabolism on drug response in cancer“, Frontiers in Oncology, Bd. 8, S. 500, 2018.
3 Z.-F. Lim und P. C. Ma, „Emerging insights of tumor heterogeneity and drug resistance mechanisms in lung cancer targeted therapy,“ Journal of Hematology & Oncology, vol. 12, no. 1, p. 134, 2019.
4 V. De Matteis, M. Cascione, C. Toma, and S. Leporatti, „Silver nanoparticles: synthetic routes, in vitro toxicity and theranostic applications for cancer disease,“ Nanomaterials, vol. 8, no. 5, p. 319, 2018.
5 N. Durán, W. J. Fávaro, und A. B. Seabra, „What do we really know about nanotoxicology of silver nanoparticles in vivo? Neue Aspekte, mögliche Mechanismen und Perspektiven“, Current Nanoscience, vol. 16, no. 3, pp. 292-320, 2020.
6 M. Ahamed, M. S. AlSalhi, und M. K. J. Siddiqui, „Silver nanoparticle applications and human health,“ Clinica Chimica Acta, vol. 411, no. 23-24, pp. 1841-1848, 2010.
7 K. Habiba, K. Aziz, K. Sanders et al., „Enhancing colorectal cancer radiation therapy efficacy using silver nanoprisms decorated with graphene as radiosensitizers,“ Scientific Reports, vol. 9, no. 1, p. 17120, 2019.
8 T. Tataranni und C. Piccoli, „Dichloroacetate (DCA) and cancer: an overview towards clinical applications,“ Oxidative Medicine and Cellular Longevity, vol. 2019, 14 pages, 2019.
9 S. Pustylnikov, F. Costabile, S. Beghi, and A. Facciabene, „Targeting mitochondria in cancer: current concepts and immunotherapy approaches,“ Translational Research, vol. 202, pp. 35-51, 2018.
10 S. Grazioli und J. Pugin, „Mitochondrial damage-associated molecular patterns: from inflammatory signaling to human diseases,“ Frontiers in Immunology, vol. 9, p. 832, 2018.
11 Y. Nie, D. Yang, and J. J. Oppenheim, „Alarmins and antitumor immunity,“ Clinical Therapeutics, vol. 38, no. 5, pp. 1042-1053, 2016.
12 M. Rodríguez-Salazar, M. A. Franco-Molina, E. Mendoza-Gamboa et al., „The novel immunomodulator IMMUNEPOTENT CRP combined with chemotherapy agent increased the rate of immunogenic cell death and prevented melanoma growth“, Oncology Letters, vol. 14, no. 1, pp. 844-852, 2017.
13 C. A. Sierra Rivera, M. A. Franco Molina, E. Mendoza Gamboa, P. Zapata Benavides, R. S. Tamez Guerra, and C. Rodriacute guez Padilla, „Potential of colloidal or silver nanoparticles to reduce the growth of B16F10 melanoma tumors,“ African Journal of Microbiology Research, vol. 7, no. 22, pp. 2745-2750, 2013.
14 L. M. Valenzuela-Salas, N. G. Girón-Vázquez, J. C. García-Ramos et al., „Antiproliferative and antitumour effect of nongenotoxic silver nanoparticles on melanoma models,“ Oxidative Medicine and Cellular Longevity, vol. 2019, 12 pages, 2019.
15 A. L. R. LazarAAn, A. Zugasti Cruz, G A A.¡n. A. de la PeAAa, S. Y. S. Belmares, and C. A. Sierra Rivera, „Synergistic cytotoxic effect of sodium dichloroacetate combined with chemotherapeutic drugs on B16F10 murine melanoma cell line,“ Biomedical Research, vol. 30, no. 1, 2019.
16 R. B. Mokhtari, T. S. Homayouni, N. Baluch et al., „Combination therapy in combating cancer,“ Oncotarget, vol. 8, no. 23, pp. 38022-38043, 2017.
17 A. M. Brotas, J. M. T. Cunha, E. H. J. Lago, C. C. N. Machado, and S. C. S. Carneiro, „Tumor necrosis factor-alpha and the cytokine network in psoriasis,“ Anais Brasileiros de Dermatologia, vol. 87, no. 5, pp. 673-683, 2012.
18 S. Moretti, C. Pinzi, A. Spallanzani et al., „Immunohistochemical evidence of cytokine networks during progression of human melanocytic lesions,“ International Journal of Cancer, vol. 84, no. 2, pp. 160-168, 1999.
19 S. Rossi, M. Cordella, C. Tabolacci et al., „TNF-alpha and metalloproteases as key players in melanoma cells aggressiveness,“ Journal of Experimental & Clinical Cancer Research, vol. 37, no. 1, p. 326, 2018.
20 A. Montfort, C. Colacios, T. Levade, N. Andrieu-Abadie, N. Meyer, und B. Ségui, „The TNF paradox in cancer progression and immunotherapy,“ Frontiers in Immunology, vol. 10, p. 1818, 2019.
21 V. A. Soldatenkov, A. Dritschilo, Z. Ronai, and S. Y. Fuchs, „Inhibition of homologue of Slimb (HOS) function sensitizes human melanoma cells for apoptosis,“ Cancer Research, vol. 59, no. 20, pp. 5085-5088, 1999.
22 C. Wang, M. W. Mayo, R. G. Korneluk, D. V. Goeddel, and Baldwin AS Jr, „NF-B antiapoptosis: induction of TRAF1 and TRAF2 and c-IAP1 and c-IAP2 to suppress caspase-8 activation,“ Science, vol. 281, no. 5383, pp. 1680-1683, 1998.
23 O. Salvucci, M. Carsana, I. Bersani, G. Tragni, und A. Anichini, „Antiapoptotic role of endogenous nitric oxide in human melanoma cells,“ Cancer Research, vol. 61, no. 1, pp. 318-326, 2001.
24 L. Rössig, B. Fichtlscherer, K. Breitschopf et al., „Nitric oxide inhibits caspase-3 by S -nitrosation in vivo,“ The Journal of Biological Chemistry, vol. 274, no. 11, pp. 6823-6826, 1999.
25 B. Rapoport und R. Anderson, „Realizing the clinical potential of immunogenic cell death in cancer chemotherapy and radiotherapy“ (Das klinische Potenzial des immunogenen Zelltods in der Krebs-Chemo- und Strahlentherapie ausschöpfen), International Journal of Molecular Sciences, vol. 20, no. 4, p. 959, 2019.
26 A. Terenzi, C. Pirker, B. K. Keppler, and W. Berger, „Anticancer metal drugs and immunogenic cell death,“ Journal of Inorganic Biochemistry, vol. 165, pp. 71-79, 2016.
27 O. Kepp, L. Menger, E. Vacchelli et al., „Crosstalk between ER stress and immunogenic cell death,“ Cytokine & Growth Factor Reviews, vol. 24, no. 4, pp. 311-318, 2013.