Zaida Torres-Cavazos1, Moisés Armides Franco-Molina2, Silvia Elena Santana-Krímskaya2, Cristina Rodríguez-Padilla2, Jorge Ramsy Kawas-Garza1, Gustavo Hernández-Vidal1, Gustavo Moreno-Degollado1, en Diana Elisa Zamora-Ávila1
1 Posgrado Conjunto de las Facultades de Agronomía y Medicina Veterinaria y Zootecnia, Universidad Autónoma de Nuevo León,
Ave. Universidad S/N, Cd. Universitaria, San Nicolás de los Garza, N. L., CP 66455, Mexico
2 Laboratorio de Inmunología y Virología, Unidad C, Facultad de Ciencias Biológicas, Universidad Autónoma de Nuevo León,
Ave. Universidad S/N, Cd. Universitaria, San Nicolás de los Garza, N. L., CP 66455, Mexico
Correspondentie: Moisés Armides Franco-Molina; [email protected]
Ontvangen: 13 juli 2020
Herzien: 28 september 2020
Aanvaard: 14 oktober 2020
Gepubliceerd: 7 november 2020
Abstract
Onze belangrijkste focus was het evalueren van de werkzaamheid van zilver en natriumdichlooracetaat als middelen met dubbele functie voor gebruik bij de behandeling van melanoom. Deze strategie is ontworpen om de activiteit van deze twee verbindingen, die de integriteit van het DNA en de mitochondriën op verschillende niveaus beïnvloeden, te verhogen. Bovendien evalueerden wij of het door onze behandelingen geïnduceerde celdoodmechanisme immunogene celdood was. Om de antitumorwerking te evalueren, beoordeelden wij het tumorvolume en de productie van tumornecrosefactor-α, kernfactor κ B (beide met ELISA), en de stikstofoxideniveaus (Nitraat/Nitriet colorimetrische testkit); voor de immunogene celdood evalueerden wij het vrijkomen van gevaar-geassocieerde moleculaire patronen met behulp van immunohistochemie en flowcytometrie, alsmede een in vivo uitdaging. Uit onze resultaten bleek dat de combinatie van colloïdaal zilver en natriumdichlooracetaat effectiever is dan elke behandeling afzonderlijk en dat het antitumormechanisme niet via immunogene celdood verloopt. Voorts kan deze studie een brede bijdrage leveren aan de ontwikkeling van dichlooracetaat-geladen zilveren nanodeeltjes en aan het ontwerp van gerichte farmacologische formuleringen ter bestrijding van melanoom en andere soorten kanker.
Academisch redacteur: Yanis Toledaño Magaña
Copyright © 2020 Zaida Torres-Cavazos et al. Dit is een open access artikel verspreid onder de Creative Commons Naamsvermelding Licentie, die onbeperkt gebruik, distributie en reproductie toestaat in elk medium, mits het originele werk correct wordt geciteerd.
INLEIDING
Gerichte therapieën hebben de overlevingskansen van mensen met melanoom vergroot [1]; kankercellen in de tumor hebben echter een voorkeur voor verschillende metabolische routes [2]; als gevolg daarvan wordt de tumor uiteindelijk resistent tegen gerichte therapieën, vooral die tegen één enkel doelwit [3].
De ontwikkeling van op zilver gebaseerde therapieën is een veelbelovend hulpmiddel bij de behandeling van kanker. Zilverionen en zilveren nanodeeltjes induceren oxidatieve stress, disfunctie van de mitochondriale membraan, DNA-schade en upregulatie van cytokinen [4]. Het exacte werkingsmechanisme varieert afhankelijk van de fysische en chemische eigenschappen van het nanodeeltje en het type kanker [5]. Bovendien bewijst het klinisch gebruik van colloïdaal zilver voor bacteriedodende en antivirale doeleinden dat deze behandeling veilig is [6],
7].
Natriumdichlooracetaat (DCA) is een pyruvaatanaloog die de tumorgeassocieerde glycolyse verstoort (Warburg-effect), de maligniteit van kanker vermindert en de productie van lactaat vermindert door de metabolische routes van kankercellen te veranderen [8]. Een afname van lactaat gaat de zure toestand van het tumormilieu tegen, waardoor tumorgroei en metastase afnemen [8 ]. WZB117, een bis-hydroxybenzoaat, 2-deoxy-d-glucose, metformine en DCA verminderen de glycolyse en blokkeren de glucose-opname in kankercellen. Bij lage intracellulaire glucoseniveaus worden biosynthesewegen, zoals de aanmaak van nucleotiden en aminozuren, onderbroken door een tekort aan intermediaire moleculen, waardoor de celproliferatie wordt onderbroken. Ondanks het gebruik als monotherapie of in combinatie met chemotherapie zijn er weinig of geen bijwerkingen gemeld [9].
Vanwege deze activiteiten evalueerden wij immunogene celdood als mogelijk werkingsmechanisme, vanwege het toenemende aantal studies dat aantoont dat cellulaire en mitochondriale danger-associated molecular patterns (DAMPs) actief kunnen vrijkomen bij blootstelling aan externe prikkels [10]. Het vrijkomen van alarmines (Hsp70, HSP90, calreticuline, HMGB1, ATP, DNA en RNA) en tumorneoantigenen induceren een tumorspecifieke immuunrespons die levende kankercellen en resterend tumorweefsel elimineert, waardoor herhaling van de kanker wordt voorkomen [11].
Het hoofddoel van deze studie was het gebruik van zilver en DCA als middelen met twee functies die de integriteit van het DNA en de activiteit van de mitochondriën beïnvloeden, teneinde de antitumorrespons bij de behandeling van melanoom te verhogen. Voorts zou deze studie kunnen dienen als uitgangspunt voor de volgende ontwikkelingsfase van dichlooracetaat-geladen zilveren nanodeeltjes gerichte farmacologische formulering.
Materialen en methoden
Reagentia
Penicilline-streptomycine oplossing, Ficoll-Hypaque oplossing, trypsine-EDTA oplossing, RPMI-1640 medium, Dulbecco’s Modified Eagle’s Medium (DMEM/F-12), en 1% antibiotica-antimycotische oplossing werden verkregen van Life Technologies GIBCO, Grand Island, NY, USA. Foetaal runderserum (FBS) werd gekocht van Sigma-Aldrich (St. Louis, MO).
Celcultuur
De B16F10-muismelanoomcellijnwerd gekocht bij American Type Culture Collection (ATCC, Manassas, VA, VS). De cellen werden gekweekt en gehandhaafd in Dulbecco’s Modified Eagle’s Medium aangevuld met 10% foetaal runderserum (FBS) en 1% penicilline-streptomycine-oplossing bij 37°C en 5%CO2-atmosfeer.
Levensvatbaarheid van de cellen
cellen(5 ×103 cellen/well) werden uitgezet op 96 platen met platte bodem en gedurende 24 uur geïncubeerd bij 37°C in een atmosfeer van 5%CO2. Na incubatie werd het kweekmedium verwijderd en werd Ag (0,8mM tot 6:5 × 10-5mM) of DCA (75mM/ml tot 750mM/ml) verdund in hetzelfde medium toegevoegd. De platen werden vervolgens 4 uur geïncubeerd bij 37°C en 5%CO2 atmosfeer. Daarna werd het supernatant verwijderd en werden de cellen tweemaal gewassen met DMEM/F-12-medium. De levensvatbaarheid van de cellen werd bepaald met de resazurine-methode (Alamar Blue), en de cytotoxiciteit werd uitgedrukt als de concentratie van 50% celgroeiremming (LD50). De resultaten werden gegeven als het gemiddelde ± standaarddeviatie (SD) van drie onafhankelijke experimenten. De LD50 van elke behandeling werd gebruikt in verdere experimenten.
Bepaling van celdood
Voor de bepaling van celdood volgden wij de door Rodríguez-Salazar et al. beschreven methode [12]. Kort gezegd werden B16F10-cellen (1 ×105) uitgezaaid in platen met 12 putjes en ’s nachts gekweekt in 5%CO2 bij 37°C. Cellen werden behandeld met AgC (LD50) of DCA (LD50) of een combinatie van AgC (LD25) + DCA (LD25) gedurende 5 uur. Na behandeling werden de cellen verzameld en gewassen met fosfaatgebufferde zoutoplossing (PBS) en geresuspendeerd in 100μl 1× bindingsbuffer (0,1M Hepes pH 7,4, 1,4M NaCl, en 25 mM CaCl2; Sigma-Aldrich; Merck KGaA, Darmstadt, Duitsland) aangevuld met APC-geconjugeerd Annexine V (5μl/monster) en propidiumjodide (1μl/monster), geïncubeerd bij 4°C, en gedurende 15 min. in het donker bewaard. Flowcytometrie-analyse werd uitgevoerd met een Accuri C6 cytometer; de BD Accuri C6 Software versie 1.0.264.21 werd gebruikt voor gegevensanalyse (beide BD Biosciences, San Jose, CA, USA).
Dieren
Vrouwelijke C57BL/6 muizen van 6 en 10 weken oud met een lichaamsgewicht van ongeveer 23 (±2) g werden gekocht bij de Harlan Laboratories (Mexico City, Mexico). De muizen werden gehouden bij 25-29°C en een cyclus van 12 uur licht tot 12 uur donker. Voedsel en water werden ad libitum verstrekt. Het experimentele protocol werd goedgekeurd door de ethische toetsingscommissie voor dierproeven van de faculteit Biologische Wetenschappen van de Autonome Universiteit van Nuevo Leon (San Nicolas de los Garza, Mexico).
Tumorimplantatie en behandeling
Tumoren werden subcutaan geïnduceerd door injectie van 1 x106 B16F10-cellen in 200μlmet fosfaat gebufferde zoutoplossing (PBS). Zeven dagen na de B16F10-celtransplantatie verscheen een merkbare tumormassa en werden de muizen willekeurig verdeeld over vier groepen (vijf muizen per groep). De controlegroep kreeg alleen een zoutoplossing. De DCA-groep kreeg 50mg/kg DCA, terwijl de Ag-groep 28mg/kg Ag kreeg. Zoutoplossing, Ag en DCA werden toegediend via de peritumor route, dagelijks, gedurende 21 dagen. Tenslotte kreeg de Ag + DCA groep om de dag dezelfde doses Ag en DCA via de peritumor route, afwisselend tussen de behandelingen. Tumorlengte en -breedte werden wekelijks gemeten, en het tumorvolume werd bepaald met behulp van de vergelijking: L x W2, waarbij L de langste zijde en W de kortste zijde is. De dieren werden geëuthanaseerd op het eindpunt van de studie (21 dagen), en de tumoren werden uitgesneden voor verdere experimenten.
ELISA voor actieve NF-κBp65 subeenheid
Om de activering van de NF-κBp65 subeenheid te meten, werden nucleaire extracten bereid van 3 x106 tumorcellen, met een Nuclear Extract Kit volgens het protocol van de fabrikant. De nucleaire p65-concentraties werden bepaald met een gevoelige ELISA-test (TRANS-AM, Active Motif, Rixensart, België).
TNF-α en NO-productie
Tumoren werden gemacereerd met RPMI en het supernatant werd verzameld en aangepast aan een eiwitconcentratie door BSA en opgeslagen bij -20°C voor evaluatie. TNF-α werd gemeten in het tumorsupernatant met behulp van enzyme-linked immunosorbent assays (TNF alpha Mouse ELISA Kit; Invitrogen; Thermo Fisher Scientific; Viena, Oostenrijk). Alle testprocedures werden uitgevoerd volgens het protocol van de fabrikant.
Nitraat/Nitriet assay kit werd gebruikt om de niveaus van NO in de weefselhomogenaten van de tumor te meten volgens het protocol van de fabrikant (Nitraat/Nitriet colorimetrische assay kit; Cayman Chemical, USA).
Immunocytochemie voor HMGB1, HSP70 en HSP90 Bepaling
Cellen(100 x103 cellen/well) werden gedurende 24 uur op glazen dekglaasjes gezaaid bij 37°C en 5%CO2. Daarna werden de cellen behandeld met Ag LD50 (2,8 x 10-5 mM), DCA LD50 (195 mM), of Ag + DCA LD50 (2,8 x 10-5mM en 135 mM, respectievelijk) bij 37°C en 5%CO2 gedurende 4 uur. Vervolgens werden de cellen gefixeerd met methanol, geblokkeerd met normaal paardenserum (2,5%) (Vector Laboratories, ABC Kit) gedurende 20 minuten, en gedurende 4 uur geïncubeerd met Santa Cruz (Santa Cruz, CA, USA) muismonoklonale antilichamen tegen HMGB1(sc-56698), HSP70 (sc-24), of HSP90 (sc-7947), alle gebruikt in een 1 :1000 verdunning. Vervolgens werden de cellen geïncubeerd met HRP-biotinylated anti-mouse/rabbit IgG (Vector Laboratories, ABC Kit) gedurende 1 uur en Avidin-DH oplossing (Vector Laboratories, ABC Kit) gedurende 30 minuten; daarna werd DAB (3,3-diaminobenzidine) toegevoegd. DAB-chromogeen produceert een bruine reactie in aanwezigheid van peroxidase (HRP). De plaatjes werden gecontrasteerd met hematoxyline van Mayer, gedehydrateerd in een alcohol-xylol gradiënt, en gemonteerd met Entellan® (kunsthars) op glasplaatjes. Onbehandelde B16F10-cellen werden gebruikt als controle voor de basale expressie van HMGB1, HSP70 en HSP90. De HMGB1, HSP70, en HSP90 expressie (DAB kleuring intensiteit) werd uitgevoerd met behulp van de Fiji (ImageJ) software versie 2.0 zoals beschreven door Patera (2019). Gegevens worden gepresenteerd als DAB optische dichtheid (=log (max intensiteit/gemiddelde intensiteit)) van vijf secties per dia. Er werden drie onafhankelijke experimenten uitgevoerd.
Flow Cytometrie voor Calreticulin bepaling
Cellen(50 x103 cellen/well) werden gezaaid op ultra-low-attachment, 24-well platen bij 37°C en 5%CO2. Daarna werden cellen behandeld met Ag LD50 (2,8 x 10-5 mM), DCA LD50 (195 mM), of Ag + DCA LD50 (2,4 x 10-5 mM en 135 mM, respectievelijk) bij 37 ° C en 5%CO2 gedurende 4 uur. Vervolgens werden de cellen hersteld en gekleurd met calreticuline polyklonaal antilichaam geconjugeerd met phycoerythrine gedurende 1 uur bij 37°C en 5%CO2. Cellen werden gewassen met PBS + runderserumalbumine (BSA) (1%) en geresuspendeerd in 200μlPBS. De events werden verkregen in de Accouri C6 flowcytometer (BD Biosciences, San Jose, CA, USA).
In vivo antitumorvaccinatie-experimenten
Voor cellysaatbereiding volgden we het protocol beschreven door Rodríguez-Salazar et al. [12] met kleine wijzigingen. Kort gezegd werden B16F10-cellen (5 x106) in vitro behandeld met Ag (LD50) of DCA (LD50) of de combinatie Ag (LD25) + DCA (LD25) gedurende 5 uur. Vervolgens werden de cellen gecentrifugeerd bij 260 × g gedurende 10 minuten en tweemaal gewassen met PBS. Tenslotte werden de cellen geresuspendeerd in 200μlPBS en subcutaan geïnoculeerd in de linkerflank van de muis. Na 7 dagen werden de muizen uitgedaagd met 5 x105 levende B16F10-cellen geresuspendeerd in 200μlPBS via subcutane injectie in de rechterflank. Tumorincidentie en -groei werden gedurende 30 dagen dagelijks gemeten op de twee injectieplaatsen met een digitale schuifmaat. Het tumorvolume werd berekend met de formule V = (L x W2)/2, waarbij V het tumorvolume is, L de tumorlengte en W de tumorbreedte, dezelfde formule als eerder gebruikt door Rodríguez-Salazar et al. [12].
Statistische analyse
De statistische analyse werd uitgevoerd met een eenzijdige variantieanalyse (ANOVA) gevolgd door Dunnett’s test, tenzij anders vermeld. Statistisch significant verschil werd beschouwd bij . Alle experimenten werden uitgevoerd in drievoud.
Resultaten
DCA-Ag verminderde de cellulaire levensvatbaarheid van Melanoma B16F10-cellen
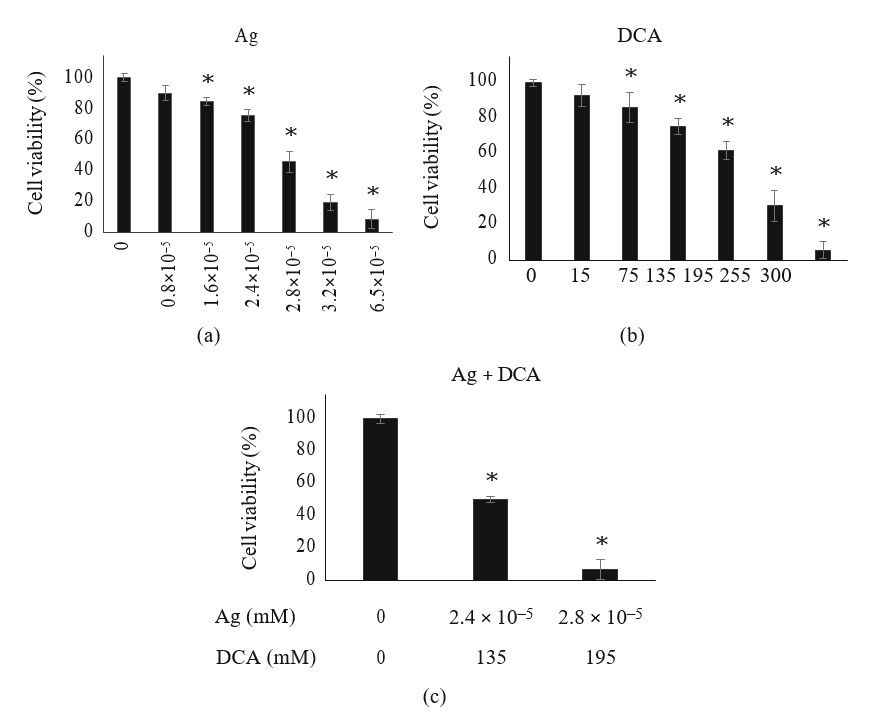
De behandeling met Ag of DCA induceerde een afname van de levensvatbaarheid van B16F10-cellen op dosisafhankelijke wijze in vergelijking met de controle (p < 0,01) (figuren 1(a) en 1(b)). DL25 (2,4 ×105mM) en DL50 (2,8 ×105) werden bepaald voor Ag (figuur 1(a)); DL25 (135 mM) en DL50 (195 mM) werden ook bepaald voor DCA (figuur 1(b)). In de combinatorische setting waren lagere doses Ag en DCA nodig om DL25 en DL50 te bereiken (figuur 1(c)).
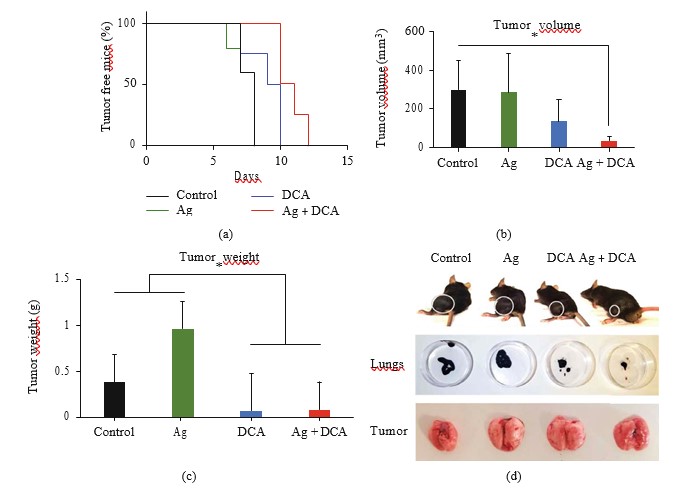
Ag-DCA geïnduceerde tumorregressie
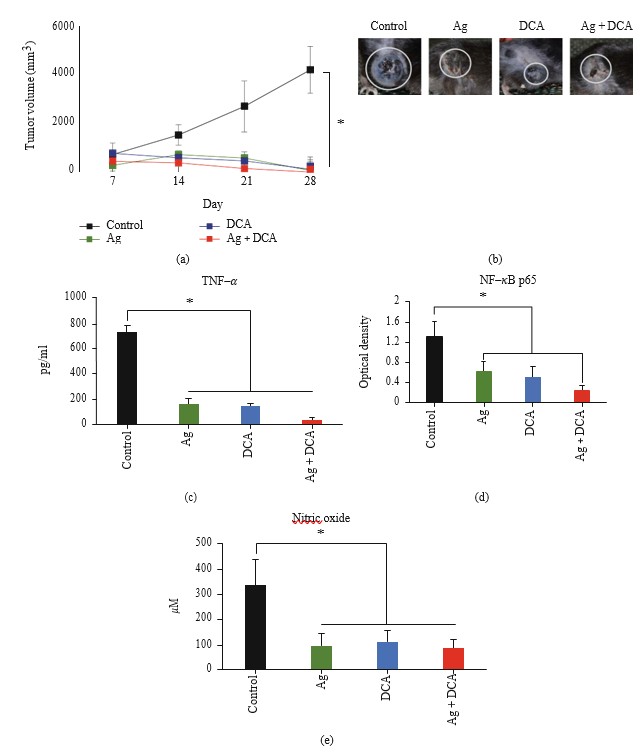
De toediening van Ag, DCA, en Ag + DCA induceerde tumorvolume regressie (p < 0:05) op tijdsafhankelijke wijze, waarbij een beter effect werd waargenomen bij muizen die werden behandeld met Ag + DCA behandeling (figuur 2(a)).
Ag, DCA, en Ag + DCA-behandelingen verminderden TNF-α, NF-κB, en stikstofoxide
Alle behandelingen verminderden (p < 0:05) de TNF-α productie (figuur 2(c)), NFκB activiteit (figuur 2(d)), en stikstofoxide (NO) productie significant in vergelijking met de controlegroep; significant verschil werd niet waargenomen tussen de behandelde groepen (figuren 2(c)-2(e)).
HMGB1, HSP70, en HSP90 expressie en lokalisatie in B16F10-cellen behandeld met Ag, DCA, of Ag + DCA
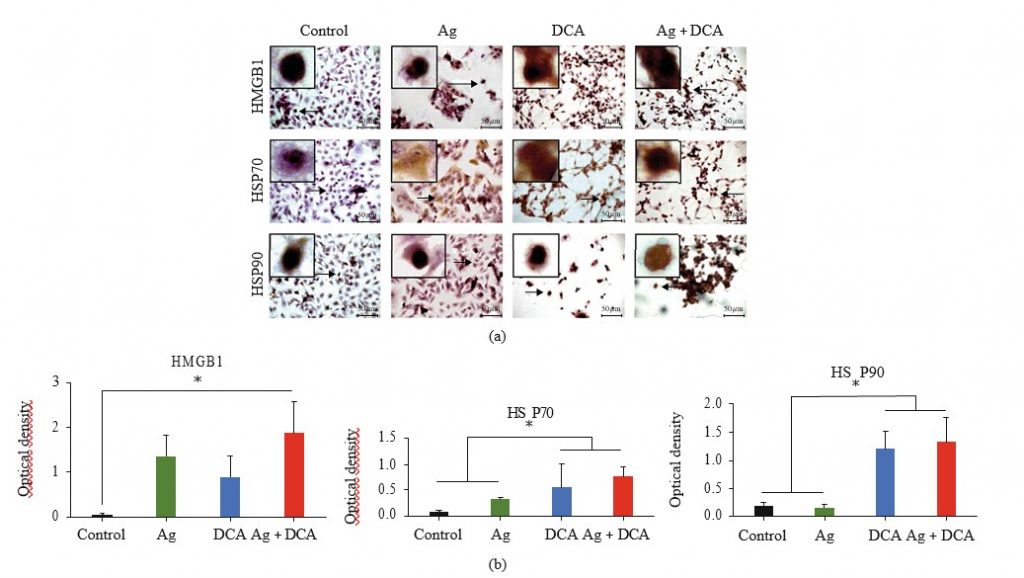
HMGB1, HSP70, en HSP90 lokalisatie werden bepaald door microscopie (figuur 3 (a)). In controleomstandigheden waren HMGB1, HSP70 en HSP90 niet detecteerbaar of gelokaliseerd in de kern (figuur 3(a)). Ag behandeling gemobiliseerd HSP70 naar het cytoplasma en celmembraan, DCA behandeling gemobiliseerd HMGB1 en HSP70 naar het cytoplasma en celmembraan, en AgDCA gecombineerde behandeling gemobiliseerd HMGB1, HSP70, en HSP90 naar het cytoplasma en celmembraan (figuur 3 (a)). Alle behandelingen verhoogden significant (p < 0:05) de expressie van HMGB1 en HSP70, maar alleen DCA en Ag + DCA verhoogden significant (p < 0:05) HSP90, vergeleken met de controle (onbehandelde B16F10-cellen) (figuur 3(b)).
Calreticuline blootstelling in Ag, DCA, of Ag + DCA Behandelde cellen
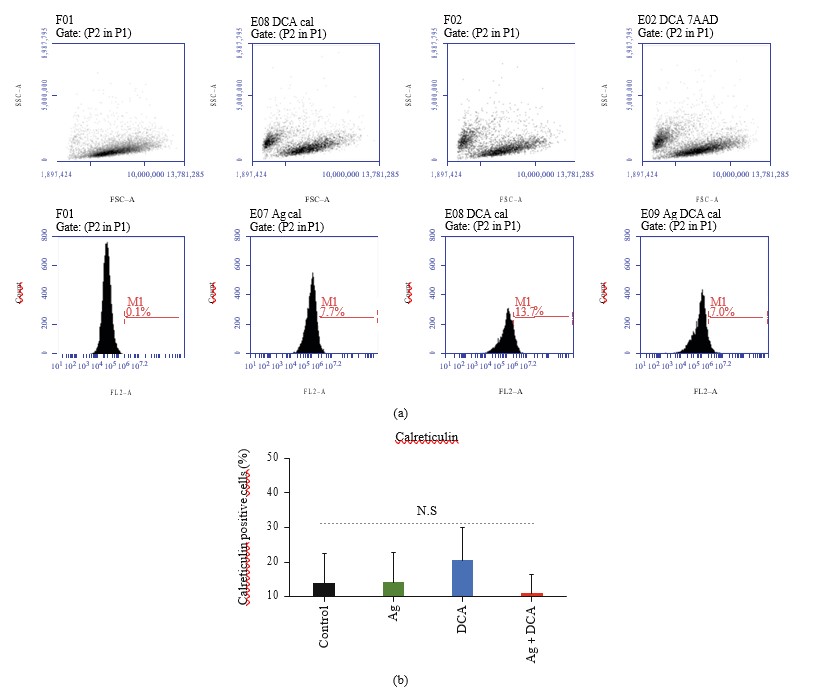
Ag, DCA, en Ag + DCA behandelingen niet induceren calreticuline oppervlak blootstelling in B16F10 cellen, in vergelijking met de controle (B16F10 onbehandelde cellen) (Figuren 4 (a) en 4 (b)).
Ag, DCA of Ag + DCA induceren geen immunogene celdood
B16F10-cellendie met Ag, DCA en AgDCA zijn gelyseerd, voorkomen niet dat er tumoren worden geïmplanteerd in C57BL/6 muizen (figuren 5(a)-5(d)).
Bespreking
Het cytotoxische effect van colloïdaal zilver (Ag), natriumdichlooracetaat (DCA) en hun combinatie werd geëvalueerd tegen B16F10 muriene melanoomcellen. Onze resultaten tonen aan dat Ag antiproliferatieve effecten heeft tegen B16F10 cellen, zoals eerder gerapporteerd door onze onderzoeksgroep [13]. Verdere rapporten over de cytotoxische activiteit van zilver tegen melanoomcellen verwijzen naar zilveren nanodeeltjes, hoewel het voorgestelde toxiciteitsmechanisme hetzelfde blijft [14]. Ook DCA vertoonde een antiproliferatief effect tegen melanoomcellen. Op soortgelijke wijze meldden Rivera-Lazarín et al. een dosisafhankelijke afname van de levensvatbaarheid in B16F10-cellen behandeld met DCA [15].
De cytotoxische activiteit van Ag en DCA nam toe bij gecombineerd gebruik. Dit was te verwachten, aangezien de combinatie van twee of meer middelen een hoeksteen is voor de behandeling van kanker; hierdoor kunnen belangrijke pathways tegelijkertijd worden aangepakt, waardoor de werkzaamheid toeneemt [16].
Na de waarneming van het verhoogde cytotoxische effect hebben wij geëvalueerd of onze resultaten correleerden met een in vivo antitumoractiviteit. Op tumorniveau werd necrose geconstateerd; vermeldenswaard is dat de letsels in alle gevallen van tumoreliminatie volledig genazen. Huidletsels kunnen ontstaan door overexpressie van tumornecrosefactor alfa [17]. Onze resultaten toonden hogere niveaus van TNF-α in onbehandelde melanomen en een significante daling van deze factor in reactie op al onze behandelingen. TNF-α correleert met de agressiviteit en het metastatisch potentieel van melanomen in vivo [18], en de overexpressie ervan is door Rossi et al. gerapporteerd in gevorderde primaire melanomen [19].
Het is belangrijk te vermelden dat TNF-α een pleiotroop cytokine is, en de pro-apoptotische effecten ervan tegen kankercellen zijn uitgebreid beschreven [20]; melanoomcellen weerstaan de door TNF-α geïnduceerdeapoptose echter via NF-κBen stikstofmonoxide [21].
In deze studie toonden onze resultaten een afname van NF-κBen stikstofmonoxide bij muizen die werden behandeld met Ag, DCA, of de combinatie van beide, hetgeen correleert met tumorregressie. Wang et al. meldden dat NF-κBTNF-α-gemedieerdeapoptose onderdrukt via de activering van de anti-apoptotische eiwitten TRAF1, TRAF2, c-IAP1 en c-IAP2 [22]. Anderzijds meldden Salvucci et al. de productie van stikstofmonoxide in menselijke melanoomcellen, en het blokkeren van deze productie induceert celdood in menselijk melanoom [23]. Met name remt stikstofmonoxide ten minste zeven caspasen door s-nitrosylering [24]
.
Ondanks onze waarnemingen is het belangrijk te vermelden dat TNF-α, NF-κBen NO pleiotrope effecten hebben, en dat hun rol in melanoom niet goed wordt begrepen. Wij benadrukken echter dat onze resultaten erop wijzen dat deze moleculen afnemen in correlatie met tumorregressie en wondgenezing.
Veel antikankertherapieën kunnen kankercelsterfte induceren, wat leidt tot de eliminatie van de tumor en een patiënt die vrij is van maligniteit. Echter, alleen immunogene celdoodinductoren kunnen herhaling van kanker voorkomen. Daarom vormen geneesmiddelen die immunogene celdood induceren een recente innovatie op het gebied van onco-immunotherapie [25], zoals het geval is bij het gebruik van de immunomodulator IMMUNEPOTENT CRP, die deze capaciteit onlangs heeft aangetoond [12]. Wij wilden nagaan of onze behandelingen in staat waren een immunogene celdood te induceren.
De aanwezigheid van alarmines in vitro wijst op het potentieel om immunogene celdood te induceren [26]. Maar ondanks de behandelingsafhankelijke toename van HMGB1, HSP70 en HSP90 (maar niet van calreticuline), induceerde de vaccinatie van muizen met B16F10 cellen gelyseerd met Ag, DCA, of de combinatie Ag + DCA geen immunogene celdood, zoals blijkt uit het verschijnen van tumoren in alle muizen (gevaccineerd of ongevaccineerd) na uitdaging met levensvatbare B16F10 cellen. Tumorgroei geeft aan dat de vaccins geen specifieke immuunrespons opwekten. Een reden hiervoor zou kunnen zijn dat DCA, Ag, en DCA + Ag de afgifte van DAMP’s niet induceren in een gecoördineerd spatiotemporeel patroon; daarom missen zij het vermogen om cytokinen en efficiënte antigenpresentatie te induceren [27].
De conclusie is dat de combinatie van Ag en DCA potentiële antitumoreigenschappen heeft tegen melanoomcellen; het in vivo antitumormechanisme is echter geen immunogene celdood. Verdere studies om het celdoodmechanisme op te helderen zijn belangrijk om strategieën en combinaties met klinische werkzaamheid tegen melanoom te ontwerpen.
Beschikbare gegevens
Gegevens in verband met het manuscript zijn beschikbaar op redelijk verzoek.
Belangenverstrengeling
De auteurs verklaren dat er geen sprake is van belangenverstrengeling.
Erkenningen
Deze studie werd gesteund door “Fondo Sectorial de Investigación para la Educación” subsidie A1-S-35951, CONACYT, Mexico. Wij danken MsC. Alejandra Arreola Triana voor de revisie van het manuscript.
VERWIJZINGEN
1 D. B. Johnson en J. A. Sosman, “Update on the targeted therapy of melanoma,” Current Treatment Options in Oncology, vol. 14, no. 2, pp. 280-292, 2013.
2 E. A. Zaal en C. R. Berkers, “The influence of metabolism on drug response in cancer,” Frontiers in Oncology, vol. 8, p. 500, 2018.
3 Z.-F. Lim en P. C. Ma, “Emerging insights of tumor heterogeneity and drug resistance mechanisms in lung cancer targeted therapy,” Journal of Hematology & Oncology, vol. 12, no. 1, p. 134, 2019.
4 V. De Matteis, M. Cascione, C. Toma, and S. Leporatti, “Silver nanoparticles: synthetic routes, in vitro toxicity and theranostic applications for cancer disease,” Nanomaterials, vol. 8, no. 5, p. 319, 2018.
5 N. Durán, W. J. Fávaro, en A. B. Seabra, “Wat weten we eigenlijk over nanotoxicologie van zilveren nanodeeltjes in vivo? Nieuwe aspecten, mogelijke mechanismen en perspectieven,” Current Nanoscience, vol. 16, no. 3, pp. 292-320, 2020.
6 M. Ahamed, M. S. AlSalhi, en M. K. J. Siddiqui, “Silver nanoparticle applications and human health,” Clinica Chimica Acta, vol. 411, no. 23-24, pp. 1841-1848, 2010.
7 K. Habiba, K. Aziz, K. Sanders et al., “Enhancing colorectal cancer radiation therapy efficacy using silver nanoprisms decorated with graphene as radiosensitizers,” Scientific Reports, vol. 9, no. 1, p. 17120, 2019.
8 T. Tataranni en C. Piccoli, “Dichloroacetate (DCA) and cancer: an overview towards clinical applications,” Oxidative Medicine and Cellular Longevity, vol. 2019, 14 pages, 2019.
9 S. Pustylnikov, F. Costabile, S. Beghi, en A. Facciabene, “Targeting mitochondria in cancer: current concepts and immunotherapy approaches,” Translational Research, vol. 202, pp. 35-51, 2018.
10 S. Grazioli en J. Pugin, “Mitochondrial damage-associated molecular patterns: from inflammatory signaling to human diseases,” Frontiers in Immunology, vol. 9, p. 832, 2018.
11 Y. Nie, D. Yang, en J. J. Oppenheim, “Alarmins and antitumor immunity,” Clinical Therapeutics, vol. 38, no. 5, pp. 1042-1053, 2016.
12 M. Rodríguez-Salazar, M. A. Franco-Molina, E. Mendoza-Gamboa et al., “The novel immunomodulator IMMUNEPOTENT CRP combined with chemotherapy agent increased the rate of immunogenic cell death and prevented melanoma growth,” Oncology Letters, vol. 14, no. 1, pp. 844-852, 2017.
13 C. A. Sierra Rivera, M. A. Franco Molina, E. Mendoza Gamboa, P. Zapata Benavides, R. S. Tamez Guerra, en C. Rodriacute guez Padilla, “Potential of colloidal or silver nanoparticles to reduce the growth of B16F10 melanoma tumors,” African Journal of Microbiology Research, vol. 7, no. 22, pp. 2745-2750, 2013.
14 L. M. Valenzuela-Salas, N. G. Girón-Vázquez, J. C. García-Ramos et al., “Antiproliferative and antitumour effect of nongenotoxic silver nanoparticles on melanoma models,” Oxidative Medicine and Cellular Longevity, vol. 2019, 12 pages, 2019.
15 A. L. R. LazarAAn, A. Zugasti Cruz, G A.¡n. A. de la PeAAa, S. Y. S. Belmares, and C. A. Sierra Rivera, “Synergistic cytotoxic effect of sodium dichloroacetate combined with chemotherapeutic drugs on B16F10 murine melanoma cell line,” Biomedical Research, vol. 30, no. 1, 2019.
16 R. B. Mokhtari, T. S. Homayouni, N. Baluch et al., “Combinatietherapie bij de bestrijding van kanker,” Oncotarget, vol. 8, no. 23, pp. 38022-38043, 2017.
17 A. M. Brotas, J. M. T. Cunha, E. H. J. Lago, C. C. N. Machado, en S. C. S. Carneiro, “Tumor necrosis factor-alpha and the cytokine network in psoriasis,” Anais Brasileiros de Dermatologia, vol. 87, no. 5, pp. 673-683, 2012.
18 S. Moretti, C. Pinzi, A. Spallanzani et al., “Immunohistochemical evidence of cytokine networks during progression of human melanocytic lesions,” International Journal of Cancer, vol. 84, no. 2, pp. 160-168, 1999.
19 S. Rossi, M. Cordella, C. Tabolacci et al., “TNF-alfa en metalloproteasen als hoofdrolspelers in de agressiviteit van melanoomcellen,” Journal of Experimental & Clinical Cancer Research, vol. 37, no. 1, p. 326, 2018.
20 A. Montfort, C. Colacios, T. Levade, N. Andrieu-Abadie, N. Meyer, en B. Ségui, “The TNF paradox in cancer progression and immunotherapy,” Frontiers in Immunology, vol. 10, p. 1818, 2019.
21 V. A. Soldatenkov, A. Dritschilo, Z. Ronai, and S. Y. Fuchs, “Inhibition of homologue of Slimb (HOS) function sensitizes human melanoma cells for apoptosis,” Cancer Research, vol. 59, no. 20, pp. 5085-5088, 1999.
22 C. Wang, M. W. Mayo, R. G. Korneluk, D. V. Goeddel, and Baldwin AS Jr, “NF-B anti-apoptosis: induction of TRAF1 and TRAF2 and c-IAP1 and c-IAP2 to suppress caspase-8 activation,” Science, vol. 281, no. 5383, pp. 1680-1683, 1998.
23 O. Salvucci, M. Carsana, I. Bersani, G. Tragni, en A. Anichini, “Antiapoptotische rol van endogeen stikstofoxide in menselijke melanoomcellen,” Cancer Research, vol. 61, no. 1, pp. 318-326, 2001.
24 L. Rössig, B. Fichtlscherer, K. Breitschopf et al., “Nitric oxide inhibits caspase-3 by S -nitrosation in vivo,” The Journal of Biological Chemistry, vol. 274, no. 11, pp. 6823-6826, 1999.
25 B. Rapoport en R. Anderson, “Realizing the clinical potential of immunogenic cell death in cancer chemotherapy and radiotherapy,” International Journal of Molecular Sciences, vol. 20, no. 4, p. 959, 2019.
26 A. Terenzi, C. Pirker, B. K. Keppler, en W. Berger, “Anticancer metal drugs and immunogenic cell death,” Journal of Inorganic Biochemistry, vol. 165, pp. 71-79, 2016.
27 O. Kepp, L. Menger, E. Vacchelli et al., “Crosstalk between ER stress and immunogenic cell death,” Cytokine & Growth Factor Reviews, vol. 24, no. 4, pp. 311-318, 2013.