Zaida Torres-Cavazos1, Moisés Armides Franco-Molina2, Silvia Elena Santana-Krímskaya2, Cristina Rodríguez-Padilla2, Jorge Ramsy Kawas-Garza1, Gustavo Hernández-Vidal1, Gustavo Moreno-Degollado1e Diana Elisa Zamora-Ávila1
1 Posgrado Conjunto de las Facultades de Agronomía y Medicina Veterinaria y Zootecnia, Universidad Autónoma de Nuevo León,
Ave. Universidad S/N, Cd. Universitaria, San Nicolás de los Garza, N. L., CP 66455, Mexico
2 Laboratorio de Inmunología y Virología, Unidad C, Facultad de Ciencias Biológicas, Universidad Autónoma de Nuevo León,
Ave. Universidad S/N, Cd. Universitaria, San Nicolás de los Garza, N. L., CP 66455, Messico
Corrispondenza: Moisés Armides Franco-Molina; [email protected]
Ricevuto: 13 luglio 2020
Revisione: 28 settembre 2020
Accettato: 14 ottobre 2020
Pubblicato: 7 novembre 2020
Abstract
Il nostro obiettivo principale è stato quello di valutare l’efficacia dell’argento e del dicloroacetato di sodio come agenti a doppia funzione da utilizzare nel trattamento del melanoma. Questa strategia è stata progettata per aumentare l’attività di questi due composti che agiscono sull’integrità del DNA e sui mitocondri a diversi livelli. Inoltre, abbiamo valutato se il meccanismo di morte cellulare indotto dai nostri trattamenti fosse una morte cellulare immunogenica. Per valutare l’efficacia antitumorale, abbiamo valutato il volume del tumore e la produzione del fattore di necrosi tumorale α, del fattore nucleare κ B (entrambi mediante ELISA) e i livelli di ossido nitrico (kit per il dosaggio colorimetrico di nitrato/nitrito); per la morte cellulare immunogenica, abbiamo valutato il rilascio di pattern molecolari associati al pericolo mediante immunoistochimica e citometria a flusso, oltre a un challenge in vivo. I nostri risultati hanno dimostrato che la combinazione di argento colloidale e dicloroacetato di sodio è più efficace di ciascun trattamento da solo e che il meccanismo antitumorale non passa attraverso la morte cellulare immunogenica. Inoltre, questo studio può contribuire ampiamente allo sviluppo di nanoparticelle d’argento caricate con dicloroacetato e alla progettazione di formulazioni farmacologiche mirate per combattere il melanoma e altri tipi di cancro.
Editore accademico: Yanis Toledaño Magaña
Copyright © 2020 Zaida Torres-Cavazos et al. Questo è un articolo ad accesso libero distribuito secondo la Creative Commons Attribution License, che ne consente l’uso, la distribuzione e la riproduzione illimitata su qualsiasi supporto, a condizione che l’opera originale sia adeguatamente citata.
INTRODUZIONE
Le terapie mirate hanno aumentato le possibilità di sopravvivenza per le persone affette da melanoma [1]; tuttavia, le cellule tumorali presenti all’interno del tumore favoriscono diverse vie metaboliche [2]; di conseguenza, il tumore finisce per diventare resistente alle terapie mirate, soprattutto quelle progettate contro un singolo bersaglio [3].
Lo sviluppo di terapie a base di argento è uno strumento promettente per il trattamento del cancro. Gli ioni d’argento e le nanoparticelle d’argento inducono stress ossidativo, disfunzione della membrana mitocondriale, danno al DNA e aumento delle citochine [4]. L’esatto meccanismo d’azione varia a seconda delle proprietà fisiche e chimiche della nanoparticella e del tipo di cancro [5]. Inoltre, l’uso clinico dell’argento colloidale a scopo battericida e antivirale dimostra che questo trattamento è sicuro [6],
7].
Il dicloroacetato di sodio (DCA) è un analogo del piruvato che interferisce con la glicolisi associata al tumore (effetto Warburg), diminuisce la malignità del cancro e riduce la produzione di lattato alterando le vie metaboliche delle cellule tumorali [8]. La diminuzione del lattato contrasta lo stato acido del microambiente tumorale, riducendo la crescita del tumore e le metastasi [8]. WZB117, un bis-idrossibenzoato, 2-deossi-d-glucosio, metformina e DCA riducono la glicolisi e bloccano l’assorbimento del glucosio nelle cellule tumorali. In presenza di bassi livelli di glucosio intracellulare, le vie biosintetiche, come la genesi dei nucleotidi e degli amminoacidi, vengono interrotte a causa della carenza di molecole intermedie, mettendo in crisi la proliferazione cellulare. Nonostante il suo uso come monoterapia o in combinazione con la chemioterapia, sono stati riportati pochi o nessun effetto negativo [9].
A causa di queste attività, abbiamo valutato la morte cellulare immunogenica come possibile meccanismo d’azione, in virtù del crescente numero di studi che dimostrano che i pattern molecolari associati al pericolo (DAMP) cellulari e mitocondriali possono essere rilasciati attivamente quando esposti a stimoli esterni [10]. Il rilascio di allarmine (Hsp70, HSP90, calreticulina, HMGB1, ATP, DNA e RNA) e neoantigeni tumorali induce una risposta immunitaria tumore-specifica che elimina le cellule tumorali vive e il tessuto tumorale residuo, evitando la recidiva del cancro [11].
L’obiettivo principale di questo studio è stato quello di utilizzare l’argento e il DCA come agenti a doppia funzione che agiscono sull’integrità del DNA e sull’attività dei mitocondri per aumentare la risposta antitumorale nel trattamento del melanoma. Inoltre, questo studio potrebbe servire come punto di partenza per la fase successiva di sviluppo di nanoparticelle d’argento caricate con dicloroacetato e formulazione farmacologica mirata.
Materiali e metodi
Reagenti
La soluzione di penicillina-streptomicina, la soluzione di Ficoll-Hypaque, la soluzione di tripsina-EDTA, il terreno RPMI-1640, il Dulbecco’s Modified Eagle’s Medium (DMEM/F-12) e la soluzione antibiotico-antimicotica all’1% sono stati ottenuti da Life Technologies GIBCO, Grand Island, NY, USA. Il siero fetale bovino (FBS) è stato acquistato da Sigma-Aldrich (St. Louis, MO).
Coltura cellulare
La linea cellulare di melanoma murinoB16F10è stata acquistata dall’American Type Culture Collection (ATCC, Manassas, VA, USA). Le cellule sono state coltivate e mantenute in Dulbecco’s Modified Eagle’s Medium integrato con il 10% di siero fetale bovino (FBS) e l’1% di penicillina-streptomicina a 37°C e in un’atmosfera al 5%di CO2.
Vitalità cellulare
ellule(5 ×103 cellule/pozzetto) sono state disposte su 96 piastre a pozzetto a fondo piatto e incubate per 24 ore a 37°C in atmosfera al 5%di CO2. Dopo l’incubazione, il terreno di coltura è stato rimosso e sono stati aggiunti Ag (da 0,8mM a 6:5 × 10-5mM) o DCA (da 75mM/ml a 750mM/ml) diluiti nello stesso terreno. Le piastre sono state poi incubate per 4 ore a 37°C e in atmosfera diCO2 al 5%. Successivamente, è stato rimosso il surnatante e le cellule sono state lavate due volte con terreno DMEM/F-12. La vitalità cellulare è stata determinata con il metodo della resazurina (Alamar Blue) e la citotossicità è stata espressa come concentrazione di inibizione del 50% della crescita cellulare (LD50). I risultati sono stati espressi come media ± deviazione standard (SD) di tre esperimenti indipendenti. La LD50 di ciascun trattamento è stata utilizzata per ulteriori esperimenti.
Determinazione della morte cellulare
Per la determinazione della morte cellulare, abbiamo seguito la metodologia descritta da Rodríguez-Salazar et al. [12]. In breve, le cellule B16F10 (1 ×105) sono state seminate in piastre a 12 pozzetti e coltivate per tutta la notte in 5%CO2 a 37°C. Le cellule sono state trattate con AgC (LD50) o DCA (LD50) o una combinazione di AgC (LD25) + DCA (LD25) per 5 ore. Dopo il trattamento, le cellule sono state raccolte e lavate con soluzione fisiologica tamponata con fosfato (PBS) e risospese in 100μldi tampone di legame 1× (0,1M Hepes pH 7,4, 1,4M NaCl e 25 mM CaCl2; Sigma-Aldrich; Merck KGaA, Darmstadt, Germania) integrato con Annexina V coniugata con APC (5μl/campione) e ioduro di propidio (1μl/campione), incubato a 4°C e mantenuto al buio per 15 min. L’analisi in citometria a flusso è stata eseguita con un citometro Accuri C6; per l’analisi dei dati è stato utilizzato il software BD Accuri C6 versione 1.0.264.21 (entrambi BD Biosciences, San Jose, CA, USA).
Animali
Le femmine di topi C57BL/6 di 6 e 10 settimane di età con un peso corporeo di circa 23 (±2) g sono state acquistate dai Laboratori Harlan (Città del Messico, Messico). I topi sono stati tenuti a 25-29°C e con un ciclo di luce-12 ore di buio. Cibo e acqua sono stati forniti ad libitum. Il protocollo sperimentale è stato approvato dal Comitato Etico per la Sperimentazione Animale della Facoltà di Scienze Biologiche dell’Università Autonoma del Nuevo Leon (San Nicolas de los Garza, Messico).
Impianto del tumore e somministrazione del trattamento
I tumori sono stati indotti per via sottocutanea iniettando 1 x106 cellule B16F10 in 200μldi soluzione salina tamponata con fosfato (PBS). Sette giorni dopo il trapianto di cellule B16F10, è comparsa una massa tumorale evidente e i topi sono stati distribuiti a caso in quattro gruppi (cinque topi per gruppo). Il gruppo di controllo ha ricevuto solo soluzione salina. Il gruppo DCA ha ricevuto 50mg/kg di DCA, mentre il gruppo Ag ha ricevuto 28mg/kg di Ag. Soluzione salina, Ag e DCA sono stati somministrati per via peritumorale, ogni giorno, per 21 giorni. Infine, il gruppo Ag + DCA ha ricevuto le stesse dosi di Ag e DCA per via peritumorale a giorni alterni, alternando i trattamenti. La lunghezza e la larghezza del tumore sono state misurate settimanalmente e il volume del tumore è stato determinato utilizzando l’equazione: L x W2, dove L è il lato più lungo e W è il lato più corto. Gli animali sono stati eutanasia al termine dello studio (21 giorni) e i tumori sono stati escissi per ulteriori esperimenti.
ELISA per l’attivazione della subunità NF-κBp65
Per misurare l’attivazione della subunità NF-κBp65, sono stati preparati estratti nucleari da 3 x106 cellule tumorali, utilizzando un kit di estrazione nucleare secondo il protocollo del produttore. I livelli di concentrazione di p65 nucleare sono stati determinati con un saggio ELISA sensibile (TRANS-AM, Active Motif, Rixensart, Belgio).
TNF-α e produzione di NO
I tumori sono stati macerati con RPMI e il supernatante è stato raccolto e regolato a una concentrazione di proteine di BSA e conservato a -20°C per la valutazione. Il TNF-α è stato misurato nel surnatante tumorale mediante test di immunoassorbimento enzimatico (TNF alpha Mouse ELISA Kit; Invitrogen; Thermo Fisher Scientific; Viena, Austria). Tutte le procedure di analisi sono state eseguite secondo il protocollo del produttore.
Per misurare i livelli di NO negli omogenati di tessuto del tumore è stato utilizzato il kit per il dosaggio dei nitrati/nitriti, seguendo il protocollo stabilito dal produttore (Nitrate/Nitrite colorimetric assay kit; Cayman Chemical, USA).
Immunocitochimica per la determinazione di HMGB1, HSP70 e HSP90
Le cellule (100 x103 cellule/pozzetto) sono state seminate su vetrini di copertura a 37°C e 5% diCO2 per 24 ore. Successivamente, le cellule sono state trattate con Ag LD50 (2,8 x 10-5 mM), DCA LD50 (195 mM) o Ag + DCA LD50 (2,8 x 10-5mM e 135 mM, rispettivamente) a 37°C e 5%CO2 per 4 ore. Successivamente, le cellule sono state fissate con metanolo, bloccate con siero di cavallo normale (2,5%) (Vector Laboratories, ABC Kit) per 20 minuti e incubate per 4 ore con anticorpi monoclonali di topo Santa Cruz (Santa Cruz, CA, USA) contro HMGB1 (sc-56698), HSP70 (sc-24) o HSP90 (sc-7947), tutti utilizzati in diluizione 1 :1000. Quindi, le cellule sono state incubate con IgG anti-mouse/rabbit HRP-biotinilate (Vector Laboratories, ABC Kit) per 1 ora e con la soluzione Avidin-DH (Vector Laboratories, ABC Kit) per 30 minuti; successivamente è stato aggiunto il DAB (3,3-diaminobenzidina). Il cromogeno DAB produce una reazione marrone in presenza di perossidasi (HRP). I vetrini sono stati controcolorati con ematossilina di Mayer, disidratati in un gradiente di alcol-xilolo e montati con Entellan® (resina sintetica) su vetrini. Le cellule B16F10 non trattate sono state utilizzate come controllo dell’espressione basale di HMGB1, HSP70 e HSP90. L’espressione di HMGB1, HSP70 e HSP90 (intensità di colorazione DAB) è stata eseguita utilizzando il software Fiji (ImageJ) versione 2.0 come descritto da Patera (2019). I dati sono presentati come densità ottica DAB (=log (intensità massima/intensità media)) di cinque sezioni per vetrino. Sono stati eseguiti tre esperimenti indipendenti.
Citometria a flusso per la determinazione della calreticulina
Le cellule (50 x103 cellule/pozzetto) sono state seminate su piastre a 24 pozzetti a bassissimo attacco a 37°C e 5% diCO2. Successivamente, le cellule sono state trattate con Ag LD50 (2,8 x 10-5mM), DCA LD50 (195mM) o Ag + DCA LD50 (2,4 x 10-5 mM e 135 mM, rispettivamente) a 37°C e 5%CO2 per 4 ore. Successivamente, le cellule sono state recuperate e colorate con l’anticorpo policlonale calreticulina coniugato con ficoeritrina per 1 ora a 37°C e 5% diCO2. Le cellule sono state lavate con PBS+albumina di siero bovino (BSA) (1% ) e risospese in 200μldi PBS. Gli eventi sono stati acquisiti nel citometro a flusso Accouri C6 (BD Biosciences, San Jose, CA, USA).
Esperimenti di vaccinazione antitumoralein vivo
Per la preparazione del lisato cellulare, abbiamo seguito il protocollo descritto da Rodríguez-Salazar et al. [12] con piccole modifiche. In breve, le cellule B16F10 (5 x106) sono state trattate in vitro con Ag (LD50) o DCA (LD50) o con la combinazione Ag (LD25) + DCA (LD25) per 5 ore. Successivamente, le cellule sono state centrifugate a 260 × g per 10 minuti e lavate due volte con PBS. Infine, le cellule sono state risospese in 200μldi PBS e inoculate per via sottocutanea nel fianco sinistro del topo. Dopo 7 giorni, i topi sono stati esposti a 5 x105 cellule B16F10 vive risospese in 200μldi PBS mediante iniezione sottocutanea nel fianco destro. L’incidenza e la crescita del tumore sono state misurate ogni giorno nei due siti di iniezione per 30 giorni con un calibro digitale. Il volume del tumore è stato calcolato con la formula V = (L x W2)/2, dove V è il volume del tumore, L è la lunghezza del tumore e W è la larghezza del tumore, la stessa formula utilizzata in precedenza da Rodríguez-Salazar et al. [12].
Analisi statistica
L’analisi statistica è stata eseguita utilizzando un’analisi della varianza (ANOVA) a una via seguita dal test di Dunnett, salvo diversa indicazione. La differenza statisticamente significativa è stata considerata a . Tutti gli esperimenti sono stati eseguiti in triplo.
Risultati
IlDCA-Ag ha ridotto la vitalità cellulare delle cellule di melanoma B16F10
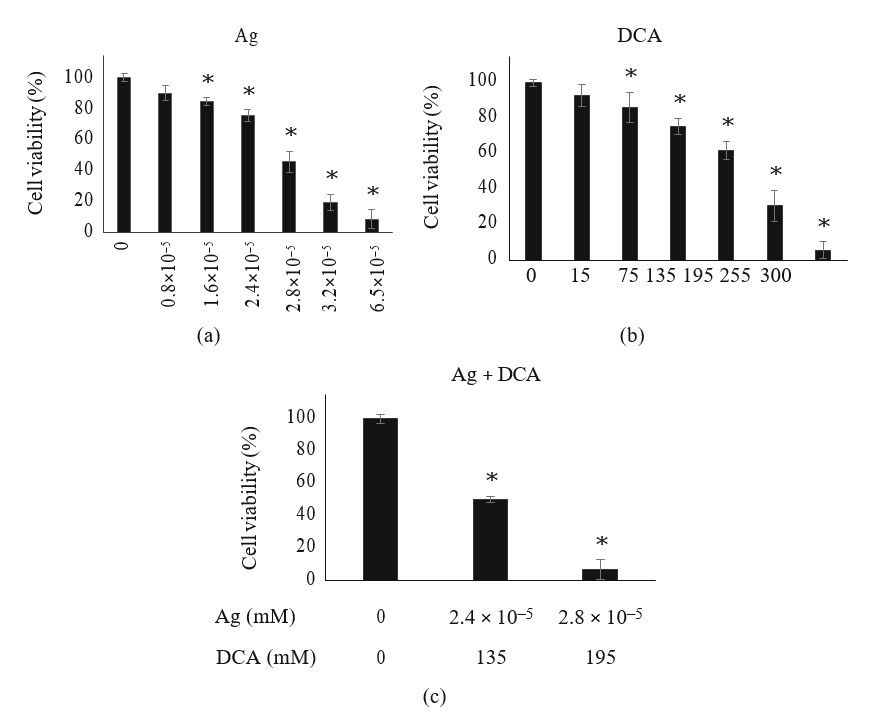
Il trattamento con Ag o DCA ha indotto una riduzione della vitalità cellulare delle cellule B16F10 in modo dose-dipendente rispetto al controllo (p < 0:01) (Figure 1(a) e 1(b)). La DL25 (2,4 ×105mM) e la DL50 (2,8 ×105) sono state determinate per l’Ag (Figura 1(a)); la DL25 (135mM) e la DL50 (195 mM) sono state determinate anche per il DCA (Figura 1(b)). Nell’impostazione combinatoria sono state necessarie dosi inferiori di Ag e DCA per raggiungere la DL25 e la DL50 (Figura 1(c)).
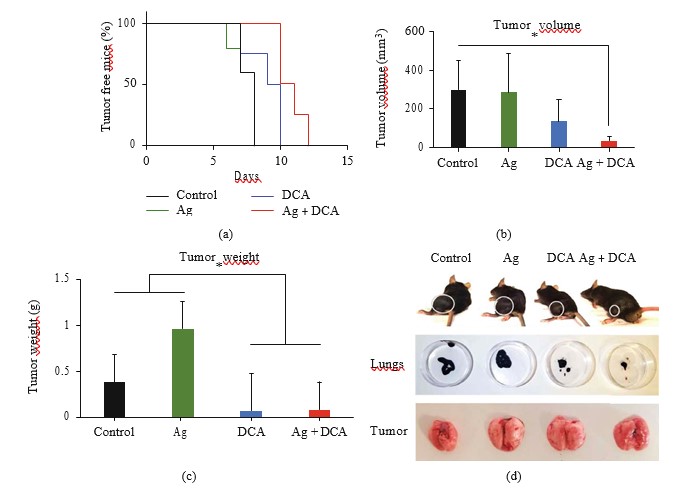
Regressione tumorale indotta da Ag-DCA
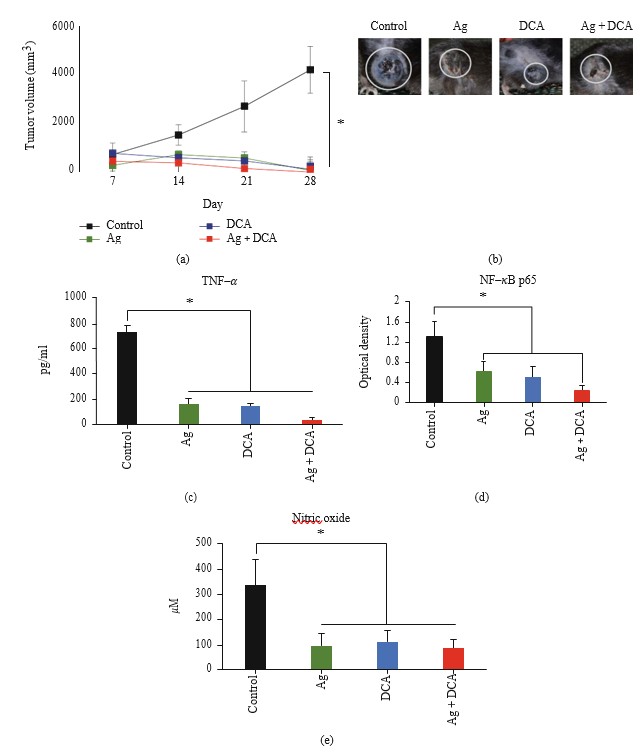
La somministrazione di Ag, DCA e Ag + DCA ha indotto una regressione del volume tumorale (p < 0:05) in modo dipendente dal tempo, osservando un effetto migliore nei topi trattati con Ag + DCA (Figura 2(a)).
Itrattamenti con Ag, DCA e Ag + DCA hanno ridotto laproduzione diTNF-α, NF-κB e ossido nitrico
Tutti i trattamenti hanno ridotto significativamente (p < 0:05) la produzione di TNF-α (Figura 2(c)), l’attività di NFκB (Figura 2(d)) e la produzione di ossido nitrico (NO) rispetto al gruppo di controllo; non sono state osservate differenze significative tra i gruppi trattati (Figure 2(c)-2(e)).
Espressione e localizzazione di HMGB1, HSP70 e HSP90 in cellule B16F10 trattate con Ag, DCA o Ag + DCA
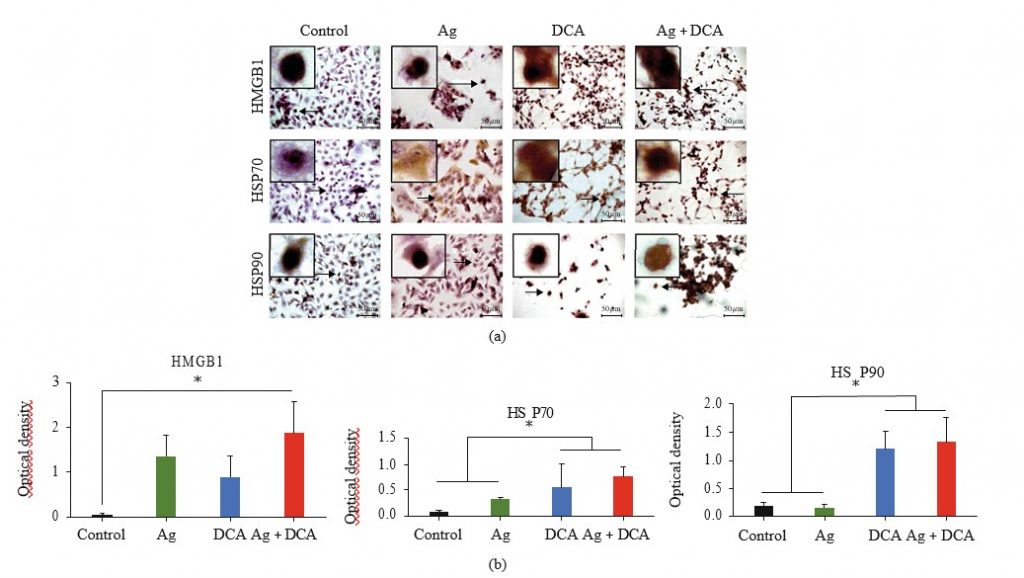
La localizzazione diHMGB1, HSP70 e HSP90 è stata determinata al microscopio (Figura 3(a)). In condizioni di controllo, HMGB1, HSP70 e HSP90 non erano rilevabili o erano localizzati nel nucleo (Figura 3(a)). Il trattamento con Ag ha mobilitato HSP70 nel citoplasma e nella membrana cellulare, il trattamento con DCA ha mobilitato HMGB1 e HSP70 nel citoplasma e nella membrana cellulare e il trattamento combinato AgDCA ha mobilitato HMGB1, HSP70 e HSP90 nel citoplasma e nella membrana cellulare (Figura 3(a)). Tutti i trattamenti hanno aumentato significativamente (p < 0:05) l’espressione di HMGB1 e HSP70; tuttavia, solo DCA e Ag + DCA hanno aumentato significativamente (p < 0:05) HSP90, rispetto al controllo (cellule B16F10 non trattate) (Figura 3(b)).
Esposizione della calreticulina nelle cellule trattate con Ag, DCA o Ag + DCA
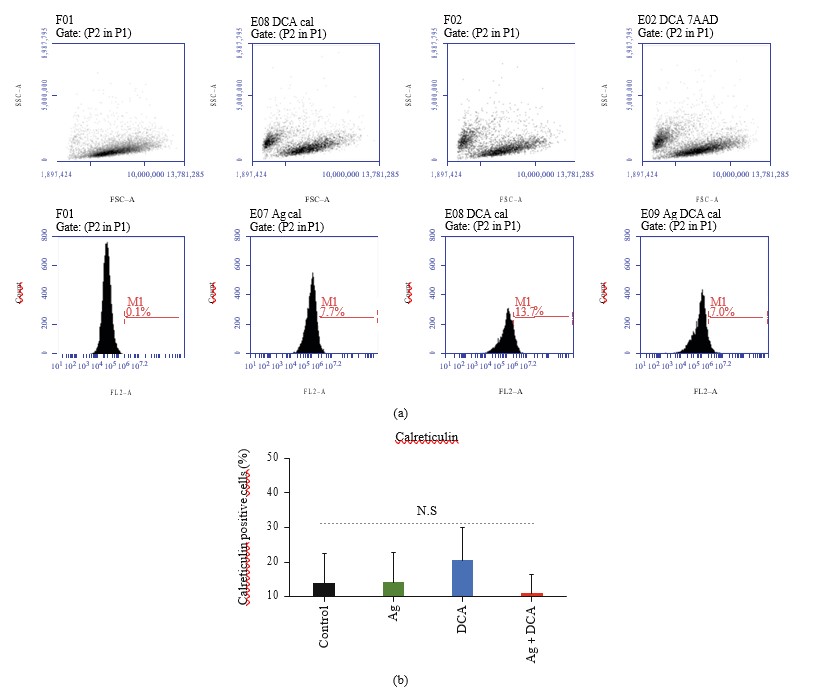
I trattamenti con Ag, DCA e Ag + DCA non inducono l’esposizione della calreticulina in superficie nelle cellule B16F10, rispetto al controllo (cellule B16F10 non trattate) (Figure 4(a) e 4(b)).
Ag, DCA o Ag + DCA non inducono morte cellulare immunogenica
Le celluleB16F10lisate con Ag, DCA e AgDCA non impediscono l’impianto del tumore in topi C57BL/6 (Figure 5(a)-5(d)).
Discussione
L’effetto citotossico dell’argento colloidale (Ag), del dicloroacetato di sodio (DCA) e della loro combinazione è stato valutato contro le cellule di melanoma murino B16F10. I nostri risultati mostrano che l’Ag ha effetti antiproliferativi contro le cellule B16F10, come precedentemente riportato dal nostro gruppo di ricerca [13]. Altri rapporti sull’attività citotossica dell’argento contro le cellule di melanoma fanno riferimento a nanoparticelle d’argento, anche se il meccanismo di tossicità proposto rimane lo stesso [14]. Anche il DCA ha mostrato un effetto antiproliferativo contro le cellule di melanoma. In modo simile, Rivera-Lazarín et al. hanno riportato una diminuzione dose-dipendente della vitalità delle cellule B16F10 trattate con DCA [15].
L’attività citotossica di Ag e DCA è aumentata quando sono stati utilizzati come trattamento combinato. Ciò era atteso, poiché la combinazione di due o più agenti è una pietra miliare per il trattamento del cancro; essa consente di colpire simultaneamente vie chiave, ottenendo un aumento dell’efficacia [16].
Dopo aver osservato l’aumento dell’effetto citotossico, abbiamo valutato se i nostri risultati fossero correlati a un’attività antitumorale in vivo. A livello tumorale è stata osservata la generazione di necrosi; vale la pena ricordare che le lesioni sono completamente guarite in tutti i casi di eliminazione del tumore. Le lesioni cutanee possono verificarsi a causa della sovraespressione del fattore di necrosi tumorale alfa [17]. I nostri risultati hanno rivelato livelli più elevati di TNF-α nei melanomi non trattati e una diminuzione significativa di questo fattore in risposta a tutti i nostri trattamenti. Il TNF-α è correlato all’aggressività del melanoma e al potenziale metastatico in vivo [18] e la sua sovraespressione è stata riportata da Rossi et al. in melanomi primari avanzati [19].
È importante ricordare che il TNF-α è una citochina pleiotropica e i suoi effetti pro-apoptotici contro le cellule tumorali sono stati ampiamente descritti [20]; tuttavia, le cellule di melanoma resistono all’apoptosi indottadal TNF-α attraverso NF-κBe l’ossido nitrico [21].
In questo studio, i nostri risultati hanno mostrato che NF-κBe l’ossido nitrico sono diminuiti nei topi trattati con Ag, DCA o la combinazione di entrambi, correlando con la regressione del tumore. Wang et al. hanno riportato che NF-κBsopprime l’apoptosi mediatada TNF-α attraverso l’attivazione delle proteine antiapoptotiche TRAF1, TRAF2, c-IAP1 e c-IAP2 [22]. D’altra parte, Salvucci et al. hanno riportato la produzione di ossido nitrico nelle cellule di melanoma umano e il blocco di questa produzione induce la morte cellulare nel melanoma umano [23]. In particolare, l’ossido nitrico inibisce almeno sette caspasi attraverso la s-nitrosilazione [24]
.
Nonostante le nostre osservazioni, è importante ricordare che TNF-α, NF-κBe NO hanno effetti pleiotropici e il loro ruolo nel melanoma non è ben compreso. Tuttavia, sottolineiamo che i nostri risultati indicano che queste molecole diminuiscono in correlazione con la regressione del tumore e la guarigione della ferita.
Molte terapie antitumorali hanno il potenziale di indurre la morte delle cellule tumorali, con conseguente eliminazione del tumore e un paziente privo di malignità. Tuttavia, solo gli induttori di morte cellulare immunogena possono prevenire la recidiva del cancro. Pertanto, i farmaci che inducono la morte cellulare immunogenica rappresentano una recente innovazione nel campo dell’onco-immunoterapia [25], come nel caso dell’uso dell’immunomodulatore IMMUNEPOTENT CRP, che ha recentemente dimostrato questa capacità [12]. Ci siamo proposti di valutare se i nostri trattamenti fossero in grado di indurre una morte cellulare immunogenica.
La presenza di allarmine in vitro indica la possibilità di indurre una morte cellulare immunogenica [26]. Tuttavia, nonostante l’aumento dipendente dal trattamento di HMGB1, HSP70 e HSP90 (ma non della calreticulina), la vaccinazione dei topi con cellule B16F10 lisate con Ag, DCA o la combinazione Ag + DCA non ha indotto la morte cellulare immunogenica, come dimostra la comparsa del tumore in tutti i topi (vaccinati o non vaccinati) dopo la sfida con cellule B16F10 vitali. La crescita del tumore indica che i vaccini non hanno indotto una risposta immunitaria specifica. Ciò potrebbe essere dovuto al fatto che DCA, Ag e DCA + Ag non inducono il rilascio di DAMP in uno schema spazio-temporale coordinato; pertanto, non hanno la capacità di indurre citochine e una presentazione efficiente dell’antigene [27].
In conclusione, la combinazione di Ag e DCA ha potenziali proprietà antitumorali contro le cellule di melanoma; tuttavia, il meccanismo antitumorale in vivo non è la morte cellulare immunogenica. Ulteriori studi per chiarire il meccanismo di morte cellulare sono importanti per progettare strategie e combinazioni con efficacia clinica contro il melanoma.
Disponibilità dei dati
I dati associati al manoscritto sono disponibili su richiesta.
Conflitti di interesse
Gli autori dichiarano l’assenza di conflitti di interesse.
Ringraziamenti
Questo studio è stato sostenuto dal “Fondo Sectorial de Investigación para la Educación” con sovvenzione A1-S-35951, CONACYT, Messico. Si ringrazia MsC. Alejandra Arreola Triana per la revisione del manoscritto.
RIFERIMENTI
1 D. B. Johnson e J. A. Sosman, “Update on the targeted therapy of melanoma”, Current Treatment Options in Oncology, vol. 14, n. 2, pp. 280-292, 2013.
2 E. A. Zaal e C. R. Berkers, “L’influenza del metabolismo sulla risposta ai farmaci nel cancro”, Frontiers in Oncology, vol. 8, pag. 500, 2018.
3 Z.-F. Lim e P. C. Ma, “Approfondimenti emergenti sull’eterogeneità tumorale e sui meccanismi di resistenza ai farmaci nella terapia mirata del cancro al polmone”, Journal of Hematology & Oncology, vol. 12, n. 1, pag. 134, 2019.
4 V. De Matteis, M. Cascione, C. Toma e S. Leporatti, “Nanoparticelle d’argento: vie sintetiche, tossicità in vitro e applicazioni terapeutiche per le patologie oncologiche”, Nanomateriali, vol. 8, no. 5, p. 319, 2018.
5 N. Durán, W. J. Fávaro e A. B. Seabra, “Cosa sappiamo veramente della nanotossicologia delle nanoparticelle d’argento in vivo? Nuovi aspetti, possibili meccanismi e prospettive”, Current Nanoscience, vol. 16, no. 3, pp. 292-320, 2020.
6 M. Ahamed, M. S. AlSalhi e M. K. J. Siddiqui, “Applicazioni delle nanoparticelle d’argento e salute umana”, Clinica Chimica Acta, vol. 411, n. 23-24, pp. 1841-1848, 2010.
7 K. Habiba, K. Aziz, K. Sanders et al., “Enhancing colorectal cancer radiation therapy efficacy using silver nanoprisms decorated with graphene as radiosensitizers”, Scientific Reports, vol. 9, n. 1, pag. 17120, 2019.
8 T. Tataranni e C. Piccoli, “Dicloroacetato (DCA) e cancro: una panoramica verso le applicazioni cliniche”, Oxidative Medicine and Cellular Longevity, vol. 2019, 14 pagine, 2019.
9 S. Pustylnikov, F. Costabile, S. Beghi e A. Facciabene, “Targeting mitochondria in cancer: current concepts and immunotherapy approaches”, Translational Research, vol. 202, pp. 35-51, 2018.
10 S. Grazioli e J. Pugin, “Mitochondrial damage-associated molecular patterns: from inflammatory signaling to human diseases”, Frontiers in Immunology, vol. 9, pag. 832, 2018.
11 Y. Nie, D. Yang e J. J. Oppenheim, “Alarmins and antitumor immunity”, Clinical Therapeutics, vol. 38, no. 5, pp. 1042-1053, 2016.
12 M. Rodríguez-Salazar, M. A. Franco-Molina, E. Mendoza-Gamboa et al., “Il nuovo immunomodulatore IMMUNEPOTENT CRP combinato con un agente chemioterapico ha aumentato il tasso di morte cellulare immunogenica e ha impedito la crescita del melanoma”, Oncology Letters, vol. 14, n. 1, pp. 844-852, 2017.
13 C. A. Sierra Rivera, M. A. Franco Molina, E. Mendoza Gamboa, P. Zapata Benavides, R. S. Tamez Guerra e C. Rodriacute guez Padilla, “Potenziale delle nanoparticelle colloidali o di argento per ridurre la crescita dei tumori del melanoma B16F10”, African Journal of Microbiology Research, vol. 7, n. 22, pp. 2745-2750, 2013.
14 L. M. Valenzuela-Salas, N. G. Girón-Vázquez, J. C. García-Ramos et al., “Effetto antiproliferativo e antitumorale di nanoparticelle d’argento non genotossiche su modelli di melanoma”, Oxidative Medicine and Cellular Longevity, vol. 2019, 12 pagine, 2019.
15 A. L. R. LazarAAn, A. Zugasti Cruz, G A A.¡n. A. de la PeAAa, S. Y. S. Belmares, e C. A. Sierra Rivera, “Effetto citotossico sinergico del dicloroacetato di sodio combinato con farmaci chemioterapici sulla linea cellulare di melanoma murino B16F10”, Biomedical Research, vol. 30, n. 1, 2019.
16 R. B. Mokhtari, T. S. Homayouni, N. Baluch et al., “Combination therapy in combating cancer”, Oncotarget, vol. 8, n. 23, pp. 38022-38043, 2017.
17 A. M. Brotas, J. M. T. Cunha, E. H. J. Lago, C. C. N. Machado e S. C. S. Carneiro, “Tumor necrosis factor-alpha and the cytokine network in psoriasis”, Anais Brasileiros de Dermatologia, vol. 87, no. 5, pp. 673-683, 2012.
18 S. Moretti, C. Pinzi, A. Spallanzani et al., “Evidenza immunoistochimica di reti di citochine durante la progressione di lesioni melanocitarie umane”, International Journal of Cancer, vol. 84, n. 2, pp. 160-168, 1999.
19 S. Rossi, M. Cordella, C. Tabolacci et al., “TNF-alfa e metalloproteasi come attori chiave nell’aggressività delle cellule di melanoma”, Journal of Experimental & Clinical Cancer Research, vol. 37, n. 1, pag. 326, 2018.
20 A. Montfort, C. Colacios, T. Levade, N. Andrieu-Abadie, N. Meyer e B. Ségui, “The TNF paradox in cancer progression and immunotherapy”, Frontiers in Immunology, vol. 10, pag. 1818, 2019.
21 V. A. Soldatenkov, A. Dritschilo, Z. Ronai e S. Y. Fuchs, “L’inibizione della funzione dell’omologo di Slimb (HOS) sensibilizza le cellule di melanoma umano all’apoptosi”, Cancer Research, vol. 59, n. 20, pp. 5085-5088, 1999.
22 C. Wang, M. W. Mayo, R. G. Korneluk, D. V. Goeddel e Baldwin AS Jr, “NF-B antiapoptosi: induzione di TRAF1 e TRAF2 e c-IAP1 e c-IAP2 per sopprimere l’attivazione della caspasi-8”, Science, vol. 281, no. 5383, pp. 1680-1683, 1998.
23 O. Salvucci, M. Carsana, I. Bersani, G. Tragni e A. Anichini, “Ruolo antiapoptotico dell’ossido nitrico endogeno nelle cellule di melanoma umano”, Cancer Research, vol. 61, n. 1, pp. 318-326, 2001.
24 L. Rössig, B. Fichtlscherer, K. Breitschopf et al., “L’ossido nitrico inibisce la caspasi-3 mediante S-nitrosazione in vivo”, The Journal of Biological Chemistry, vol. 274, n. 11, pp. 6823-6826, 1999.
25 B. Rapoport e R. Anderson, “Realizzare il potenziale clinico della morte cellulare immunogenica nella chemioterapia e nella radioterapia del cancro”, International Journal of Molecular Sciences, vol. 20, n. 4, pag. 959, 2019. 4, p. 959, 2019.
26 A. Terenzi, C. Pirker, B. K. Keppler e W. Berger, “Anticancer metal drugs and immunogenic cell death”, Journal of Inorganic Biochemistry, vol. 165, pagg. 71-79, 2016.
27 O. Kepp, L. Menger, E. Vacchelli et al., “Crosstalk between ER stress and immunogenic cell death”, Cytokine & Growth Factor Reviews, vol. 24, no. 4, pp. 311-318, 2013.