Zaida Torres-Cavazos1moisés Armides Franco-Molina2silvia Elena Santana-Krímskaya2cristina Rodríguez-Padilla2jorge Ramsy Kawas-Garza1, Gustavo Hernández-Vidal1, Gustavo Moreno-Degollado1y Diana Elisa Zamora-Ávila1
1 Posgrado Conjunto de las Facultades de Agronomía y Medicina Veterinaria y Zootecnia, Universidad Autónoma de Nuevo León,
Ave. Universidad S/N, Cd. Universitaria, San Nicolás de los Garza, N. L., CP 66455, México
2 Laboratorio de Inmunología y Virología, Unidad C, Facultad de Ciencias Biológicas, Universidad Autónoma de Nuevo León,
Ave. Universidad S/N, Cd. Universitaria, San Nicolás de los Garza, N. L., CP 66455, México
Correspondencia: Moisés Armides Franco-Molina; [email protected]
Recibido: 13 de julio de 2020
Revisado: 28 de septiembre de 2020
Aceptado: 14 de octubre de 2020
Publicado: 7 de noviembre de
Resumen
Nuestro objetivo principal fue evaluar la eficacia de la plata y el dicloroacetato de sodio como agentes de doble función para ser utilizados en el tratamiento del melanoma. Esta estrategia está diseñada para aumentar la actividad de estos dos compuestos que afectan a la integridad del ADN y la mitocondria a diferentes niveles. Además, evaluamos si el mecanismo de muerte celular inducido por nuestros tratamientos era la muerte celular inmunogénica. Para evaluar la eficacia antitumoral, evaluamos el volumen tumoral y la producción de factor de necrosis tumoral-α, factor nuclear κ B (ambos mediante ELISA) y los niveles de óxido nítrico (kit de ensayo colorimétrico de nitrato/nitrito); para la muerte celular inmunogénica, evaluamos la liberación de patrones moleculares asociados al peligro mediante inmunohistoquímica y citometría de flujo, así como un desafío in vivo. Nuestros resultados mostraron que la combinación de plata coloidal y dicloroacetato sódico es más eficaz que cada tratamiento por separado y que el mecanismo antitumoral no es a través de la muerte celular inmunogénica. Además, este estudio puede contribuir ampliamente al desarrollo de nanopartículas de plata cargadas con dicloroacetato y al diseño de formulaciones farmacológicas dirigidas a combatir el melanoma, así como otros tipos de cáncer.
Editor académico: Yanis Toledaño Magaña
Copyright © 2020 Zaida Torres-Cavazos et al. Este es un artículo de acceso abierto distribuido bajo la Licencia de Atribución Creative Commons, que permite su uso, distribución y reproducción sin restricciones en cualquier medio, siempre que se cite adecuadamente el trabajo original.
INTRODUCCIÓN
Las terapias dirigidas han aumentado las posibilidades de supervivencia de las personas con melanoma [1]; sin embargo, las células cancerosas presentes en el tumor favorecen diferentes vías metabólicas [2]; como consecuencia, el tumor acaba haciéndose resistente a las terapias dirigidas, especialmente a las diseñadas contra una única diana [3].
El desarrollo de terapias basadas en la plata es una herramienta prometedora en el tratamiento del cáncer. Los iones de plata y las nanopartículas de plata inducen estrés oxidativo, disfunción de la membrana mitocondrial, daños en el ADN y aumento de las citocinas [4]. El mecanismo de acción exacto varía en función de las propiedades físicas y químicas de la nanopartícula y del tipo de cáncer [5]. Además, el uso clínico de la plata coloidal con fines bactericidas y antivirales demuestra que este tratamiento es seguro [6],
7].
El dicloroacetato sódico (DCA) es un análogo del piruvato que interfiere en la glucólisis asociada al tumor (efecto Warburg), disminuye la malignidad del cáncer y reduce la producción de lactato alterando las vías metabólicas de las células cancerosas [8]. La disminución del lactato contrarresta el estado ácido del microambiente tumoral, reduciendo el crecimiento tumoral y la metástasis [8]. El WZB117, un bis-hidroxibenzoato, la 2-deoxi-d-glucosa, la metformina y el DCA reducen la glucólisis y bloquean la captación de glucosa en las células cancerosas. Bajo niveles bajos de glucosa intracelular, las vías biosintéticas, como la génesis de nucleótidos y aminoácidos, se interrumpen debido a la escasez de moléculas intermedias, lo que pone freno a la proliferación celular. A pesar de su uso como monoterapia o combinado con quimioterapia, se han descrito pocos o ningún efecto adverso [9].
Debido a estas actividades, evaluamos la muerte celular inmunogénica como posible mecanismo de acción, debido al creciente número de estudios que demuestran que los patrones moleculares asociados a peligro (DAMPs) celulares y mitocondriales pueden ser liberados activamente cuando se exponen a estímulos externos [10]. La liberación de alarminas (Hsp70, HSP90, calreticulina, HMGB1, ATP, ADN y ARN) y neoantígenos tumorales induce una respuesta inmunitaria específica del tumor que elimina las células cancerosas vivas y el tejido tumoral residual, evitando la recurrencia del cáncer [11].
El objetivo principal de este estudio era utilizar la plata y el DCA como agentes de doble función que afectan a la integridad del ADN y a la actividad mitocondrial para aumentar la respuesta antitumoral en el tratamiento del melanoma. Además, este estudio podría servir como punto de partida para el siguiente nivel de desarrollo de la formulación farmacológica dirigida de nanopartículas de plata cargadas con dicloroacetato.
Materiales y métodos
Reactivos
La solución de penicilina-estreptomicina, la solución de Ficoll-Hypaque, la solución de tripsina-EDTA, el medio RPMI-1640, el medio Eagle modificado de Dulbecco (DMEM/F-12) y la solución antibiótica-antimicótica al 1% se obtuvieron de Life Technologies GIBCO, Grand Island, NY, EE.UU.. El suero fetal bovino (FBS) se adquirió a Sigma-Aldrich (St. Louis, MO).
Cultivo celular
La línea celular de melanoma murinoB16F10se adquirió a American Type Culture Collection (ATCC, Manassas, VA, EE.UU.). Las células se cultivaron y mantuvieron en medio Dulbecco’s Modified Eagle’s Medium suplementado con un 10% de suero fetal bovino (FBS) y un 1% de solución de penicilina-estreptomicina a 37°C y en una atmósferacon un 5% deCO2.
Viabilidad celular
ells (5 ×103 células/pocillo) se sembraron en placas de 96 pocillos de fondo plano y se incubaron durante 24 h a 37°C en atmósfera deCO2 al 5%. Tras la incubación, se retiró el medio de cultivo y se añadió Ag (0,8mM a 6:5 × 10-5mM) o DCA (75mM/ml a 750mM/ml) diluidos en el mismo medio. A continuación, las placas se incubaron durante 4 h a 37 °C y en una atmósferacon un 5% deCO2. A continuación, se eliminó el sobrenadante y las células se lavaron dos veces con medio DMEM/F-12. La viabilidad celular se determinó por el método de la resazurina (Alamar Blue), y la citotoxicidad se expresó como la concentración del 50% de inhibición del crecimiento celular (LD50). Los resultados se expresaron como la media ± desviación estándar (DE) de tres experimentos independientes. La LD50 de cada tratamiento se utilizó en experimentos posteriores.
Determinación de la muerte celular
Para la determinación de la muerte celular, se siguió la metodología descrita por Rodríguez-Salazar et al. [12]. Brevemente, se sembraron células B16F10 (1 ×105) en placas de 12 pocillos y se cultivaron durante la noche en 5% deCO2 a 37°C. Las células fueron tratadas con AgC (LD50) o DCA (LD50) o una combinación de AgC (LD25) + DCA (LD25) durante 5h. Tras el tratamiento, se recogieron las células, se lavaron con solución salina tamponada con fosfato (PBS) y se resuspendieron en 100μlde tampón de unión 1× (0,1M Hepes pH 7,4, 1,4M NaCl y 25 mM CaCl2; Sigma-Aldrich; Merck KGaA, Darmstadt, Alemania) complementado con Annexin V conjugada con APC (5μl/muestra) y yoduro de propidio (1μl/muestra), se incubaron a 4°C y se mantuvieron en la oscuridad durante 15 min. El análisis por citometría de flujo se realizó con un citómetro Accuri C6; para el análisis de datos se utilizó el software BD Accuri C6 versión 1.0.264.21 (ambos BD Biosciences, San Jose, CA, EE.UU.).
Animales
Ratones hembra C57BL/6 de 6 y 10 semanas de edad con un peso corporal en torno a 23 (±2) g fueron adquiridos en los Laboratorios Harlan (Ciudad de México, México). Los ratones se mantuvieron a 25-29°C y un ciclo de 12h de luz a 12h de oscuridad. Se les proporcionó comida y agua ad libitum. El protocolo experimental fue aprobado por el Comité de Revisión Ética para la Experimentación Animal de la Facultad de Ciencias Biológicas de la Universidad Autónoma de Nuevo León (San Nicolás de los Garza, México).
Implantación de tumores y administración del tratamiento
Los tumores se indujeron por vía subcutánea inyectando 1 x106 células B16F10 en 200 μlde solución salina tamponada con fosfato (PBS). Siete días después del trasplante de células B16F10, apareció una masa tumoral apreciable, y los ratones se distribuyeron aleatoriamente en cuatro grupos (cinco ratones por grupo). El grupo de control recibió únicamente solución salina. El grupo DCA recibió 50mg/kg de DCA, mientras que el grupo Ag recibió 28mg/kg de Ag. La solución salina, la Ag y el DCA se administraron por vía peritumoral, diariamente, durante 21 días. Por último, el grupo Ag + DCA recibió las mismas dosis de Ag y DCA por vía peritumoral en días alternos, alternando los tratamientos. La longitud y la anchura del tumor se midieron semanalmente, y el volumen tumoral se determinó mediante la ecuación L x W2, donde L es el lado más largo y W el lado más corto. Se practicó la eutanasia a los animales al final del estudio (21 días) y se extirparon los tumores para otros experimentos.
ELISA para la subunidad activa NF-κBp65
Para medir la activación de la subunidad NF-κBp65, se prepararon extractos nucleares a partir de 3 x106 células tumorales, utilizando un kit de extracción nuclear de acuerdo con el protocolo del fabricante. Los niveles de concentración nuclear de p65 se determinaron mediante un ensayo ELISA sensible (TRANS-AM, Active Motif, Rixensart, Bélgica).
Producción de TNF-α y NO
Los tumores se maceraron con RPMI y se recogió el sobrenadante, que se ajustó a una concentración de proteína mediante BSA y se almacenó a -20 °C para su evaluación. El TNF-α se midió en el sobrenadante tumoral mediante ensayos inmunoenzimáticos (TNF alpha Mouse ELISA Kit; Invitrogen; Thermo Fisher Scientific; Viena, Austria). Todos los procedimientos de ensayo se realizaron de acuerdo con el protocolo del fabricante.
Se utilizó un kit de ensayo de nitrato/nitrito para medir los niveles de NO en los homogeneizados tisulares del tumor siguiendo el protocolo establecido por el fabricante (kit de ensayo colorimétrico de nitrato/nitrito; Cayman Chemical, EE.UU.).
Inmunocitoquímica para la determinación de HMGB1, HSP70 y HSP90
Se sembraroncélulas(100 x103 células/pocillo) en cubreobjetos de vidrio a 37°C y 5% deCO2 durante 24 horas. A continuación, las células se trataron con Ag LD50 (2,8 x 10-5 mM), DCA LD50 (195 mM), o Ag + DCA LD50 (2,8 x 10-5mM y 135 mM, respectivamente) a 37°C y 5%CO2 durante 4 horas. Posteriormente, las células se fijaron con metanol, se bloquearon con suero de caballo normal (2,5%) (Vector Laboratories, ABC Kit) durante 20 minutos y se incubaron durante 4 horas con anticuerpos monoclonales de ratón de Santa Cruz (Santa Cruz, CA, EE.UU.) contra HMGB1(sc-56698), HSP70 (sc-24) o HSP90 (sc-7947), todos ellos utilizados en una dilución de 1 :1000. A continuación, se incubaron las células con IgG antiratón/conejo biotinilado con HRP (Vector Laboratories, ABC Kit) durante 1 hora y solución de Avidina-DH (Vector Laboratories, ABC Kit) durante 30 minutos; después se añadió DAB (3,3-diaminobencidina). El cromógeno DAB produce una reacción marrón en presencia de peroxidasa (HRP). Los portaobjetos se contrateñían con hematoxilina de Mayer, se deshidrataban en un gradiente de alcohol-xilol y se montaban con Entellan® (resina sintética) en portaobjetos de vidrio. Las células B16F10 no tratadas se utilizaron como control de la expresión basal de HMGB1, HSP70 y HSP90. La expresión de HMGB1, HSP70 y HSP90 (intensidad de la tinción DAB) se realizó utilizando el software Fiji (ImageJ) versión 2.0, tal como describe Patera (2019). Los datos se presentan como densidad óptica DAB (=log (intensidad máxima/intensidad media)) de cinco secciones por portaobjetos. Se realizaron tres experimentos independientes.
Citometría de flujo para la determinación de calreticulina
Las células(50 x103 células/pocillo) se sembraron en placas de 24 pocillos de fijación ultrabaja a 37 °C y 5% deCO2. A continuación, las células se trataron con Ag LD50 (2,8 x 10-5mM), DCA LD50 (195mM), o Ag + DCA LD50 (2,4 x 10-5 mM y 135 mM, respectivamente) a 37°C y 5%CO2 durante 4 horas. Posteriormente, se recuperaron las células y se tiñeron con anticuerpo policlonal de calreticulina conjugado con ficoeritrina durante 1 hora a 37°C y 5%CO2. Las células se lavaron con PBS+albúmina de suero bovino (BSA) (1% ) y se resuspendieron en 200μlde PBS. Los eventos se adquirieron en el citómetro de flujo Accouri C6 (BD Biosciences, San Jose, CA, USA).
Experimentos de vacunación antitumoralin vivo
Para la preparación del lisado celular, seguimos el protocolo descrito por Rodríguez-Salazar et al. [12] con pequeñas modificaciones. Brevemente, células B16F10 (5 x106) fueron tratadas in vitro con Ag (LD50) o DCA (LD50) o la combinación Ag (LD25) + DCA (LD25) durante 5h. A continuación, las células se centrifugaron a 260 × g durante 10 minutos y se lavaron dos veces con PBS. Por último, las células se resuspendieron en 200μlde PBS y se inocularon por vía subcutánea en el flanco izquierdo del ratón. Al cabo de 7 días, los ratones fueron desafiados con 5 x105 células B16F10 vivas resuspendidas en 200 μlde PBS mediante inyección subcutánea en el flanco derecho. La incidencia y el crecimiento del tumor se midieron cada día en los dos puntos de inyección durante 30 días con un calibrador digital. El volumen tumoral se calculó mediante la fórmula: V = (L x W2)/2, donde V es el volumen tumoral, L es la longitud tumoral y W es la anchura tumoral, misma fórmula utilizada previamente por Rodríguez-Salazar et al. [12].
Análisis estadístico
El análisis estadístico se realizó mediante un análisis de varianza unidireccional (ANOVA) seguido de la prueba de Dunnett, a menos que se indique lo contrario. Se consideraron diferencias estadísticamente significativas a . Todos los experimentos se realizaron por triplicado.
Resultados
El DCA-Ag disminuyó la viabilidad celular de las células de melanoma B16F10
El tratamiento con Ag o DCA indujo una disminución de la viabilidad celular de las células B16F10 de forma dependiente de la dosis en comparación con el control (p < 0:01) (Figuras 1(a) y 1(b)). Se determinaron la DL25 (2,4 ×105mM) y la DL50 (2,8 ×105) para el Ag (Figura 1(a)); también se determinaron la DL25 (135mM) y la DL50 (195 mM) para el DCA (Figura 1(b)). Se necesitaron dosis más bajas de Ag y DCA en la configuración combinatoria para alcanzar DL25 y DL50 (Figura 1(c)).
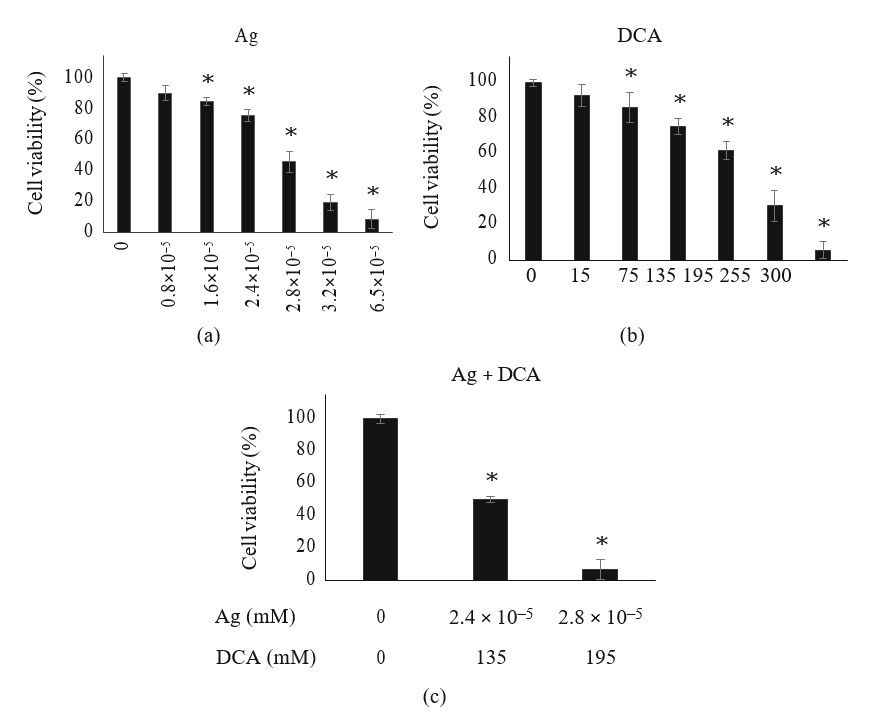
Regresión tumoral inducida por Ag-DCA
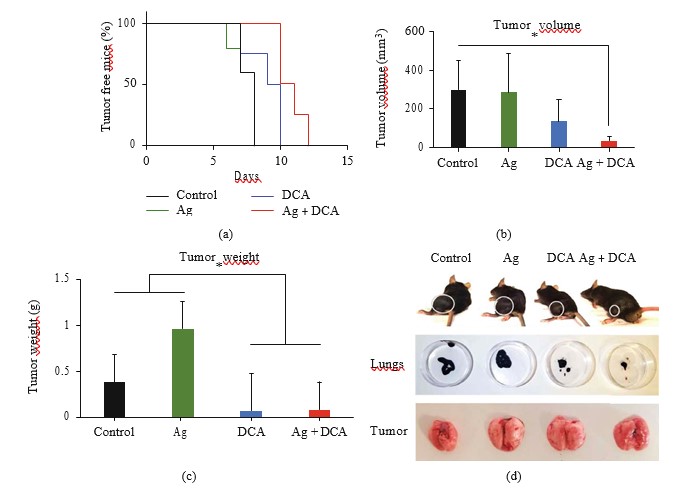
La administración de Ag, DCA y Ag + DCA indujo la regresión del volumen tumoral (p < 0:05) de forma dependiente del tiempo, observándose un mejor efecto en los ratones tratados con Ag + DCA (Figura 2(a)).
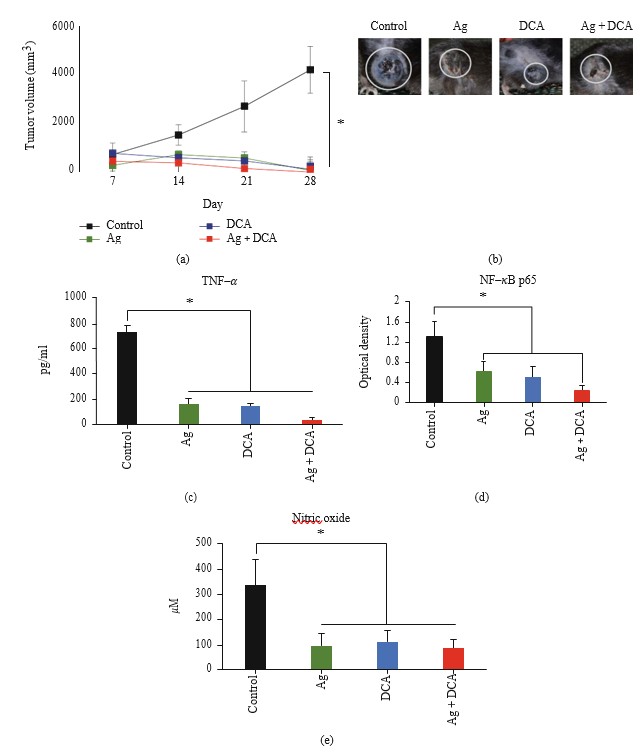
Los tratamientos con Ag, DCA y Ag + DCA disminuyeron la producción de TNF-α, NF-κB y óxido nítrico
Todos los tratamientos disminuyeron significativamente (p < 0:05) la producción de TNF-α (figura 2(c)), la actividad de NFκB (figura 2(d)) y la producción de óxido nítrico (NO) en comparación con el grupo de control; no se observaron diferencias significativas entre los grupos tratados (figuras 2(c)-2(e)).
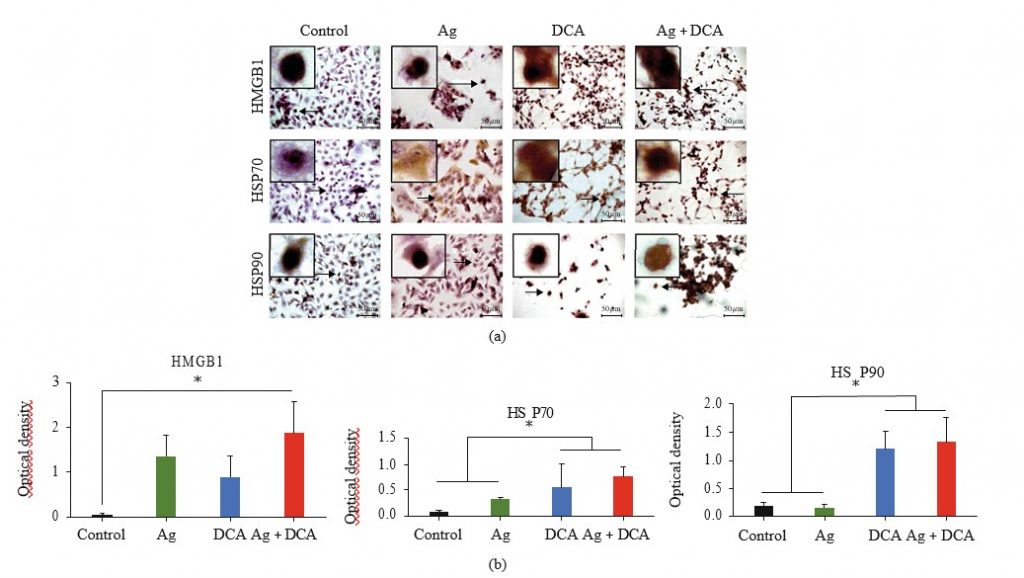
Expresión y localización de HMGB1, HSP70 y HSP90 en células B16F10 tratadas con Ag, DCA o Ag + DCA
La localización deHMGB1, HSP70 y HSP90 se determinó mediante microscopía (Figura 3(a)). En condiciones de control, HMGB1, HSP70 y HSP90 eran indetectables o se localizaban en el núcleo (Figura 3(a)). El tratamiento con Ag movilizó la HSP70 al citoplasma y a la membrana celular, el tratamiento con DCA movilizó la HMGB1 y la HSP70 al citoplasma y a la membrana celular, y el tratamiento combinado con AgDCA movilizó la HMGB1, la HSP70 y la HSP90 al citoplasma y a la membrana celular (Figura 3(a)). Todos los tratamientos aumentaron significativamente (p < 0:05) la expresión de HMGB1 y HSP70; sin embargo, sólo DCA y Ag + DCA aumentaron significativamente (p < 0:05) HSP90, en comparación con el control (células B16F10 no tratadas) (Figura 3(b)).
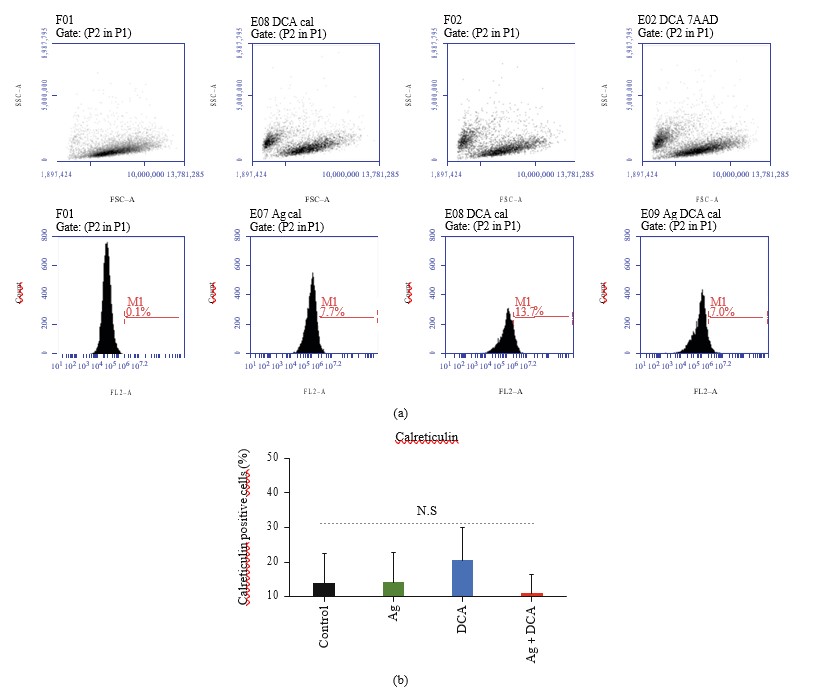
Exposición de la calreticulinaen células tratadas con Ag, DCAoAg + DCA
Los tratamientos con Ag, DCA y Ag + DCA no inducen la exposición de la superficie de la calreticulina en las células B16F10, en comparación con el control (células B16F10 no tratadas) (Figuras 4(a) y 4(b)).
Ag, DCA o Ag + DCA no inducen la muerte celular inmunogénica
Las célulasB16F10lisadas con Ag, DCA y AgDCA no impiden la implantación tumoral en ratones C57BL/6 (Figuras 5(a)-5(d)).
Discusión
Se evaluó el efecto citotóxico de la plata coloidal (Ag), el dicloroacetato sódico (DCA) y su combinación frente a células de melanoma murino B16F10. Nuestros resultados muestran que la Ag tiene efectos antiproliferativos contra las células B16F10, tal y como informó previamente nuestro grupo de investigación [13]. Otros informes sobre la actividad citotóxica de la plata contra células de melanoma se refieren a nanopartículas de plata, aunque el mecanismo de toxicidad propuesto sigue siendo el mismo [14]. El DCA también mostró un efecto antiproliferativo contra las células de melanoma. De forma similar, Rivera-Lazarín et al. informaron de una disminución de la viabilidad dependiente de la dosis en células B16F10 tratadas con DCA [15].
La actividad citotóxica de Ag y DCA aumentó cuando se utilizaron como tratamiento combinado. Esto era de esperar ya que la combinación de dos o más agentes es una piedra angular para el tratamiento del cáncer; permite atacar vías clave simultáneamente, consiguiendo un aumento de la eficacia [16].
Tras observar el aumento del efecto citotóxico, evaluamos si nuestros resultados se correlacionaban con una actividad antitumoral in vivo. A nivel tumoral, se observó la generación de necrosis; cabe mencionar que las lesiones cicatrizaron completamente en todos los casos de eliminación tumoral. Las lesiones cutáneas pueden producirse debido a la sobreexpresión del factor de necrosis tumoral alfa [17]. Nuestros resultados revelaron niveles más altos de TNF-α en melanomas no tratados y una disminución significativa de este factor en respuesta a todos nuestros tratamientos. El TNF-α se correlaciona con la agresividad y el potencial metastásico del melanoma in vivo [18], y Rossi et al. han descrito su sobreexpresión en melanomas primarios avanzados [19].
Es importante mencionar que el TNF-α es una citocina pleiotrópica, y sus efectos proapoptóticos contra las células cancerosas han sido ampliamente descritos [20]; sin embargo, las células de melanoma resisten la apoptosis inducidapor TNF-α a través de NF-κBy óxido nítrico [21].
En este estudio, nuestros resultados mostraron una disminución de NF-κBy óxido nítrico en ratones tratados con Ag, DCA o la combinación de ambos, correlacionándose con la regresión tumoral. Wang et al. informaron de que NF-κBsuprime la apoptosis mediada por TNF-αa través de la activación de las proteínas antiapoptóticas TRAF1, TRAF2, c-IAP1 y c-IAP2 [22]. Por otro lado, Salvucci et al. informaron de la producción de óxido nítrico en células de melanoma humano, y el bloqueo de esta producción induce la muerte celular en el melanoma humano [23]. En concreto, el óxido nítrico inhibe al menos siete caspasas a través de la s-nitrosilación [24]
.
A pesar de nuestras observaciones, es importante mencionar que el TNF-α, el NF-κBy el NO tienen efectos pleiotrópicos, y su papel en el melanoma no se conoce bien. Sin embargo, destacamos que nuestros resultados indican que estas moléculas disminuyen en correlación con la regresión tumoral y la cicatrización de heridas.
Muchas terapias contra el cáncer tienen el potencial de inducir la muerte de las células cancerosas, lo que resulta en la eliminación del tumor y un paciente libre de malignidad. Sin embargo, sólo los inductores inmunogénicos de la muerte celular pueden prevenir la recurrencia del cáncer. Por ello, los fármacos que inducen la muerte celular inmunogénica representan una innovación reciente en el campo de la oncoinmunoterapia [25], como es el caso del uso del inmunomodulador IMMUNEPOTENT CRP, que recientemente ha demostrado esta capacidad [12]. Nos propusimos evaluar si nuestros tratamientos eran capaces de inducir una muerte celular inmunogénica.
La presencia de alarminas in vitro indica el potencial de inducir una muerte celular inmunogénica [26]. Sin embargo, a pesar del aumento dependiente del tratamiento de HMGB1, HSP70 y HSP90 (pero no de calreticulina), la vacunación de ratones con células B16F10 lisadas con Ag, DCA o la combinación Ag + DCA no indujo la muerte celular inmunogénica, como demuestra la aparición de tumores en todos los ratones (vacunados o no vacunados) tras la exposición a células B16F10 viables. El crecimiento del tumor indica que las vacunas no indujeron una respuesta inmunitaria específica. Una razón para esto podría ser que DCA, Ag y DCA + Ag no inducen la liberación de DAMPs en un patrón espacio-temporal coordinado; por lo tanto, carecen de la capacidad de inducir citoquinas y una presentación eficiente del antígeno [27].
En conclusión, la combinación de Ag y DCA tiene potenciales propiedades antitumorales contra células de melanoma; sin embargo, el mecanismo antitumoral in vivo no es la muerte celular inmunogénica. Es importante realizar más estudios para dilucidar el mecanismo de muerte celular con el fin de diseñar estrategias y combinaciones con eficacia clínica contra el melanoma.
Disponibilidad de datos
Los datos asociados al manuscrito están disponibles previa solicitud razonable.
Conflictos de intereses
Los autores declaran que no existe ningún conflicto de intereses.
Agradecimientos
Este estudio fue apoyado por el Fondo Sectorial de Investigación para la Educación A1-S-35951, CONACYT, México. Agradecemos a MsC. Alejandra Arreola Triana por la revisión del manuscrito.
REFERENCIAS
1 D. B. Johnson y J. A. Sosman, «Update on the targeted therapy of melanoma», Current Treatment Options in Oncology, vol. 14, no. 2, pp. 280-292, 2013.
2 E. A. Zaal y C. R. Berkers, «The influence of metabolism on drug response in cancer», Frontiers in Oncology, vol. 8, p. 500, 2018.
3 Z.-F. Lim y P. C. Ma, «Emerging insights of tumor heterogeneity and drug resistance mechanisms in lung cancer targeted therapy», Journal of Hematology & Oncology, vol. 12, n.º 1, p. 134, 2019.
4 V. De Matteis, M. Cascione, C. Toma, y S. Leporatti, «Silver nanoparticles: synthetic routes, in vitro toxicity and theranostic applications for cancer disease», Nanomaterials, vol. 8, no. 5, p. 319, 2018.
5 N. Durán, W. J. Fávaro y A. B. Seabra, «¿Qué sabemos realmente sobre nanotoxicología de nanopartículas de plata in vivo? New aspects, possible mechanisms, and perspectives», Current Nanoscience, vol. 16, no. 3, pp. 292-320, 2020.
6 M. Ahamed, M. S. AlSalhi y M. K. J. Siddiqui, «Silver nanoparticle applications and human health», Clinica Chimica Acta, vol. 411, nº 23-24, pp. 1841-1848, 2010.
7 K. Habiba, K. Aziz, K. Sanders y otros, «Enhancing colorectal cancer radiation therapy efficacy using silver nanoprisms decorated with graphene as radiosensitizers», Scientific Reports, vol. 9, n.º 1, p. 17120, 2019.
8 T. Tataranni y C. Piccoli, «Dicloroacetato (DCA) y cáncer: una visión general hacia las aplicaciones clínicas», Medicina oxidativa y longevidad celular, vol. 2019, 14 páginas, 2019.
9 S. Pustylnikov, F. Costabile, S. Beghi y A. Facciabene, «Targeting mitochondria in cancer: current concepts and immunotherapy approaches», Translational Research, vol. 202, págs. 35-51, 2018.
10 S. Grazioli y J. Pugin, «Mitochondrial damage-associated molecular patterns: from inflammatory signaling to human diseases», Frontiers in Immunology, vol. 9, pág. 832, 2018.
11 Y. Nie, D. Yang y J. J. Oppenheim, «Alarmins and antitumor immunity», Clinical Therapeutics, vol. 38, no. 5, pp. 1042-1053, 2016.
12 M. Rodríguez-Salazar, M. A. Franco-Molina, E. Mendoza-Gamboa et al., «The novel immunomodulator IMMUNEPOTENT CRP combined with chemotherapy agent increased the rate of immunogenic cell death and prevented melanoma growth,» Oncology Letters, vol. 14, n.º 1, pp. 844-852, 2017.
13 C. A. Sierra Rivera, M. A. Franco Molina, E. Mendoza Gamboa, P. Zapata Benavides, R. S. Tamez Guerra, y C. Rodriacute guez Padilla, «Potential of colloidal or silver nanoparticles to reduce the growth of B16F10 melanoma tumors,» African Journal of Microbiology Research, vol. 7, no. 22, pp. 2745-2750, 2013.
14 L. M. Valenzuela-Salas, N. G. Girón-Vázquez, J. C. García-Ramos et al., «Antiproliferative and antitumour effect of nongenotoxic silver nanoparticles on melanoma models,» Oxidative Medicine and Cellular Longevity, vol. 2019, 12 páginas, 2019.
15 A. L. R. LazarAAn, A. Zugasti Cruz, G A.¡n. A. de la PeAAa, S. Y. S. Belmares, y C. A. Sierra Rivera, «Synergistic cytotoxic effect of sodium dichloroacetate combined with chemotherapeutic drugs on B16F10 murine melanoma cell line,» Biomedical Research, vol. 30, n.º 1, 2019.
16 R. B. Mokhtari, T. S. Homayouni, N. Baluch y otros, «Combination therapy in combating cancer», Oncotarget, vol. 8, n.º 23, pp. 38022-38043, 2017.
17 A. M. Brotas, J. M. T. Cunha, E. H. J. Lago, C. C. N. Machado y S. C. S. Carneiro, «Tumor necrosis factor-alpha and the cytokine network in psoriasis», Anais Brasileiros de Dermatologia, vol. 87, no. 5, pp. 673-683, 2012.
18 S. Moretti, C. Pinzi, A. Spallanzani et al., «Immunohistochemical evidence of cytokine networks during progression of human melanocytic lesions,» International Journal of Cancer, vol. 84, no. 2, pp. 160-168, 1999.
19 S. Rossi, M. Cordella, C. Tabolacci y otros, «TNF-alfa y metaloproteasas como actores clave en la agresividad de las células de melanoma», Journal of Experimental & Clinical Cancer Research, vol. 37, n.º 1, p. 326, 2018.
20 A. Montfort, C. Colacios, T. Levade, N. Andrieu-Abadie, N. Meyer y B. Ségui, «The TNF paradox in cancer progression and immunotherapy», Frontiers in Immunology, vol. 10, p. 1818, 2019.
21 V. A. Soldatenkov, A. Dritschilo, Z. Ronai y S. Y. Fuchs, «Inhibition of homologue of Slimb (HOS) function sensitizes human melanoma cells for apoptosis», Cancer Research, vol. 59, nº 20, pp. 5085-5088, 1999.
22 C. Wang, M. W. Mayo, R. G. Korneluk, D. V. Goeddel, y Baldwin AS Jr, «NF-B antiapoptosis: induction of TRAF1 and TRAF2 and c-IAP1 and c-IAP2 to suppress caspase-8 activation,» Science, vol. 281, no. 5383, pp. 1680-1683, 1998.
23 O. Salvucci, M. Carsana, I. Bersani, G. Tragni y A. Anichini, «Antiapoptotic role of endogenous nitric oxide in human melanoma cells», Cancer Research, vol. 61, nº 1, pp. 318-326, 2001.
24 L. Rössig, B. Fichtlscherer, K. Breitschopf et al., «Nitric oxide inhibits caspase-3 by S -nitrosation in vivo,» The Journal of Biological Chemistry, vol. 274, nº 11, pp. 6823-6826, 1999.
25 B. Rapoport y R. Anderson, «Realizing the clinical potential of immunogenic cell death in cancer chemotherapy and radiotherapy», International Journal of Molecular Sciences, vol. 20, no. 4, p. 959, 2019.
26 A. Terenzi, C. Pirker, B. K. Keppler y W. Berger, «Anticancer metal drugs and immunogenic cell death», Journal of Inorganic Biochemistry, vol. 165, pp. 71-79, 2016.
27 O. Kepp, L. Menger, E. Vacchelli et al., «Crosstalk between ER stress and immunogenic cell death,» Cytokine & Growth Factor Reviews, vol. 24, no. 4, pp. 311-318, 2013.