TATSUAKI ISHIGURO1,2, MIYU ISHIGURO1, RYUMEI ISHIGURO1 und SAYURI IWAI1*
1 Abteilung für experimentelle Therapeutika, Kamui Medical Co., Ltd., Tokio 11200022
Hibiya Uchisaiwaicho Klinik, Tokio 1050004, Japan.
Korrespondenz: Dr. Tatsuaki Ishiguro, Kamui Medical Co., Ltd, 2-20-13 Koishikawa Bunkyo-ku, Tokio 1120002, JapanE-Mail
:
[email protected]: 14. November 2011
Akzeptiert: 28. Dezember 2011DOI
: 10.3892/ol.2012.552
Zusammenfassung
Es wurde berichtet, dass die Behandlung von Krebszellen mit Dichloracetat (DCA), einer zugelassenen Behandlung für angeborene Laktatazidose, den Warburg-Effekt umkehrt und das Tumorwachstum hemmt). Außerdem ist Omeprazol (OMP) ein bekannter Wirkstoff, der die Wirkung von Krebsmedikamenten verstärkt. Ziel dieser Studie war es, klinisch eingesetzte Arzneimittel zu finden, die die Wirkung von DCA verstärken. Die Kombination von DCA und OMP zeigte bei HT1080-Fibrosarkomzellen und RKO-Kolonkarzinomzellen eine stärkere Antitumorwirkung als DCA allein, während die Medikamente die Proliferation menschlicher WI-38-Fibroblasten nicht beeinträchtigten. Die hemmende Wirkung von DCA in Kombination mit OMP wurde durch Vitamin E und Z-VAD-FMK aufgehoben; daher wurde die konventionelle kaspaseabhängige Hemmung des Zellwachstums durch Superoxidproduktion als Mechanismus für die Hemmung vorgeschlagen. Die Kombination dieser Medikamente hatte auch eine Wirkung auf HT1080-Fibrosarkomzellen, die Mäusen eingeimpft wurden. Da OMP und DCA oral verabreicht werden können und seit mehreren Jahren ohne größere Nebenwirkungen klinisch eingesetzt werden, glauben wir, dass diese Kombinationstherapie ohne weiteres zur Behandlung bösartiger Tumore eingesetzt werden könnte.
Schlüsselwörter: Fibrosarkom, Dickdarmkrebs, Dichloracetat, OmeprazolAbkürzungen
: DCA, Dichloracetat; PPI, Protonenpumpeninhibitor; OMP, Omeprazol; SOD, Superoxid; ROS, reaktive Sauerstoffspezies
Einleitung
Warburg stellte erstmals fest, dass Krebszellen auch in Gegenwart von ausreichend Sauerstoff bevorzugt Glukose verstoffwechseln und Milchsäure produzieren [1-4]. Der damit einhergehende Anstieg der Glukoseaufnahme kann klinisch für den Nachweis der meisten soliden bösartigen Tumoren mittels Fluordesoxyglukose-Positronenemissionstomographie (FDG-PET) genutzt werden. Ein möglicher Grund dafür, dass Krebserkrankungen diesen im Vergleich zur oxidativen Phosphorylierung weniger effizienten Weg zur Herstellung von Adenosintriphosphat (ATP) wählen, ist sein Vorteil für das Überleben und die Vermehrung in der einzigartigen hypoxischen Tumorumgebung [5]. Diese Vorliebe für die anaerobe Atmung wird auch als Grund für die Resistenz von Krebszellen gegenüber Krebsmedikamenten angesehen, die die Apoptose über den mitochondrialen Weg auslösen. Bonnet et al. haben berichtet, dass die Behandlung von Krebszellen mit Dichloracetat (DCA), einer zugelassenen Behandlung für kongenitale Laktatazidose, den Warburg-Effekt umkehrt und das Tumorwachstum hemmt (3,4,6-8). DCA erhöht den Fluss von Pyruvat in die Mitochondrien durch Hemmung der Pyruvat-Dehydrogenase-Kinase und fördert die Glukoseoxidation gegenüber der Glykolyse. Infolgedessen verringert DCA die Produktion von Milchsäure durch den Tumor und erhöht den intrazellulären pH-Wert. DCA induziert die Apoptose über zwei Wege, einen in den Mitochondrien, wo die Depolarisierung und die Produktion von Superoxid (SOD) die mitochondrienabhängige Apoptose aktiviert, und den anderen auf der plasmalemmalen Ebene, wo die Aktivierung/Umregulierung der Kv1.5-Kanäle den (K+)i verringert und die Caspasen aktiviert [6]. DCA ist ein vielversprechendes Krebsmedikament, da es bequem oral eingenommen werden kann, wenig kostet, kaum Nebenwirkungen hat und seit langem klinisch eingesetzt wird [7,8]. Obwohl es eine vielversprechende Behandlung für bösartige Tumore zu sein scheint, ist seine Wirkung in den laufenden Berichten über klinische Studien begrenzt. Daher suchten wir nach klinisch verwendeten Medikamenten, die die Wirkung von DCA verstärken.
Omeprazol (OMP) ist ein Protonenpumpeninhibitor (PPI) und ist ebenfalls dafür bekannt, die Wirkung von Krebsmedikamenten zu verstärken [9]. OMP hemmt nicht nur die Aktivität der V-ATPase, sondern zielt auch auf die Magensäurepumpe ab. Es wurde berichtet, dass es die Proliferation von Tumorzellen hemmt, möglicherweise durch Alkalisierung der Lysosomen und Permeabilisierung der Lysosomenmembranen, gefolgt von der Produktion reaktiver Sauerstoffspezies (ROS) [10,11].
Wie beschrieben, hemmen DCA und OMP das Wachstum von Tumorzellen über den gemeinsamen Weg der ROS-Produktion durch Beeinflussung des intrazellulären pH-Werts. Da diese beiden Medikamente klinisch mit geringen Nebenwirkungen eingesetzt werden, glauben wir, dass ihre Kombination ein vielversprechendes Protokoll für die Krebsbehandlung darstellt.
Materialien und Methoden
Chemikalien
DCA und Vitamin E (Tocopherolacetat) wurden von Wako Chemical Industries, Ltd. (Tokio, Japan) erworben. OMP wurde von Astra Zeneca Japan (Osaka, Japan) erworben. Z-VAD-FMK wurde vom Peptide Institute, Inc. (Osaka, Japan) erworben.
Zellkultur
Humane Fibrosarkomzellen HT1080, humane Fibroblastenzellen WI-38 und Kolonkarzinomzellen RKO wurden in modifiziertem Dulbecco-Eagle-Medium mit 10 % fötalem Rinderserum (FBS) ausgesät und in einem Inkubator bei 37 °C und 5 %CO2 gezüchtet. Für die Zellproliferationsversuche wurden die Zellen in 12-Well-Platten ausgesät und unter den gleichen Bedingungen bebrütet. Nach 7 Tagen wurden die Zellen mit Trypsin-EDTA behandelt und unter einem Mikroskop gezählt.
Tierversuche
HT1080-Zellen (5×106 ) wurden subkutan in Nacktmäuse (8w weiblich) injiziert. Die Medikamente wurden dem Trinkwasser zugesetzt, um eine Tagesdosis zu erreichen, die der klinisch verwendeten entspricht (DCA 50 mg/kg, OMP 2 mg/kg). Die Größe jedes Tumors wurde mit einer Schieblehre gemessen, und das Tumorvolumen wurde durch Multiplikation von drei Durchmessern berechnet.
Ergebnisse
Diekombinierte Behandlung mit DCA und OMP hemmte die Zellproliferation
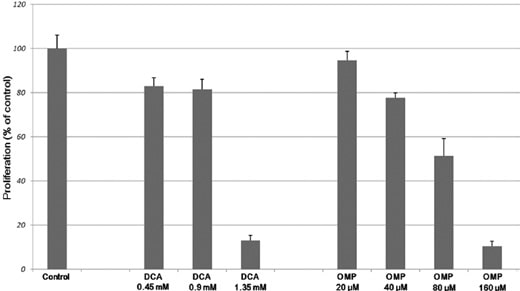
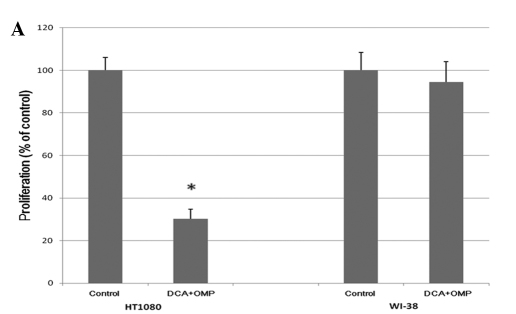
Die menschlichen Fibrosarkomzellen HT1080 wurden 7 Tage lang mit steigenden Konzentrationen von DCA und OMP kultiviert, was zu einer dosisabhängigen Hemmung der Proliferation führte (Abb. 1). Wie in Abb. 2A gezeigt, blockierte die Kombination von DCA und OMP die Proliferation von HT1080-Fibrosarkomzellen deutlich, während dieselbe Kombination die Proliferation von normalen menschlichen WI-38-Fibroblastenzellen nicht beeinträchtigte.
 |  |
Vitamin E hemmte die Wirkung von DCA und OMP
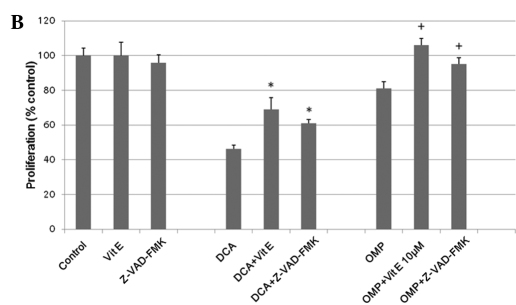
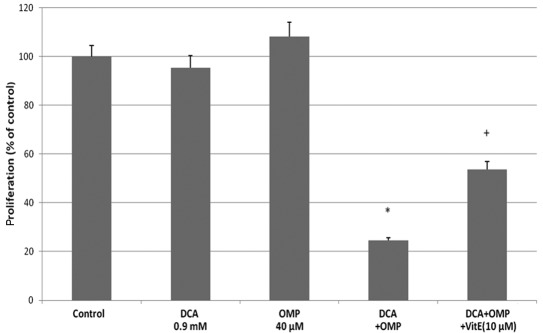
Obwohl der Mechanismus der kaspaseabhängigen Zellwachstumshemmung durch OMP umstritten ist [10,11]wurde berichtet, dass DCA und OMP das Wachstum von Tumorzellen durch die Produktion von SODs hemmen (6,10). Um festzustellen, ob derselbe Mechanismus bei den HT1080-Fibrosarkomzellen zum Tragen kommt, haben wir Vitamin E als SOD-Inhibitor eingesetzt. Vitamin E hemmte erfolgreich die Wirkungen von DCA und OMP, so dass davon auszugehen ist, dass die SOD-Produktion an der Hemmung des Tumorzellwachstums beteiligt ist (Abb. 2B). Der Pan-Caspase-Inhibitor Z-VAD-FMK hemmte ebenfalls die Wirkungen dieser Medikamente; daher wurde angenommen, dass ein Caspase-abhängiger Antitumor-Mechanismus zumindest teilweise an diesen Prozessen beteiligt ist (Abb. 2B). Zusammengenommen hemmen DCA und OMP das Wachstum von HT1080-Fibrosarkomzellen, möglicherweise über einen Caspase-abhängigen Weg durch die SOD-Produktion. Infolgedessen könnten die Medikamente in Kombination eine synergistische Wirkung aufweisen. Dieser synergistische Effekt und die hemmende Wirkung von Vitamin E wurden auch bei RKO-Kolonkrebszellen beobachtet (Abb. 3).
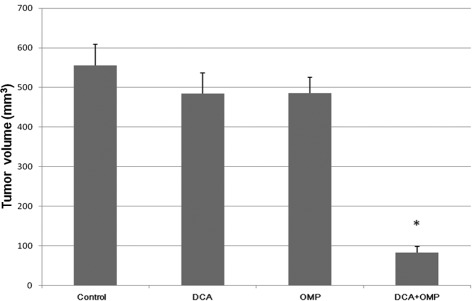
Wir führten Tierversuche durch, um die Auswirkungen von DCA und OMP in vivo zu untersuchen.
Wiein Abb. 4 gezeigt, war die Antitumorwirkung der Kombination von DCA und OMP ebenfalls größer als die eines der beiden Medikamente allein.
Diskussion
Wir haben gezeigt, dass eine kombinierte Behandlung mit DCA und OMP bei menschlichen Fibrosarkomzellen (HT1080) und Dickdarmkrebszellen (RKO) wirksamer ist als die Behandlung mit einem der beiden Medikamente allein. Die kombinierte Therapie war auch in Tierversuchen wirksam.
DCA und OMP werden seit einigen Jahren sicher verwendet, sind aber nicht als Krebsmedikamente eingestuft. DCA wurde zur Behandlung angeborener metabolischer Azidose und OMP zur Behandlung säurebedingter Krankheiten eingesetzt, beides ohne größere Nebenwirkungen [7,8,12,13]. Es wird erwartet, dass die Kombination von DCA und OMP die erforderliche Dosis jedes einzelnen Arzneimittels und die damit verbundenen Risiken verringert.
Orale Dosen von 20 mg OMP einmal täglich führen Berichten zufolge bei Patienten zu einer maximalen Plasmakonzentration von ~2,5 µg/ml (7 µM) 2 Stunden nach Verabreichung der Dosis[14]. Eine Dosis von 120 mg OMP dreimal täglich wurde zur Behandlung des Zollinger-Ellison-Syndroms eingesetzt, wobei selbst bei langfristiger Anwendung nur seltene und leichte Nebenwirkungen auftraten [15,16]. Diese Dosis entspricht einer hypothetischen In-vivo-Spitzenkonzentration von ~15 µg/ml (42 µM). Überdosierungen von bis zu 2.400 mg [eine hypothetische Plasmaspitzenkonzentration von 300 µg/ml (840 µM)] wurden mit geringen Nebenwirkungen vertragen [17]. DCA ist in der klinischen Praxis bereits etabliert. Der Cmax-Wert von DCA bei Erwachsenen nach 6 Monaten kontinuierlicher Behandlung (orale Dosen von 25 mg/kg/Tag) betrug 53±18 µg/ml (0,35±0,12 mM) [18]. Die Patienten wurden sicher chronisch mit DCA in der Höchstdosis von 50 mg/kg/Tag behandelt [19]. Eine Reihe von Kindern mit Laktatazidose erhielten über einen langen Zeitraum hinweg täglich >100 mg/kg DCA (8). Aufgrund dieser Daten gehen wir davon aus, dass die erforderliche Dosis der beiden Arzneimittel vertretbar ist. Außerdem wurden Analoga von DCA mit geringerer Toxizität und besserer Bindungsaffinität entwickelt [20]. Daher wird die Kombination von DCA und OMP als potenzielle therapeutische Option für bösartige Tumore angesehen und könnte zur Entwicklung einer neuen therapeutischen Strategie führen.
REFERENZEN
1 Warburg O: Ueber den Stoffwechsel der Tumoren, Constable, London, 1930.2 Warburg O: Über den Ursprung der Krebszellen. Wissenschaft 123: 309-314, 1956.
3 Hsu PP und Sabatini DM: Cancer cell metabolism: Warburg und darüber hinaus. Zelle 134: 703-707, 2008.
4 Michelakis ED, Webster L und Mackey LR: Dichloracetat (DCA) als potenzielle metabolische Zieltherapie für Krebs. Br J Cancer 99: 989-994, 2008.
5 Plas DR und Thompson CB: Cell metabolism in the regulation of programmed cell death. Trends Endocrinol Metab 13: 75-78, 2002.
6 Bonnet S, Archer SL, Allalunis-Turner J, Haromy A, Beaulieu C, Thompson R, Lee CT, Lopaschuk GD, Puttagunta L, Bonnet S, et al: A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth. Krebszelle 11: 37-51, 2007.
7 Stacpoole PW: The pharmacology of dichloroacetate. Stoffwechsel 38: 1124-1144, 2006.
8 Stacpoole PW, Gilbert LR, Neiberger RE, Carney PR, Valenstein E, Theriaque DW und Shuster JJ: Evaluation of long-term treatment of children with congenital lactic acidosis with dichloroacetate. Pediatrics 121: 1223-1228, 2008.
9 Luciani F, Spada M, Milito AD, Molinari A, Rivoltini L, Montinaro A, Marra M, Lugini L, Logozzi M, Lozupone F, et al: Effect of proton pump inhibitor pretreatment on resistance of solid tumors to cytotoxic drugs. J Natl Cancer Inst 96: 1702-1713, 2004.
10 Milito AD, Iessi E, Logozzi M, Lozupone F, Spada M, Marino ML, Federici C, Perdicchio M, Matarrese P, Lugini L, et al: Protonenpumpeninhibitoren induzieren die Apoptose menschlicher B-Zell-Tumoren durch einen Caspase-unabhängigen Mechanismus, an dem reaktive Sauerstoffspezies beteiligt sind. Cancer Res 67: 5408-5417, 2007.
11 De Milito A, Canese R, Marino ML, Borghi M, Iero M, Villa A, Venturi G, Lozupone F, Iessi E, Logozzi M, et al: pH-abhängige Antitumoraktivität von Protonenpumpeninhibitoren gegen humane Melanome wird durch die Hemmung des Säuregehalts im Tumor vermittelt. Int J Cancer 27: 207-219, 2010.
12 Michelakis ED, Sutendra G, Dromparis P, Webster L, Haromy A, Niven E, Maguire C, Gammer TL, Mackey JR, Fulton D, et al: Metabolic modulation of glioblastoma with dichloroacetate. Sci Trasl Med 2: 31-34, 2010.
13 Shi S und Klotz U: Protonenpumpeninhibitoren: eine Aktualisierung ihrer klinischen Anwendung und Pharmakokinetik. Eur J Clin Pharmacol 64: 935-951, 2008.
14 Katagiri F, Inoue S, Itoh H und Takayema M: Omeprazol erhöht Somatostatin und Motilin im menschlichen Plasma. Biol Pharm Bull 28: 370-372, 2005.
15 Frucht H, Maton PN und Jensen RT: Verwendung von Omeprazol bei Patienten mit Zollinger-Ellison-Syndrom. Dig Dis Sci 36: 394-404, 1991.
16 Thomson ABR, Sauve MD, Kassam N und Kamitakahara H: Safety of the long-term use of proton pump inhibitors. World J Gastroenterol 16: 2323-2330, 2010.
17 Udelnow A, Kreyes A, Ellinger S, Landfester K, Walther P, Klapperstueck T, Wohlrab J, Henne-Bruns D, Knippschild U und Würl P: Omeprazol hemmt die Proliferation und moduliert die Autophagie in Pankreaskrebszellen. PLoS One 6: e20143, 2011.
18 Shroads AL, Guo X, Dixit V, Liu HP, James MO und Stacpoole PW: Age-dependent kinetics and metabolism of dichloroacetate: possible relevance to toxicity. J Pharmacol Exp Ther 324: 1163-1171, 2008.
19 Stacpoole PW, Henderson GN, Yan Z, Cornett R und James MO: Pharmakokinetik, Metabolismus und Toxikologie von Dichloro-Acetat. Drug Metab Rev 30: 499-539, 1998.
20 Subramanian K und Ramaian AS: Development of a less toxic dichloroacetate analog by docking and descriptor analysis. Bioinformation 5: 73-76, 2010.