TATSUAKI ISHIGURO1,2, MIYU ISHIGURO1, RYUMEI ISHIGURO1 et SAYURI IWAI1*
1 Département de thérapeutique expérimentale, Kamui Medical Co., Ltd, Tokyo 1120002
2 CliniqueHibiya Uchisaiwaicho, Tokyo 1050004, Japon.
Correspondance : Dr Tatsuaki Ishiguro, Kamui Medical Co., Ltd, 2-20-13 Koishikawa Bunkyo-ku, Tokyo 1120002, Japon
Courriel : [email protected]
Reçu : 14 novembre 2011
Accepté : 28 décembre 2011
DOI : 10.3892/ol.2012.552
Résumé
Il a été rapporté que le traitement des cellules cancéreuses avec du dichloroacétate (DCA), un traitement approuvé pour l’acidose lactique congénitale, inverse l’effet Warburg et inhibe la croissance tumorale). En outre, l’oméprazole (OMP) est un agent bien connu qui renforce les effets des médicaments anticancéreux. L’objectif de cette étude était de trouver des médicaments utilisés en clinique qui renforcent les effets du DCA. L’association de DCA et d’OMP a présenté une activité antitumorale plus puissante que le DCA seul dans les cellules de fibrosarcome HT1080 et les cellules cancéreuses du côlon RKO, tandis que les médicaments n’ont pas affecté la prolifération des fibroblastes humains WI-38. L’effet inhibiteur du DCA combiné à l’OMP a été inversé par la vitamine E et le Z-VAD-FMK ; par conséquent, l’inhibition classique de la croissance cellulaire dépendante de la caspase par la production de superoxyde a été suggérée comme mécanisme d’inhibition. L’association de ces médicaments a également eu un effet sur les cellules de fibrosarcome HT1080 inoculées à des souris. Étant donné que l’OMP et le DCA peuvent être administrés par voie orale et qu’ils sont utilisés cliniquement depuis plusieurs années sans effets secondaires majeurs, nous pensons que cette thérapie combinée pourrait être facilement appliquée au traitement des tumeurs malignes.
Mots-clés : fibrosarcome, cancer du côlon, dichloroacétate, oméprazole
Abréviations : DCA, dichloroacétate ; PPI, inhibiteur de la pompe à protons ; OMP, oméprazole ; SOD, superoxyde ; ROS, espèces réactives de l’oxygène
Introduction
Warburg a été le premier à observer que, même en présence d’une quantité suffisante d’oxygène, les cellules cancéreuses préfèrent métaboliser le glucose et produire de l’acide lactique [1-4]. L’augmentation concomitante de l’absorption du glucose peut être exploitée cliniquement pour la détection de la plupart des tumeurs malignes solides par tomographie par émission de positons au fluorodésoxyglucose (FDG-PET). L’une des raisons possibles pour lesquelles les cancers adoptent cette voie moins efficace pour produire de l’adénosine triphosphate (ATP) par rapport à la phosphorylation oxydative est son avantage pour la survie et la prolifération dans l’environnement hypoxique unique des tumeurs [5]. Cette préférence pour la respiration anaérobie est également considérée comme la raison de la résistance des cellules cancéreuses aux médicaments anticancéreux qui induisent l’apoptose par la voie mitochondriale. Bonnet et al ont signalé que le traitement des cellules cancéreuses avec du dichloroacétate (DCA), un traitement approuvé pour l’acidose lactique congénitale, inverse l’effet Warburg et inhibe la croissance tumorale (3,4,6-8). Le DCA augmente le flux de pyruvate dans les mitochondries en inhibant la pyruvate déshydrogénase kinase et favorise l’oxydation du glucose par rapport à la glycolyse. En conséquence, le DCA diminue la production d’acide lactique par la tumeur et augmente le pH intracellulaire. Le DCA induit l’apoptose par deux voies, l’une dans les mitochondries, où la dépolarisation et la production de superoxyde (SOD) activent l’apoptose dépendante des mitochondries, et l’autre au niveau plasmalemal, où l’activation/régulation des canaux Kv1.5 diminue le (K+)i, activant les caspases [6]. Le DCA est un médicament anticancéreux prometteur en raison de la commodité de son administration orale, de son faible coût, de ses effets secondaires limités et de sa longue expérience d’utilisation clinique [7,8]. Bien qu’il semble être un traitement prometteur pour les tumeurs malignes, son effet est limité dans un rapport continu d’essais cliniques. Nous avons donc cherché à trouver des médicaments utilisés en clinique qui renforcent les effets du DCA.
L’oméprazole (OMP) est un inhibiteur de la pompe à protons (IPP) et est également connu pour renforcer les effets des médicaments anticancéreux [9]. L’OMP inhibe l’activité de la V-ATPase en plus de cibler la pompe à acide gastrique. Il a été signalé qu’il inhibe la prolifération des cellules tumorales, probablement par l’alcalinisation des lysosomes et la perméabilisation des membranes des lysosomes, suivies par la production d’espèces réactives de l’oxygène (ROS) [10,11].
Comme décrit, on pense que le DCA et l’OMP inhibent la croissance des cellules tumorales par la voie commune de la production de ROS en influençant les niveaux de pH intracellulaire. Comme ces deux médicaments sont utilisés en clinique avec des effets secondaires mineurs, nous pensons que leur combinaison est un protocole prometteur pour le traitement du cancer.
Matériel et méthodes
Produits chimiques
Le DCA et la vitamine E (acétate de tocophérol) ont été achetés auprès de Wako Chemical Industries, Ltd. (Tokyo, Japon). L’OMP a été acheté auprès d’Astra Zeneca Japan (Osaka, Japon). Le Z-VAD-FMK a été acheté auprès du Peptide Institute, Inc. (Osaka, Japon).
Culture cellulaire
Les cellules de fibrosarcome humain HT1080, les cellules de fibroblastes humains WI-38 et les cellules de cancer du côlon RKO ont été ensemencées et cultivées dans du milieu Eagle modifié de Dulbecco contenant 10 % de sérum bovin fœtal (FBS) et maintenues dans un incubateur à 37˚C et 5 % deCO2. Pour les expériences de prolifération cellulaire, les cellules ont été ensemencées dans des plaques à 12 puits et incubées dans les mêmes conditions. Après 7 jours, les cellules ont été traitées avec de la trypsine-EDTA et comptées au microscope.
Expériences animales
Les cellules HT1080 (5×106 ) ont été inoculées par voie sous-cutanée à des souris nude (femelles 8w). Les médicaments ont été ajoutés à l’eau de boisson afin d’obtenir une dose quotidienne similaire à celle utilisée en clinique (DCA 50 mg/kg, OMP 2 mg/kg). La taille de chaque tumeur a été mesurée avec un pied à coulisse et le volume tumoral a été calculé par la multiplication de trois diamètres.
Résultats
Le traitement combiné de DCA et d’OMP a inhibé la prolifération cellulaire
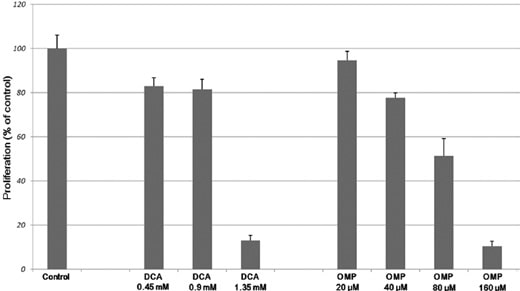
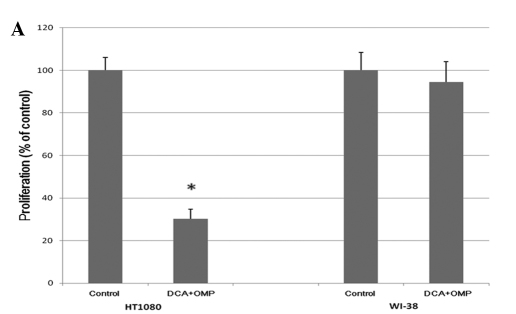
Les cellules de fibrosarcome humain HT1080 ont été cultivées avec des concentrations croissantes de DCA et d’OMP pendant 7 jours, ce qui a entraîné une inhibition dose-dépendante de la prolifération (Fig. 1). Comme le montre la figure 2A, la combinaison de DCA et d’OMP a bloqué de façon marquée la prolifération des cellules de fibrosarcome HT1080, alors que la même combinaison n’a pas affecté la prolifération des cellules de fibroblastes humains normaux WI-38.
 |  |
La vitamine E a inhibé les effets du DCA et de l’OMP
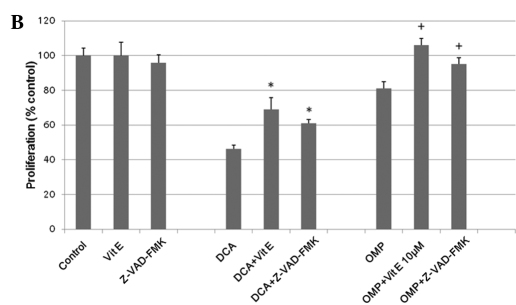
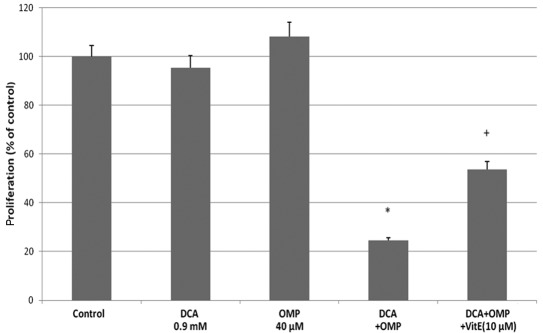
Bien que le mécanisme d’inhibition de la croissance cellulaire dépendant de la caspase par l’OMP ait fait l’objet de controverses [10,11], le DCA et l’OMP ont été signalés comme inhibant la croissance des cellules tumorales par la production de SOD (6,10). Pour déterminer si le même mécanisme s’applique aux cellules de fibrosarcome HT1080, nous avons utilisé la vitamine E comme inhibiteur de la SOD. La vitamine E a réussi à inhiber les effets du DCA et de l’OMP, et on pense donc que la production de SOD est impliquée dans l’inhibition de la croissance des cellules tumorales (Fig. 2B). L’inhibiteur de la caspase Z-VAD-FMK a également inhibé les effets de ces médicaments ; on pense donc qu’un mécanisme antitumoral dépendant de la caspase est impliqué, au moins en partie, dans ces processus (Fig. 2B). Dans l’ensemble, le DCA et l’OMP inhibent la croissance des cellules de fibrosarcome HT1080, probablement par une voie dépendante des caspases par la production de SOD. Par conséquent, les médicaments peuvent présenter un effet synergique lorsqu’ils sont combinés. Cet effet synergique et l’effet inhibiteur avec la vitamine E ont également été observés dans les cellules cancéreuses du côlon RKO (Fig. 3).
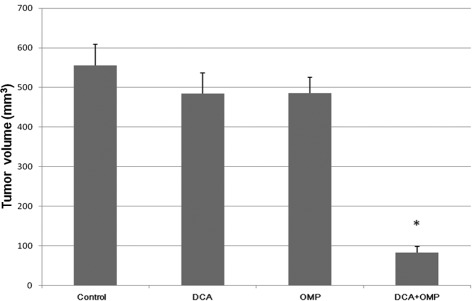
Nous avons réalisé des expériences sur des animaux pour étudier les effets du DCA et de l’OMP in vivo.
Commele montre la figure 4, l’effet antitumoral de l’association du DCA et de l’OMP était également supérieur à celui de l’un ou l’autre des médicaments pris séparément.
Discussion
Nous avons montré qu’un traitement combiné de DCA et d’OMP est plus efficace que le traitement avec l’un ou l’autre médicament seul dans les cellules de fibrosarcome humain HT1080 et les cellules de cancer du côlon RKO. Le traitement combiné a également été efficace dans les expériences sur les animaux.
Le DCA et l’OMP sont utilisés en toute sécurité depuis un certain nombre d’années mais ne sont pas classés comme des médicaments anticancéreux. Le DCA a été utilisé pour traiter l’acidose métabolique congénitale et l’OMP a été utilisé pour traiter les maladies liées à l’acide, tous deux sans effets secondaires majeurs [7,8,12,13]. L’association du DCA et de l’OMP devrait permettre de réduire la dose nécessaire de chaque médicament et les risques qui y sont associés.
On a rapporté que des doses orales de 20 mg d’OMP une fois par jour conduisaient à une concentration plasmatique maximale chez les patients de ~2,5 µg/ml (7 µM) 2 heures après l’administration de la dose[14]. Une dose de 120 mg d’OMP trois fois par jour a été utilisée pour le traitement du syndrome de Zollinger-Ellison, avec seulement des effets secondaires rares et légers, même après une utilisation à long terme [15,16]. Cette dose correspond à une concentration maximale hypothétique in vivo de ~15 µg/ml (42 µM). Des surdoses allant jusqu’à 2 400 mg [une concentration plasmatique maximale hypothétique de 300 µg/ml (840 µM)] ont été tolérées avec des effets secondaires mineurs [17]. Le DCA est déjà établi dans la pratique clinique. La valeur Cmax du DCA chez les adultes après 6 mois de traitement continu (doses orales de 25 mg/kg/jour) était de 53±18 µg/ml (0,35±0,12 mM) [18]. Les patients ont été traités en toute sécurité avec du DCA à la dose maximale de 50 mg/kg/jour [19]. Un certain nombre d’enfants atteints d’acidose lactique ont reçu des doses de DCA supérieures à 100 mg/kg par jour pendant une longue période (8). D’après ces données, nous considérons que la dose nécessaire des deux médicaments est tolérable. En outre, des analogues candidats du DCA présentant une toxicité moindre et une meilleure affinité de liaison ont été développés [20]. Ainsi, l’association du DCA et de l’OMP est considérée comme une option thérapeutique potentielle pour les tumeurs malignes et pourrait conduire au développement d’une nouvelle stratégie thérapeutique.
RÉFÉRENCES
1 Warburg O : Ueber den Stoffwechsel der Tumoren, Constable, Londres, 1930.2 Warburg O : On the origin of cancer cells. Science 123 : 309-314, 1956.
3 Hsu PP et Sabatini DM : Cancer cell metabolism : Warburg and beyond. Cell 134 : 703-707, 2008.
4 Michelakis ED, Webster L et Mackey LR : Dichloroacetate (DCA) as a potential metabolic-targeting therapy for cancer. Br J Cancer 99 : 989-994, 2008.
5 Plas DR et Thompson CB : Le métabolisme cellulaire dans la régulation de la mort cellulaire programmée. Trends Endocrinol Metab 13 : 75-78, 2002.
6 Bonnet S, Archer SL, Allalunis-Turner J, Haromy A, Beaulieu C, Thompson R, Lee CT, Lopaschuk GD, Puttagunta L, Bonnet S, et al : A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth. Cancer Cell 11 : 37-51, 2007.
7 Stacpoole PW : The pharmacology of dichloroacetate. Metabolism 38 : 1124-1144, 2006.
8 Stacpoole PW, Gilbert LR, Neiberger RE, Carney PR, Valenstein E, Theriaque DW et Shuster JJ : Evaluation of long-term treatment of children with congenital lactic acidosis with dichloroacetate. Pediatrics 121 : 1223-1228, 2008.
9 Luciani F, Spada M, Milito AD, Molinari A, Rivoltini L, Montinaro A, Marra M, Lugini L, Logozzi M, Lozupone F, et al : Effect of proton pump inhibitor pretreatment on resistance of solid tumors to cytotoxic drugs. J Natl Cancer Inst 96 : 1702-1713, 2004.
10 Milito AD, Iessi E, Logozzi M, Lozupone F, Spada M, Marino ML, Federici C, Perdicchio M, Matarrese P, Lugini L, et al : Proton pump inhibitors induce apoptosis of human B-cell tumors through a caspase-independent mechanism involving reactive oxygen species. Cancer Res 67 : 5408-5417, 2007.
11 De Milito A, Canese R, Marino ML, Borghi M, Iero M, Villa A, Venturi G, Lozupone F, Iessi E, Logozzi M, et al : pH-dependent antitumor activity of proton pump inhibitors against human melanoma is mediated by inhibition of tumor acidity. Int J Cancer 27 : 207-219, 2010.
12 Michelakis ED, Sutendra G, Dromparis P, Webster L, Haromy A, Niven E, Maguire C, Gammer TL, Mackey JR, Fulton D, et al : modulation métabolique du glioblastome avec le dichloroacétate. Sci Trasl Med 2 : 31-34, 2010.
13 Shi S et Klotz U : Inhibiteurs de la pompe à protons : une mise à jour de leur utilisation clinique et de leur pharmacocinétique. Eur J Clin Pharmacol 64 : 935-951, 2008.
14 Katagiri F, Inoue S, Itoh H et Takayema M : Omeprazole raises somatostatin and motilin in human plasma. Biol Pharm Bull 28 : 370-372, 2005.
15 Frucht H, Maton PN et Jensen RT : Use of omeprazole in patients with Zollinger-Ellison syndrome. Dig Dis Sci 36 : 394-404, 1991.
16 Thomson ABR, Sauve MD, Kassam N et Kamitakahara H : Safety of the long-term use of proton pump inhibitors. World J Gastroenterol 16 : 2323-2330, 2010.
17 Udelnow A, Kreyes A, Ellinger S, Landfester K, Walther P, Klapperstueck T, Wohlrab J, Henne-Bruns D, Knippschild U et Würl P : L’oméprazole inhibe la prolifération et module l’autophagie dans les cellules cancéreuses du pancréas. PLoS One 6 : e20143, 2011.
18 Shroads AL, Guo X, Dixit V, Liu HP, James MO et Stacpoole PW : Age-dependent kinetics and metabolism of dichloroacetate : possible relevance to toxicity. J Pharmacol Exp Ther 324 : 1163-1171, 2008.
19 Stacpoole PW, Henderson GN, Yan Z, Cornett R et James MO : Pharmacocinétique, métabolisme et toxicologie du dichloro-acétate. Drug Metab Rev 30 : 499-539, 1998.
20 Subramanian K et Ramaian AS : Development of a less toxic dichloroacetate analogue by docking and descriptor analysis. Bioinformation 5 : 73-76, 2010.