TATSUAKI ISHIGURO1,2, MIYU ISHIGURO1, RYUMEI ISHIGURO1 e SAYURI IWAI1*
1 Dipartimento di Terapeutica Sperimentale, Kamui Medical Co., Ltd., Tokyo 1120002
2 ClinicaHibiya Uchisaiwaicho, Tokyo 1050004, Giappone.
Corrispondenza: Dr Tatsuaki Ishiguro, Kamui Medical Co., Ltd., 2-20-13 Koishikawa Bunkyo-ku, Tokyo 1120002, Giappone
E-mail: [email protected]
Ricevuto: 14 novembre 2011
Accettato: 28 dicembre 2011
DOI: 10.3892/ol.2012.552
Abstract
È stato riportato che il trattamento delle cellule tumorali con dicloroacetato (DCA), un trattamento approvato per l’acidosi lattica congenita, inverte l’effetto Warburg e inibisce la crescita tumorale). Inoltre, l’omeprazolo (OMP) è un noto agente che potenzia gli effetti dei farmaci antitumorali. Lo scopo di questo studio è stato quello di trovare farmaci di uso clinico che potenziassero gli effetti del DCA. La combinazione di DCA e OMP ha mostrato un’attività antitumorale più potente rispetto al solo DCA nelle cellule di fibrosarcoma HT1080 e di cancro del colon RKO, mentre i farmaci non hanno influenzato la proliferazione dei fibroblasti umani WI-38. L’effetto inibitorio del DCA combinato con l’OMP è stato invertito con la vitamina E e lo Z-VAD-FMK; pertanto l’inibizione convenzionale della crescita cellulare caspasi-dipendente attraverso la produzione di superossido è stata suggerita come meccanismo di inibizione. La combinazione di questi farmaci ha avuto effetto anche sulle cellule di fibrosarcoma HT1080 inoculate nei topi. Poiché l’OMP e il DCA possono essere somministrati per via orale e sono stati utilizzati clinicamente per diversi anni senza effetti collaterali di rilievo, riteniamo che questa terapia combinata possa essere facilmente applicata al trattamento dei tumori maligni.
Parole chiave: fibrosarcoma, cancro del colon, dicloroacetato, omeprazolo
Abbreviazioni: DCA, dicloroacetato; PPI, inibitore di pompa protonica; OMP, omeprazolo; SOD, superossido; ROS, specie reattive dell’ossigeno
Introduzione
Warburg ha osservato per primo che, anche in presenza di ossigeno sufficiente, le cellule tumorali preferiscono metabolizzare il glucosio e produrre acido lattico [1-4]. Il concomitante aumento della captazione di glucosio può essere sfruttato clinicamente per la rilevazione della maggior parte dei tumori solidi maligni mediante tomografia a emissione di positroni con fluorodesossiglucosio (FDG-PET). Una possibile ragione per cui i tumori adottano questa via meno efficiente per la produzione di adenosina trifosfato (ATP) rispetto alla fosforilazione ossidativa è il suo vantaggio per la sopravvivenza e la proliferazione nell’ambiente ipossico del tumore [5]. Questa preferenza per la respirazione anaerobica è anche considerata la ragione della resistenza delle cellule tumorali ai farmaci antitumorali che inducono l’apoptosi attraverso la via mitocondriale. Bonnet et al. hanno riportato che il trattamento delle cellule tumorali con dicloroacetato (DCA), un trattamento approvato per l’acidosi lattica congenita, inverte l’effetto Warburg e inibisce la crescita tumorale (3,4,6-8). Il DCA aumenta il flusso di piruvato nei mitocondri inibendo la piruvato deidrogenasi chinasi e promuove l’ossidazione del glucosio rispetto alla glicolisi. Di conseguenza, il DCA diminuisce la produzione di acido lattico da parte del tumore e aumenta il pH intracellulare. Il DCA induce l’apoptosi attraverso due vie, una a livello dei mitocondri, dove la depolarizzazione e la produzione di superossido (SOD) attivano l’apoptosi mitocondrio-dipendente, e l’altra a livello plasmalemmale, dove l’attivazione/upregolazione dei canali Kv1.5 diminuisce la (K+)i, attivando le caspasi [6]. Il DCA è un promettente farmaco antitumorale grazie alla praticità della sua somministrazione orale, al basso costo, ai pochi effetti collaterali e alla lunga esperienza di utilizzo clinico [7,8]. Sebbene sembri essere un trattamento promettente per i tumori maligni, il suo effetto è limitato in un rapporto di studi clinici in corso. Pertanto, abbiamo cercato di trovare farmaci di uso clinico che potenziassero gli effetti del DCA.
L’omeprazolo (OMP) è un inibitore della pompa protonica (PPI) ed è noto anche per potenziare gli effetti dei farmaci antitumorali [9]. L’OMP inibisce l’attività della V-ATPasi oltre a colpire la pompa acida gastrica. È stato riportato che inibisce la proliferazione delle cellule tumorali, probabilmente attraverso l’alcalinizzazione dei lisosomi e la permeabilizzazione delle membrane dei lisosomi, seguita dalla produzione di specie reattive dell’ossigeno (ROS) [10,11].
Come descritto, si ritiene che DCA e OMP inibiscano la crescita delle cellule tumorali attraverso la via comune della produzione di ROS, influenzando i livelli di pH intracellulare. Poiché questi due farmaci sono utilizzati in clinica con effetti collaterali minimi, riteniamo che la loro combinazione sia un protocollo promettente per il trattamento del cancro.
Materiali e metodi
Prodotti chimici
DCA e vitamina E (tocoferolo acetato) sono stati acquistati da Wako Chemical Industries, Ltd.
(Tokyo, Giappone). L’OMP è stato acquistato da Astra Zeneca Japan (Osaka, Giappone). Z-VAD-FMK è stato acquistato dal Peptide Institute, Inc. (Osaka, Giappone).
Coltura cellulare
Le cellule di fibrosarcoma umano HT1080, i fibroblasti umani WI-38 e le cellule di cancro del colon RKO sono state seminate e coltivate in terreno Dulbecco’s modified Eagle’s medium contenente il 10% di siero fetale bovino (FBS) e mantenute in un incubatore a 37˚C e 5% diCO2. Per gli esperimenti di proliferazione cellulare, le cellule sono state seminate in piastre a 12 pozzetti e incubate nelle stesse condizioni. Dopo 7 giorni, le cellule sono state trattate con tripsina-EDTA e contate al microscopio.
Esperimenti sugli animali
Le cellule HT1080 (5×106 ) sono state inoculate per via sottocutanea in topi nudi (femmine di 8w). I farmaci sono stati aggiunti all’acqua potabile in modo da ottenere una dose giornaliera simile a quella utilizzata clinicamente (DCA 50 mg/kg, OMP 2 mg/kg). Le dimensioni di ciascun tumore sono state misurate con un calibro e il volume del tumore è stato calcolato moltiplicando i tre diametri.
Risultati
Iltrattamento combinato di DCA e OMP ha inibito la proliferazione cellulare
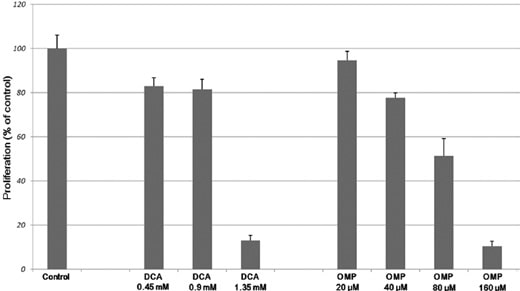
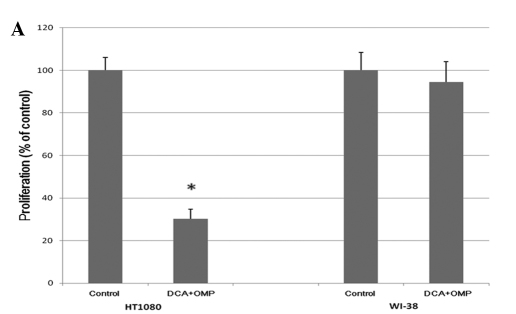
Le cellule di fibrosarcoma umano HT1080 sono state coltivate con concentrazioni crescenti di DCA e OMP per 7 giorni, con conseguente inibizione dose-dipendente della proliferazione (Fig. 1). Come mostrato nella Fig. 2A, la combinazione di DCA e OMP ha bloccato marcatamente la proliferazione delle cellule di fibrosarcoma HT1080, mentre la stessa combinazione non ha influenzato la proliferazione delle cellule di fibroblasti umani normali WI-38.
 |  |
Lavitamina E ha inibito gli effetti del DCA e dell’OMP
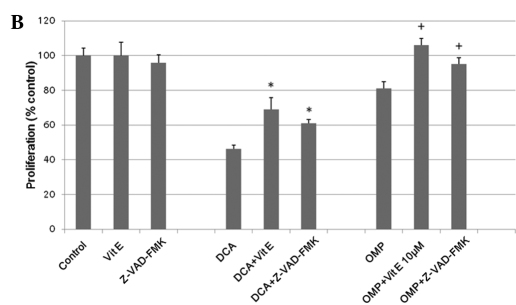
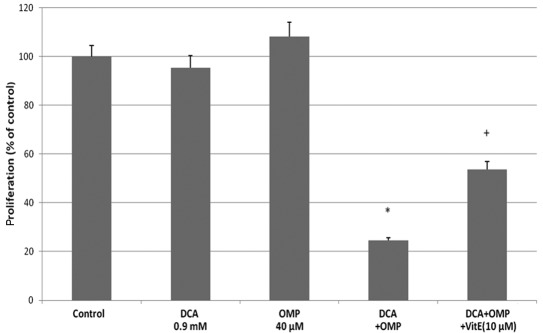
Sebbene vi siano state controversie sul meccanismo di inibizione della crescita cellulare caspasedipendente da parte dell’OMP [10,11], è stato riportato che il DCA e l’OMP inibiscono la crescita delle cellule tumorali attraverso la produzione di SOD (6,10). Per stabilire se lo stesso meccanismo fosse applicato alle cellule di fibrosarcoma HT1080, abbiamo utilizzato la vitamina E come inibitore della SOD. La vitamina E ha inibito con successo gli effetti di DCA e OMP, per cui si è ritenuto che la produzione di SOD fosse coinvolta nell’inibizione della crescita delle cellule tumorali (Fig. 2B). Anche l’inibitore pan-caspasico Z-VAD-FMK ha inibito gli effetti di questi farmaci; pertanto si ritiene che un meccanismo antitumorale caspasi-dipendente sia coinvolto, almeno in parte, in questi processi (Fig. 2B). Nel complesso, il DCA e l’OMP inibiscono la crescita delle cellule di fibrosarcoma HT1080, probabilmente attraverso un percorso caspasi-dipendente dalla produzione di SOD. Di conseguenza, i farmaci possono avere un effetto sinergico quando vengono combinati. Questo effetto sinergico e l’effetto inibitorio della vitamina E sono stati osservati anche nelle cellule di cancro del colon RKO (Fig. 3).
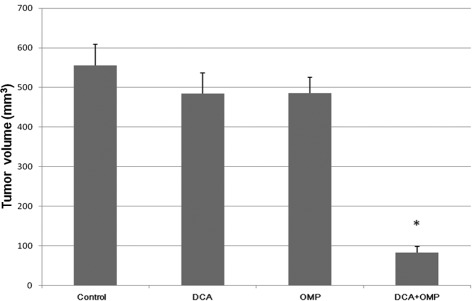
Abbiamo condotto esperimenti sugli animali per studiare gli effetti di DCA e OMP in vivo.
Comemostrato nella Fig. 4, l’effetto antitumorale della combinazione di DCA e OMP è stato superiore a quello di uno dei due farmaci da solo.
Discussione
Abbiamo dimostrato che il trattamento combinato di DCA e OMP è più efficace del trattamento con uno dei due farmaci da solo nelle cellule di fibrosarcoma umano HT1080 e di cancro del colon RKO. La terapia combinata è risultata efficace anche negli esperimenti sugli animali.
Il DCA e l’OMP sono utilizzati in modo sicuro da diversi anni, ma non sono classificati come farmaci antitumorali. Il DCA è stato utilizzato per trattare l’acidosi metabolica congenita e l’OMP per trattare le malattie legate all’acidità, entrambi senza effetti collaterali rilevanti [7,8,12,13]. La combinazione di DCA e OMP dovrebbe ridurre la dose necessaria di ciascun farmaco e i rischi che ne derivano.
È stato riportato che dosi orali di 20 mg di OMP una volta al giorno portano a una concentrazione plasmatica massima nei pazienti di ~2,5 µg/ml (7 µM) 2 ore dopo la somministrazione della dose[14]. Una dose di 120 mg di OMP tre volte al giorno è stata utilizzata per il trattamento della sindrome di Zollinger-Ellison, con effetti collaterali rari e lievi anche dopo un uso prolungato [15,16]. Questa dose corrisponde a un ipotetico picco di concentrazione in vivo di ~15 µg/ml (42 µM). Sovradosaggi fino a 2.400 mg [un’ipotetica concentrazione plasmatica di picco di 300 µg/ml (840 µM)] sono stati tollerati con effetti collaterali minori [17]. Il DCA è già consolidato nella pratica clinica. Il valore di Cmax del DCA negli adulti dopo 6 mesi di trattamento continuo (dosi orali di 25 mg/kg/die) è stato di 53±18 µg/ml (0,35±0,12 mM) [18]. I pazienti sono stati trattati in modo sicuro in modo cronico con DCA alla dose massima di 50 mg/kg/die [19]. Ad alcuni bambini con acidosi lattica sono stati somministrati >100 mg/kg di DCA al giorno per un lungo periodo (8). Da questi dati riteniamo che la dose necessaria dei due farmaci sia tollerabile. Inoltre, sono stati sviluppati analoghi candidati del DCA con minore tossicità e migliore affinità di legame [20]. Pertanto, la combinazione di DCA e OMP è considerata una potenziale opzione terapeutica per i tumori maligni e potrebbe portare allo sviluppo di una nuova strategia terapeutica.
RIFERIMENTI
1 Warburg O: Ueber den Stoffwechsel der Tumoren, Constable, London, 1930.2 Warburg O: Sull’origine delle cellule tumorali. Science 123: 309-314, 1956.
3 Hsu PP e Sabatini DM: Il metabolismo delle cellule tumorali: Warburg e oltre. Cell 134: 703-707, 2008.
4 Michelakis ED, Webster L e Mackey LR: Il dicloroacetato (DCA) come potenziale terapia a bersaglio metabolico per il cancro. Br J Cancer 99: 989-994, 2008.
5 Plas DR e Thompson CB: Il metabolismo cellulare nella regolazione della morte cellulare programmata. Trends Endocrinol Metab 13: 75-78, 2002.
6 Bonnet S, Archer SL, Allalunis-Turner J, Haromy A, Beaulieu C, Thompson R, Lee CT, Lopaschuk GD, Puttagunta L, Bonnet S, et al: A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth. Cancer Cell 11: 37-51, 2007.
7 Stacpoole PW: La farmacologia del dicloroacetato. Metabolismo 38: 1124-1144, 2006.
8 Stacpoole PW, Gilbert LR, Neiberger RE, Carney PR, Valenstein E, Theriaque DW e Shuster JJ: Valutazione del trattamento a lungo termine di bambini con acidosi lattica congenita con dicloroacetato. Pediatria 121: 1223-1228, 2008.
9 Luciani F, Spada M, Milito AD, Molinari A, Rivoltini L, Montinaro A, Marra M, Lugini L, Logozzi M, Lozupone F, et al: Effect of proton pump inhibitor pretreatment on resistance of solid tumors to cytotoxic drugs. J Natl Cancer Inst 96: 1702-1713, 2004.
10 Milito AD, Iessi E, Logozzi M, Lozupone F, Spada M, Marino ML, Federici C, Perdicchio M, Matarrese P, Lugini L, et al: Proton pump inhibitors induce apoptosis of human B-cell tumors through a caspase-independent mechanism involving reactive oxygen species. Cancer Res 67: 5408-5417, 2007.
11 De Milito A, Canese R, Marino ML, Borghi M, Iero M, Villa A, Venturi G, Lozupone F, Iessi E, Logozzi M, et al: pH-dependent antitumor activity of proton pump inhibitors against human melanoma is mediated by inhibition of tumor acidity. Int J Cancer 27: 207-219, 2010.
12 Michelakis ED, Sutendra G, Dromparis P, Webster L, Haromy A, Niven E, Maguire C, Gammer TL, Mackey JR, Fulton D, et al: Metabolic modulation of glioblastoma with dichloroacetate. Sci Trasl Med 2: 31-34, 2010.
13 Shi S e Klotz U: Inibitori della pompa protonica: un aggiornamento del loro uso clinico e della loro farmacocinetica. Eur J Clin Pharmacol 64: 935-951, 2008.
14 Katagiri F, Inoue S, Itoh H e Takayema M: L’omeprazolo aumenta la somatostatina e la motilina nel plasma umano. Biol Pharm Bull 28: 370-372, 2005.
15 Frucht H, Maton PN e Jensen RT: Uso dell’omeprazolo in pazienti con sindrome di Zollinger-Ellison. Dig Dis Sci 36: 394-404, 1991.
16 Thomson ABR, Sauve MD, Kassam N e Kamitakahara H: Sicurezza dell’uso a lungo termine degli inibitori della pompa protonica. World J Gastroenterol 16: 2323-2330, 2010.
17 Udelnow A, Kreyes A, Ellinger S, Landfester K, Walther P, Klapperstueck T, Wohlrab J, Henne-Bruns D, Knippschild U e Würl P: L’omeprazolo inibisce la proliferazione e modula l’autofagia nelle cellule del cancro del pancreas. PLoS One 6: e20143, 2011.
18 Shroads AL, Guo X, Dixit V, Liu HP, James MO e Stacpoole PW: Cinetica e metabolismo del dicloroacetato in funzione dell’età: possibile rilevanza per la tossicità. J Pharmacol Exp Ther 324: 1163-1171, 2008.
19 Stacpoole PW, Henderson GN, Yan Z, Cornett R e James MO: Farmacocinetica, metabolismo e tossicologia del dicloro-acetato. Drug Metab Rev 30: 499-539, 1998.
20 Subramanian K e Ramaian AS: Sviluppo di un analogo meno tossico del dicloroacetato mediante docking e analisi dei descrittori. Bioinformation 5: 73-76, 2010.