TATSUAKI ISHIGURO1,2, MIYU ISHIGURO1, RYUMEI ISHIGURO1 en SAYURI IWAI1*
1 Afdeling Experimentele Therapeutica, Kamui Medical Co., Ltd., Tokyo 1120002
2 Hibiya Uchisaiwaicho Clinic, Tokyo 1050004, Japan.
Correspondentie: Dr. Tatsuaki Ishiguro, Kamui Medical Co., Ltd., 2-20-13 Koishikawa Bunkyo-ku, Tokyo 1120002, Japan
E-mail: [email protected]
Ontvangen: 14 november 2011
Aanvaard: 28 december 2011
DOI: 10.3892/ol.2012.552
Abstract
Het is gemeld dat de behandeling van kankercellen met dichlooracetaat (DCA), een goedgekeurde behandeling voor aangeboren melkzuur, het Warburg-effect omkeert en tumorgroei remt). Bovendien is omeprazol (OMP) een bekend middel dat de effecten van geneesmiddelen tegen kanker versterkt. Het doel van deze studie was het vinden van klinisch gebruikte geneesmiddelen die de effecten van DCA versterken. De combinatie van DCA en OMP vertoonde een krachtiger antitumoractiviteit dan DCA alleen in HT1080 fibrosarcoomcellen en RKO darmkankercellen, terwijl de geneesmiddelen de proliferatie van WI-38 menselijke fibroblasten niet beïnvloedden. Het remmende effect van DCA in combinatie met OMP werd omgekeerd met vitamine E en Z-VAD-FMK; daarom werd conventionele caspase-afhankelijke remming van de celgroei door superoxideproductie voorgesteld als het remmingsmechanisme. De combinatie van deze geneesmiddelen had ook effect op HT1080 fibrosarcoomcellen die in muizen werden geïnoculeerd. Aangezien OMP en DCA oraal kunnen worden toegediend en al verscheidene jaren klinisch worden gebruikt zonder grote bijwerkingen, menen wij dat deze combinatietherapie gemakkelijk kan worden toegepast bij de behandeling van kwaadaardige tumoren.
Trefwoorden: fibrosarcoom, darmkanker, dichlooracetaat, omeprazol
Afkortingen: DCA, dichlooracetaat; PPI, protonpompremmer; OMP, omeprazol; SOD, superoxide; ROS, reactieve zuurstofsoorten
Inleiding
Warburg stelde voor het eerst vast dat kankercellen, zelfs in aanwezigheid van voldoende zuurstof, er de voorkeur aan geven glucose te metaboliseren en melkzuur te produceren [1-4]. De gelijktijdige toename van de glucose-opname kan klinisch worden benut voor de opsporing van de meeste vaste kwaadaardige tumoren door middel van fluorodeoxyglucose positronemissietomografie (FDG-PET). Een mogelijke reden waarom kankers voor deze minder efficiënte route voor de productie van adenosinetrifosfaat (ATP) kiezen in vergelijking met oxidatieve fosforylering, is het voordeel voor overleving en proliferatie in de unieke hypoxische tumoromgeving [5]. Deze voorkeur voor anaërobe ademhaling wordt ook beschouwd als de reden voor de resistentie van kankercellen tegen antikankermedicijnen die apoptose induceren via de mitochondriale route. Bonnet et al hebben gerapporteerd dat de behandeling van kankercellen met dichlooracetaat (DCA), een goedgekeurde behandeling voor aangeboren melkziekte, het Warburg-effect omkeert en de tumorgroei remt (3,4,6-8). DCA verhoogt de flux van pyruvaat naar de mitochondriën door het pyruvaatdehydrogenase kinase te remmen en bevordert glucose-oxidatie boven glycolyse. Dientengevolge vermindert DCA de productie van melkzuur door de tumor en verhoogt het de intracellulaire pH. DCA induceert apoptose via twee routes, één in de mitochondria, waar depolarisatie en superoxide (SOD) productie mitochondria-afhankelijke apoptose activeert, en de andere op plasmalemmaal niveau, waar activering/opregulering van Kv1.5 kanalen de (K+)i verlaagt, waardoor caspases worden geactiveerd [6]. DCA is een veelbelovend middel tegen kanker vanwege het gemak van orale toediening, de lage kosten, de weinige bijwerkingen en de lange ervaring met klinisch gebruik [7,8]. Hoewel het een veelbelovende behandeling bleek te zijn voor kwaadaardige tumoren, is het effect ervan beperkt in een lopend verslag van klinische proeven. Daarom zochten wij naar klinisch gebruikte geneesmiddelen die de effecten van DCA versterken.
Omeprazol (OMP) is een protonpompremmer (PPI) en het is ook bekend dat het de effecten van antikankergeneesmiddelen kan versterken [9]. OMP remt de activiteit van V-ATPase en richt zich daarnaast op de maagzuurpomp. Het zou de proliferatie van tumorcellen remmen, mogelijk door alkalinisatie van de lysosomen en permeabilisatie van de lysosoommembranen, gevolgd door de productie van reactieve zuurstofsoorten (ROS) [10,11].
Zoals beschreven zouden DCA en OMP de groei van tumorcellen remmen via de gemeenschappelijke weg van ROS-productie door beïnvloeding van de intracellulaire pH-waarde. Aangezien deze twee geneesmiddelen klinisch worden gebruikt met geringe bijwerkingen, geloven wij dat hun combinatie een veelbelovend protocol is voor de behandeling van kanker.
Materialen en methoden
Chemicaliën
DCA en vitamine E (tocoferolacetaat) werden aangekocht bij Wako Chemical Industries, Ltd.
(Tokio, Japan). OMP werd aangekocht bij Astra Zeneca Japan (Osaka, Japan). Z-VAD-FMK werd aangekocht bij het Peptide Institute, Inc. (Osaka, Japan).
Celcultuur
HT1080 menselijke fibrosarcoomcellen, WI-38 menselijke fibroblastcellen en RKO darmkankercellen werden gezaaid en gekweekt in Dulbecco’s gemodificeerd Eagle’s medium met 10% foetaal runderserum (FBS) en onderhouden in een incubator bij 37˚C en 5%CO2. Voor de celproliferatie-experimenten werden de cellen uitgezaaid in platen met 12 putjes en onder dezelfde omstandigheden geïncubeerd. Na 7 dagen werden de cellen behandeld met trypsine-EDTA en geteld onder een microscoop.
Dierexperimenten
HT1080-cellen (5×106 ) werden subcutaan geïnoculeerd in naakte muizen (vrouwtjes van 8w). De geneesmiddelen werden aan het drinkwater toegevoegd om een dagelijkse dosis te verkrijgen die vergelijkbaar was met de klinische dosis (DCA 50 mg/kg, OMP 2 mg/kg). De grootte van elke tumor werd gemeten met een schuifmaat en het tumorvolume werd berekend door vermenigvuldiging van drie diameters.
Resultaten
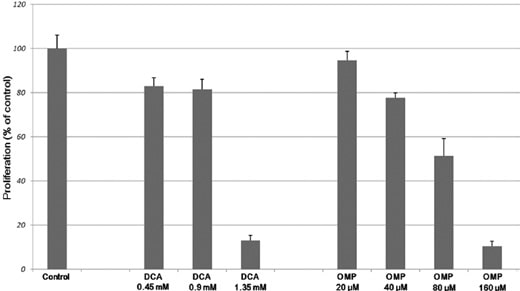
Gecombineerde behandeling van DCA en OMP remde de celproliferatie
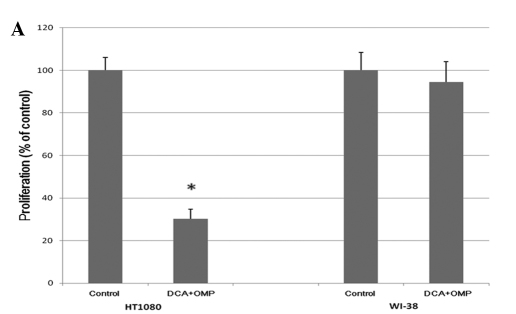
HT1080 menselijke fibrosarcoomcellen werden gedurende 7 dagen gekweekt met oplopende concentraties DCA en OMP, hetgeen resulteerde in een dosisafhankelijke remming van de proliferatie (fig. 1). Zoals blijkt uit fig. 2A, blokkeerde de combinatie van DCA en OMP de proliferatie van HT1080 fibrosarcoomcellen duidelijk, terwijl dezelfde combinatie de proliferatie van WI-38 normale menselijke fibroblastcellen niet beïnvloedde.
 |  |
Vitamine E remde de effecten van DCA en OMP
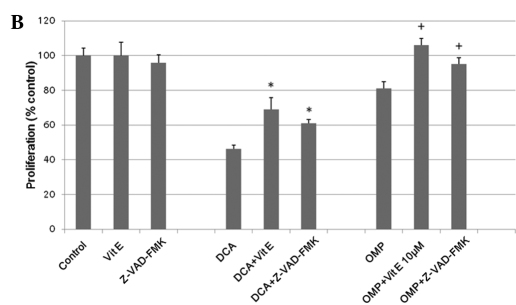
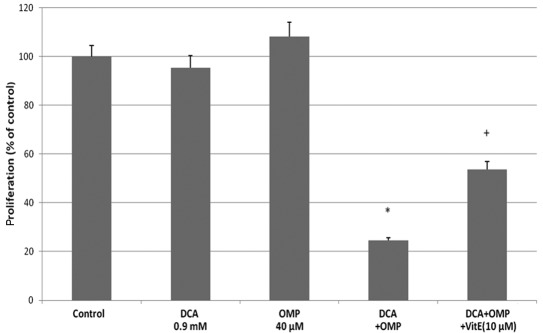
Hoewel er controverse is geweest over het mechanisme van de caspasedentieke celgroeiremming door OMP [10,11], is gemeld dat DCA en OMP de groei van tumorcellen remmen door de productie van SOD’s (6,10). Om na te gaan of hetzelfde mechanisme van toepassing was op de HT1080 fibrosarcoomcellen, gebruikten wij vitamine E als remmer van SOD. Vitamine E remde met succes de effecten van DCA en OMP, dus werd aangenomen dat de SOD-productie betrokken was bij de remming van de tumorcelgroei (fig. 2B). De pan-caspase-remmer Z-VAD-FMK remde ook de effecten van deze geneesmiddelen; daarom werd aangenomen dat een caspase-afhankelijk antitumormechanisme ten minste gedeeltelijk bij deze processen betrokken was (fig. 2B). Tezamen genomen remmen DCA en OMP de groei van HT1080 fibrosarcoomcellen, mogelijk via een caspase-afhankelijke route door SOD-productie. Bijgevolg kunnen de geneesmiddelen in combinatie een synergetisch effect vertonen. Dit synergetisch effect en de remmende werking met vitamine E werd ook waargenomen bij RKO-darmkankercellen (fig. 3).
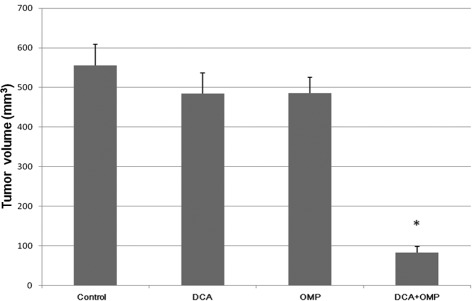
Wij voerden dierexperimenten uit om de effecten van DCA en OMP in vivo te onderzoeken.
Zoalsgetoond in Fig. 4 was het antitumoreffect van de combinatie van DCA en OMP ook groter dan dat van een van beide geneesmiddelen alleen.
Bespreking
Wij hebben aangetoond dat een gecombineerde behandeling van DCA en OMP doeltreffender is dan behandeling met een van beide geneesmiddelen alleen in HT1080 menselijke fibrosarcoomcellen en RKO darmkankercellen. De gecombineerde therapie was ook effectief in dierproeven.
DCA en OMP worden al een aantal jaren veilig gebruikt, maar zijn niet geclassificeerd als geneesmiddelen tegen kanker. DCA is gebruikt om congenitale metabole acidose te behandelen en OMP is gebruikt om zuurgerelateerde ziekten te behandelen, beide zonder grote bijwerkingen [7,8,12,13]. De combinatie van DCA en OMP zal naar verwachting de noodzakelijke dosis van elk geneesmiddel en de bijbehorende risico’s verminderen.
Orale doses van 20 mg OMP eenmaal daags leiden bij patiënten tot een maximale plasmaconcentratie van ~2,5 µg/ml (7 µM) 2 uur na toediening van de dosis[14]. Een dosis van 120 mg OMP driemaal daags is gebruikt voor de behandeling van het Zollinger-Ellison syndroom, met slechts zeldzame en milde bijwerkingen, zelfs na langdurig gebruik [15,16]. Deze dosis komt overeen met een hypothetische piekconcentratie in vivo van ~15 µg/ml (42 µM). Overdoses tot 2.400 mg [een hypothetische plasmapiekconcentratie van 300 µg/ml (840 µM)] werden verdragen met lichte bijwerkingen [17]. DCA is reeds ingeburgerd in de klinische praktijk. De Cmax-waarde van DCA bij volwassenen na 6 maanden continue behandeling (orale doses van 25 mg/kg/dag) was 53±18 µg/ml (0,35±0,12 mM) [18]. Patiënten werden veilig chronisch behandeld met DCA in de maximale dosis van 50 mg/kg/dag [19]. Een aantal kinderen met lactose kreeg gedurende lange tijd dagelijks >100 mg/kg DCA toegediend (8). Uit deze gegevens leiden wij af dat de noodzakelijke dosis van beide geneesmiddelen verdraagbaar is. Bovendien zijn er kandidaat-analogen van DCA ontwikkeld met minder toxiciteit en een betere bindingsaffiniteit [20]. De combinatie van DCA en OMP wordt dus beschouwd als een potentiële therapeutische optie voor kwaadaardige tumoren en kan leiden tot de ontwikkeling van een nieuwe therapeutische strategie.
VERWIJZINGEN
1 Warburg O: Ueber den Stoffwechsel der Tumoren, Constable, Londen, 1930.2 Warburg O: On the origin of cancer cells. Science 123: 309-314, 1956.
3 Hsu PP en Sabatini DM: Cancer cell metabolism: Warburg and beyond. Cell 134: 703-707, 2008.
4 Michelakis ED, Webster L en Mackey LR: Dichloroacetate (DCA) as a potential metabolic-targeting therapy for cancer. Br J Cancer 99: 989-994, 2008.
5 Plas DR en Thompson CB: Cell metabolism in the regulation of programmed cell death. Trends Endocrinol Metab 13: 75-78, 2002.
6 Bonnet S, Archer SL, Allalunis-Turner J, Haromy A, Beaulieu C, Thompson R, Lee CT, Lopaschuk GD, Puttagunta L, Bonnet S, et al: A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth. Cancer Cell 11: 37-51, 2007.
7 Stacpoole PW: The pharmacology of dichloroacetate. Metabolisme 38: 1124-1144, 2006.
8 Stacpoole PW, Gilbert LR, Neiberger RE, Carney PR, Valenstein E, Theriaque DW en Shuster JJ: Evaluation of long-term treatment of children with congenital lactic acidosis with dichloroacetate. Pediatrics 121: 1223-1228, 2008.
9 Luciani F, Spada M, Milito AD, Molinari A, Rivoltini L, Montinaro A, Marra M, Lugini L, Logozzi M, Lozupone F, et al: Effect of proton pump inhibitor pretreatment on resistance of solid tumors to cytotoxic drugs. J Natl Cancer Inst 96: 1702-1713, 2004.
10 Milito AD, Iessi E, Logozzi M, Lozupone F, Spada M, Marino ML, Federici C, Perdicchio M, Matarrese P, Lugini L, et al: Proton pump inhibitors induceer apoptosis of human B-cell tumors through a caspase-independent mechanism involving reactive oxygen species. Cancer Res 67: 5408-5417, 2007.
11 De Milito A, Canese R, Marino ML, Borghi M, Iero M, Villa A, Venturi G, Lozupone F, Iessi E, Logozzi M, et al: pH-dependent antitumor activity of proton pump inhibitors against human melanoma is mediated by inhibition of tumor acidity. Int J Cancer 27: 207-219, 2010.
12 Michelakis ED, Sutendra G, Dromparis P, Webster L, Haromy A, Niven E, Maguire C, Gammer TL, Mackey JR, Fulton D, et al: Metabolic modulation of glioblastoma with dichloroacetate. Sci Trasl Med 2: 31-34, 2010.
13 Shi S en Klotz U: Protonpompremmers: een update van hun klinisch gebruik en farmacokinetiek. Eur J Clin Pharmacol 64: 935-951, 2008.
14 Katagiri F, Inoue S, Itoh H and Takayema M: Omeprazole increases somatostatin and motilin in human plasma. Biol Pharm Bull 28: 370-372, 2005.
15 Frucht H, Maton PN en Jensen RT: Use of omeprazole in patients with Zollinger-Ellison syndrome. Dig Dis Sci 36: 394-404, 1991.
16 Thomson ABR, Sauve MD, Kassam N en Kamitakahara H: Safety of the long-term use of proton pump inhibitors. World J Gastroenterol 16: 2323-2330, 2010.
17 Udelnow A, Kreyes A, Ellinger S, Landfester K, Walther P, Klapperstueck T, Wohlrab J, Henne-Bruns D, Knippschild U en Würl P: Omeprazol remt proliferatie en moduleert autofagie in pancreaskankercellen. PLoS One 6: e20143, 2011.
18 Shroads AL, Guo X, Dixit V, Liu HP, James MO en Stacpoole PW: Age-dependent kinetics and metabolism of dichloroacetate: possible relevance to toxicity. J Pharmacol Exp Ther 324: 1163-1171, 2008.
19 Stacpoole PW, Henderson GN, Yan Z, Cornett R en James MO: Pharmacokinetics, metabolism and toxicology of dichloro-acetate. Drug Metab Rev 30: 499-539, 1998.
20 Subramanian K and Ramaian AS: Development of a less toxic dichloroacetate analogue by docking and descriptor analysis. Bio-informatie 5: 73-76, 2010.