Dana F. Flavin1, 2
1Klinikim Alpenpark, Defreggerweg 2-6, Ringsee, 83707 Tegernsee, Duitsland
2 Foundation for Collaborative Medicine and Research, 24 Midwood Drive, Greenwich, CT 06830, USA
Correspondentie dient te worden gericht aan Dana F. Flavin, [email protected]
Ontvangen: 4 juni 2010
Aanvaard: 23 juli 2010
Academische redacteur: Michael A. Carducci
Copyright © 2010 Dana F. Flavin. Dit is een open access artikel verspreid onder de Creative Commons Naamsvermelding Licentie, die onbeperkt gebruik, distributie en reproductie toestaat in elk medium, op voorwaarde dat het originele werk correct wordt geciteerd.
In juni 2007 werd een 48-jarige mannelijke patiënt, gediagnosticeerd met stadium 4 Non-Hodgkin’s Follicular Lymphoma (NHL), gedurende 3 maanden behandeld met conventionele chemotherapie, resulterend in een volledige remissie. Bijna een jaar later keerden de tumoren terug in de neuskeelholte en de halslymfeklieren. De patiënt weigerde alle voorgestelde chemotherapieën en begon zelf 900 mg dichlooracetaat (DCA) per dag toe te dienen; vier maanden later toonde een PET-scan volledige remissie. Sinds zijn laatste PET-scan, mei 2009, is hij nog steeds tumorvrij door het continue gebruik van DCA.
INLEIDING
Non-Hodgkin lymfoom (NHL), een kanker van het lymfesysteem die overal in het lichaam kan beginnen, treft 400.000+ mensen in de Verenigde Staten met 66.000 nieuwe gevallen in 2009 [1]. NHL presenteert zich vaak als lage koorts met zweten, gezwollen lymfeklieren, algemene malaise en vermoeidheid. Hoewel het goed reageert op gevestigde therapieën, waaronder chemotherapie en bestraling [2], worden agressievere nieuwe behandelingen ontwikkeld, waaronder chemotherapie met bestraling van het hele lichaam gevolgd door stamceltransplantaties [3]. Hoewel deze behandelingen bij sommige patiënten tot volledige remissie hebben geleid [4], zoeken andere patiënten, die zich bewust zijn van de aantasting van de levenskwaliteit door agressieve therapieën [3], samen met professionals of op eigen houtje naar alternatieve behandelmethoden, waarvan vele niet-conventioneel zijn of zich in een experimenteel stadium bevinden. Eén zo’n therapie is dichlooracetaat (DCA) [5].
DCA is een bijproduct van waterchlorering [6, 7] dat de aërobe glycolyse remt. Het wordt al meer dan 30 jaar in de geneeskunde gebruikt [8] als onderzoeksgeneesmiddel voor de behandeling van ernstige stofwisselingsstoornissen zoals diabetes en hypercholesterolemie [5, 9] , alsmede voor de behandeling van congenitale melkzuurvergiftiging bij Noord-Amerikaanse kinderen [10]. De biologische beschikbaarheid [11] en de farmacokinetiek [12] van DCA zijn tientallen jaren lang goed onderzocht bij volwassenen [6], kinderen [13, 14] en dieren [15]. Als geneesmiddel wordt DCA over het algemeen goed verdragen vanaf doseringen tussen 10 mg/Kg en 50 mg/Kg, hoewel langdurige blootstelling in verband wordt gebracht met perifere neuropathie [16]. Zijn activering van het enzym pyruvaatdehydrogenase (PDH) van de mitochondriën vermindert de glycolyse en reactiveert de glucose-oxidatie, een gunstige aanpak om melkzuurgasvorming te verbeteren [9].
Kankercellen gebruiken voornamelijk een systeem van glycolyse voor energie in plaats van de glucose-oxidatie die door gezonde cellen wordt gebruikt. Kanker lijkt een vorm van intracellulaire melkverzuring die wordt veroorzaakt door een blokkering van de oxidatie van glucose op het niveau van PDH (pyruvaat dehydrogenase). Het glycolyse-metabolisme van glucose verhoogt het melkzuur van de kankercellen en verlaagt de intracellulaire pH [7] met als gevolg grote verschuivingen in de intracellulaire biochemie. Aërobe glycolyse, bekend als het “Warburg Effect” [17], inactiveert de mitochondriale ademhaling waardoor de kankercellen kunnen groeien [18]. DCA keert deze glycolyse om en veroorzaakt verschillende belangrijke nadelige veranderingen in de kankertumorcellen.
Eerst en vooral remt DCA pyruvaat dehydrogenase kinase (PDK). PDK blokkeert pyruvaat dehydrogenase (PDH) door zijn fosforyleringsactiviteit. Wanneer dit kinase wordt geremd door DCA, wordt de PDH gereactiveerd waardoor de mitochondriën niet langer hypergepolariseerd zijn, maar het membraan en de mitochondriën worden gedepolariseerd, waardoor de mitochondriale K+-kanalen worden gereactiveerd, waardoor het cytosolische K+ afneemt. Wanneer PDH in kankercellen wordt geremd door PDK, ontstaat een teveel aan cytosolisch K+ dat de caspasen 3 en 9, belangrijke factoren bij apoptose, inactiveert. DCA reactiveert deze caspases samen met een toename van H2O2 intracellulair, waardoor cytochroom c uit de mitochondriën vrijkomt. Het vrijkomen van cytochroom c is een belangrijke activerende stap voor celapoptose, omdat het de caspase-cascade in gang zet [19]. De resultaten van DCA op kankers worden zowel in vitro als in vivo waargenomen. Deze effecten worden niet gezien in normale cellen.
Een ander belangrijk effect van dichlooracetaat op kankercellen is het vrijkomen van mitochondriaal calcium (Ca++). De toename van Ca++ in kankercellen wordt in verband gebracht met de toename en proliferatie van transcriptiefactoren. Calcium activeert ook ornithine decarboxylase, het snelheidsbeperkende enzym in de DNA-synthese [20], en de anti-apoptose factor NFAT (nuclear factor of activated T lymphocytes) [21]. Wanneer het calcium afneemt met de introductie van DCA, wordt de cel verder gestuurd in de richting van apoptose en een afname van de celreplicatie. Behalve dat DCA een grote verschuiving veroorzaakt in de mitochondriën, het cytoplasma en de celmembraan [19], is het eindeffect van DCA een celcyclusstilstand in de Gap 1-fase (G1), waardoor ook de apoptose toeneemt [22].
Materialen en methode
Na een succesvolle behandeling met zes behandelingen met Rituxan plus CHOP (cyclofosfamide, doxorubicinehydrochloride, vincristine en prednisolon) over een periode van drie maanden in 2007, toonde een positronemissietomografie (PET-scan) een volledige remissie van het NHL. Zonder verdere behandelingen in augustus 2008 toonde de PET-scan aan dat zijn tumoren in de nasofarynx en de lymfeklieren in de hals waren teruggekeerd, wat gepaard ging met een lage koorts van 99,8, zweten en vermoeidheid.
De Non-Hodgkin’s Lymfoom patiënt weigerde conventionele therapie, in plaats daarvan verkreeg hij persoonlijk dichlooracetaat (DCA) dat hij in augustus 2008 zelf begon toe te dienen met 900 mg per dag bij 10 mg/kg, met toevoeging van een dagelijkse 750 mg thiamine om zijn zenuwen te beschermen tegen toxiciteit [15, 23]. Vier maanden later toonde een PET-scan volledige remissie (zie figuur 2). Hij is tumorvrij gebleven op het voortgezette regime van DCA en thiamine sinds zijn laatste PET in mei 2009. Maandelijks bloedonderzoek toont aan dat al zijn parameters normaal zijn.
Resultaten
In augustus 2008 klaagde een NHL-patiënt, die na chemotherapie bijna een jaar in remissie was, over pijn en gevoeligheid in zijn nek, waar bij onderzoek uitsteeksels zichtbaar waren. Er werd een PET afgenomen om de aard van het probleem en de omvang van de lymfeklierbetrokkenheid te onderzoeken.
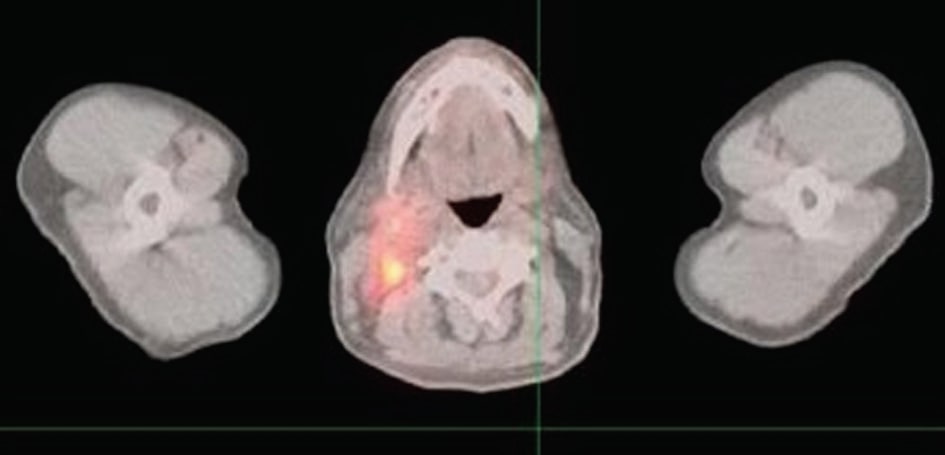
Figuur 1 laat zien dat verschillende nieuwe hypermetabolische foci binnen het hoofd en de hals compatibel zijn met recidiverend lymfoom; nieuw hypermetabolisme in het rechter postlaterale aspect van de nasopharynx, met een afmeting van 3,2 × 2,2 cm; nieuwe hypermetabolische adenopathie binnen de rechter hals waarbij de rechter jugulo digastrische regio, de rechter jugular keten en de rechter posterieure driehoek zijn betrokken en die zich uitstrekt tot de basis van de hals; de grootste knoop meet ongeveer 1..9 × 1,9 cm; verscheidene kleinere hypermetabolische lymfeklieren in de achterste driehoek die zich uitstrekken tot de basis van de hals; een enkel focaal gebied van hypermetabolisme in de linker achterste driehoek dat overeenkomt met een kleine lymfeklier van 1,0 × 0,5 cm.
Vier maanden na de dagelijkse zelfmedicatie van de patiënt met 750 mg DCA toonde een PET-scan geen zichtbare tekenen van lymfoom. De symptomen verdwenen na enkele weken en de resultaten van de PET-scan 4 maanden later in figuur 2 laten zien dat de eerder geziene foci van abnormale activiteit in de nasofarynx en de hals waren verdwenen; er werden geen abnormale foci van metabole activiteit gezien; geen aanwijzingen voor terugkerende ziekte.

Bespreking
De medische wereld ziet steeds meer patiënten die op eigen houtje vormen van therapie zoeken, met wisselende resultaten; sommige zijn schadelijk en bedreigend, terwijl andere hun leven kunnen verlengen, maar toch onder medisch toezicht moeten worden gedaan. Het is begrijpelijk dat artsen vaak niet ethisch kunnen adviseren of het gebruik van de voorkeuren van de patiënt kunnen beheren, en de patiënt aan zijn lot overlaten. Hoewel dit geval, en andere anekdotische gevallen, resulteerden in een succesvol resultaat dat kan worden verklaard door het bestaande uitgebreide onderzoek naar de farmacologie en toxicologie van de behandeling met dicholoroacetaat waarvoor de patiënt koos, wordt de toepassing van de verbinding bij kankerpatiënten nog steeds onderzocht. Momenteel onderzoeken wij in vitro tumormonsters om de gevoeligheid voor DCA te testen. We kijken ook naar laboratoriumparameters voor een mogelijke correlatie bij responders op specifieke enzymniveaus, aangezien de kanker van sommige patiënten positief reageert of wordt opgelost, lijkt DCA niet tumorspecifiek te zijn.
Tumorcellen gebruiken bij voorkeur glycolyse om adenosinetrifosfaat (ATP) te genereren, zelfs in aanwezigheid van zuurstof, een fenomeen dat bekend staat als aërobe glycolyse of het “Warburg-effect” [17]. Pyruvaatdehydrogenase (PDH), een poortwachtersenzym voor de opname van pyruvaat in de mitochondriale tricarbonzuurcyclus (TCA) [24], wordt in kankercellen geremd door fosforylering van het enzym pyruvaatdehydrogenase kinase (PDK) [ 18]. Deze remming van PDH door PDK resulteert in een verschuiving van glucose-oxidatie naar glycolyse, wat tumorgroei bevordert [19]. Er is aangetoond dat DCA deze fosforylering door PDK op mitochondriaal membraanniveau blokkeert en de glycolyse vermindert ten gunste van glucose-oxidatie. Deze terugkeer naar een normaal glucosemetabolisme zorgt voor belangrijke veranderingen, waaronder een afname van Ca++ intracellulair, en stabilisatie van de mitochondriën waardoor een reactivering van caspases in kankercellen mogelijk wordt, wat leidt tot apoptose [19].
De effecten van DCA, veroorzaakt door reactivering van de mitochondriale ademhaling, zijn niet zonder complicaties, hoewel het om onverklaarbare redenen voornamelijk beperkt lijkt te blijven tot kankercellen, terwijl de meeste normale cellen onaangetast blijven [24]. Een omkeerbare, minimale zenuwbeschadiging kan aanzienlijk worden verminderd door een dagelijkse inname van enkele honderden milligrammen thiamine bij mensen [23] en dieren [15]. De hoeveelheid thiamine varieert van 50 mg/dag tot 100 mg/dag, afhankelijk van de vraag of het oraal wordt toegediend of intramusculair wordt geïnjecteerd [23].
Het corrigeren van mitochondriale disfunctie kan een van de belangrijkste toekomstige farmacologische doelen zijn voor de behandeling van veel ziekten, aangezien mitochondriale disfunctie bij veel ziekten een gemeenschappelijke pathologische noemer blijkt te zijn. Lactische acidose wordt ook gezien als een complicatie bij malaria [25], wat wijst op mitochondriale betrokkenheid, en meer recent bij het chronisch vermoeidheidssyndroom [ 26]. DCA blijkt ook aanzienlijk te helpen bij diabetes [27] en familiaire hypercholesterolemie [28].
Conclusie
Een Non-Hodgkin-lymfoompatiënt die uit eigen beweging dagelijks 10 mg/kg [750 mg] dichlooracetaat nam, had na vier maanden een volledige remissie van zijn Non-Hodgkin-lymfoom, die tot op heden voortduurt doordat hij zijn DCA-dosering handhaaft en daarnaast 750 mg thiamine neemt ter bescherming tegen de lichte tintelingen en gevoelloosheid in de zenuwen van de vingers en tenen, zonder dat dit ten koste gaat van zijn levenskwaliteit of de werkzaamheid van de behandeling aantast. Ondanks het medische advies om niet aan zelfmedicatie te doen, is hij doorgegaan met zijn DCA/thiamine-kuur, waarbij hij aangaf bezorgd te zijn dat het stoppen met DCA een terugkeer van de ziekte mogelijk maakt.
Er zijn te weinig gegevens om absolute conclusies te trekken over het gebruik van DCA bij kanker. Er moet gecontroleerd onderzoek worden gedaan om de doeltreffendheid en de onderhoudsniveaus van DCA in het spectrum van kankertherapieën te valideren en te bevestigen.
Belangenverstrengeling
De auteur meldt geen belangenverstrengeling. De auteur is als enige verantwoordelijk voor de inhoud en het schrijven van het artikel.
Erkenningen
De hulp van Jimmy Xu van de Carnegie Mellon University wordt dankbaar erkend. Dit werk werd ondersteund door de Valerie Beth Schwartz Foundation.
VERWIJZINGEN
1 Non-Hodgkin’s Lymphoma, National Cancer Institute, U.S. National Institutes of Health, Rockville, Md, USA, mei 2009, http://www.cancer.gov/cancertopics/types/non-hodgkin.
2 J. O. Armitage en D. L. Longo, “Malignancies of lymphoid cells,” in Harrisons’s Principles of Internal Medicine, D. L. Kasper, E. Braunwald, and A. S. Fauci, Eds., blz. 642-655, McGraw Hill, New York, NY, USA, 16e editie, 2005.
3 E. Kimby, L. Brandt, P. Nygren, en B. Glimelius, “A systematic overview of chemotherapy effects in aggressive non-Hodgkin’s lymphoma,” Acta Oncologica, vol. 40, no. 2-3, pp. 198-212, 2001.
4 N. G. Mikhaeel, “Use of FDG-PET to monitor response to chemotherapy and radiotherapy in patients with lymphomas,” European Journal of Nuclear Medicine and Molecular Imaging, vol. 33, no. 13, supplement 1, pp. 22-26, 2006.
5 J. M. Donohue, H. Galal-Gorchev, W. Brattin, J. J. Liccione, en K. B. Altshuler, Toxicological Review of Dichloroacetic Acid, Integrated Risk Information System, U.S. EPA, Washington, DC, USA, augustus 2003.
6 I. R. Schultz en R. E. Shangraw, “Effect of short-term drinking water exposure to dichloroacetate on its pharmacokinetics nd oral bioavailability in human volunteers: a stable isotope study,” Toxicological Sciences, vol. 92, no. 1, pp. 42-50, 2006.
7 P. W. Stacpoole, G. N. Henderson, Z. Yan, en M. O. James, “Clinical pharmacology and toxicology of dichloroacetate,” Environmental Health Perspectives, vol. 106, supplement 4, pp. 989-994, 1998.
8 P. W. Stacpoole, A. C. Lorenz, R. G. Thomas, en E. M. Harman, “Dichloroacetate in the treatment of lactic acidosis,” Annals of Internal Medicine, vol. 108, no. 1, pp. 58-63, 1988.
9 P. W. Stacpoole, “The pharmacology of dichloroacetate,” Metabolism, vol. 38, no. 11, pp. 1124-1144, 1989.
10 P. W. Stacpoole, L. R. Gilbert, R. E. Neiberger et al., “Evaluation of long-term treatment of children with congenital lactic acidosis with dichloroacetate,” Pediatrics, vol. 121, no. 5, pp. e1223-e1228, 2008.
11 S. H. Curry, A. Lorenz, P.-I. Chu, M. Limacher, and P. W. Stacpoole, “(DCA) and oxalate following oral DCA doses,” Biopharmaceutics and Drug Disposition, vol. 12, no. 5, pp. 375- 390, 1991.
12 M. Jia, B. Coats, M. Chadha et al., “Human kinetics of orally and intravenously administered low-dose 1,2-(13)Cdichloroacetate,” Journal of Clinical Pharmacology, vol. 46, no. 12, pp. 1449-1459, 2006.
13 K. Berendzen, D. W. Theriaque, J. Shuster, and P. W. Stacpoole, “Therapeutic potential of dichloroacetate for pyruvate dehydrogenase complex deficiency,” Mitochondrion, vol. 6, no. 3, pp. 126-135, 2006.
14 P. W. Stacpoole, D. S. Kerr, C. Barnes et al., “Controlled clinical trial of dichloroacetate for treatment of congenital lactic acidosis in children,” Pediatrics, vol. 117, no. 5, pp. 1519- 1531, 2006.
15 P. W. Stacpoole, H. J. Harwood Jr., D. F. Cameron et al., “Chronic toxicity of dichloroacetate: possible relation to thiamine deficiency in rats,” Fundamental and Applied Toxicology, vol. 14, no. 2, pp. 327-337, 1990.
16 P. W. Stacpoole, T. L. Kurtz, Z. Han, en T. Langaee, “Role of dichloroacetate in the treatment of genetic mitochondrial diseases,” Advanced Drug Delivery Reviews, vol. 60, no. 13-14, pp. 1478-1487, 2008.
17 O. Warburg, F. Wind, and E. Negelein, “Uber den Sto¨ ffwechsel von Tumoren im Korper,” ¨ Journal of Molecular Medicine, vol. 5, no. 19, pp. 829-832, 1926.
18 E. D. Michelakis, L. Webster, and J. R. Mackey, “Dichloroacetate (DCA) as a potential metabolic-targeting therapy for cancer,” British Journal of Cancer, vol. 99, no. 7, pp. 989-994, 2008.
19 S. Bonnet, S. L. Archer, J. Allalunis-Turner et al., “A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth,” Cancer Cell, vol. 11, no. 1, pp. 37-51, 2007.
20 R. K. Boutwell, “Biochemical mechanism of tumor promotion,” in Carcinogensis Mechanisms of Tumor Promotion and Cocarcinogenesis, T. J. Slaga, A. Sivak, and R. K. Boutwell, Eds., pp. 29-58, Raven press, New York, NY, USA, 1978.
21 J. Y. Y. Wong, G. S. Huggins, M. Debidda, N. C. Munshi, and I. De Vivo, “Dichloroacetate induces apoptosis in endometrial cancer cells,” Gynecologic Oncology, vol. 109, no. 3, pp. 394- 402, 2008.
22 W. Cao, S. Yacoub, K. T. Shiverick et al., “Dichloroacetate (DCA) sensitizes both wild-type and over expressing bcl-2 prostate cancer cells in vitro to radiation,” Prostate, vol. 68, no. 11, pp. 1223-1231, 2008.
23 L. Spruijt, R. K. Naviaux, K. A. McGowan et al., “Nerve conduction changes in patients with mitochondrial diseases treated with dichloroacetate,” Muscle and Nerve, vol. 24, no. 7, pp. 916-924, 2001.
24 J. G. Pan en T. W. Mak, “Metabolic targeting as an anticancer strategy: dawn of a new era?” Science’s STKE, vol. 2007, no. 381, p. pe14, 2007.
25 S. Krishna, T. Agbenyega, B. J. Angus et al., “Pharmacokinetics and pharmacodynamics of dichloroacetate in children with lactic acidosis due to severe malaria,” QJM, vol. 88, no. 5, pp. 341-349, 1995.
26 S. Myhill, N. E. Booth, and J. McLaren-Howard, “Chronic fatigue syndrome and mitochondrial dysfunction,” International Journal of Clinical and Experimental Medicine, vol. 2, no. 1, pp. 1-16, 2009.
27 P. W. Stacpoole, G. W. Moore, en D. M. Kornhauser, “Metabolic e ffects of dichloroacetate in patients with diabetes mellitus and hyperlipoproteinemia,” New England Journal of Medicine, vol. 298, no. 10, pp. 526-530, 1978.
28 G. W. Moore, L. L. Swift, and D. Rabinowitz, “Reduction of serum cholesterol in two patients with homozygous familial hypercholesterolemia by dichloroacetate,” Atherosclerosis, vol. 33, no. 3, pp. 285-293, 1979.