Дана Ф. Флавин1, 2
1Klinikim Alpenpark, Defreggerweg 2-6, Ringsee, 83707 Tegernsee, Germany
2 Foundation for Collaborative Medicine and Research, 24 Midwood Drive, Greenwich, CT 06830, USA
Корреспонденцию следует направлять по адресу: Dana F. Флавин, [email protected]
Получено: 4 июня 2010 г.
Принято: 23 июля 2010 г.
Научный редактор: Michael A. Carducci
Copyright © 2010 Dana F. Флавин. Это статья в открытом доступе, распространяемая по лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение в любых средствах массовой информации при условии надлежащего цитирования оригинальной работы.
В июне 2007 года 48-летний мужчина с диагнозом неходжкинская фолликулярная лимфома (НХЛ) 4 стадии в течение 3 месяцев проходил лечение традиционной химиотерапией, что привело к полной ремиссии. Почти через год опухоли в носоглотке и шейных лимфатических железах вернулись. Отказавшись от всех предложенных химиотерапий, пациент начал самостоятельно принимать дихлорацетат (DCA) по 900 мг ежедневно, и через четыре месяца ПЭТ-сканирование показало полную ремиссию. С момента последнего ПЭТ-сканирования в мае 2009 года пациент остается свободным от опухолей благодаря постоянному применению ДХА.
ВВЕДЕНИЕ
Неходжкинская лимфома (НХЛ), рак лимфатической системы, который может начаться в любой части тела, поражает более 400 000 человек в США, а в 2009 году было зарегистрировано 66 000 новых случаев [1]. НХЛ часто проявляется в виде лихорадки низкого уровня с потливостью, опухших лимфатических узлов, общего недомогания и усталости. Хотя он хорошо реагирует на традиционные методы лечения, включая химиотерапию и облучение [2], разрабатываются более агрессивные новые методы лечения, включая химиотерапию с облучением всего тела с последующей трансплантацией стволовых клеток [3]. Хотя эти методы лечения привели к полной ремиссии у некоторых пациентов [4], другие пациенты, зная о снижении качества жизни при агрессивных методах лечения [3], ищут альтернативные способы лечения у специалистов или самостоятельно, многие из которых являются нетрадиционными или находятся на экспериментальной стадии. Одним из таких методов лечения является дихлорацетат (ДХА) [5].
ДХА — это побочный продукт хлорирования воды [6, 7] , который ингибирует аэробный гликолиз. Он используется в медицине уже более 30 лет [8] в качестве экспериментального препарата для лечения тяжелых метаболических нарушений, таких как диабет и гиперхолестеринемия [5, 9] , а также для лечения врожденного молочнокислого ацидоза у детей Северной Америки [10]. Биодоступность [11] и фармакокинетика [12] ДКА были хорошо изучены в течение нескольких десятилетий у взрослых [6], детей [13, 14] и животных [15]. Как лекарственное средство, ДКА обычно хорошо переносится в дозах от 10 мг/кг до 50 мг/кг, хотя длительное воздействие связано с периферической нейропатией [16]. Его активация фермента пируватдегидрогеназы (PDH) митохондрий снижает гликолиз и реактивирует окисление глюкозы, что является благоприятным подходом для смягчения молочнокислого ацидоза [9].
Раковые клетки преимущественно используют систему гликолиза для получения энергии вместо окисления глюкозы, используемого здоровыми клетками. Рак представляется формой внутриклеточного молочнокислого ацидоза, вызванного блоком окисления глюкозы на уровне PDH (пируватдегидрогеназы). В результате метаболизма глюкозы при гликолизе в раковых клетках увеличивается количество молочной кислоты и снижается внутриклеточный pH [7] , что приводит к серьезным сдвигам во внутриклеточной биохимии. Аэробный гликолиз, известный как «эффект Варбурга» [17], инактивирует митохондриальное дыхание, что обеспечивает рост раковых клеток [18]. DCA обращает вспять этот гликолиз, вызывая несколько основных пагубных изменений в клетках раковой опухоли.
Прежде всего, DCA ингибирует киназу пируватдегидрогеназы (PDK). PDK блокирует пируватдегидрогеназу (PDH) посредством фосфорилирующей активности. Когда эта киназа ингибируется DCA, PDH реактивируется, в результате чего митохондрии больше не гиперполяризуются, вместо этого мембрана и митохондрии деполяризуются, реактивируя митохондриальные K+ каналы, которые затем уменьшают цитозольный K+. Когда PDH ингибируется в раковых клетках PDK, возникает избыток цитозольного K+, который инактивирует каспазы 3 и 9, важные факторы апоптоза. DCA реактивирует эти каспазы наряду с увеличением внутриклеточного содержания H2O2, что позволяет высвободить цитохром c из митохондрий. Высвобождение цитохрома c является основным активирующим шагом для клеточного апоптоза, поскольку запускает каскад каспаз [19]. Результаты воздействия DCA на раковые клетки наблюдаются как in vitro, так и in vivo. Эти эффекты не наблюдаются в нормальных клетках.
Другим важным эффектом дихлорацетата на раковые клетки является высвобождение митохондриального кальция (Ca++). Повышение уровня Ca++ в раковых клетках связано с увеличением и пролиферацией транскрипционных факторов. Кальций также активирует орнитиндекарбоксилазу, фермент, ограничивающий скорость синтеза ДНК [20], и антиапоптозный фактор NFAT (ядерный фактор активированных Т-лимфоцитов) [21]. Когда кальций снижается при введении ДКА, клетка еще больше направляется в сторону апоптоза и снижения клеточной репликации. Помимо того, что ДКА вызывает значительные изменения в митохондриях, цитоплазме и клеточной мембране [19], конечным эффектом ДКА является остановка клеточного цикла в фазе Gap 1 (G1), что также увеличивает апоптоз [22].
Материалы и метод
После успешного лечения шестью курсами Ритуксана плюс режим CHOP (циклофосфамид, доксорубицина гидрохлорид, винкристин и преднизолон) в течение трех месяцев в 2007 году, позитронно-эмиссионная томография (ПЭТ) показала полную ремиссию НХЛ. Без дальнейшего лечения к августу 2008 года ПЭТ показала возвращение опухолей в носоглотке и шейных лимфатических железах, что сопровождалось низкой температурой 99,8, потливостью и усталостью.
Пациент с неходжкинской лимфомой отказался от обычной терапии, вместо этого он лично приобрел дихлорацетат (DCA) и начал самостоятельно принимать 900 мг ежедневно в дозе 10 мг/кг в августе 2008 года, добавляя ежедневно 750 мг тиамина для защиты нервов от токсичности [15, 23]. Через четыре месяца ПЭТ-сканирование показало полную ремиссию (см. рис. 2). С момента последней ПЭТ в мае 2009 года он остается без опухоли, продолжая принимать DCA и тиамин. Ежемесячные анализы крови показывают, что все его показатели в норме.
Результаты
В августе 2008 года пациент с НХЛ, который почти год находился в ремиссии после химиотерапии, пожаловался на болезненность и нежность в области шеи, где при осмотре были видны выступы. Для выяснения характера проблемы и степени поражения лимфы была проведена ПЭТ.
На рисунке 1 показано, что несколько новых гиперметаболических очагов в области головы и шеи, совместимых с рецидивирующей лимфомой; новый гиперметаболизм в правой постлатеральной части носоглотки размером 3,2 × 2,2 см; новая гиперметаболическая аденопатия в правой части шеи с вовлечением правой ягуло-дигастральной области, правой яремной цепи и правого заднего треугольника, простирающаяся до основания шеи; самый большой узел размером приблизительно 1.9 × 1,9 см; несколько небольших гиперметаболических лимфатических узлов в заднем треугольнике, простирающихся до основания шеи; один очаг гиперметаболизма в левом заднем треугольнике, соответствующий небольшому лимфатическому узлу размером 1,0 × 0,5 см.
Через четыре месяца после ежедневного самолечения пациента 750 мг ДКА, ПЭТ-сканирование не выявило видимых признаков лимфомы. Симптомы исчезли через несколько недель, а результаты ПЭТ-сканирования через 4 месяца, представленные на рисунке 2, показывают, что ранее наблюдавшиеся очаги аномальной активности в носоглотке и шее рассосались; не было обнаружено никаких аномальных очагов метаболической активности; нет признаков рецидива заболевания.

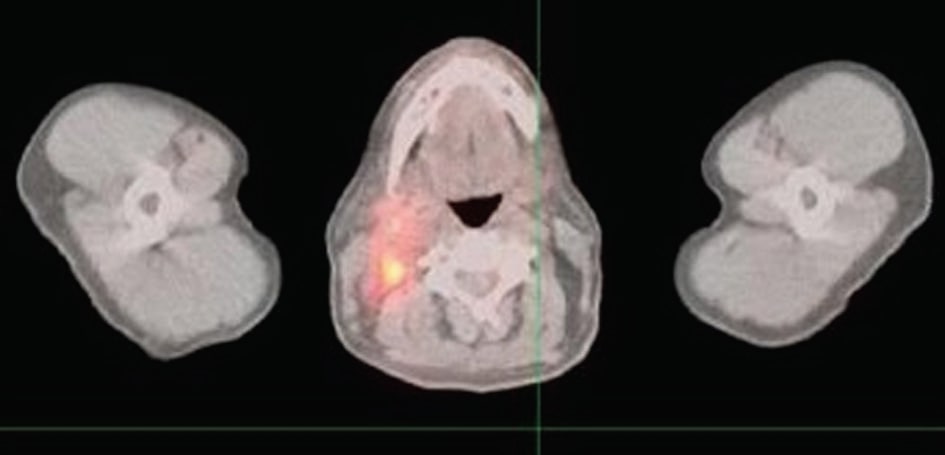
Обсуждение
Медицинское сообщество наблюдает все больше и больше пациентов, которые самостоятельно ищут формы терапии с различными результатами; некоторые из них являются вредными и опасными, в то время как другие могут продлить жизнь, но все же должны проводиться под наблюдением врача. Понятно, что врачи часто не могут по этическим соображениям советовать или управлять использованием патентов, оставляя пациента на произвол судьбы. Хотя этот случай и другие, анекдотичные, привели к успешному исходу, который можно объяснить существующими обширными исследованиями фармакологии и токсикологии лечения дихлорацетатом, которое выбрал пациент, применение этого соединения у онкологических больных все еще находится в стадии изучения. В настоящее время мы изучаем образцы опухолей in vitro для проверки чувствительности к DCA. Мы также изучаем лабораторные параметры на предмет возможной лабораторной корреляции у пациентов, реагирующих на специфические уровни ферментов, поскольку рак у некоторых пациентов реагирует положительно или разрешается.
Опухоле
клетки предпочтительно используют гликолиз для выработки аденозинтрифосфата (АТФ) даже в присутствии кислорода — явление, известное как аэробный гликолиз или «эффект Варбурга» [17]. Пируватдегидрогеназа (PDH), фермент, контролирующий поступление пирувата в митохондриальный цикл трикарбоновых кислот (TCA) [24], ингибируется в раковых клетках фосфорилированием фермента киназы пируватдегидрогеназы (PDK) [18]. В результате ингибирования PDH PDK происходит переход от окисления глюкозы к гликолизу, что благоприятствует росту опухоли [19]. Было показано, что DCA блокирует это фосфорилирование PDK на уровне митохондриальной мембраны и снижает гликолиз в пользу окисления глюкозы. Возвращение к нормальному метаболизму глюкозы приводит к значительным изменениям, включая снижение внутриклеточного уровня Ca++ и стабилизацию митохондрий, что позволяет реактивировать каспазы в раковых клетках, приводя к апоптозу [19].
Эффекты DCA, вызванные реактивацией митохондриального дыхания, не лишены осложнений, хотя необъяснимо кажется, что они ограничиваются преимущественно раковыми клетками, в то время как большинство нормальных клеток остаются незатронутыми [24]. Обратимое, минимальное повреждение нервов может быть значительно уменьшено ежедневным приемом тиамина в количестве нескольких сотен миллиграммов для людей [23] и животных [15]. Количество тиамина варьируется от 50 мг/день до 100 мг/день в зависимости от того, принимается ли он перорально или вводится внутримышечно [23].
Коррекция митохондриальной дисфункции может стать одной из основных будущих фармакологических мишеней для лечения многих заболеваний, поскольку митохондриальная дисфункция при многих заболеваниях является общим патологическим знаменателем. Молочнокислый ацидоз также наблюдается как осложнение при малярии [25], что указывает на участие митохондрий, а в последнее время — при синдроме хронической усталости [26]. Также было показано, что DCA значительно помогает при диабете [27] и семейной гиперхолестеринемии [28].
Заключение
У пациента с неходжкинской лимфомой, принимавшего ежедневно по собственному желанию 10 мг/кг [750 мг] дихлорацетата, через четыре месяца наступила полная ремиссия рака неходжкинской лимфомы, которая продолжается до сих пор при сохранении дозировки DCA в дополнение к приему 750 мг тиамина для защиты от легкого покалывания и онемения в нервах пальцев рук и ног, без ухудшения качества жизни или снижения эффективности лечения. Игнорируя советы врача не заниматься самолечением, он продолжает принимать DCA/тиамин, выражая опасение, что прекращение приема DCA может привести к рецидиву заболевания.
Существует слишком мало данных, чтобы делать абсолютные выводы о применении DCA при раке. Необходимо провести контролируемые исследования для проверки и подтверждения эффективности и поддерживающих уровней DCA в спектре терапии рака.
Конфликт интересов
Автор не сообщает о конфликте интересов. Автор единолично несет ответственность за содержание и написание статьи.
Благодарности
Выражаем благодарность за помощь Джимми Сюю из Университета Карнеги-Меллон. Эта работа была поддержана Фондом Валери Бет Шварц.
ССЫЛКИ
1 Неходжкинская лимфома, Национальный институт рака, Национальные институты здоровья США, Роквилл, штат Мэриленд, США, май 2009 г., http://www.cancer.gov/cancertopics/types/non-hodgkin.
2 J. O. Armitage и D. L. Longo, «Злокачественные опухоли лимфоидных клеток», в Harrisons’s Principles of Internal Medicine, D. L. Kasper, E. Braunwald, and A. S. Fauci, Eds., pp. 642-655, McGraw Hill, New York, NY, USA, 16th edition, 2005.
3 Э. Кимби, Л. Брандт, П. Нигрен и Б. Глимелиус, «Систематический обзор эффектов химиотерапии при агрессивной неходжкинской лимфоме», Acta Oncologica, том 40, № 2-3, стр. 198-212, 2001.
4 Н. Г. Михаэль, «Использование ФДГ-ПЭТ для мониторинга ответа на химиотерапию и радиотерапию у пациентов с лимфомами», Европейский журнал ядерной медицины и молекулярной визуализации, том 33, № 13, приложение 1, стр. 22-26, 2006.
5 J. M. Donohue, H. Galal-Gorchev, W. Brattin, J. J. Liccione, and K. B. Altshuler, Toxicological Review of Dichloroacetic Acid, Integrated Risk Information System, U.S. EPA, Washington, DC, USA, August 2003.
6 И. Р. Шульц и Р. Е. Шангроу, «Влияние кратковременного воздействия дихлорацетата питьевой воды на его фармакокинетику и пероральную биодоступность у людей-добровольцев: исследование стабильных изотопов», Токсикологические науки, том 92, № 1, стр. 42-50, 2006.
7 P. W. Stacpoole, G. N. Henderson, Z. Yan, and M. O. James, «Clinical pharmacology and toxicology of dichloroacetate,» Environmental Health Perspectives, vol. 106, supplement 4, pp. 989-994, 1998.
8 P. W. Stacpoole, A. C. Lorenz, R. G. Thomas, and E. M. Harman, «Dichloroacetate in the treatment of lactic acidosis,» Annals of Internal Medicine, vol. 108, no. 1, pp. 58-63, 1988.
9 P. W. Stacpoole, «The pharmacology of dichloroacetate,» Metabolism, vol. 38, no. 11, pp. 1124-1144, 1989.
10 P. W. Stacpoole, L. R. Gilbert, R. E. Neiberger et al., «Evaluation of long-term treatment of children with congenital lactic acidosis with dichloroacetate,» Pediatrics, vol. 121, no. 5, pp. e1223-e1228, 2008.
11 С. Х. Карри, А. Лоренц, П.-И. Chu, M. Limacher, and P. W. Stacpoole, «(DCA) and oxalate following oral DCA doses,» Biopharmaceutics and Drug Disposition, vol. 12, no. 5, pp. 375- 390, 1991.
12 М. Цзя, Б. Коутс, М. Чадха и др., «Кинетика низких доз 1,2-(13)кдихлорацетата при пероральном и внутривенном введении у человека», Журнал клинической фармакологии, том 46, № 12, стр. 1449-1459, 2006.
13 K. Berendzen, D. W. Theriaque, J. Shuster, and P. W. Stacpoole, «Therapeutic potential of dichloroacetate for pyruvate dehydrogenase complex deficiency,» Mitochondrion, vol. 6, no. 3, pp. 126-135, 2006.
14 P. W. Stacpoole, D. S. Kerr, C. Barnes et al., «Controlled clinical trial of dichloroacetate for treatment of congenital lactic acidosis in children,» Pediatrics, vol. 117, no. 5, pp. 1519- 1531, 2006.
15 P. W. Stacpoole, H. J. Harwood Jr., D. F. Cameron et al., «Хроническая токсичность дихлорацетата: возможная связь с дефицитом тиамина у крыс», Фундаментальная и прикладная токсикология, том 14, № 2, стр. 327-337, 1990.
16 P. W. Stacpoole, T. L. Kurtz, Z. Han, and T. Langaee, «Role of dichloroacetate in the treatment of genetic mitochondrial diseases,» Advanced Drug Delivery Reviews, vol. 60, no. 13-14, pp. 1478-1487, 2008.
17 О. Варбург, Ф. Винд и Э. Негелейн, «Uber den Sto ¨ ffwechsel von Tumoren im Korper,» ¨ Journal of Molecular Medicine, vol. 5, no. 19, pp. 829-832, 1926.
18 E. D. Michelakis, L. Webster, and J. R. Mackey, «Dichloroacetate (DCA) as a potential metabolic-targeting therapy for cancer,» British Journal of Cancer, vol. 99, no. 7, pp. 989-994, 2008.
19 S. Bonnet, S. L. Archer, J. Allalunis-Turner et al., «A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth,» Cancer Cell, vol. 11, no. 1, pp. 37-51, 2007.
20 Р. К. Бутвелл, «Биохимический механизм развития опухоли», в «Carcinogensis Mechanisms of Tumor Promotion and Cocarcinogenesis», T. J. Slaga, A. Sivak, and R. K. Boutwell, Eds., pp. 29-58, Raven press, New York, NY, USA, 1978.
21 J. Y. Y. Wong, G. S. Huggins, M. Debidda, N. C. Munshi, and I. De Vivo, «Dichloroacetate induces apoptosis in endometrial cancer cells,» Gynecologic Oncology, vol. 109, no. 3, pp. 394- 402, 2008.
22 W. Cao, S. Yacoub, K. T. Shiverick et al., «Dichloroacetate (DCA) sensitizes both wild-type and over expressing bcl-2 prostate cancer cells in vitro to radiation,» Prostate, vol. 68, no. 11, pp. 1223-1231, 2008.
23 L. Spruijt, R. K. Naviaux, K. A. McGowan et al., «Изменения нервной проводимости у пациентов с митохондриальными заболеваниями, получающих дихлорацетат», Muscle and Nerve, vol. 24, no. 7, pp. 916-924, 2001.
24 J. G. Pan и T. W. Mak, «Metabolic targeting as an anticancer strategy: dawn of a new era?» Science’s STKE, vol. 2007, no. 381, p. pe14, 2007.
25 S. Krishna, T. Agbenyega, B. J. Angus et al., «Pharmacokinetics and pharmacodynamics of dichloroacetate in children with lactic acidosis due to severe malaria,» QJM, vol. 88, no. 5, pp. 341-349, 1995.
26 С. Майхилл, Н. Е. Бут и Дж. Макларен-Ховард, «Синдром хронической усталости и митохондриальная дисфункция», Международный журнал клинической и экспериментальной медицины, том 2, № 1, с. 1-16, 2009.
27 P. W. Stacpoole, G. W. Moore, and D. M. Kornhauser, «Metabolic e ffects of dichloroacetate in patients with diabetes mellitus and hyperlipoproteinemia,» New England Journal of Medicine, vol. 298, no. 10, pp. 526-530, 1978.
28 G. W. Moore, L. L. Swift, and D. Rabinowitz, «Reduction of serum cholesterol in two patients with homozygous familial hypercholesterolemia by dichloroacetate,» Atherosclerosis, vol. 33, no. 3, pp. 285-293, 1979.