Dana F. Flavin1, 2
1Klinikim Alpenpark, Defreggerweg 2-6, Ringsee, 83707 Tegernsee, Deutschland2
Foundation for Collaborative Medicine and Research, 24 Midwood Drive, Greenwich, CT 06830, USA
Die Korrespondenz ist zu richten an Dana F. Flavin, [email protected]
Eingereicht: 4. Juni 2010Angenommen
: 23. Juli 2010Akademischer
Redakteur: Michael A. CarducciCopyright
© 2010 Dana F. Flavin. Dies ist ein frei zugänglicher Artikel, der unter der Creative Commons Attribution License veröffentlicht wird, die die uneingeschränkte Nutzung, Verbreitung und Vervielfältigung in jedem Medium erlaubt, sofern das Originalwerk ordnungsgemäß zitiert wird.
Im Juni 2007 wurde bei einem 48-jährigen männlichen Patienten ein follikuläres Non-Hodgkin-Lymphom (NHL) im Stadium 4 diagnostiziert und drei Monate lang mit einer herkömmlichen Chemotherapie behandelt, die zu einer vollständigen Remission führte. Fast ein Jahr später kehrten die Tumore im Nasopharynx und in den Halslymphdrüsen zurück. Der Patient lehnte alle vorgeschlagenen Chemotherapien ab und begann mit der Selbstverabreichung von Dichloracetat (DCA) 900 mg täglich, wobei ein PET-Scan vier Monate später eine vollständige Remission zeigte. Seit seiner letzten PET-Untersuchung im Mai 2009 ist er unter kontinuierlicher DCA-Einnahme weiterhin tumorfrei.
EINFÜHRUNG
Das Non-Hodgkin-Lymphom (NHL), ein Lymphdrüsenkrebs, der überall im Körper entstehen kann, betrifft mehr als 400.000 Menschen in den Vereinigten Staaten. 2009 gab es 66.000 neue Fälle [1]. NHL äußert sich häufig in Form von niedrigem Fieber, Schweißausbrüchen, geschwollenen Lymphknoten, allgemeinem Unwohlsein und Müdigkeit. Obwohl es gut auf etablierte Therapien wie Chemotherapie und Bestrahlung anspricht, werden immer aggressivere neuere Behandlungen entwickelt [2]werden derzeit aggressivere neuere Behandlungen entwickelt, darunter eine Chemotherapie mit Ganzkörperbestrahlung und anschließender Stammzellentransplantation [3]. Während diese Behandlungen bei einigen Patienten zu einer vollständigen Remission geführt haben [4]während diese Behandlungen bei einigen Patienten zu einer vollständigen Remission geführt haben, suchen andere Patienten, die sich der Beeinträchtigung der Lebensqualität durch aggressive Therapien bewusst sind [3]sie suchen bei Fachleuten oder auf eigene Faust nach alternativen Behandlungsmöglichkeiten, von denen viele nicht konventionell sind oder sich in einem experimentellen Stadium befinden. Eine dieser Therapien ist Dichloroacetat (DCA) [5].
DCA ist ein Nebenprodukt der Chlorierung von Wasser [6, 7] , das die aerobe Glykolyse hemmt. Es wird in der Medizin seit über 30 Jahren [8] als Prüfpräparat zur Behandlung schwerer Stoffwechselstörungen wie Diabetes und Hypercholesterinämie [5, 9] sowie zur Behandlung der angeborenen Laktatazidose bei nordamerikanischen Kindern [10] eingesetzt. Die Bioverfügbarkeit [11] und Pharmakokinetik [12] von DCA wurden über mehrere Jahrzehnte hinweg bei Erwachsenen [6], Kindern [13, 14] und Tieren [15] gut erforscht. Als Arzneimittel wird DCA in Dosierungen zwischen 10 mg/Kg und 50 mg/Kg im Allgemeinen gut vertragen, obwohl eine längere Exposition mit peripherer Neuropathie verbunden ist [16]. Seine Aktivierung des Pyruvat-Dehydrogenase-Enzyms (PDH) der Mitochondrien verringert die Glykolyse und reaktiviert die Glukoseoxidation, ein günstiger Ansatz zur Verbesserung der Laktatazidose [9].
Krebszellen nutzen überwiegend ein System der Glykolyse zur Energiegewinnung anstelle der von gesunden Zellen verwendeten Glukoseoxidation. Krebs scheint eine Form der intrazellulären Laktatazidose zu sein, die durch eine Blockade der Glukoseoxidation auf der Ebene der PDH (Pyruvatdehydrogenase) verursacht wird. Der Glykolyse-Stoffwechsel von Glukose erhöht die Milchsäure der Krebszellen und senkt den intrazellulären pH-Wert [7] , was zu erheblichen Verschiebungen in der intrazellulären Biochemie führt. Die aerobe Glykolyse, die als „Warburg-Effekt“ [17] bekannt ist, inaktiviert die mitochondriale Atmung, was das Wachstum der Krebszellen ermöglicht [18]. DCA kehrt diese Glykolyse um und verursacht mehrere wichtige schädliche Veränderungen in den Krebstumorzellen.
Zuallererst hemmt DCA die Pyruvat-Dehydrogenase-Kinase (PDK). PDK blockiert die Pyruvatdehydrogenase (PDH) durch ihre Phosphorylierungsaktivität. Wenn diese Kinase durch DCA gehemmt wird, wird die PDH reaktiviert, was dazu führt, dass die Mitochondrien nicht mehr hyperpolarisiert werden, sondern dass die Membran und die Mitochondrien depolarisiert werden, wodurch die mitochondrialen K+-Kanäle reaktiviert werden, was zu einer Verringerung des zytosolischen K+ führt. Wenn PDH in Krebszellen durch PDK gehemmt wird, entsteht ein Überschuss an zytosolischem K+, der die Caspasen 3 und 9, wichtige Faktoren der Apoptose, inaktiviert. DCA reaktiviert diese Caspasen zusammen mit einem Anstieg des intrazellulärenH2O2, wodurch die Freisetzung von Cytochrom c aus den Mitochondrien ermöglicht wird. Die Freisetzung von Cytochrom c ist ein wichtiger Aktivierungsschritt für die Zellapoptose, da sie die Caspase-Kaskade auslöst [19]. Die Auswirkungen von DCA auf Krebserkrankungen sind sowohl in vitro als auch in vivo zu beobachten. Diese Wirkungen sind bei normalen Zellen nicht zu beobachten.
Eine weitere wichtige Wirkung von Dichloracetat auf Krebszellen ist die Freisetzung von mitochondrialem Kalzium (Ca++). Der Anstieg von Ca++ in Krebszellen ist mit der Zunahme und Vermehrung von Transkriptionsfaktoren verbunden. Kalzium aktiviert auch die Ornithindecarboxylase, das ratenlimitierende Enzym der DNA-Synthese [20], und den Antiapoptosefaktor NFAT (Nuclear Factor of Activated T Lymphocytes) [21]. Wenn der Kalziumspiegel durch die Einführung von DCA sinkt, wird die Zelle weiter in Richtung Apoptose und Rückgang der Zellreplikation gelenkt. DCA führt nicht nur zu einer erheblichen Verschiebung der Mitochondrien, des Zytoplasmas und der Zellmembran [19], sondern bewirkt letztendlich auch eine Verlangsamung des Zellzyklus in der Gap-1-Phase (G1), was ebenfalls die Apoptose fördert [22].
Materialien und Methode
Nach einer erfolgreichen Behandlung mit sechs Rituxan- plus CHOP-Behandlungen (Cyclophosphamid, Doxorubicinhydrochlorid, Vincristin und Prednisolon) über einen Zeitraum von drei Monaten im Jahr 2007 zeigte eine Positronen-Emissions-Tomographie (PET) eine vollständige Remission des NHL. Als im August 2008 keine weiteren Behandlungen mehr durchgeführt wurden, zeigte die PET-Untersuchung, dass die Tumoren im Nasenrachenraum und in den Halslymphdrüsen zurückgekehrt waren, was sich in Form von niedrigem Fieber (99,8 Grad), Schweißausbrüchen und Müdigkeit äußerte.
Der Non-Hodgkin-Lymphom-Patient lehnte eine konventionelle Therapie ab, stattdessen besorgte er sich persönlich Dichloracetat (DCA) und begann im August 2008 mit der Selbstverabreichung von 900 mg täglich in einer Dosierung von 10 mg/kg, wobei er zusätzlich täglich 750 mg Thiamin einnahm, um seine Nerven vor Toxizität zu schützen [15, 23]. Vier Monate später zeigte ein PET-Scan eine vollständige Remission (siehe Abbildung 2). Seit der letzten PET-Untersuchung im Mai 2009 ist er unter der fortgesetzten Behandlung mit DCA und Thiamin tumorfrei geblieben. Die monatlichen Blutuntersuchungen zeigen, dass alle seine Parameter normal sind.
Ergebnisse
Im August 2008 klagte ein NHL-Patient, der sich nach einer Chemotherapie seit fast einem Jahr in Remission befand, über Schmerzen und Empfindlichkeit im Halsbereich, wo bei der Untersuchung Ausstülpungen sichtbar waren. Es wurde eine PET-Untersuchung durchgeführt, um die Art des Problems und das Ausmaß des Lymphbefalls zu ermitteln.
Abbildung 1 zeigt mehrere neue hypermetabolische Herde im Kopf- und Halsbereich, die mit einem rezidivierenden Lymphom vereinbar sind; ein neuer Hypermetabolismus im rechten postlateralen Aspekt des Nasopharynx mit einer Größe von 3,2 × 2,2 cm; eine neue hypermetabolische Adenopathie im rechten Halsbereich, die die rechte Jugulo-digastric-Region, die rechte Jugularkette und das rechte hintere Dreieck betrifft und sich bis zum Halsansatz erstreckt; der größte Knoten misst etwa 1.9 × 1,9 cm; mehrere kleinere hypermetabolische Lymphknoten im hinteren Dreieck, die sich bis zur Basis des Halses erstrecken; ein einzelner fokaler Bereich von Hypermetabolismus im linken hinteren Dreieck, der einem kleinen Lymphknoten entspricht, der 1,0 × 0,5 cm groß ist.
Vier Monate nach der täglichen Selbstmedikation der Patientin mit 750 mg DCA zeigte ein PET-Scan keine sichtbaren Anzeichen eines Lymphoms. Die Symptome verschwanden nach einigen Wochen, und die Ergebnisse des PET-Scans 4 Monate später in Abbildung 2 zeigen, dass die zuvor gesehenen Herde abnormaler Aktivität im Nasopharynx und im Hals verschwunden waren; es waren keine abnormalen Herde metabolischer Aktivität zu sehen; es gab keine Hinweise auf eine rezidivierende Erkrankung.

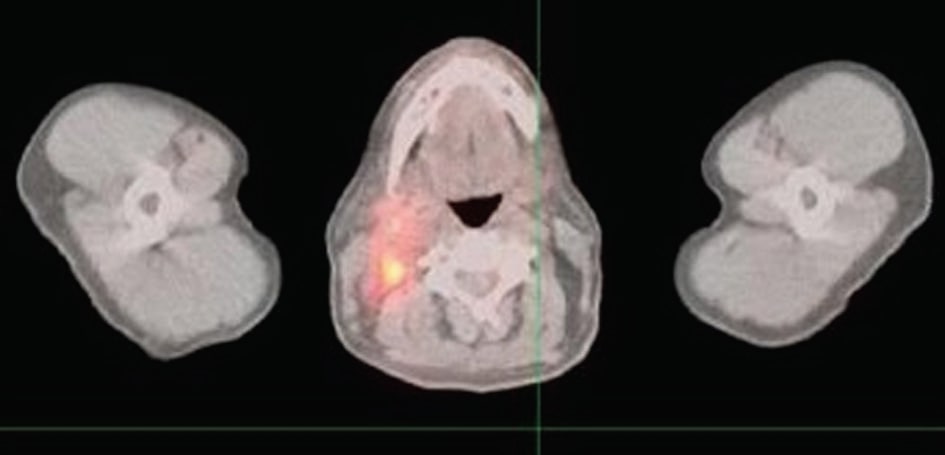
Diskussion
Die Ärzteschaft sieht immer mehr Patienten, die auf eigene Faust nach Therapieformen suchen, die zu unterschiedlichen Ergebnissen führen; einige sind schädlich und gefährlich, während andere das Leben verlängern können, aber dennoch unter ärztlicher Aufsicht durchgeführt werden sollten. Verständlicherweise können Ärzte häufig aus ethischen Gründen keine Ratschläge erteilen oder die von den Patienten bevorzugten Mittel verabreichen, so dass sie die Patienten sich selbst überlassen. Obwohl dieser Fall und andere anekdotische Fälle zu einem erfolgreichen Ergebnis führten, das sich durch die umfangreichen Forschungsarbeiten zur Pharmakologie und Toxikologie der von der Patientin gewählten Dicholoroacetat-Behandlung erklären ließe, wird die Anwendung der Substanz bei Krebspatienten noch untersucht. Derzeit untersuchen wir In-vitro-Tumorproben, um die Empfindlichkeit gegenüber DCA zu testen. Wir untersuchen auch Laborparameter für eine mögliche Laborkorrelation bei Patienten, die auf bestimmte Enzymwerte ansprechen, da die Krebserkrankungen einiger Patienten positiv reagieren oder sich auflösen, DCA scheint nicht tumortypspezifisch zu sein.
Tumorzellen nutzen bevorzugt die Glykolyse, um Adenosintriphosphat (ATP) zu erzeugen, auch in Gegenwart von Sauerstoff, ein Phänomen, das als aerobe Glykolyse oder „Warburg-Effekt“ bekannt ist [17]. Pyruvatdehydrogenase (PDH), ein Gatekeeping-Enzym für den Eintritt von Pyruvat in den mitochondrialen Tricarbonsäurezyklus (TCA) [24], wird in Krebszellen durch Phosphorylierung durch das Enzym Pyruvatdehydrogenasekinase (PDK) gehemmt [18]. Diese Hemmung von PDH durch PDK führt zu einer Verlagerung von der Glukoseoxidation zur Glykolyse, was das Tumorwachstum begünstigt [19]. Es hat sich gezeigt, dass DCA diese Phosphorylierung durch PDK auf der Ebene der Mitochondrienmembran blockiert und die Glykolyse zugunsten der Glukoseoxidation verringert. Diese Rückkehr zu einem normalen Glukosestoffwechsel ermöglicht wichtige Veränderungen, darunter eine Abnahme des intrazellulären Ca++ und eine Stabilisierung der Mitochondrien, die eine Reaktivierung der Caspasen in den Krebszellen ermöglicht, was zur Apoptose führt [19].
Die Wirkungen von DCA, die durch die Reaktivierung der mitochondrialen Atmung verursacht werden, sind nicht ohne Komplikationen, obwohl sie unerklärlicherweise überwiegend auf Krebszellen beschränkt zu sein scheinen, während die meisten normalen Zellen nicht betroffen sind [24]. Eine reversible, minimale Nervenschädigung kann durch eine tägliche Thiaminzufuhr von mehreren hundert Milligramm bei Menschen [23] und Tieren [15] erheblich reduziert werden. Die Thiaminmenge variiert zwischen 50 mg/Tag und 100 mg/Tag, je nachdem, ob es oral verabreicht oder intramuskulär injiziert wird [23].
Die Korrektur der mitochondrialen Dysfunktion könnte in Zukunft eines der wichtigsten pharmakologischen Ziele für die Behandlung vieler Krankheiten sein, da die mitochondriale Dysfunktion bei vielen Krankheiten ein gemeinsamer pathologischer Nenner zu sein scheint. Laktatazidose wird auch als Komplikation bei Malaria [25 ] beobachtet, was auf eine mitochondriale Beteiligung hindeutet, und in jüngerer Zeit auch beim Chronischen Müdigkeitssyndrom [26]. DCA hat sich auch bei Diabetes [27] und familiärer Hypercholesterinämie [28] als sehr hilfreich erwiesen.
Schlussfolgerung
Ein Non-Hodgkin-Lymphom-Patient, der aus eigenem Antrieb täglich 10 mg/kg [750 mg] Dichloracetat einnahm, hatte nach vier Monaten eine vollständige Remission seines Non-Hodgkin-Lymphom-Krebses, die bis heute anhält, wenn er seine DCA-Dosis beibehält und zusätzlich 750 mg Thiamin zum Schutz vor dem leichten Kribbeln und Taubheitsgefühl in den Nerven der Finger und Zehen einnimmt, ohne dass seine Lebensqualität beeinträchtigt oder die Wirksamkeit der Behandlung beeinträchtigt wird. Er hat den ärztlichen Rat, sich nicht selbst zu behandeln, ignoriert und seine DCA/Thiamin-Kur fortgesetzt, da er befürchtet, dass das Absetzen von DCA zu einem Wiederauftreten der Krankheit führen könnte.
Es gibt zu wenig Daten, um absolute Schlussfolgerungen über die Verwendung von DCA bei Krebs zu ziehen. Zur Validierung und Bestätigung der Wirksamkeit von DCA und seiner Erhaltungswerte im Spektrum der Krebstherapien müssen kontrollierte Untersuchungen durchgeführt werden.
Interessenkonflikt
Der Autor meldet keine Interessenkonflikte. Der Autor ist allein für den Inhalt und das Verfassen des Artikels verantwortlich.
Danksagung
Wir sind Jimmy Xu von der Carnegie Mellon University für seine Hilfe dankbar. Diese Arbeit wurde von der Valerie Beth Schwartz Foundation unterstützt.
REFERENZEN
1 Non-Hodgkin’s Lymphoma, National Cancer Institute, U.S. National Institutes of Health, Rockville, Md, USA, Mai 2009, http://www.cancer.gov/cancertopics/types/non-hodgkin.
2 J. O. Armitage und D. L. Longo, „Malignancies of lymphoid cells,“ in Harrisons’s Principles of Internal Medicine, D. L. Kasper, E. Braunwald und A. S. Fauci, Hrsg., S. 642-655, McGraw Hill, New York, NY, USA, 16.
3 E. Kimby, L. Brandt, P. Nygren und B. Glimelius, „A systematic overview of chemotherapy effects in aggressive non-Hodgkin’s lymphoma“, Acta Oncologica, vol. 40, no. 2-3, pp. 198-212, 2001.
4 N. G. Mikhaeel, „Use of FDG-PET to monitor response to chemotherapy and radiotherapy in patients with lymphomas,“ European Journal of Nuclear Medicine and Molecular Imaging, vol. 33, no. 13, supplement 1, pp. 22-26, 2006.
5 J. M. Donohue, H. Galal-Gorchev, W. Brattin, J. J. Liccione, und K. B. Altshuler, Toxicological Review of Dichloroacetic Acid, Integrated Risk Information System, U.S. EPA, Washington, DC, USA, August 2003.
6 I. R. Schultz und R. E. Shangraw, „Effect of short-term drinking water exposure to dichloroacetate on its pharmacokinetics nd oral bioavailability in human volunteers: a stable isotope study,“ Toxicological Sciences, vol. 92, no. 1, pp. 42-50, 2006.
7 P. W. Stacpoole, G. N. Henderson, Z. Yan und M. O. James, „Clinical pharmacology and toxicology of dichloroacetate“, Environmental Health Perspectives, Bd. 106, Beilage 4, S. 989-994, 1998.
8 P. W. Stacpoole, A. C. Lorenz, R. G. Thomas und E. M. Harman, „Dichloracetate in the treatment of lactic acidosis,“ Annals of Internal Medicine, vol. 108, no. 1, pp. 58-63, 1988.
9 P. W. Stacpoole, „The pharmacology of dichloroacetate“, Metabolism, Bd. 38, Nr. 11, S. 1124-1144, 1989.
10 P. W. Stacpoole, L. R. Gilbert, R. E. Neiberger et al., „Evaluation of long-term treatment of children with congenital lactic acidosis with dichloroacetate“, Pediatrics, vol. 121, no. 5, pp. e1223-e1228, 2008.
11 S. H. Curry, A. Lorenz, P.-I. Chu, M. Limacher, and P. W. Stacpoole, „(DCA) and oxalate following oral DCA doses,“ Biopharmaceutics and Drug Disposition, vol. 12, no. 5, pp. 375- 390, 1991.
12 M. Jia, B. Coats, M. Chadha et al., „Human kinetics of orally and intravenously administered low-dose 1,2-(13)Cdichloroacetate,“ Journal of Clinical Pharmacology, vol. 46, no. 12, pp. 1449-1459, 2006.
13 K. Berendzen, D. W. Theriaque, J. Shuster, and P. W. Stacpoole, „Therapeutic potential of dichloroacetate for pyruvate dehydrogenase complex deficiency,“ Mitochondrion, vol. 6, no. 3, pp. 126-135, 2006.
14 P. W. Stacpoole, D. S. Kerr, C. Barnes et al., „Controlled clinical trial of dichloroacetate for treatment of congenital lactic acidosis in children“, Pediatrics, vol. 117, no. 5, pp. 1519- 1531, 2006.
15 P. W. Stacpoole, H. J. Harwood Jr., D. F. Cameron et al., „Chronic toxicity of dichloroacetate: possible relation to thiamine deficiency in rats,“ Fundamental and Applied Toxicology, vol. 14, no. 2, pp. 327-337, 1990.
16 P. W. Stacpoole, T. L. Kurtz, Z. Han und T. Langaee, „Role of dichloroacetate in the treatment of genetic mitochondrial diseases“ (Rolle von Dichloracetat bei der Behandlung genetischer mitochondrialer Erkrankungen), Advanced Drug Delivery Reviews, Bd. 60, Nr. 13-14, S. 1478-1487, 2008.
17 O. Warburg, F. Wind, and E. Negelein, „Uber den Sto ¨ ffwechsel von Tumoren im Korper,“ ¨ Journal of Molecular Medicine, vol. 5, no. 19, pp. 829-832, 1926.
18 E. D. Michelakis, L. Webster und J. R. Mackey, „Dichloroacetate (DCA) as a potential metabolic-targeting therapy for cancer“, British Journal of Cancer, Bd. 99, Nr. 7, S. 989-994, 2008.
19 S. Bonnet, S. L. Archer, J. Allalunis-Turner et al., „A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth,“ Cancer Cell, vol. 11, no. 1, pp. 37-51, 2007.
20 R. K. Boutwell, „Biochemical mechanism of tumor promotion“ (Biochemischer Mechanismus der Tumorförderung), in Carcinogensis Mechanisms of Tumor Promotion and Cocarcinogenesis, T. J. Slaga, A. Sivak, and R. K. Boutwell, Eds., pp. 29-58, Raven press, New York, NY, USA, 1978.
21 J. Y. Y. Wong, G. S. Huggins, M. Debidda, N. C. Munshi, and I. De Vivo, „Dichloroacetate induces apoptosis in endometrial cancer cells,“ Gynecologic Oncology, vol. 109, no. 3, pp. 394- 402, 2008.
22 W. Cao, S. Yacoub, K. T. Shiverick et al., „Dichloracetat (DCA) sensibilisiert sowohl Wildtyp- als auch überexprimierende bcl-2-Prostatakrebszellen in vitro für Strahlung“, Prostate, vol. 68, no. 11, pp. 1223-1231, 2008.
23 L. Spruijt, R. K. Naviaux, K. A. McGowan et al., „Nerve conduction changes in patients with mitochondrial diseases treated with dichloroacetate,“ Muscle and Nerve, vol. 24, no. 7, pp. 916-924, 2001.
24 J. G. Pan und T. W. Mak, „Metabolic targeting as an anticancer strategy: dawn of a new era?“ Science’s STKE, vol. 2007, no. 381, p. pe14, 2007.
25 S. Krishna, T. Agbenyega, B. J. Angus et al., „Pharmacokinetics and pharmacodynamics of dichloroacetate in children with lactic acidosis due to severe malaria,“ QJM, vol. 88, no. 5, pp. 341-349, 1995.
26 S. Myhill, N. E. Booth und J. McLaren-Howard, „Chronic fatigue syndrome and mitochondrial dysfunction“ (Chronisches Müdigkeitssyndrom und mitochondriale Dysfunktion), International Journal of Clinical and Experimental Medicine, Bd. 2, Nr. 1, S. 1-16, 2009.
27 P. W. Stacpoole, G. W. Moore und D. M. Kornhauser, „Metabolic e ffects of dichloroacetate in patients with diabetes mellitus and hyperlipoproteinemia,“ New England Journal of Medicine, vol. 298, no. 10, pp. 526-530, 1978.
28 G. W. Moore, L. L. Swift, and D. Rabinowitz, „Reduction of serum cholesterol in two patients with homozygous familial hypercholesterolemia by dichloroacetate,“ Atherosclerosis, vol. 33, no. 3, pp. 285-293, 1979.