Dana F. Flavin1, 2
1Klinikim Alpenpark, Defreggerweg 2-6, Ringsee, 83707 Tegernsee, Germania
2 Foundation for Collaborative Medicine and Research, 24 Midwood Drive, Greenwich, CT 06830, USA
La corrispondenza va indirizzata a Dana F. Flavin, [email protected]
Ricevuto: 4 giugno 2010
Accettato: 23 luglio 2010
Academic Editor: Michael A. Carducci
Copyright © 2010 Dana F. Flavin. Questo è un articolo ad accesso libero distribuito secondo la Creative Commons Attribution License, che ne consente l’uso, la distribuzione e la riproduzione illimitata su qualsiasi supporto, a condizione che l’opera originale sia adeguatamente citata.
Nel giugno 2007, un paziente maschio di 48 anni, con diagnosi di linfoma non Hodgkin follicolare (NHL) al quarto stadio, è stato trattato per 3 mesi con chemioterapia convenzionale, ottenendo una remissione completa. Quasi un anno dopo, i tumori sono tornati nel rinofaringe e nelle ghiandole linfatiche del collo. Rifiutando tutte le chemioterapie proposte, il paziente ha iniziato ad autosomministrarsi 900 mg di dicloroacetato (DCA) al giorno, con una scansione PET che ha mostrato una remissione completa quattro mesi dopo. Dall’ultima PET, effettuata nel maggio 2009, il paziente è rimasto libero da tumori grazie all’uso continuo del DCA.
INTRODUZIONE
Il linfoma non Hodgkin (NHL), un tumore del sistema linfatico che può insorgere in qualsiasi parte del corpo, colpisce oltre 400.000 persone negli Stati Uniti, con 66.000 nuovi casi nel 2009 [1]. Il NHL si presenta spesso con febbre di basso grado, sudorazione, ingrossamento dei linfonodi, malessere generale e affaticamento. Sebbene risponda bene alle terapie consolidate, tra cui la chemioterapia e le radiazioni [2], si stanno sviluppando nuovi trattamenti più aggressivi, tra cui la chemioterapia con radiazioni su tutto il corpo seguita da trapianti di cellule staminali [3]. Sebbene questi trattamenti abbiano portato alla remissione completa in alcuni pazienti [4], altri pazienti, consapevoli della compromissione della qualità di vita sostenuta con le terapie aggressive [3], cercano vie alternative di trattamento con professionisti o da soli, molte delle quali non convenzionali o in fase sperimentale. Una di queste terapie è il dicloroacetato (DCA) [5].
Il DCA è un sottoprodotto della clorazione dell’acqua [6, 7] che inibisce la glicolisi aerobica. Viene utilizzato in medicina da oltre 30 anni [8] come farmaco sperimentale per il trattamento di gravi disturbi metabolici come il diabete e l’ipercolesterolemia [5, 9] e per il trattamento dell’acidosi lattica congenita nei bambini nordamericani [10]. La biodisponibilità [11] e la farmacocinetica [12] del DCA sono state studiate a fondo per diversi decenni negli adulti [6], nei bambini [13, 14] e negli animali [15]. Come medicinale, il DCA è generalmente ben tollerato a partire da dosaggi compresi tra 10 mg/Kg e 50 mg/Kg, anche se un’esposizione prolungata è associata a neuropatia periferica [16]. La sua attivazione dell’enzima piruvato deidrogenasi (PDH) dei mitocondri diminuisce la glicolisi e riattiva l’ossidazione del glucosio, un approccio favorevole per migliorare l’acidosi lattica [9].
Le cellule tumorali utilizzano prevalentemente un sistema di glicolisi per ottenere energia, invece dell’ossidazione del glucosio utilizzata dalle cellule sane. Il cancro sembra essere una forma di acidosi lattica intracellulare causata da un blocco dell’ossidazione del glucosio a livello della PDH (piruvato deidrogenasi). Il metabolismo glicolitico del glucosio aumenta l’acido lattico delle cellule tumorali e riduce il pH intracellulare [7] con conseguenti importanti cambiamenti nella biochimica intracellulare. La glicolisi aerobica, nota come “effetto Warburg” [17], inattiva la respirazione mitocondriale, consentendo la crescita delle cellule tumorali [18]. Il DCA inverte questa glicolisi causando diversi cambiamenti dannosi nelle cellule tumorali.
Innanzitutto il DCA inibisce la piruvato deidrogenasi chinasi (PDK). La PDK blocca la piruvato deidrogenasi (PDH) attraverso la sua attività di fosforilazione. Quando questa chinasi viene inibita dal DCA, la PDH viene riattivata e i mitocondri non sono più iperpolarizzati, ma la membrana e i mitocondri si depolarizzano, riattivando i canali del K+ mitocondriale che fanno diminuire il K+ citosolico. Quando la PDH è inibita nelle cellule tumorali dalla PDK, si verifica un eccesso di K+ citosolico che inattiva le caspasi 3 e 9, importanti fattori di apoptosi. Il DCA riattiva queste caspasi insieme a un aumento dell’H2O2 intracellulare, consentendo il rilascio del citocromo c dai mitocondri. Il rilascio di citocromo c è una delle principali fasi di attivazione dell’apoptosi cellulare, poiché innesca la cascata delle caspasi [19]. I risultati del DCA sui tumori sono visibili sia in vitro che in vivo. Questi effetti non si osservano nelle cellule normali.
L’altro effetto principale del dicloroacetato sulle cellule tumorali è il rilascio di calcio mitocondriale (Ca++). L’aumento del Ca++ nelle cellule tumorali è associato all’aumento e alla proliferazione dei fattori di trascrizione. Il calcio attiva anche l’ornitina decarbossilasi, l’enzima che limita la velocità di sintesi del DNA [20], e il fattore antiapoptosi NFAT (fattore nucleare dei linfociti T attivati) [21]. Quando il calcio diminuisce con l’introduzione di DCA, la cellula viene ulteriormente indirizzata verso l’apoptosi e una diminuzione della replicazione cellulare. Oltre al fatto che il DCA causa uno spostamento importante nei mitocondri, nel citoplasma e nella membrana cellulare [19], l’effetto finale del DCA è un arresto del ciclo cellulare nella fase Gap 1 (G1), che aumenta anche l’apoptosi [22].
Materiali e metodi
Dopo essere stato trattato con successo con sei trattamenti di Rituxan più regime CHOP (ciclofosfamide, doxorubicina cloridrato, vincristina e prednisolone) per un periodo di tre mesi nel 2007, una tomografia a emissione di positroni (PET) ha mostrato una remissione completa del NHL. Nell’agosto 2008, senza ulteriori trattamenti, la PET ha mostrato il ritorno del tumore nel rinofaringe e nelle ghiandole linfatiche del collo, che si è presentato con febbre di basso grado (99,8), sudorazione e affaticamento.
Il paziente affetto da linfoma non Hodgkin ha rifiutato la terapia convenzionale, procurandosi personalmente il dicloroacetato (DCA), di cui ha iniziato ad autosomministrarsi 900 mg al giorno a 10 mg/kg nell’agosto 2008, aggiungendo ogni giorno 750 mg di tiamina per proteggere i nervi dalla tossicità [15, 23]. Quattro mesi dopo, una scansione PET ha mostrato una remissione completa (vedi Figura 2). Il paziente è rimasto libero da tumori grazie al regime continuato di DCA e tiamina dall’ultima PET, nel maggio 2009. Gli esami del sangue mensili mostrano che tutti i parametri sono normali.
Risultati
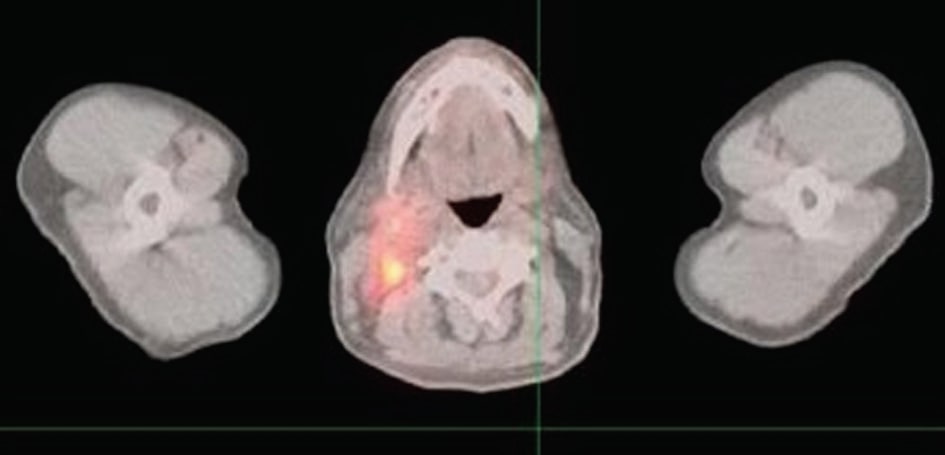
Nell’agosto 2008, un paziente affetto da NHL, in remissione da quasi un anno dopo la chemioterapia, ha lamentato dolore e tenerezza nella zona del collo, dove all’esame erano visibili delle protrusioni. È stata eseguita una PET per indagare la natura del problema e l’estensione del coinvolgimento linfatico.
La Figura 1 mostra diversi nuovi focolai ipermetabolici all’interno della testa e del collo compatibili con un linfoma recidivante; nuovo ipermetabolismo nell’aspetto post-laterale destro del rinofaringe, con dimensioni di 3,2 × 2,2 cm; nuova adenopatia ipermetabolica all’interno del collo destro che coinvolge la regione giugulo-digastrica destra, la catena giugulare destra e il triangolo posteriore destro che si estende fino alla base del collo; il nodo più grande misura circa 1,9 × 1,9 cm; diversi linfonodi di dimensioni maggiori.9 × 1,9 cm; diversi linfonodi ipermetabolici più piccoli nel triangolo posteriore che si estende fino alla base del collo; un’unica area focale di ipermetabolismo nel triangolo posteriore sinistro corrispondente a un piccolo linfonodo che misurava 1,0 × 0,5 cm.
Quattro mesi dopo l’automedicazione quotidiana con 750 mg di DCA, una PET non ha mostrato segni visibili di linfoma. I sintomi sono scomparsi dopo alcune settimane e i risultati della PET di 4 mesi dopo, riportati nella Figura 2, mostrano che i focolai di attività anomala precedentemente osservati nel rinofaringe e nel collo si sono risolti; non sono stati osservati focolai anomali di attività metabolica; non vi è alcuna evidenza di malattia ricorrente.

Discussione
La comunità medica vede sempre più pazienti che cercano forme di terapia per conto proprio con risultati variabili; alcune sono deleterie e pericolose, mentre altre possono prolungare la vita, ma dovrebbero comunque essere effettuate sotto controllo medico. Comprensibilmente, i medici spesso non possono eticamente consigliare o somministrare l’uso delle preferenze dei brevettati, lasciando il paziente ai propri mezzi. Sebbene questo caso, e altri aneddotici, abbiano avuto un esito positivo che potrebbe essere spiegato dall’ampia ricerca esistente sulla farmacologia e la tossicologia del trattamento con dicloracetato scelto dal paziente, l’applicazione del composto nei pazienti oncologici è ancora in fase di studio. Attualmente stiamo esaminando campioni di tumore in vitro per testare la sensibilità al DCA. Stiamo anche esaminando i parametri di laboratorio per verificare una possibile correlazione di laboratorio tra i responder e i livelli enzimatici specifici, poiché i tumori di alcuni pazienti rispondono positivamente o si risolvono, il DCA non sembra essere specifico per il tipo di tumore.
Le cellule tumorali utilizzano preferenzialmente la glicolisi per generare adenosina trifosfato (ATP) anche in presenza di ossigeno, un fenomeno noto come glicolisi aerobica o “effetto Warburg” [17]. La piruvato deidrogenasi (PDH), un enzima che mantiene l’ingresso del piruvato nel ciclo mitocondriale degli acidi tricarbossilici (TCA) [24], è inibita nelle cellule tumorali dalla fosforilazione dell’enzima piruvato deidrogenasi chinasi (PDK) [18]. L’inibizione della PDH da parte della PDK determina un passaggio dall’ossidazione del glucosio alla glicolisi, favorendo la crescita tumorale [19]. È stato dimostrato che il DCA blocca questa fosforilazione da parte della PDK a livello della membrana mitocondriale e diminuisce la glicolisi a favore dell’ossidazione del glucosio. Il ritorno a un normale metabolismo del glucosio consente di ottenere importanti cambiamenti, tra cui una diminuzione del Ca++ intracellulare e una stabilizzazione dei mitocondri che consente la riattivazione delle caspasi nelle cellule tumorali, portando all’apoptosi [19].
Gli effetti del DCA, causati dalla riattivazione della respirazione mitocondriale, non sono privi di complicazioni, anche se inspiegabilmente sembrano essere prevalentemente limitati alle cellule tumorali, mentre la maggior parte delle cellule normali non ne risente [24]. Un danno nervoso reversibile e minimo può essere notevolmente ridotto da un’assunzione giornaliera di tiamina di diverse centinaia di milligrammi per l’uomo [23] e per gli animali [15]. La quantità di tiamina varia da 50 mg/die a 100 mg/die a seconda che venga somministrata per via orale o per via intramuscolare [23].
La correzione della disfunzione mitocondriale potrebbe essere uno dei principali obiettivi farmacologici futuri per il trattamento di molte malattie, dato che la disfunzione mitocondriale di molte malattie sembra essere un denominatore patologico comune. L’acidosi lattica è anche una complicazione della malaria [25], che indica un coinvolgimento mitocondriale, e più recentemente della sindrome da fatica cronica [26]. È stato inoltre dimostrato che il DCA è di grande aiuto nel diabete [27] e nell’ipercolesterolemia familiare [28].
Conclusioni
Un paziente affetto da linfoma Non-Hodgkin che assumeva di propria iniziativa 10 mg/kg [750 mg] di dicloroacetato al giorno, dopo quattro mesi ha avuto una remissione completa del suo linfoma Non-Hodgkin, che è proseguita fino ad oggi mantenendo il dosaggio di DCA e assumendo 750 mg di tiamina per proteggersi dal leggero formicolio e intorpidimento dei nervi delle dita delle mani e dei piedi, senza compromettere la qualità della vita o l’efficacia del trattamento. Ignorando il consiglio medico di non automedicarsi, ha continuato il suo regime di DCA/tiamina, dichiarando di temere che l’interruzione del DCA possa consentire una recidiva della malattia.
I dati a disposizione sono troppo pochi per trarre conclusioni assolute sull’uso del DCA per il cancro. È necessario condurre ricerche controllate per convalidare e confermare l’efficacia e i livelli di mantenimento del DCA nello spettro delle terapie antitumorali.
Conflitto di interessi
L’autore non segnala alcun conflitto di interessi. L’autore è l’unico responsabile del contenuto e della stesura dell’articolo.
Ringraziamenti
Si ringrazia l’aiuto di Jimmy Xu della Carnegie Mellon University. Questo lavoro è stato sostenuto dalla Valerie Beth Schwartz Foundation.
RIFERIMENTI
1 Linfoma non Hodgkin, National Cancer Institute, U.S. National Institutes of Health, Rockville, Md, USA, maggio 2009, http://www.cancer.gov/cancertopics/types/non-hodgkin.
2 J. O. Armitage e D. L. Longo, “Malignità delle cellule linfoidi”, in Harrisons’s Principles of Internal Medicine, D. L. Kasper, E. Braunwald, and A. S. Fauci, Eds., pp. 642-655, McGraw Hill, New York, NY, USA, 16a edizione, 2005.
3 E. Kimby, L. Brandt, P. Nygren e B. Glimelius, “A systematic overview of chemotherapy effects in aggressive non-Hodgkin’s lymphoma”, Acta Oncologica, vol. 40, n. 2-3, pp. 198-212, 2001.
4 N. G. Mikhaeel, “Uso della FDG-PET per monitorare la risposta alla chemioterapia e alla radioterapia in pazienti con linfomi”, European Journal of Nuclear Medicine and Molecular Imaging, vol. 33, n. 13, supplemento 1, pp. 22-26, 2006.
5 J. M. Donohue, H. Galal-Gorchev, W. Brattin, J. J. Liccione e K. B. Altshuler, Toxicological Review of Dichloroacetic Acid, Integrated Risk Information System, U.S. EPA, Washington, DC, USA, agosto 2003.
6 I. R. Schultz e R. E. Shangraw, “Effect of short-term drinking water exposure to dichloroacetate on its pharmacokinetics nd oral bioavailability in human volunteers: a stable isotope study”, Toxicological Sciences, vol. 92, no. 1, pp. 42-50, 2006.
7 P. W. Stacpoole, G. N. Henderson, Z. Yan e M. O. James, “Clinical pharmacology and toxicology of dichloroacetate”, Environmental Health Perspectives, vol. 106, supplemento 4, pp. 989-994, 1998.
8 P. W. Stacpoole, A. C. Lorenz, R. G. Thomas e E. M. Harman, “Il dicloroacetato nel trattamento dell’acidosi lattica”, Annals of Internal Medicine, vol. 108, n. 1, pp. 58-63, 1988.
9 P. W. Stacpoole, “La farmacologia del dicloroacetato”, Metabolismo, vol. 38, n. 11, pp. 1124-1144, 1989.
10 P. W. Stacpoole, L. R. Gilbert, R. E. Neiberger et al., “Evaluation of long-term treatment of children with congenital lactic acidosis with dichloroacetate”, Pediatrics, vol. 121, no. 5, pp. e1223-e1228, 2008.
11 S. H. Curry, A. Lorenz, P.-I. Chu, M. Limacher e P. W. Stacpoole, “(DCA) e ossalato in seguito a dosi orali di DCA”, Biopharmaceutics and Drug Disposition, vol. 12, no. 5, pp. 375-390, 1991.
12 M. Jia, B. Coats, M. Chadha et al., “Cinetica umana di 1,2-(13)dicloroacetato somministrato per via orale ed endovenosa a basse dosi”, Journal of Clinical Pharmacology, vol. 46, n. 12, pp. 1449-1459, 2006.
13 K. Berendzen, D. W. Theriaque, J. Shuster e P. W. Stacpoole, “Potenziale terapeutico del dicloroacetato per il deficit del complesso della piruvato deidrogenasi”, Mitochondrion, vol. 6, n. 3, pp. 126-135, 2006. 3, pagg. 126-135, 2006.
14 P. W. Stacpoole, D. S. Kerr, C. Barnes et al., “Studio clinico controllato del dicloroacetato per il trattamento dell’acidosi lattica congenita nei bambini”, Pediatrics, vol. 117, no. 5, pagg. 1519-1531, 2006.
15 P. W. Stacpoole, H. J. Harwood Jr., D. F. Cameron et al., “Tossicità cronica del dicloroacetato: possibile relazione con la carenza di tiamina nei ratti”, Fundamental and Applied Toxicology, vol. 14, n. 2, pp. 327-337, 1990.
16 P. W. Stacpoole, T. L. Kurtz, Z. Han e T. Langaee, “Role of dichloroacetate in the treatment of genetic mitochondrial diseases”, Advanced Drug Delivery Reviews, vol. 60, n. 13-14, pp. 1478-1487, 2008.
17 O. Warburg, F. Wind e E. Negelein, “Uber den Sto ¨ ffwechsel von Tumoren im Korper”, ¨ Journal of Molecular Medicine, vol. 5, n. 19, pp. 829-832, 1926.
18 E. D. Michelakis, L. Webster e J. R. Mackey, “Il dicloroacetato (DCA) come potenziale terapia a bersaglio metabolico per il cancro”, British Journal of Cancer, vol. 99, n. 7, pp. 989-994, 2008.
19 S. Bonnet, S. L. Archer, J. Allalunis-Turner et al., “A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth”, Cancer Cell, vol. 11, n. 1, pp. 37-51, 2007.
20 R. K. Boutwell, “Biochemical mechanism of tumor promotion”, in Carcinogensis Mechanisms of Tumor Promotion and Cocarcinogenesis, T. J. Slaga, A. Sivak, and R. K. Boutwell, Eds., pp. 29-58, Raven press, New York, NY, USA, 1978.
21 J. Y. Y. Wong, G. S. Huggins, M. Debidda, N. C. Munshi e I. De Vivo, “Il dicloroacetato induce l’apoptosi nelle cellule del cancro endometriale”, Oncologia ginecologica, vol. 109, n. 3, pp. 394-40. 3, pp. 394-402, 2008.
22 W. Cao, S. Yacoub, K. T. Shiverick et al., “Il dicloroacetato (DCA) sensibilizza alle radiazioni sia le cellule di cancro alla prostata wild-type che quelle che esprimono bcl-2 in vitro”, Prostate, vol. 68, n. 11, pp. 1223-1231, 2008.
23 L. Spruijt, R. K. Naviaux, K. A. McGowan et al., “Cambiamenti nella conduzione nervosa in pazienti con malattie mitocondriali trattati con dicloroacetato”, Muscle and Nerve, vol. 24, n. 7, pp. 916-924, 2001.
24 J. G. Pan e T. W. Mak, “Il targeting metabolico come strategia antitumorale: l’alba di una nuova era?” Science’s STKE, vol. 2007, no. 381, pag. pe14, 2007.
25 S. Krishna, T. Agbenyega, B. J. Angus et al., “Pharmacokinetics and pharmacodynamics of dichloroacetate in children with lactic acidosis due to severe malaria”, QJM, vol. 88, no. 5, pp. 341-349, 1995.
26 S. Myhill, N. E. Booth e J. McLaren-Howard, “Sindrome da fatica cronica e disfunzione mitocondriale”, International Journal of Clinical and Experimental Medicine, vol. 2, n. 1, pp. 1-16, 2009.
27 P. W. Stacpoole, G. W. Moore e D. M. Kornhauser, “Metabolic e ffects of dichloroacetate in patients with diabetes mellitus and hyperlipoproteinemia”, New England Journal of Medicine, vol. 298, n. 10, pp. 526-530, 1978.
28 G. W. Moore, L. L. Swift e D. Rabinowitz, “Riduzione del colesterolo sierico in due pazienti con ipercolesterolemia familiare omozigote mediante dicloroacetato”, Atherosclerosis, vol. 33, n. 3, pp. 285-293, 1978. 3, pp. 285-293, 1979.