Dana F. Flavin1, 2
1Klinikim Alpenpark, Defreggerweg 2-6, Ringsee, 83707 Tegernsee, Allemagne
2 Fondation pour la médecine et la recherche collaboratives, 24 Midwood Drive, Greenwich, CT 06830, USA
Toute correspondance doit être adressée à Dana F. Flavin, [email protected]
Reçue : 4 juin 2010
Accepté : 23 juillet 2010
Rédacteur académique : Michael A. Carducci
Copyright © 2010 Dana F. Flavin. Il s’agit d’un article en libre accès distribué sous la licence Creative Commons Attribution, qui permet l’utilisation, la distribution et la reproduction sans restriction sur tout support, à condition que l’œuvre originale soit correctement citée.
En juin 2007, un homme de 48 ans, chez qui on a diagnostiqué un lymphome folliculaire non hodgkinien (LNH) de stade 4, a été traité pendant trois mois par chimiothérapie conventionnelle, ce qui a entraîné une rémission complète. Près d’un an plus tard, des tumeurs sont réapparues dans le nasopharynx et les ganglions lymphatiques du cou. Refusant toutes les chimiothérapies proposées, le patient a commencé à s’auto-administrer du dichloroacétate (DCA) à raison de 900 mg par jour. Un scanner TEP a révélé une rémission complète quatre mois plus tard. Depuis son dernier examen TEP, en mai 2009, il n’a plus de tumeur grâce à l’utilisation continue de DCA.
INTRODUCTION
Le lymphome non hodgkinien (LNH), un cancer du système lymphatique qui peut se développer n’importe où dans le corps, touche plus de 400 000 personnes aux États-Unis, avec 66 000 nouveaux cas en 2009 [1]. Le LNH se présente souvent sous la forme d’une fièvre légère accompagnée de sueurs, de ganglions lymphatiques enflés, d’un malaise général et de fatigue. Bien qu’il réponde bien aux thérapies établies, notamment la chimiothérapie et la radiothérapie [2], de nouveaux traitements plus agressifs sont en cours de développement, notamment la chimiothérapie avec radiothérapie du corps entier suivie de greffes de cellules souches [3]. Bien que ces traitements aient entraîné une rémission complète chez certains patients [4], d’autres patients, conscients de la qualité de vie compromise par les thérapies agressives [3], recherchent d’autres voies de traitement avec des professionnels ou par eux-mêmes, dont beaucoup sont non conventionnelles ou à un stade expérimental. L’une de ces thérapies est le dichloroacétate (DCA) [5].
Le DCA est un sous-produit de la chloration de l’eau [6, 7] qui inhibe la glycolyse aérobie. Il est utilisé en médecine depuis plus de 30 ans [8] comme médicament expérimental pour traiter des troubles métaboliques graves tels que le diabète et l’hypercholestérolémie [5, 9] ainsi que pour traiter l’acidose lactique congénitale chez les enfants nord-américains [10]. La biodisponibilité [11] et la pharmacocinétique [12] du DCA ont fait l’objet de recherches approfondies pendant plusieurs décennies chez les adultes [6], les enfants [13, 14] et les animaux [15]. En tant que médicament, le DCA est généralement bien toléré à des doses comprises entre 10 mg/Kg et 50 mg/Kg, bien qu’une exposition prolongée soit associée à une neuropathie périphérique [16]. Son activation de l’enzyme pyruvate déshydrogénase (PDH) de la mitochondrie diminue la glycolyse et réactive l’oxydation du glucose, une approche favorable pour améliorer l’acidose lactique [9].
Les cellules cancéreuses utilisent principalement un système de glycolyse pour produire de l’énergie au lieu de l’oxydation du glucose utilisée par les cellules saines. Le cancer semble être une forme d’acidose lactique intracellulaire causée par un blocage de l’oxydation du glucose au niveau de la PDH (pyruvate déshydrogénase). Le métabolisme du glucose par la glycolyse augmente l’acide lactique des cellules cancéreuses et réduit le pH intracellulaire [7] entraînant des modifications majeures de la biochimie intracellulaire. La glycolyse aérobie, connue sous le nom d' »effet Warburg » [17], désactive la respiration mitochondriale, ce qui permet la croissance des cellules cancéreuses [18]. Le DCA inverse cette glycolyse en provoquant plusieurs changements préjudiciables majeurs dans les cellules tumorales cancéreuses.
Tout d’abord, le DCA inhibe la pyruvate déshydrogénase kinase (PDK). La PDK bloque la pyruvate déshydrogénase (PDH) par son activité de phosphorylation. Lorsque cette kinase est inhibée par le DCA, la PDH est réactivée, ce qui fait que la mitochondrie n’est plus hyperpolarisée, mais que la membrane et la mitochondrie sont dépolarisées, ce qui réactive les canaux K+ mitochondriaux et diminue ensuite le K+ cytosolique. Lorsque la PDH est inhibée par la PDK dans les cellules cancéreuses, il se produit un excès de K+ cytosolique qui inactive les caspases 3 et 9, facteurs importants de l’apoptose. Le DCA réactive ces caspases en même temps qu’une augmentation de H2O2 au niveau intracellulaire, permettant la libération du cytochrome c par les mitochondries. La libération du cytochrome c est une étape majeure de l’activation de l’apoptose cellulaire car elle déclenche la cascade des caspases [19]. Les résultats du DCA sur les cancers sont observés à la fois in vitro et in vivo. Ces effets ne sont pas observés sur les cellules normales.
L’autre effet majeur du dichloroacétate sur les cellules cancéreuses est la libération de calcium mitochondrial (Ca++). L’augmentation du Ca++ dans les cellules cancéreuses est associée à l’augmentation et à la prolifération des facteurs de transcription. Le calcium active également l’ornithine décarboxylase, l’enzyme limitant la vitesse de synthèse de l’ADN [20], et le facteur anti-apoptose NFAT (nuclear factor of activated T lymphocytes) [21]. Lorsque le calcium diminue avec l’introduction du DCA, la cellule s’oriente davantage vers l’apoptose et une diminution de la réplication cellulaire. En plus du fait que le DCA provoque un changement majeur dans les mitochondries, le cytoplasme et la membrane cellulaire [19], l’effet final du DCA est un arrêt du cycle cellulaire dans la phase Gap 1 (G1), ce qui augmente également l’apoptose [22].
Matériel et méthode
Après avoir été traité avec succès par six traitements de Rituxan plus le régime CHOP (cyclophosphamide, chlorhydrate de doxorubicine, vincristine et prednisolone) sur une période de trois mois en 2007, une tomographie par émission de positrons (TEP) a montré une rémission complète du LNH. En août 2008, sans autre traitement, la TEP a montré que les tumeurs étaient revenues dans le nasopharynx et les ganglions lymphatiques du cou. Le patient a présenté une faible fièvre de 99,8, des sueurs et de la fatigue.
Le patient atteint d’un lymphome non hodgkinien a refusé le traitement conventionnel et s’est procuré personnellement du dichloroacétate (DCA) qu’il a commencé à s’auto-administrer à raison de 900 mg par jour à 10 mg/kg en août 2008, en ajoutant 750 mg de thiamine par jour pour protéger ses nerfs de la toxicité [15, 23]. Quatre mois plus tard, une TEP a révélé une rémission complète (voir figure 2). Il est resté sans tumeur grâce au régime continu de DCA et de thiamine depuis sa dernière TEP en mai 2009. Les analyses de sang mensuelles montrent que tous ses paramètres sont normaux.
Résultats
En août 2008, un patient atteint de LNH, qui était en rémission depuis près d’un an après une chimiothérapie, s’est plaint d’une douleur et d’une sensibilité dans la région du cou où des protubérances étaient visibles à l’examen. Une TEP a été réalisée pour étudier la nature du problème et l’étendue de l’atteinte lymphatique.
La figure 1 montre que plusieurs nouveaux foyers hypermétaboliques dans la tête et le cou compatibles avec un lymphome récurrent ; un nouvel hypermétabolisme dans l’aspect post-latéral droit du nasopharynx, mesurant 3,2 × 2,2 cm ; une nouvelle adénopathie hypermétabolique dans le cou droit impliquant la région jugulo-digastrique droite, la chaîne jugulaire droite et le triangle postérieur droit s’étendant jusqu’à la base du cou ; le plus grand ganglion mesurant environ 1.9 × 1,9 cm ; plusieurs ganglions lymphatiques hypermétaboliques plus petits dans le triangle postérieur s’étendant jusqu’à la base du cou ; une seule zone focale d’hypermétabolisme dans le triangle postérieur gauche correspondant à un petit ganglion lymphatique qui mesurait 1,0 × 0,5 cm.
Quatre mois après l’automédication quotidienne du patient avec 750 mg de DCA, un PET scan n’a montré aucun signe visible de lymphome. Les symptômes ont disparu après plusieurs semaines et les résultats de la TEP 4 mois plus tard (figure 2) montrent que les foyers d’activité anormale observés précédemment dans le nasopharynx et le cou se sont résorbés ; aucun foyer anormal d’activité métabolique n’a été observé ; aucun signe de maladie récurrente.

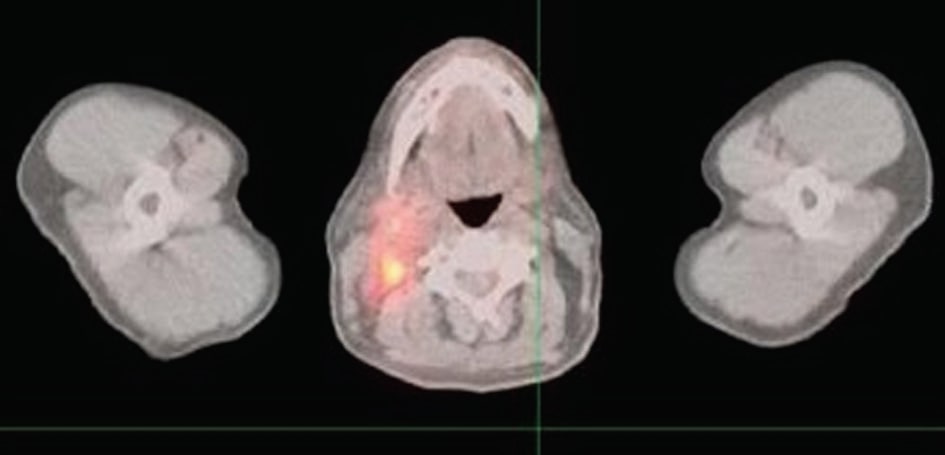
Discussion
La communauté médicale voit de plus en plus de patients qui recherchent des formes de thérapie par eux-mêmes avec des résultats variables ; certains sont délétères et dangereux tandis que d’autres peuvent prolonger leur vie mais doivent toujours être effectués sous surveillance médicale. Il est compréhensible que les médecins ne puissent souvent pas, d’un point de vue éthique, conseiller ou administrer l’utilisation des préférences des brevets, laissant le patient à ses propres moyens. Bien que ce cas, et d’autres cas anecdotiques, se soient soldés par une issue favorable qui pourrait s’expliquer par les recherches approfondies existantes sur la pharmacologie et la toxicologie du traitement au dicholoroacétate choisi par le patient, l’application du composé chez les patients atteints de cancer est toujours à l’étude. Nous étudions actuellement des échantillons de tumeurs in vitro pour tester la sensibilité au DCA. Nous étudions également les paramètres de laboratoire afin d’établir une éventuelle corrélation entre les répondeurs et les niveaux d’enzymes spécifiques, car les cancers de certains patients réagissent positivement ou sont résolus.
Les cellules tumorales utilisent de préférence la glycolyse pour générer de l’adénosine triphosphate (ATP) même en présence d’oxygène, un phénomène connu sous le nom de glycolyse aérobie ou « effet Warburg
[17]. La pyruvate déshydrogénase (PDH), une enzyme de contrôle de l’entrée du pyruvate dans le cycle mitochondrial de l’acide tricarboxylique (TCA) [24], est inhibée dans les cellules cancéreuses par la phosphorylation de l’enzyme pyruvate déshydrogénase kinase (PDK) [18]. Cette inhibition de la PDH par la PDK entraîne un passage de l’oxydation du glucose à la glycolyse, ce qui favorise la croissance tumorale [19]. Il a été démontré que le DCA bloque cette phosphorylation par la PDK au niveau de la membrane mitochondriale et diminue la glycolyse au profit de l’oxydation du glucose. Ce retour à un métabolisme normal du glucose permet des changements majeurs dont une diminution du Ca++ intracellulaire, et une stabilisation des mitochondries permettant une réactivation des caspases dans les cellules cancéreuses conduisant à l’apoptose [19].
Les effets du DCA, causés par la réactivation de la respiration mitochondriale, ne sont pas sans complications, bien qu’ils semblent inexplicablement se limiter principalement aux cellules cancéreuses, alors que la plupart des cellules normales ne sont pas affectées [24]. Une lésion nerveuse minime et réversible peut être considérablement réduite par un apport quotidien de thiamine de plusieurs centaines de milligrammes chez l’homme [23] et chez l’animal [15]. La quantité de thiamine varie de 50 mg/jour à 100 mg/jour selon qu’elle est administrée par voie orale ou injectée par voie intramusculaire [23].
La correction du dysfonctionnement mitochondrial pourrait être l’une des principales cibles pharmacologiques futures pour le traitement de nombreuses maladies, car le dysfonctionnement mitochondrial de nombreuses maladies semble être un dénominateur pathologique commun. L’acidose lactique est également observée comme une complication de la malaria [25], indiquant une implication mitochondriale, et plus récemment du syndrome de fatigue chronique [26]. Il a également été démontré que le DCA apporte une aide considérable dans le diabète [27] et l’hypercholestérolémie familiale [28].
Conclusion
Un patient souffrant d’un lymphome non hodgkinien et prenant de son propre chef 10 mg/kg [750 mg] de dichloroacétate par jour a connu une rémission complète de son lymphome non hodgkinien au bout de quatre mois, rémission qui s’est poursuivie jusqu’à ce jour grâce au maintien de la dose de DCA et à la prise de 750 mg de thiamine pour se protéger contre les légers picotements et engourdissements des nerfs des doigts et des orteils, sans compromettre sa qualité de vie ni affecter l’efficacité du traitement. Ignorant le conseil médical de ne pas s’automédicamenter, il a poursuivi son régime DCA/thiamine, déclarant qu’il craignait que l’arrêt du DCA ne permette une récidive de la maladie.
Il y a trop peu de données pour tirer des conclusions absolues sur l’utilisation du DCA pour le cancer. Des recherches contrôlées doivent être menées pour valider et confirmer l’efficacité et les niveaux de maintien du DCA dans le spectre des thérapies du cancer.
Conflit d’intérêts
L’auteur ne signale aucun conflit d’intérêts. L’auteur est seul responsable du contenu et de la rédaction de l’article.
Remerciements
Nous tenons à remercier Jimmy Xu de l’Université Carnegie Mellon pour son aide. Ce travail a été soutenu par la Fondation Valerie Beth Schwartz.
RÉFÉRENCES
1 Non-Hodgkin’s Lymphoma, National Cancer Institute, U.S. National Institutes of Health, Rockville, Md, USA, mai 2009, http://www.cancer.gov/cancertopics/types/non-hodgkin.
2 J. O. Armitage et D. L. Longo, « Malignancies of lymphoid cells », in Harrisons’s Principles of Internal Medicine, D. L. Kasper, E. Braunwald, and A. S. Fauci, Eds, pp. 642-655, McGraw Hill, New York, NY, USA, 16th edition, 2005.
3 E. Kimby, L. Brandt, P. Nygren et B. Glimelius, « A systematic overview of chemotherapy effects in aggressive non-Hodgkin’s lymphoma », Acta Oncologica, vol. 40, no. 2-3, pp. 198-212, 2001.
4 N. G. Mikhaeel, « Use of FDG-PET to monitor response to chemotherapy and radiotherapy in patients with lymphomas, » European Journal of Nuclear Medicine and Molecular Imaging, vol. 33, no. 13, supplement 1, pp. 22-26, 2006.
5 J. M. Donohue, H. Galal-Gorchev, W. Brattin, J. J. Liccione, et K. B. Altshuler, Toxicological Review of Dichloroacetic Acid, Integrated Risk Information System, U.S. EPA, Washington, DC, USA, août 2003.
6 I. R. Schultz et R. E. Shangraw, « Effect of short-term drinking water exposure to dichloroacetate on its pharmacokinetics nd oral bioavailability in human volunteers : a stable isotope study », Toxicological Sciences, vol. 92, no. 1, pp. 42-50, 2006.
7 P. W. Stacpoole, G. N. Henderson, Z. Yan, and M. O. James, « Clinical pharmacology and toxicology of dichloroacetate, » Environmental Health Perspectives, vol. 106, supplement 4, pp. 989-994, 1998.
8 P. W. Stacpoole, A. C. Lorenz, R. G. Thomas, and E. M. Harman, « Dichloroacetate in the treatment of lactic acidosis, » Annals of Internal Medicine, vol. 108, no. 1, pp. 58-63, 1988.
9 P. W. Stacpoole, « The pharmacology of dichloroacetate, » Metabolism, vol. 38, no. 11, pp. 1124-1144, 1989.
10 P. W. Stacpoole, L. R. Gilbert, R. E. Neiberger et al. « Evaluation of long-term treatment of children with congenital lactic acidosis with dichloroacetate », Pediatrics, vol. 121, no. 5, pp. e1223-e1228, 2008.
11 S. H. Curry, A. Lorenz, P.-I. Chu, M. Limacher et P. W. Stacpoole, » (DCA) and oxalate following oral DCA doses « , Biopharmaceutics and Drug Disposition, vol. 12, no. 5, pp. 375- 390, 1991.
12 M. Jia, B. Coats, M. Chadha et al, « Human kinetics of orally and intravenously administered low-dose 1,2-(13)Cdichloroacetate, » Journal of Clinical Pharmacology, vol. 46, no. 12, pp. 1449-1459, 2006.
13 K. Berendzen, D. W. Theriaque, J. Shuster, and P. W. Stacpoole, « Therapeutic potential of dichloroacetate for pyruvate dehydrogenase complex deficiency, » Mitochondrion, vol. 6, no. 3, pp. 126-135, 2006.
14 P. W. Stacpoole, D. S. Kerr, C. Barnes et al. » Controlled clinical trial of dichloroacetate for treatment of congenital lactic acidosis in children « , Pediatrics, vol. 117, no. 5, pp. 1519- 1531, 2006.
15 P. W. Stacpoole, H. J. Harwood Jr, D. F. Cameron et al, « Chronic toxicity of dichloroacetate : possible relation to thiamine deficiency in rats, » Fundamental and Applied Toxicology, vol. 14, no. 2, pp. 327-337, 1990.
16 P. W. Stacpoole, T. L. Kurtz, Z. Han et T. Langaee, » Role of dichloroacetate in the treatment of genetic mitochondrial diseases « , Advanced Drug Delivery Reviews, vol. 60, no 13-14, pp. 1478-1487, 2008.
17 O. Warburg, F. Wind et E. Negelein, » Uber den Sto ¨ ffwechsel von Tumoren im Korper « , ¨ Journal of Molecular Medicine, vol. 5, no 19, p. 829-832, 1926.
18 E. D. Michelakis, L. Webster, and J. R. Mackey, « Dichloroacetate (DCA) as a potential metabolic-targeting therapy for cancer, » British Journal of Cancer, vol. 99, no. 7, pp. 989-994, 2008.
19 S. Bonnet, S. L. Archer, J. Allalunis-Turner et al. « A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth », Cancer Cell, vol. 11, no. 1, pp. 37-51, 2007.
20 R. K. Boutwell, « Biochemical mechanism of tumor promotion », in Carcinogensis Mechanisms of Tumor Promotion and Cocarcinogenesis, T. J. Slaga, A. Sivak, and R. K. Boutwell, Eds, pp. 29-58, Raven press, New York, NY, USA, 1978.
21 J. Y. Y. Wong, G. S. Huggins, M. Debidda, N. C. Munshi, and I. De Vivo, « Dichloroacetate induces apoptosis in endometrial cancer cells, » Gynecologic Oncology, vol. 109, no. 3, pp. 394- 402, 2008.
22 W. Cao, S. Yacoub, K. T. Shiverick et al, « Dichloroacetate (DCA) sensitizes both wild-type and over expressing bcl-2 prostate cancer cells in vitro to radiation, » Prostate, vol. 68, no. 11, pp. 1223-1231, 2008.
23 L. Spruijt, R. K. Naviaux, K. A. McGowan et al. « Nerve conduction changes in patients with mitochondrial diseases treated with dichloroacetate », Muscle and Nerve, vol. 24, no. 7, pp. 916-924, 2001.
24 J. G. Pan et T. W. Mak, « Metabolic targeting as an anticancer strategy : dawn of a new era ? » (Le ciblage métabolique comme stratégie anticancéreuse : l’aube d’une nouvelle ère ?) STKE de la science, vol. 2007, no. 381, p. pe14, 2007.
25 S. Krishna, T. Agbenyega, B. J. Angus et al. « Pharmacokinetics and pharmacodynamics of dichloroacetate in children with lactic acidosis due to severe malaria », QJM, vol. 88, no. 5, pp. 341-349, 1995.
26 S. Myhill, N. E. Booth, et J. McLaren-Howard, » Chronic fatigue syndrome and mitochondrial dysfunction « , International Journal of Clinical and Experimental Medicine, vol. 2, no. 1, pp. 1-16, 2009.
27 P. W. Stacpoole, G. W. Moore, and D. M. Kornhauser, « Metabolic e ffects of dichloroacetate in patients with diabetes mellitus and hyperlipoproteinemia, » New England Journal of Medicine, vol. 298, no. 10, pp. 526-530, 1978.
28 G. W. Moore, L. L. Swift, and D. Rabinowitz, « Reduction of serum cholesterol in two patients with homozygous familial hypercholesterolemia by dichloroacetate, » Atherosclerosis, vol. 33, no. 3, pp. 285-293, 1979.