Gulsah ALBAYRAK1, Ece KONAC1, Umit Akin DERE2, Hakan EMMEZ2
1 Gazi Universiteit, Faculteit Geneeskunde, Afdeling Medische Biologie en Genetica, Ankara, Turkije
2 Gazi Universiteit, Faculteit Geneeskunde, Afdeling Neurochirurgie, Ankara, Turkije
Correspondentie: Ece KONAC; E-mail: [email protected]
Ontvangen: 16 januari 2020
Geaccepteerd: 3 juli 2020
Gepubliceerd: 29 december 2020
Abstract
DOEL: Het onderzoeken van de effecten van metformine, dichlooracetaat (DCA), en memantine op T98G en U87-MG menselijke glioblastoma (GBM) cellen om het metabolisme van tumorcellen op een multidirectionele manier aan te pakken.
MATERIAAL EN METHODEN: De IC50-niveaus voor metformine, DCA, metformine+DCA en memantine werden bepaald door middel van een MTT-test in T98G- en U87-MG-cellen in vitro. Casp3, Bcl-2, Bax, c-Myc en GSK-3B eiwitexpressies werden onderzocht na behandelingen. Vijftien GBM+ tumorweefsels werden beoordeeld op Casp-3, Bcl-2, Bad, Bax voor apoptotische eiwitexpressiepatronen.
RESULTATEN: Kankercelmetabolisme gerichte geneesmiddelen metformine, DCA, metformine+DCA en memantine induceerden cytotoxiciteit op dosisafhankelijke wijze in T98G- en U87-MG-cellen. IC50 voor memantine werd gevonden als 0,5 mM (p<0,01), wat bijna 10 keer een lagere concentratie is dan die van metformine. Vijftien GBM+ tumorweefsels hadden verschillende apoptotische eiwitexpressies.
CONCLUSIE: Memantine oefende een antikankermechanisme uit in T98G- en U87-MG-cellen, maar een dergelijk mechanisme vereist nader onderzoek voor de behandeling van GBM.
Trefwoorden: Glioblastoom, Kankercel, Metabolisme, Metformine, Dichlooracetaat, Memantine
DOI: 10.5137/1019-5149.JTN.29176-20.3
INLEIDING
Glioblastoom (GBM) is een van de meest agressieve tumoren van het centrale zenuwstelsel, en vertegenwoordigt ongeveer 50% van alle gliale tumortypes [12,27]. De mediane overlevingskans voor GBM-patiënten verandert niet signicantly bij de huidige standaardbehandeling, die bestaat uit tumorresectie gevolgd door radiotherapie en behandeling met temozolomide. De mediane overleving is ongeveer 12-14 maanden ondanks het gecombineerde gebruik van chirurgie, radiotherapie en chemotherapie [7,23].
GBM-tumoren hebben een groot aantal genetische variaties die leiden tot dierent therapeutische reacties [5,9,21]. Intratumor hetero-geniteit zou de sleutel kunnen zijn om de oorzaak van het falen van de behandeling vast te stellen [22]. Chemotherapiemiddelen zoals temozolamide verhogen de mutatielast binnen het kankergenoom in vergelijking met onbehandelde GBM-cellen [17]. Daarom zijn er dringend alternatieve therapiemethoden nodig voor de behandeling van GBM.
Metformine is een gangbaar antidiabetisch geneesmiddel dat wordt gebruikt bij de behandeling van diabetes type 2 [18]. Behandeling met metformine wordt in verband gebracht met een lager risico op verschillende vormen van kanker, maar de effecten ervan op GBM zijn niet goed gekarakteriseerd [4,24]. Behandeling met metformine vermindert de resistentie tegen Temozolomide in GBM-cellen [26]. Metformine heeft echter veiligheidsproblemen in de klinische omgeving, aangezien de meeste preklinische werken suprafysiologische doses metformine gebruikten [25]. In deze studie wilden wij deze uitdaging overwinnen door het effect van metformine te onderzoeken in combinatie met dichlooracetaat (DCA), dat het metabolisme van kankercellen aanpakt via remming van pyruvaatdehydrogenase kinase [11]. Het aanpakken van het kankercelmetabolisme zou implicaties kunnen hebben voor de behandeling van agressieve GBM. Bovendien wilden wij de apoptotische eiwitexpressieprofielen onderzoeken om GBM op moleculair niveau beter te begrijpen. Ook wilden wij het kankercelmetabolisme verstoren met behulp van metformine, DCA en memantine in T98G en U87-MG GBM-cellijnen.
Materialen en methoden
Celcultuur en chemicaliën
T98GenU87-MGmenselijkeglioblastoma cellijnen werden geleverd door ATCC. T98G en U87-MG cellen werden gekweekt in DMEM/F12 medium aangevuld met 10% foetaal runderserum (FBS) (Sigma-Aldrich, St Louis, MO, USA). De cellen werden gekweektineen5%CO2 incubator bij 37° C. Metformine, dichlooracetaat en memantine werden geleverd door SigmaAldrich, St Louis, MO, USA. De cellen werden gedurende 48 uur met deze stoffen behandeld om de IC50-niveaus te bepalen. Alle stoffen werden opgelost in steriel gedestilleerd water.
Celcytotoxiciteitstest
3X103T98G-enU87-MG-cellenwerden in een 96-wells-plaat gezaaid en ’s nachts gekweekt. In de MTT-test werden verschillende concentraties metformine, DCA en memantine gebruikt. MTT-oplossing (5 mg/ml in PBS) werd toegevoegd en de cellen werden verder geïncubeerd gedurende 4 uur bij 37°C. DMSO werd toegevoegd om de kristallen op te lossen. De absorptieverhouding werd gemeten met de SpectraMax M3 (Molecular Devices, USA)
GBM-patiëntmonsters en proteïne-isolatie uit tumorweefsel
In totaal werden 17 GBM-tumorweefselmonsters verzameld aan de Gazi Universiteit, afdeling Neurochirurgie, in de periode april 2015-april 2016 met goedkeuring van de ethische commissie voor klinisch onderzoek van de Gazi Universiteit. Tumormonsters werden vers ingevroren bij -80°C. Twee van de tumorweefsels werden uitgesloten van de studie omdat hun pathologierapporten als GBM (-) werden bevonden. 0.1 gram tumorweefselmonster werd gehomogeniseerd in RIPA-lysebuffer. Het lysaat werd gedurende 15 minuten bij 14.000 rpm gecentrifugeerd en het supernatant werd verzameld om een BCA-eiwitkwantificatietest uit te voeren. De monsters werden opgeslagen bij -80 °C voor verdere verwerking.
Western Blotting
T98GenU87-MGcellenwerden gewassen met PBS en geschraapt in RIPA lysis buffer met 1mM PMSF gevolgd door sonicatie. De monsters werden gedurende 15 minuten bij 13500 rpm bij 4°C gecentrifugeerd en het supernatant werd verzameld. Eiwitten werden gekwantificeerd met behulp van BCA Assay Kit (Thermo Pierce, Rockford, IL, USA). Eiwitlysaten (20 μg) werden gedurende 5 minuten bij 95°C verwarmd in LDS niet-reducerende monsterbuffer (Pierce, Rockford, IL, USA), vervolgens geladen op 10% Tris-glycine gels en overgebracht op PVDF-membraan (Pierce, Rockford, IL, USA). De membranen werden gedurende 1 uur bij kamertemperatuur geblokkeerd en een nacht bij 4°C geïncubeerd met de primaire antilichamen voor Casp3, Bcl2, Bad, Bax, GSK-3B, C-Myc en β-actine (Thermo Pierce, Rockford, IL, USA). De blots werden gevisualiseerd met Luminata Forte Western HRP Substrate (Merck Millipore, Darmtadt, Duitsland). Chemiluminescente signalen van immunoblots werden gedocumenteerd met Gel Logic 2200 Pro (Carestream Health; Rochester, NY, VS).
Statistische analyse
Experimenten werden uitgevoerd in drievoud. Metformine, dichlooracetaat en memantine IC50-niveaus voor T98G- en U87-MG-cellijnen werden berekend met Graph-Pad Prism7. De resultaten werden uitgedrukt als gemiddelde ± standaardafwijking. p<0,05 werd beschouwd als statistisch significant.
Resultaten
Effecten van Metformine, DCA, Metformine+DCA en Memantine op de cytotoxiciteit van T98G en U87-MG GBM-cellen
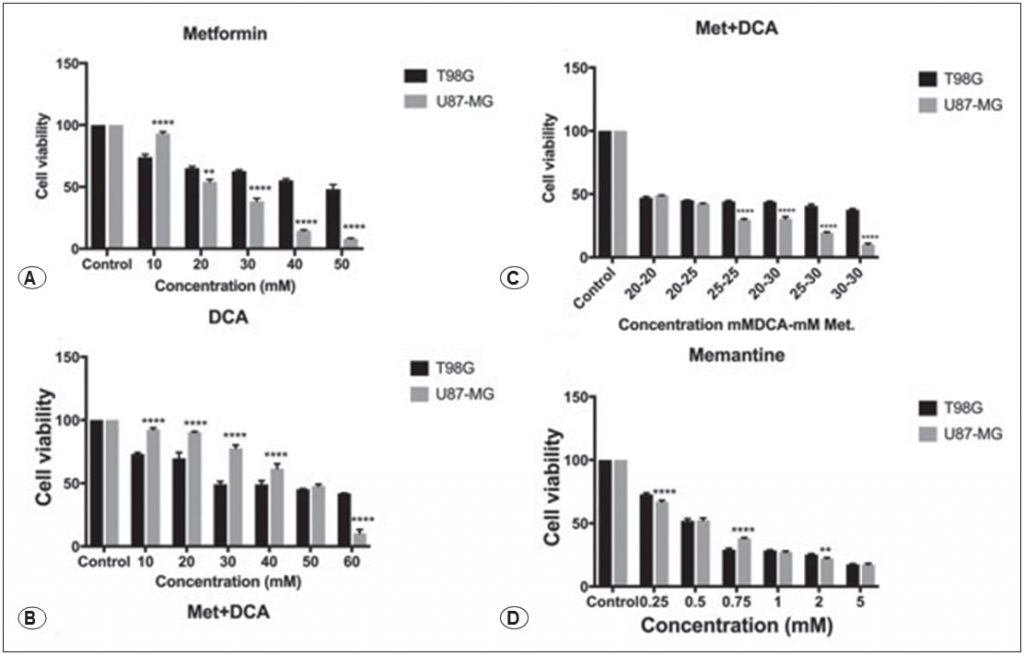
Metformine verminderde de cellulaire levensvatbaarheid van T98G en U87- MG menselijke GBM-kankercellen op dosisafhankelijke wijze, zoals getoond in figuur 1A, behandeling met 45mM en 25mM metformine verminderde de levensvatbaarheid van de cellen gedurende 48 uur (p<0,01). Wij onderzochten het effect van DCA op T98G en U87-MG cellen gedurende 48 uur, 10-60 mM concentratiebereik van DCA werd getest op cellen. DCA verminderde de levensvatbaarheid van de cellen bij een concentratie van 45 mM, zoals getoond in figuur 1B (p<0,01). Verschillende concentraties metformine+DCA werden ook getest op GBM-cellen om de IC50-doses te verlagen. De combinatie metformine+DCA verminderde de levensvatbaarheid van de cellen tot lagere doses, de IC50-dosis voor combinatiebehandeling werd gevonden als 20 mM DCA en 20 mM metformine voor T98G- en U87MG-cellen gedurende 48 uur, zoals getoond in figuur 1C (p<0,01). Bovendien beïnvloedde memantine de cellulaire toxiciteit op dosisafhankelijke wijze, zoals getoond in figuur 1D. 0.125-5 mM memantine concentratie werd getest op T98G en U87MG cellen gedurende 48 uur, en, IC50 waarde werd bepaald als 0,5 mM voor T98G en voor U87MG cellen (p<0,01).
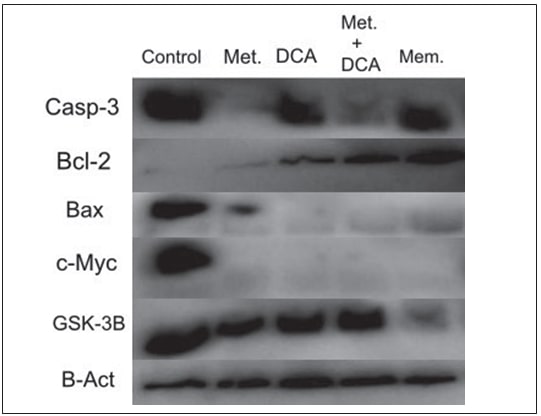
Effecten van Metformine, DCA, Metformine+DCA en Memantine op Casp3, Bcl2, Bax, c-Myc, GSK3B Eiwituitdrukkingsniveaus
T98G-cellenwerdengedurende48uur behandeld met 45 mM metformine, 45 mM DCA, 20 mM metformine in combinatie met 20 mM DCA en 0,5 mM memantine. U87-MG-cellen werden gedurende 48 uur behandeld met 25mM metformine, 45mM DCA, 20mM metformine in combinatie met 20mM DCA en 0,5mM memantine. De expressie van aan apoptose en celcyclusprogressie gerelateerde eiwitten, te weten Casp3, Bcl2, Bax, c-Myc en GSK3B, werd geëvalueerd door middel van western blot. Metformine en de combinatie metformine-DCA verminderden de expressie van Casp-3-eiwit in T98G-cellen (figuur 2), terwijl de expressie van Casp-3-eiwit in alle behandelingen (metformine, DCA, metformine+DCA, memantine) in U87-MG-cellen toenam (figuur 3). De eiwitexpressie van Bcl-2 bleek toe te nemen bij behandeling met DCA, metformine+DCA en memantine; terwijl de eiwitexpressie van Bax bij alle behandelingen voor T98G-cellen afnam. De eiwitexpressie van c-Myc nam af bij de bovengenoemde behandelingen (metformine, DCA, metformine+DCA, memantine) in T98G-cellen. De behandeling met memantine remde de eiwitexpressie van GSK3B in T98G-cellen (figuur 2).

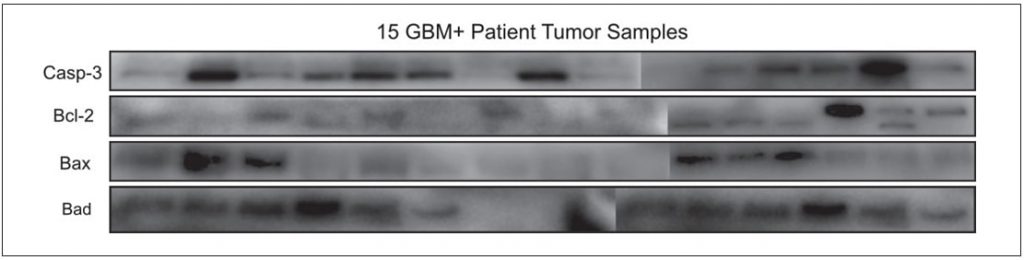
Differentiële eiwitexpressieprofielen van GBM positief
tumorweefsel GBM positieve tumorweefselmonsters werden gekarakteriseerd wat betreft apoptose, aangezien dit een indicator zou kunnen zijn van de ziekteprogressie. Vijftien GBM+ tumorweefselmonsters werden onderzocht op de Casp-3, Bcl-2, Bad, Bax eiwitexpressieprofielen. De onderzochte apoptotische eiwitten bleken bij elke patiënt differentieel tot expressie te komen (figuur 4).
Bespreking
De goedkeuring van het anti-angiogene geneesmiddel bevacizumab bij GBM liet een verbetering zien van de algehele overleving van patiënten; deze bevinding blijft echter controversieel [6]. Er is behoefte aan alternatieve behandelingsregimes voor een dergelijke agressieve tumor GBM in dit tijdperk van gepersonaliseerde geneeskunde.
Glucose- en glutamineverslaving van kankercellen staat bekend als het kenmerk van kanker [16]. Een afwijkend glucosemetabolisme wordt omschreven als de drijvende kracht achter de agressie en chemoresistentie van GBM. Targeting van tumormetabolisme bij de behandeling van kanker heeft nu de belangstelling verruimd van glucosemetabolisme naar andere moleculen zoals glutamine. Het is daarom cruciaal om meer inzicht te krijgen in het glutamine metabolisme in kankercellen [2]. Het doel van de huidige studie is dan ook om het glucose- en glutaminemetabolisme aan te pakken met behulp van metformine, DCA en memantine.
Het werkingsmechanisme van het diabetesgeneesmiddel metformine ten opzichte van kankercellen staat bekend als zijn selectiviteit bij het aanpakken van kankerstamcellen. Dit mechanisme zou afhankelijk kunnen zijn van het glutamine metabolisme [8]. DCA is een pyruvaat dehydrogenase kinase remmer die het Warburg effect omkeert [20]. Het gevoelig maken van tumorcellen voor remming van de glycolyse zou bereikt kunnen worden door een dubbele targeting via metformine en DCA. Bovendien heeft het Alzheimermedicijn memantine een veel lagere IC50-dosis dan metformine. De relatief lagere IC50-dosis voor memantine (0,5mM) zou dus de supra-fysiologische dosisgerelateerde bezwaren van metformine in een klinische omgeving kunnen ondervangen. Nieuw gesynthetiseerde memantinederivaten bleken ook anti-tumor activiteiten te hebben in U87-MG GBM cellijn [3]. Targeting NMDA receptor associated signalling pathways using memantine might enhance the treatment of glioma and GBM [1,14]. Het ophelderen van het antikankermechanisme van memantine over GBM-cellen houdt dus een belofte in als nieuw hergebruikt geneesmiddel.
Differentiële eiwitexpressieprofielen van 15 GBM+ tumorweefsels voor de apoptotische genen Casp-3, Bcl-2, Bad, Bax bevestigen eveneens de heterogene aard van de ziekte. Positieve expressie van Bax was significant geassocieerd met een betere overleving in een grote serie tumoren [19]. Het eiwitexpressieprofiel van Bax zou daarom prognostisch kunnen zijn voor de respons op de GBM-behandeling. Caspase-3 activering blijkt een voorspeller te zijn van progressievrije overleving bij GBM-patiënten [13].
Moleculaire stratificatie van patiënten is onontbeerlijk om zich te richten op patiëntengroepen die hoogstwaarschijnlijk baat zullen hebben bij het gekozen behandelingsprotocol.
In een recente studie die overgaat in fase II, onderzochten onderzoekers de maximaal verdragen doses van memantine, mefloquine en metformine in combinatie met temozolomide. Maraka et al. concludeerden dat deze geneesmiddelen veilig konden worden gecombineerd met Temozolomide bij nieuw gediagnosticeerde GBM [10]. Sommige bijwerkingen werden echter gemeld bij de gecombineerde therapieregimes en de aanpak werd onder de loep genomen, waardoor verwarring ontstond over de vraag of memantine of mefloquine de waargenomen bijwerkingen veroorzaakte [15]. Het blijft van cruciaal belang de interacties tussen geneesmiddelen en/of farmacokinetische interacties bij het gebruik van geneesmiddelencombinaties te begrijpen.
CONCLUSIE
Onze in vitro bevindingen leveren het bewijs dat het Alzheimergeneesmiddel memantine kan worden gebruikt bij de behandeling van GBM in lagere doses dan metformine. De penetrerende eigenschappen van memantine in de hersenbloedbarrière zijn ook veelbelovend voor de behandeling van GBM. Voorts is het van belang dat memantine een alternatieve neoadjuvante therapie zou kunnen bieden, vooral voor oudere kankerpatiënten. Deze bewering vereist verder onderzoek met behulp van gerandomiseerde gecontroleerde studies.
DANKBETUIGINGEN
Deze studie is ondersteund door een wetenschappelijke subsidie van de Wetenschappelijke en Technologische Onderzoeksraad van Turkije, TUBITAK (Projectnummer: SBAG- 214S578).
VERWIJZINGEN
1 Altinoz MA, Elmaci I: Targeting nitric oxide and NMDA receptor-associated pathways in treatment of high grade glial tumors. Hypotheses voor nitro-memantine en nitrones. Stikstofoxide 79:68-83, 20182 Altman BJ, Stine ZE, Dang CV: Van Krebs naar kliniek: Glutamine metabolisme naar kankertherapie. Nat Rev Cancer 16(10):619- 634, 2016
3 Cacciatore I, Fornasari E, Marinelli L, Eusepi P, Ciulla M, Ozdemir O, Tatar A, Turkez H, Di Stefano A: Memantinederived drugs as potential antitumor agents for the treatment of glioblastoma. Eur J Pharm Sci 109:402-411, 2017
4 Ferla R, Haspinger E, Surmacz E: Metformin inhibits leptininduced growth and migration of glioblastoma cells. Oncology Letters 4(5):1077-1081, 2012
5 Inda MD, Bonavia R, Seoane J: Glioblastoma multiforme: Een kijkje in zijn heterogene aard. Kanker 6(1):226-239, 2014
6 Johnson DR, Omuro AM, Ravelo A, Sommer N, Guerin A, Ionescu-Ittu R, Shi S, Macalalad A, Uhm JH: Overall survival in patients with glioblastoma before and after bevacizumab approval. Current Medical Research and Opinion 34(5):813- 820, 2018
7 Khosla D: Concurrent therapy to enhance radiotherapeutic outcomes in glioblastoma. Ann Transl Med 4(3):54, 2016
8 Kim JH, Lee KJ, Seo Y, Kwon JH, Yoon JP, Kang JY, Lee HJ, Park SJ, Hong SP, Cheon JH, Kim WH: Effects of metformin on colorectal cancer stem cells depend on alterations in glutamine metabolism. Scientific Reports 8(1):409, 2018
9 Liu Y, Xu X, Yin L, Zhang X, Li L, Lu H: Relatie tussen glioblastoom heterogeniteit en overlevingstijd: Een MR-beeldvormende textuuranalyse. Am J Neuroradiol 38(9):1695-1701, 2017
10 Maraka S, Groves MD, Mammoser AG, Melguizo-Gavilanes I, Conrad CA, Tremont-Lukats IW, Loghin ME, O’Brien BJ, Puduvalli VK, Sulman EP, Hess KR: Phase 1 lead-in to a phase 2 factorial study of temozolomide plus memantine, mefloquine, and metformin as postradiation adjuvant therapy for newly diagnosed glioblastoma. Kanker 125(3):424-433, 2019
11 Michelakis ED, Webster L, Mackey JR: Dichloroacetate (DCA) as a potential metabolic-targeting therapy for cancer. Br J Cancer 99(7):989-994, 2008
12 Mrugala MM: Advances and challenges in the treatment of glioblastoma: A clinician’s perspective. Discov Med 15(83):221-230, 2013
13 Murphy ÁC, Weyhenmeyer B, Schmid J, Kilbride SM, Rehm M, Huber HJ, Senft C, Weissenberger J, Seifert V, Dunst M, Mittelbronn M: Activation of executioner caspases is a predictor of progression-free survival in glioblastoma patients: Een systeemgeneeskundige benadering. Cell Death Dis 4(5):e629, 2013
14 Müller-Längle A, Lutz H, Hehlgans S, Rödel F, Rau K, Laube B: NMDA receptor-gemedieerde signaalwegen versterken stralingsresistentie, overleving en migratie in glioblastoma cellen-een potentieel doelwit voor adjuvante radiotherapie. Cancers (4):503, 2019
15 Nevin RL: Unexpectedly low rates of neuropsychiatric adverse effects associated with mefloquine repurposed for the treatment of glioblastoma. Kanker 125(8):1384-1385, 2019
16 Panchanathan RS, Sittur MG, Aoun RJ, Pines AR, Swanson KR, Bendok BR: War on glioblastoma multiforme: 2-pronged siege on glutamine. Wereld Neurochirurgie 91:254-256, 2016
17 Parsons DW, Jones S, Zhang X, Lin JC, Leary RJ, Angenendt P, Mankoo P, Carter H, Siu IM, Gallia GL, Olivi A, McLendon R, Rasheed BA, Keir S, Nikolskaya T, Nikolsky Y, Busam DA, Tekleab H, Diaz Jr LA, Hartigan J, Smith DR, Strausberg RL, Nagahashi Marie SK, Oba Shinjo SM, Yan H, Riggins GJ, Bigner DD, Karchin R, Papadopoulos N, Parmigiani G, Vogelstein B, Velculescu VE, Kinzler KW: An integrated genomic analysis of human glioblastoma multiforme. Science 321(5897):1807-1812, 2008
18 Rojas LBA, Gomes MB: Metformine: Een oude maar nog steeds de beste behandeling voor diabetes type 2. Diabetol Metab Syndr 5(1):6, 2013
19 Ruano Y, Mollejo M, Camacho FI, de Lope AR, Fiaño C, Ribalta T, Martinez P, Hernández Moneo JL, Meléndez B: Identification of survival related genes of the phosphatidylinositol 3′ kinase signaling pathway in glioblastoma multiforme. Kanker 112(7):1575-1584, 2008
20 Shen H, Decollogne S, Dilda PJ, Hau E, Chung SA, Luk PP, Hogg PJ, McDonald KL: Dual-targeting of aberrant glucose metabolism in glioblastoma. J Exp Clin Cancer Res 34(1):14, 2015
21 Soeda A, Hara A, Kunisada T, Yoshimura SI, Iwama T, Park DM: The evidence of glioblastoma heterogeneity. Wetenschappelijke rapporten 5:7979, 2015
22 Sottoriva A, Spiteri I, Piccirillo SG, Touloumis A, Collins VP, Marioni JC, Curtis C, Watts C, Tavaré S: Intratumor heterogenity in human glioblastoma reflects cancer evolutionary dynamics. Proc Natl Acad Sci U S A 110(10):4009- 4014, 2013
23 Stupp R, Mason WP, Van Den Bent MJ, Weller M, Fisher B, Taphoorn MJ, Belanger K, Brandes AA, Marosi C, Bogdahn U, Curschmann J, Janzer RC, Ludwin SK, Gorlia T, Allgeier A, Lacombe D, Cairncross JG, Eisenhauer E, Mirimanoff RO, European Organisation for Research and Treatment of Cancer Brain Tumor and Radiotherapy Groups; National Cancer Institute of Canada Clinical Trials Group: Radiotherapie plus gelijktijdige en adjuvante temozolomide voor glioblastoom. N Engl J Med 352(10):987-996, 2005
24 Quinn BJ, Kitagawa H, Memmott RM, Gills JJ, Dennis PA: Repositioning metformin for cancer prevention and treatment. Trends in Endocrinologie & Metabolisme 24(9):469-480, 2013
25 Whitburn J, Edwards CM, Sooriakumaran P: Metformine en prostaatkanker: Een nieuwe rol voor een oud geneesmiddel. Current Urology Reports 18(6):46, 2017
26 Yang SH, Li S, Lu G, Xue H, Kim DH, Zhu JJ, Liu Y: Metformin treatment reduces temozolomide resistance of glioblastoma cells. Oncotarget 7(48):78787-78803, 2016
27 Zhang X, Zhang W, Cao WD, Cheng G, Zhang YQ: Glioblastoma multiforme: Moleculaire karakterisering en huidige behandelstrategie. Exp Ther Med 3(1):9-14, 2012
Gerelateerde inhoud: