Gulsah ALBAYRAK1, Ece KONAC1, Umit Akin DERE2, Hakan EMMEZ2
1 Università Gazi, Facoltà di Medicina, Dipartimento di Biologia Medica e Genetica, Ankara, Turchia
2 Università Gazi, Facoltà di Medicina, Dipartimento di Neurochirurgia, Ankara, Turchia
Corrispondenza: Ece KONAC; E-mail: [email protected]
Ricevuto: 16 gennaio 2020
Accettato: 3 luglio 2020
Pubblicato: 29 dicembre 2020
Abstract
OBIETTIVO: indagare gli effetti di metformina, dicloroacetato (DCA) e memantina sulle cellule di glioblastoma umano (GBM) T98G e U87-MG per colpire il metabolismo delle cellule tumorali in modo multidirezionale.
MATERIALI e METODI: i livelli IC50 di metformina, DCA, metformina+DCA e memantina sono stati determinati mediante saggio MTT in cellule T98G e U87-MG in vitro. Le espressioni delle proteine Casp3, Bcl-2, Bax, c-Myc e GSK-3B sono state analizzate dopo i trattamenti. Quindici tessuti tumorali GBM+ sono stati valutati per i modelli di espressione delle proteine apoptotiche Casp-3, Bcl-2, Bad, Bax.
RISULTATI: i farmaci contro il metabolismo delle cellule tumorali metformina, DCA, metformina+DCA e memantina hanno indotto citotossicità in modo dose-dipendente nelle cellule T98G e U87-MG. L’IC50 per la memantina è risultata pari a 0,5 mM (p<0,01), una concentrazione quasi 10 volte inferiore a quella della metformina. Quindici tessuti tumorali GBM+ presentavano espressioni proteiche apoptotiche differenti.
CONCLUSIONE: la memantina ha esercitato un meccanismo d’azione antitumorale nelle cellule T98G e U87-MG, tuttavia tale meccanismo richiede un’indagine più approfondita per il trattamento del GBM.
Parole chiave: Glioblastoma, Cellule tumorali, Metabolismo, Metformina, Dicloroacetato, Memantina
DOI: 10.5137/1019-5149.JTN.29176-20.3
INTRODUZIONE
Il glioblastoma (GBM) è uno dei tumori più aggressivi del sistema nervoso centrale e rappresenta circa il 50% di tutti i tipi di tumore gliale [12,27]. Il tasso di sopravvivenza mediana dei pazienti affetti da GBM non cambia signicantly utilizzando gli attuali trattamenti standard di cura, che prevedono la resezione del tumore seguita da radioterapia e trattamento con Temozolomide. La sopravvivenza mediana è di circa 12-14 mesi nonostante l’uso combinato di chirurgia, radioterapia e chemioterapia [7,23].
I tumori GBM presentano un’ampia gamma di variazioni genetiche che portano a dierent risposte terapeutiche [5,9,21]. L’etero-geneità intratumorale potrebbe essere la chiave per identificare la causa del fallimento del trattamento [22]. I farmaci chemioterapici, come la temozolamide, aumentano il carico mutazionale all’interno del genoma del tumore rispetto alle cellule di GBM non trattate [17]. Per questo motivo, sono urgentemente necessari approcci terapeutici alternativi nel trattamento del GBM.
La metformina è un comune farmaco antidiabetico utilizzato nel trattamento del diabete di tipo 2 [18]. Il trattamento con metformina è associato a un minor rischio di diversi tipi di cancro, ma i suoi effetti sul GBM non sono stati ben caratterizzati [4,24]. Il trattamento con metformina riduce la resistenza alla temozolomide nelle cellule di GBM [26]. La metformina, tuttavia, presenta problemi di sicurezza in ambito clinico, poiché la maggior parte dei lavori preclinici ha utilizzato dosi sovrafisiologiche di metformina [25]. In questo studio abbiamo cercato di superare questa sfida studiando l’effetto della metformina combinandola con il dicloroacetato (DCA), che ha come bersaglio il metabolismo delle cellule tumorali attraverso l’inibizione della piruvato deidrogenasi chinasi [11]. Puntare sul metabolismo delle cellule tumorali potrebbe avere implicazioni per il trattamento del GBM aggressivo. Inoltre, abbiamo cercato di studiare i profili di espressione delle proteine apoptotiche per comprendere meglio il GBM a livello molecolare. Abbiamo anche cercato di interferire con il metabolismo delle cellule tumorali utilizzando metformina, DCA e memantina nelle linee cellulari di GBM T98G e U87-MG.
Materiali e metodi
Coltura cellulare e sostanze chimiche
Le linee cellulari di glioblastoma umanoT98Ge U87-MG sono state fornite dall’ATCC. Le cellule T98G e U87-MG sono state coltivate in terreno DMEM/F12 integrato con il 10% di siero bovino fetale (FBS) (Sigma-Aldrich, St Louis, MO, USA). Le cellule sono state coltivate in un incubatore al 5%di CO2 a 37° C. Metformina, dicloroacetato e memantina sono stati forniti da SigmaAldrich, St Louis, MO, USA. Le cellule sono state trattate con questi agenti per 48 ore per determinare i livelli di IC50. Tutti gli agenti sono stati disciolti in acqua distillata sterile.
Saggio di citotossicità cellulare
3X103cellule T98G e U87-MG sono state seminate in una piastra a 96 pozzetti e coltivate per una notte. Nel saggio MTT sono state utilizzate diverse concentrazioni di metformina, DCA e memantina. È stata aggiunta la soluzione di MTT (5 mg/ml in PBS) e le cellule sono state ulteriormente incubate per 4 ore a 37°C. È stato aggiunto DMSO per solubilizzare i cristalli. Il rapporto di assorbanza è stato misurato con SpectraMax M3 (Molecular Devices, USA)
Campioni di pazienti affetti da GBM e isolamento di proteine da tessuti tumorali
Un totale di 17 campioni di tessuto tumorale di GBM sono stati raccolti dall’Università di Gazi, Dipartimento di Neurochirurgia, nel periodo aprile 2015-aprile 2016 con l’approvazione del Comitato etico per la ricerca clinica dell’Università di Gazi. I campioni tumorali sono stati congelati a fresco a -80°C. Due dei tessuti tumorali sono stati esclusi dallo studio in quanto i loro referti patologici sono risultati GBM (-). 0.1 grammo di campione di tessuto tumorale è stato omogeneizzato in tampone di lisi RIPA. Il lisato è stato centrifugato per 15 minuti a 14.000 giri/minuto e il surnatante è stato raccolto per eseguire il saggio di quantificazione delle proteine BCA. I campioni sono stati conservati a -80 °C per ulteriori elaborazioni.
Western Blotting
Le celluleT98Ge U87-MG sono state lavate con PBS e raschiate nel tampone di lisi RIPA contenente 1mM PMSF seguito da sonicazione. I campioni sono stati centrifugati per 15 minuti a 13500 rpm a 4°C e il surnatante è stato raccolto. Le proteine sono state quantificate utilizzando il BCA Assay Kit (Thermo Pierce, Rockford, IL, USA). I lisati proteici (20 μg) sono stati riscaldati per 5 minuti a 95°C in tampone campione LDS non riducente (Pierce, Rockford, IL, USA), quindi caricati su gel di Tris-glicina al 10% e trasferiti su membrana PVDF (Pierce, Rockford, IL, USA). Le membrane sono state bloccate per 1 ora a temperatura ambiente e incubate per una notte a 4°C con gli anticorpi primari per Casp3, Bcl2, Bad, Bax, GSK-3B, C-Myc e β-actina (Thermo Pierce, Rockford, IL, USA). I blot sono stati visualizzati con Luminata Forte Western HRP Substrate (Merck Millipore, Darmtadt, Germania). I segnali chemiluminescenti degli immunoblot sono stati documentati con Gel Logic 2200 Pro (Carestream Health; Rochester, NY, USA).
Analisi statistica
Gli esperimenti sono stati eseguiti in triplicati. I livelli di IC50 di metformina, dicloroacetato e memantina per le linee cellulari T98G e U87-MG sono stati calcolati con Graph-Pad Prism7. I risultati sono stati espressi come media±deviazione standard. p<0,05 è stato considerato statisticamente significativo.
Risultati
Effetti di metformina, DCA, metformina+DCA e memantina sulla citotossicità delle cellule GBM T98G e U87-MG
La metformina ha ridotto la vitalità cellulare delle cellule tumorali GBM umane T98G e U87- MG in modo dose-dipendente, come mostrato nella Figura 1A; il trattamento con metformina 45mM e 25mM ha ridotto la vitalità cellulare per 48 ore (p<0,01). Abbiamo analizzato l’effetto del DCA sulle cellule T98G e U87-MG per 48 ore, testando un intervallo di concentrazioni di DCA compreso tra 10 e 60 mM. Il DCA ha ridotto la vitalità cellulare alla concentrazione di 45 mM, come mostrato nella Figura 1B (p<0,01). Sono state testate anche diverse concentrazioni di metformina+DCA sulle cellule di GBM per diminuire le dosi IC50. La combinazione metformina+DCA ha ridotto la vitalità cellulare a dosi inferiori; la dose IC50 per il trattamento combinato è risultata pari a 20mM DCA e 20mM metformina per le cellule T98G e U87MG per 48 ore, come mostrato nella Figura 1C (p<0,01). Inoltre, la memantina ha influenzato la tossicità cellulare in modo dose-dipendente, come mostrato nella Figura 1D. 0.la concentrazione di memantina 125-5 mM è stata testata sulle cellule T98G e U87MG per 48 ore e il valore IC50 è stato determinato in 0,5 mM per le cellule T98G e U87MG (p<0,01).
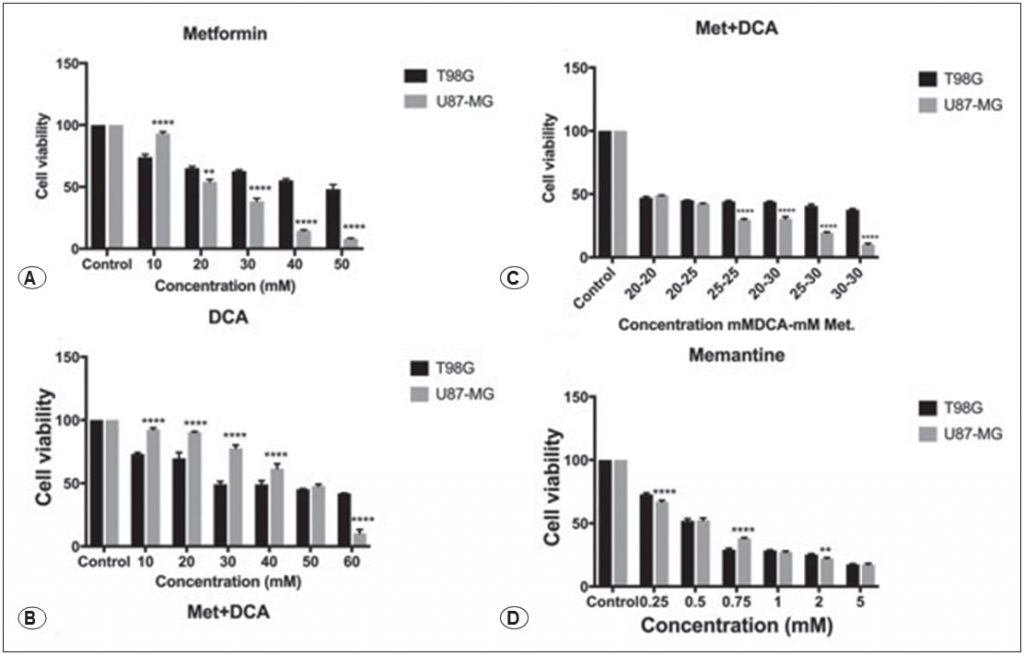
Effetti di metformina, DCA, metformina+DCA e memantina sui livelli di espressione delle proteine Casp3, Bcl2, Bax, c-Myc, GSK3B
Le celluleT98Gsono state trattate con 45mM di metformina, 45mM di DCA, 20mM di metformina in combinazione con 20mM di DCA e 0,5mM di memantina per 48 ore. Le cellule U87-MG sono state trattate con 25mM di metformina, 45mM di DCA, 20mM di metformina in combinazione con 20mM di DCA e 0,5mM di memantina per 48 ore. Le espressioni delle proteine correlate all’apoptosi e alla progressione del ciclo cellulare, ossia Casp3, Bcl2, Bax, c-Myc e GSK3B, sono state valutate mediante western blot. La metformina e la combinazione metformina-DCA hanno ridotto l’espressione della proteina Casp-3 nelle cellule T98G (Figura 2), mentre l’espressione della proteina Casp-3 è aumentata in tutti i trattamenti (metformina, DCA, metformina+DCA, memantina) nelle cellule U87-MG (Figura 3). L’espressione della proteina Bcl-2 è aumentata con il trattamento con DCA, metformina+DCA e memantina, mentre l’espressione della proteina Bax è diminuita in tutti i trattamenti per le cellule T98G. L’espressione della proteina c-Myc è diminuita con i trattamenti sopra menzionati (metformina, DCA, metformina+DCA, memantina) nelle cellule T98G. Il trattamento con memantina ha inibito l’espressione della proteina GSK3B nelle cellule T98G (Figura 2).
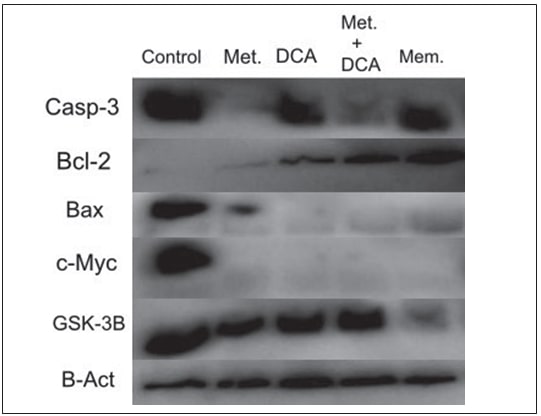

Profili di espressione proteica differenziale deitessuti tumoralipositivi al GBM
I campioni di tessuto tumorale positivo al GBM sono stati caratterizzati in termini di apoptosi, poiché questo potrebbe essere un indicatore della progressione della malattia. Quindici campioni di tessuto tumorale GBM+ sono stati analizzati per i profili di espressione delle proteine Casp-3, Bcl-2, Bad e Bax. Le proteine apoptotiche analizzate sono risultate differenzialmente espresse in ciascun paziente (Figura 4).
Discussione
L’approvazione del farmaco anti-angiogenico bevacizumab nel GBM ha mostrato un miglioramento del tasso di sopravvivenza globale dei pazienti; tuttavia, questo risultato rimane controverso [6]. Nell’era della medicina personalizzata, sono necessari regimi di trattamento alternativi per un tumore così aggressivo come il GBM.
La dipendenza da glucosio e glutammina delle cellule tumorali è nota come segno distintivo dei tumori [16]. L’alterazione del metabolismo del glucosio è definita come la causa dell’aggressività e della chemioresistenza del GBM. L’obiettivo del metabolismo tumorale nel trattamento del cancro ha ampliato l’interesse oltre il metabolismo del glucosio ad altre molecole come la glutammina. È quindi fondamentale approfondire le conoscenze sul metabolismo della glutammina nelle cellule tumorali [2]. Lo scopo del presente studio è quindi quello di colpire il metabolismo del glucosio e della glutammina utilizzando metformina, DCA e memantina.
Il meccanismo d’azione della metformina, farmaco per il diabete, sulle cellule tumorali è noto per la sua selettività nel colpire le cellule staminali del cancro. Questo meccanismo potrebbe dipendere dal metabolismo della glutammina [8]. Il DCA è un inibitore della piruvato deidrogenasi chinasi che inverte l’effetto Warburg [20]. La sensibilizzazione delle cellule tumorali all’inibizione della glicolisi potrebbe essere ottenuta con un doppio bersaglio, la metformina e il DCA. Inoltre, il farmaco per l’Alzheimer memantina ha una dose IC50 molto più bassa rispetto a quella della metformina. La dose IC50 relativamente più bassa della memantina (0,5 mM) potrebbe quindi superare le preoccupazioni legate alla dose sovrafisiologica della metformina in ambito clinico. I derivati della memantina di nuova sintesi sono risultati avere anche attività antitumorali nella linea cellulare U87-MG GBM [3]. L’uso della memantina come bersaglio delle vie di segnalazione associate ai recettori NMDA potrebbe migliorare il trattamento del glioma e del GBM [1,14]. L’approfondimento del meccanismo antitumorale della memantina sulle cellule GBM è quindi promettente come nuovo farmaco riproposto.
Anche i profili di espressione proteica differenziale di 15 tessuti tumorali GBM+ per i geni apoptotici Casp-3, Bcl-2, Bad e Bax confermano la natura eterogenea della malattia. L’espressione positiva di Bax è stata associata in modo significativo a un migliore tasso di sopravvivenza in un’ampia serie di tumori [19]. Il profilo di espressione della proteina Bax, quindi, potrebbe essere prognostico nella risposta al trattamento del GBM. L’attivazione della caspasi-3 è risultata essere un predittore di sopravvivenza libera da progressione nei pazienti con GBM [13].
La stratificazione molecolare dei pazienti è indispensabile per individuare i gruppi di pazienti che hanno maggiori probabilità di trarre beneficio dal protocollo di trattamento selezionato.
In un recente studio in fase II, i ricercatori hanno analizzato le dosi massime tollerate di memantina, meflochina e metformina in combinazione con la temozolomide. Maraka et al. hanno concluso che questi farmaci possono essere combinati in modo sicuro con la temozolomide nel GBM di nuova diagnosi [10]. Tuttavia, sono stati segnalati alcuni effetti collaterali nei regimi di terapia combinata e l’approccio è stato messo in discussione, sollevando dubbi sul fatto che memantina o meflochina abbiano causato gli effetti collaterali osservati [15]. Resta fondamentale comprendere le interazioni farmaco-farmaco e/o farmacocinetiche quando si utilizzano combinazioni di farmaci.
CONCLUSIONE
I nostri risultati in vitro dimostrano che la memantina, farmaco contro l’Alzheimer, potrebbe essere utilizzata nel trattamento della GBM a dosi inferiori rispetto alla metformina. Le proprietà di penetrazione della barriera ematica cerebrale della memantina sono promettenti anche per il trattamento del GBM. È inoltre interessante l’ipotesi che la memantina possa costituire una terapia neoadiuvante alternativa, soprattutto per i pazienti oncologici anziani. Questa affermazione richiede ulteriori indagini mediante studi randomizzati e controllati.
RICONOSCIMENTI
Questo studio è stato sostenuto da una borsa di studio scientifica del Consiglio per la Ricerca Scientifica e Tecnologica della Turchia, TUBITAK (Progetto n. SBAG- 214S578).
RIFERIMENTI
1 Altinoz MA, Elmaci I: Targeting nitric oxide and NMDA receptor-associated pathways in treatment of high grade glial tumors. Ipotesi per la nitromantina e i nitroni. Ossido nitrico 79:68-83, 20182 Altman BJ, Stine ZE, Dang CV: Da Krebs alla clinica: Il metabolismo della glutammina nella terapia del cancro. Nat Rev Cancer 16(10):619- 634, 2016
3 Cacciatore I, Fornasari E, Marinelli L, Eusepi P, Ciulla M, Ozdemir O, Tatar A, Turkez H, Di Stefano A: I farmaci memantinederivati come potenziali agenti antitumorali per il trattamento del glioblastoma. Eur J Pharm Sci 109:402-411, 2017
4 Ferla R, Haspinger E, Surmacz E: La metformina inibisce la crescita e la migrazione delle cellule di glioblastoma indotte dalla leptina. Oncology Letters 4(5):1077-1081, 2012
5 Inda MD, Bonavia R, Seoane J: Glioblastoma multiforme: Uno sguardo alla sua natura eterogenea. Cancers 6(1):226-239, 2014
6 Johnson DR, Omuro AM, Ravelo A, Sommer N, Guerin A, Ionescu-Ittu R, Shi S, Macalalad A, Uhm JH: Sopravvivenza complessiva in pazienti con glioblastoma prima e dopo l’approvazione di bevacizumab. Ricerca e opinione medica attuale 34(5):813- 820, 2018
7 Khosla D: Terapia concomitante per migliorare i risultati radioterapeutici nel glioblastoma. Ann Transl Med 4(3):54, 2016
8 Kim JH, Lee KJ, Seo Y, Kwon JH, Yoon JP, Kang JY, Lee HJ, Park SJ, Hong SP, Cheon JH, Kim WH: Gli effetti della metformina sulle cellule staminali del cancro colorettale dipendono da alterazioni del metabolismo della glutammina. Scientific Reports 8(1):409, 2018
9 Liu Y, Xu X, Yin L, Zhang X, Li L, Lu H: Relazione tra eterogeneità del glioblastoma e tempo di sopravvivenza: An MR imaging texture analysis. Am J Neuroradiol 38(9):1695-1701, 2017
10 Maraka S, Groves MD, Mammoser AG, Melguizo-Gavilanes I, Conrad CA, Tremont-Lukats IW, Loghin ME, O’Brien BJ, Puduvalli VK, Sulman EP, Hess KR: Fase 1 di lead-in per uno studio fattoriale di fase 2 di temozolomide più memantina, meflochina e metformina come terapia adiuvante postradiazione per il glioblastoma di nuova diagnosi. Cancer 125(3):424-433, 2019
11 Michelakis ED, Webster L, Mackey JR: Il dicloroacetato (DCA) come potenziale terapia a bersaglio metabolico per il cancro. Br J Cancer 99(7):989-994, 2008
12 Mrugala MM: Progressi e sfide nel trattamento del glioblastoma: la prospettiva di un medico. Discov Med 15(83):221-230, 2013
13 Murphy ÁC, Weyhenmeyer B, Schmid J, Kilbride SM, Rehm M, Huber HJ, Senft C, Weissenberger J, Seifert V, Dunst M, Mittelbronn M: L’attivazione delle caspasi esecutrici è un predittore della sopravvivenza libera da progressione nei pazienti affetti da glioblastoma: Un approccio di medicina dei sistemi. Cell Death Dis 4(5):e629, 2013
14 Müller-Längle A, Lutz H, Hehlgans S, Rödel F, Rau K, Laube B: Le vie di segnalazione mediate dai recettori NMDA aumentano la resistenza alle radiazioni, la sopravvivenza e la migrazione delle cellule di glioblastoma: un potenziale bersaglio per la radioterapia adiuvante. Cancers (4):503, 2019
15 Nevin RL: Tassi inaspettatamente bassi di effetti avversi neuropsichiatrici associati alla meflochina riproposta per il trattamento del glioblastoma. Cancer 125(8):1384-1385, 2019
16 Panchanathan RS, Sittur MG, Aoun RJ, Pines AR, Swanson KR, Bendok BR: Guerra al glioblastoma multiforme: assedio a due punte alla glutammina. Neurochirurgia mondiale 91:254-256, 2016
17 Parsons DW, Jones S, Zhang X, Lin JC, Leary RJ, Angenendt P, Mankoo P, Carter H, Siu IM, Gallia GL, Olivi A, McLendon R, Rasheed BA, Keir S, Nikolskaya T, Nikolsky Y, Busam DA, Tekleab H, Diaz Jr LA, Hartigan J, Smith DR, Strausberg RL, Nagahashi Marie SK, Oba Shinjo SM, Yan H, Riggins GJ, Bigner DD, Karchin R, Papadopoulos N, Parmigiani G, Vogelstein B, Velculescu VE, Kinzler KW: Un’analisi genomica integrata del glioblastoma multiforme umano. Science 321(5897):1807-1812, 2008
18 Rojas LBA, Gomes MB: Metformina: un trattamento vecchio ma ancora migliore per il diabete di tipo 2. Diabetol Metab Syndr 5(1):6, 2013
19 Ruano Y, Mollejo M, Camacho FI, de Lope AR, Fiaño C, Ribalta T, Martinez P, Hernández Moneo JL, Meléndez B: Identificazione di geni correlati alla sopravvivenza della via di segnalazione della fosfatidilinositolo 3′ chinasi nel glioblastoma multiforme. Cancer 112(7):1575-1584, 2008
20 Shen H, Decollogne S, Dilda PJ, Hau E, Chung SA, Luk PP, Hogg PJ, McDonald KL: Dual-targeting of aberrant glucose metabolism in glioblastoma. J Exp Clin Cancer Res 34(1):14, 2015
21 Soeda A, Hara A, Kunisada T, Yoshimura SI, Iwama T, Park DM: L’evidenza dell’eterogeneità del glioblastoma. Scientific Reports 5:7979, 2015
22 Sottoriva A, Spiteri I, Piccirillo SG, Touloumis A, Collins VP, Marioni JC, Curtis C, Watts C, Tavaré S: L’eterogeneità intratumorale nel glioblastoma umano riflette le dinamiche evolutive del cancro. Proc Natl Acad Sci U S A 110(10):4009- 4014, 2013
23 Stupp R, Mason WP, Van Den Bent MJ, Weller M, Fisher B, Taphoorn MJ, Belanger K, Brandes AA, Marosi C, Bogdahn U, Curschmann J, Janzer RC, Ludwin SK, Gorlia T, Allgeier A, Lacombe D, Cairncross JG, Eisenhauer E, Mirimanoff RO, Gruppi per il tumore cerebrale e la radioterapia dell’Organizzazione europea per la ricerca e la cura del cancro; Gruppo di studi clinici del National Cancer Institute del Canada: Radioterapia più temozolomide concomitante e adiuvante per il glioblastoma. N Engl J Med 352(10):987-996, 2005
24 Quinn BJ, Kitagawa H, Memmott RM, Gills JJ, Dennis PA: Riposizionamento della metformina per la prevenzione e il trattamento del cancro. Trends in Endocrinology & Metabolism 24(9):469-480, 2013
25 Whitburn J, Edwards CM, Sooriakumaran P: Metformina e cancro alla prostata: Un nuovo ruolo per un vecchio farmaco. Current Urology Reports 18(6):46, 2017
26 Yang SH, Li S, Lu G, Xue H, Kim DH, Zhu JJ, Liu Y: Il trattamento con metformina riduce la resistenza alla temozolomide delle cellule di glioblastoma. Oncotarget 7(48):78787-78803, 2016
27 Zhang X, Zhang W, Cao WD, Cheng G, Zhang YQ: Glioblastoma multiforme: Caratterizzazione molecolare e attuale strategia di trattamento. Exp Ther Med 3(1):9-14, 2012
Contenuti correlati: