Gulsah ALBAYRAK1, Ece KONAC1, Umit Akin DERE2, Hakan EMMEZ2
1 Universidad Gazi, Facultad de Medicina, Departamento de Biología Médica y Genética, Ankara, Turquía
2 Universidad Gazi, Facultad de Medicina, Departamento de Neurocirugía, Ankara, Turquía
Correspondencia: Ece KONAC; E-mail: [email protected]
Recibido: 16 de enero de 2020
Aceptado: 3 de julio de 2020
Publicado: 29 de diciembre de 2020
Resumen
OBJETIVO: Investigar los efectos de la metformina, el dicloroacetato (DCA) y la memantina en las células humanas de glioblastoma (GBM) T98G y U87-MG para atacar el metabolismo de las células tumorales de forma multidireccional.
MATERIAL Y MÉTODOS: Los niveles IC50 de metformina, DCA, metformina+DCA y memantina se determinaron mediante ensayo MTT en células T98G y U87-MG in vitro. Se investigaron las expresiones de las proteínas Casp3, Bcl-2, Bax, c-Myc y GSK-3B tras los tratamientos. En quince tejidos tumorales GBM+ se evaluaron los patrones de expresión de proteínas apoptóticas Casp-3, Bcl-2, Bad, Bax.
RESULTADOS: Los fármacos dirigidos al metabolismo de las células cancerosas metformina, DCA, metformina+DCA y memantina indujeron citotoxicidad de forma dependiente de la dosis en las células T98G y U87-MG. El IC50 de la memantina fue de 0,5 mM (p<0,01), una concentración casi 10 veces inferior a la de la metformina. Quince tejidos tumorales GBM+ presentaban expresiones proteicas apoptóticas diferenciales.
CONCLUSIÓN: Memantina ejerció un mecanismo de acción anticancerígeno en células T98G y U87-MG, sin embargo, dicho mecanismo requiere una investigación más profunda para el tratamiento de GBM.
Palabras clave: Glioblastoma, Célula cancerosa, Metabolismo, Metformina, Dicloroacetato, Memantina
DOI: 10.5137/1019-5149.JTN.29176-20.3
INTRODUCCIÓN
El glioblastoma (GBM) es uno de los tumores más agresivos del sistema nervioso central y representa aproximadamente el 50% de todos los tipos de tumores gliales [12,27]. La mediana de supervivencia de los pacientes con GBM no cambia signicantly utilizando los tratamientos estándar actuales, que implican la resección del tumor seguida de radioterapia y tratamiento con Temozolomida. La mediana de supervivencia es de aproximadamente 12-14 meses a pesar del uso combinado de cirugía, radioterapia y quimioterapia [7,23].
Los tumores GBM presentan una amplia gama de variaciones genéticas que conducen a dierent respuestas terapéuticas [5,9,21]. La heterogenidad intratumoral podría ser la clave para identificar la causa del fracaso del tratamiento [22]. Los fármacos quimioterapéuticos como la Temozolamida aumentan la carga mutacional en el genoma del cáncer en comparación con las células de GBM no tratadas [17]. Por lo tanto, se necesitan urgentemente enfoques terapéuticos alternativos para el tratamiento del GBM.
La metformina es un fármaco antidiabético común utilizado en el tratamiento de la diabetes de tipo 2 [18]. El tratamiento con metformina se asocia con un menor riesgo de varios tipos de cáncer, sin embargo, sus efectos sobre GBM no han sido bien caracterizados [4,24]. El tratamiento con metformina disminuye la resistencia a la temozolomida en las células de GBM [26]. Sin embargo, la metformina presenta problemas de seguridad en el ámbito clínico, ya que la mayoría de los trabajos preclínicos utilizaron dosis suprafisiológicas de metformina [25]. En este estudio nos propusimos superar este reto investigando el efecto de la metformina combinándola con dicloroacetato (DCA), que actúa sobre el metabolismo de las células cancerosas mediante la inhibición de la piruvato deshidrogenasa cinasa [11]. Dirigirse al metabolismo de las células cancerosas podría tener implicaciones para el tratamiento del GBM agresivo. Además, nos propusimos investigar los perfiles de expresión de proteínas apoptóticas para comprender mejor el GBM a nivel molecular. También nos propusimos interferir en el metabolismo de las células cancerosas utilizando metformina, DCA y memantina en las líneas celulares de GBM T98G y U87-MG.
Materiales y métodos
Cultivo celular y productos químicos
Las líneas celulares de glioblastoma humano T98G y U87-MG proceden del ATCC. Las células T98G y U87-MG se cultivaron en medio DMEM/F12 suplementado con un 10% de suero bovino fetal (FBS) (Sigma-Aldrich, St Louis, MO, EE.UU.). Las células se cultivaron en una incubadora con un 5% deCO2 a 37 °C. La metformina, el dicloroacetato y la memantina se obtuvieron de Sigma-Aldrich, St Louis, MO, EE.UU.. Las células se trataron con estos agentes durante 48 h. para determinar los niveles de IC50. Todos los agentes se disolvieron en agua destilada estéril.
Ensayo de citotoxicidad celular
Se sembraron3X103células T98G y U87-MG en una placa de 96 pocillos y se cultivaron durante la noche. Se utilizaron diferentes concentraciones de metformina, DCA y memantina en el ensayo MTT. Se añadió solución de MTT (5 mg/ml en PBS) y las células se incubaron durante 4 horas a 37°C. Se añadió DMSO para solubilizar los cristales. La relación de absorbancia se midió con SpectraMax M3 (Molecular Devices, EE.UU.)
Muestras de pacientes con GBM y aislamiento de proteínas a partir de tejidos tumorales
Se recogieron un total de 17 muestras de tejido tumoral de GBM del Departamento de Neurocirugía de la Universidad de Gazi durante el periodo comprendido entre abril de 2015 y abril de 2016 con la aprobación del Comité Ético de Investigación Clínica de la Universidad de Gazi. Las muestras tumorales se congelaron en fresco a -80 °C. Dos de los tejidos tumorales se excluyeron del estudio ya que sus informes patológicos se encontraron como GBM (-). 0.se homogeneizó 1 gramo de muestra de tejido tumoral en tampón de lisis RIPA. El lisado se centrifugó durante 15 minutos a 14.000 rpm y se recogió el sobrenadante para realizar el ensayo de cuantificación de proteínas BCA. Las muestras se almacenaron a -80 °C para su posterior procesamiento.
Western Blotting
Las célulasT98Gy U87-MG se lavaron con PBS y se rasparon en tampón de lisis RIPA que contenía 1mM PMSF seguido de sonicación. Las muestras se centrifugaron durante 15 minutos a 13500 rpm a 4°C y se recogió el sobrenadante. Las proteínas se cuantificaron utilizando el kit de ensayo BCA (Thermo Pierce, Rockford, IL, EE.UU.). Los lisados de proteínas (20 μg) se calentaron durante 5 minutos a 95°C en tampón de muestra no reductor LDS (Pierce, Rockford, IL, EE.UU.) y luego se cargaron en geles de Tris-glicina al 10% y se transfirieron a una membrana de PVDF (Pierce, Rockford, IL, EE.UU.). Las membranas se bloquearon durante 1 hora a temperatura ambiente y se incubaron durante la noche a 4 °C con los anticuerpos primarios para Casp3, Bcl2, Bad, Bax, GSK-3B, C-Myc y β-actina (Thermo Pierce, Rockford, IL, EE.UU.). Las manchas se visualizaron con Luminata Forte Western HRP Substrate (Merck Millipore, Darmtadt, Alemania). Las señales quimioluminiscentes de los inmunoblots se documentaron con Gel Logic 2200 Pro (Carestream Health; Rochester, NY, EE.UU.).
Análisis estadístico
Los experimentos se realizaron por triplicado. Los niveles IC50 de metformina, dicloroacetato y memantina para las líneas celulares T98G y U87-MG se calcularon utilizando el Graph-Pad Prism7. Los resultados se expresaron como media±desviación estándar. p<0,05 se consideró estadísticamente significativo.
Resultados
Efectos de la metformina, el DCA, la metformina+DCA y la memantina sobre la citotoxicidad de las células GBM T98G y U87-MG
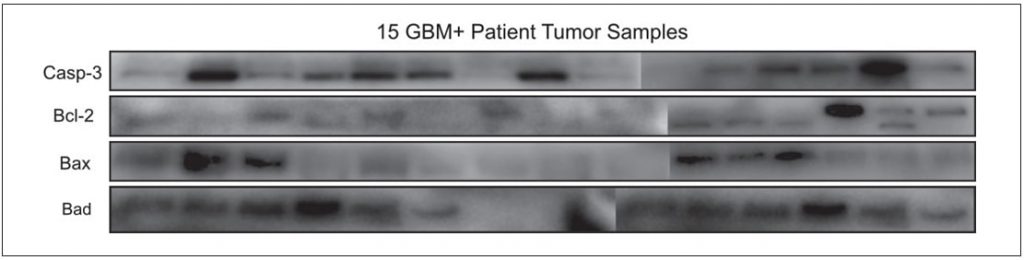
La metformina disminuyó la viabilidad celular de las células cancerosas GBM humanas T98G y U87- MG de forma dosis-dependiente como se muestra en la Figura 1A, el tratamiento con 45mM y 25mM de metformina redujo la viabilidad celular durante 48 horas (p<0,01). Investigamos el efecto del DCA sobre las células T98G y U87-MG durante 48 horas, se probó el rango de concentración de 10-60 mM de DCA sobre las células. El DCA redujo la viabilidad celular a una concentración de 45 mM, como se muestra en la Figura 1B (p<0,01). También se probaron diferentes concentraciones de metformina+DCA en células GBM para disminuir las dosis IC50. La combinación metformina+DCA disminuyó la viabilidad celular a dosis más bajas, la dosis IC50 para el tratamiento combinado se encontró como 20mM DCA y 20mM metformina para las células T98G y U87MG durante 48 horas como se muestra en la Figura 1C (p<0.01). Además, la memantina afectó a la toxicidad celular de forma dosis-dependiente como se muestra en la Figura 1D. 0.se ensayó una concentración de memantina de 125-5 mM en células T98G y U87MG durante 48 horas y se determinó que el valor IC50 era de 0,5 mM para las células T98G y U87MG (p<0,01).
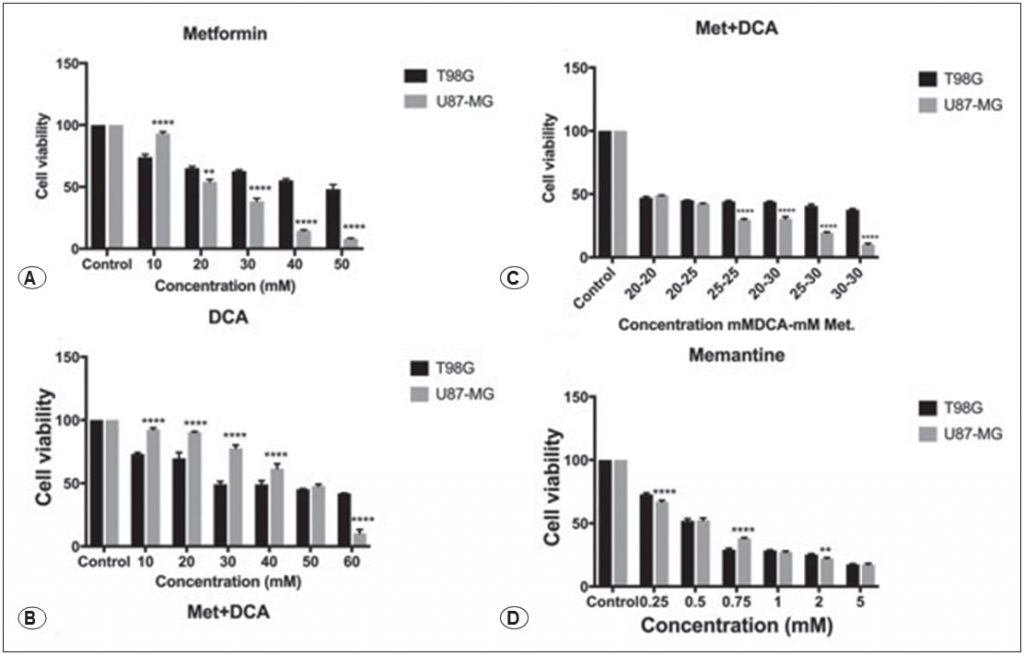
Efectos de la metformina, el DCA, la metformina+DCA y la memantina en los niveles de expresión de las proteínas Casp3, Bcl2, Bax, c-Myc y GSK3B
Las células T98G se trataron con 45 mM de metformina, 45 mM de DCA, 20 mM de metformina en combinación con 20 mM de DCA y 0,5 mM de memantina durante 48 horas. Las células U87-MG se trataron con 25mM de metformina, 45mM de DCA, 20mM de metformina en combinación con 20mM de DCA y 0,5mM de memantina durante 48 horas. Las expresiones de las proteínas relacionadas con la apoptosis y la progresión del ciclo celular, es decir, Casp3, Bcl2, Bax, c-Myc y GSK3B, se evaluaron mediante western blot. La metformina y la combinación metformina-DCA disminuyeron la expresión de la proteína Casp-3 en las células T98G (Figura 2), mientras que la expresión de la proteína Casp-3 aumentó en todos los tratamientos (metformina, DCA, metformina+DCA, memantina) en las células U87-MG (Figura 3). Se observó que la expresión de la proteína Bcl-2 aumentaba con el tratamiento con DCA, metformina+DCA y memantina; mientras que la expresión de la proteína Bax disminuía en todos los tratamientos para las células T98G. La expresión de la proteína c-Myc disminuía con los tratamientos mencionados (metformina, DCA, metformina+DCA, memantina) en las células T98G. El tratamiento con memantina inhibió la expresión de la proteína GSK3B en las células T98G (Figura 2).

Perfiles de Expresión Diferencial de Proteínas deTejido TumoralGBM Positivo
Las muestras de tejido tumoral GBM positivo se caracterizaron en términos de apoptosis, ya que esto podría ser un indicador de la progresión de la enfermedad. Quince muestras de tejido tumoral GBM+ fueron investigadas para los perfiles de expresión de las proteínas Casp-3, Bcl-2, Bad, Bax. Se observó que las proteínas apoptóticas investigadas se expresaban de forma diferencial en cada paciente (Figura 4).
Discusión
La aprobación del fármaco antiangiogénico bevacizumab en GBM mostró una mejora en la tasa de supervivencia global de los pacientes; sin embargo, este hallazgo sigue siendo controvertido [6]. En la era de la medicina personalizada se necesitan regímenes de tratamiento alternativos para un tumor tan agresivo como el GBM.
La adicción a la glucosa y la glutamina de las células cancerosas es conocida como el sello distintivo de los cánceres [16]. El metabolismo aberrante de la glucosa se define como el motor de la agresividad y la quimiorresistencia del GBM. El tratamiento del cáncer dirigido al metabolismo tumoral ha ampliado el interés más allá del metabolismo de la glucosa a otras moléculas como la glutamina. Por lo tanto, es crucial conocer mejor el metabolismo de la glutamina en las células cancerosas [2]. Así pues, el objetivo del presente estudio es abordar el metabolismo de la glucosa y la glutamina utilizando metformina, DCA y memantina.
El mecanismo de acción de la metformina, un fármaco para la diabetes, sobre las células cancerosas es conocido por su selectividad para atacar las células madre cancerosas. Este mecanismo podría depender del metabolismo de la glutamina [8]. El DCA es un inhibidor de la piruvato deshidrogenasa cinasa que invierte el efecto Warburg [20]. La sensibilización de las células tumorales a la inhibición de la glucólisis podría lograrse mediante la doble acción de la metformina y el DCA. Además, el fármaco para el Alzheimer memantina tiene una dosis IC50 mucho más baja en comparación con la de metformina. La dosis IC50 relativamente más baja de memantina (0,5mM) podría superar los problemas relacionados con la dosis suprafisiológica de metformina en el ámbito clínico. También se ha observado que los derivados de memantina recién sintetizados tienen actividad antitumoral en la línea celular U87-MG GBM [3]. Dirigirse a las vías de señalización asociadas al receptor NMDA mediante memantina podría mejorar el tratamiento del glioma y el GBM [1,14]. Por lo tanto, el estudio del mecanismo anticancerígeno de la memantina en células de GBM es prometedor como nuevo fármaco reutilizado.
Los perfiles de expresión proteica diferencial de 15 tejidos tumorales GBM+ para los genes apoptóticos Casp-3, Bcl-2, Bad, Bax también confirman la naturaleza heterogénea de la enfermedad. La expresión positiva de Bax se asoció significativamente con la mejor tasa de supervivencia en una gran serie de tumores [19]. El perfil de expresión de la proteína Bax, por tanto, podría ser pronóstico en la respuesta al tratamiento del GBM. Se ha observado que la activación de la caspasa-3 es un factor predictivo de la supervivencia libre de progresión en pacientes con GBM [13].
La estratificación molecular de los pacientes es indispensable para seleccionar los grupos de pacientes que tienen más probabilidades de beneficiarse del protocolo de tratamiento seleccionado.
En un estudio reciente de transición a ensayo de fase II, los investigadores estudiaron las dosis máximas toleradas de memantina, mefloquina y metformina en combinación con temozolomida. Maraka et al. concluyeron que esos fármacos podían combinarse de forma segura con la Temozolomida en el GBM recién diagnosticado [10]. Algunos efectos secundarios, sin embargo, fueron reportados en los regímenes de terapia combinada y el enfoque fue escudriñado, aumentando las confusiones sobre si la memantina o la mefloquina causaron los efectos secundarios observados [15]. Sigue siendo crucial comprender las interacciones fármaco-fármaco y/o farmacocinéticas cuando se utilizan combinaciones de fármacos.
CONCLUSIÓN
Nuestros hallazgos in vitro proporcionan una prueba de concepto de que la memantina, un fármaco contra el Alzheimer, podría utilizarse en el tratamiento del GBM a dosis más bajas en comparación con la metformina. Las propiedades de penetración de la barrera hematoencefálica de memantina también son prometedoras en el tratamiento del GBM. Además, es de interés que la memantina pueda proporcionar una terapia neoadyuvante alternativa, especialmente para los pacientes de cáncer de edad avanzada. Esta afirmación requiere más investigación mediante ensayos controlados aleatorizados.
AGRADECIMIENTOS
Este estudio ha contado con el apoyo de una subvención científica del Consejo de Investigación Científica y Tecnológica de Turquía, TUBITAK (Proyecto nº: SBAG- 214S578).
REFERENCIAS
1 Altinoz MA, Elmaci I: Targeting nitric oxide and NMDA receptor-associated pathways in treatment of high grade glial tumors. Hipótesis para la nitro-memantina y las nitronas. Nitric Oxide 79:68-83, 20182 Altman BJ, Stine ZE, Dang CV: De Krebs a la clínica: Metabolismo de la glutamina a la terapia del cáncer. Nat Rev Cancer 16(10):619- 634, 2016
3 Cacciatore I, Fornasari E, Marinelli L, Eusepi P, Ciulla M, Ozdemir O, Tatar A, Turkez H, Di Stefano A: Memantinederived drugs as potential antitumor agents for the treatment of glioblastoma. Eur J Pharm Sci 109:402-411, 2017
4 Ferla R, Haspinger E, Surmacz E: Metformin inhibits leptinduced growth and migration of glioblastoma cells. Oncology Letters 4(5):1077-1081, 2012
5 Inda MD, Bonavia R, Seoane J: Glioblastoma multiforme: Una mirada al interior de su naturaleza heterogénea. Cancers 6(1):226-239, 2014
6 Johnson DR, Omuro AM, Ravelo A, Sommer N, Guerin A, Ionescu-Ittu R, Shi S, Macalalad A, Uhm JH: Supervivencia global en pacientes con glioblastoma antes y después de la aprobación de bevacizumab. Current Medical Research and Opinion 34(5):813- 820, 2018
7 Khosla D: Terapia concurrente para mejorar los resultados radioterapéuticos en el glioblastoma. Ann Transl Med 4(3):54, 2016
8 Kim JH, Lee KJ, Seo Y, Kwon JH, Yoon JP, Kang JY, Lee HJ, Park SJ, Hong SP, Cheon JH, Kim WH: Efectos de la metformina en células madre de cáncer colorrectal dependen de alteraciones en el metabolismo de la glutamina. Scientific Reports 8(1):409, 2018
9 Liu Y, Xu X, Yin L, Zhang X, Li L, Lu H: Relación entre la heterogeneidad del glioblastoma y el tiempo de supervivencia: Un análisis de textura de imágenes de RM. Am J Neuroradiol 38(9):1695-1701, 2017
10 Maraka S, Groves MD, Mammoser AG, Melguizo-Gavilanes I, Conrad CA, Tremont-Lukats IW, Loghin ME, O’Brien BJ, Puduvalli VK, Sulman EP, Hess KR: Fase 1 de introducción a un estudio factorial de fase 2 de temozolomida más memantina, mefloquina y metformina como terapia adyuvante postradiación para glioblastoma recién diagnosticado. Cancer 125(3):424-433, 2019
11 Michelakis ED, Webster L, Mackey JR: Dicloroacetato (DCA) como potencial terapia metabólica-objetivo para el cáncer. Br J Cancer 99(7):989-994, 2008
12 Mrugala MM: Avances y retos en el tratamiento del glioblastoma: la perspectiva de un clínico. Discov Med 15(83):221-230, 2013
13 Murphy ÁC, Weyhenmeyer B, Schmid J, Kilbride SM, Rehm M, Huber HJ, Senft C, Weissenberger J, Seifert V, Dunst M, Mittelbronn M: Activation of executioner caspases is a predictor of progression-free survival in glioblastoma patients: A systems medicine approach. Cell Death Dis 4(5):e629, 2013
14 Müller-Längle A, Lutz H, Hehlgans S, Rödel F, Rau K, Laube B: NMDA receptor-mediated signaling pathways enhance radiation resistance, survival and migration in glioblastoma cells-a potential target for adjuvant radiotherapy. Cancers (4):503, 2019
15 Nevin RL: Tasas inesperadamente bajas de efectos adversos neuropsiquiátricos asociados a la mefloquina reorientada para el tratamiento del glioblastoma. Cancer 125(8):1384-1385, 2019
16 Panchanathan RS, Sittur MG, Aoun RJ, Pines AR, Swanson KR, Bendok BR: Guerra contra el glioblastoma multiforme: asedio en dos frentes contra la glutamina. World Neurosurgery 91:254-256, 2016
17 Parsons DW, Jones S, Zhang X, Lin JC, Leary RJ, Angenendt P, Mankoo P, Carter H, Siu IM, Gallia GL, Olivi A, McLendon R, Rasheed BA, Keir S, Nikolskaya T, Nikolsky Y, Busam DA, Tekleab H, Diaz Jr LA, Hartigan J, Smith DR, Strausberg RL, Nagahashi Marie SK, Oba Shinjo SM, Yan H, Riggins GJ, Bigner DD, Karchin R, Papadopoulos N, Parmigiani G, Vogelstein B, Velculescu VE, Kinzler KW: Un análisis genómico integrado del glioblastoma multiforme humano. Science 321(5897):1807-1812, 2008
18 Rojas LBA, Gomes MB: Metformin: An old but still the best treatment for type 2 diabetes. Diabetol Metab Syndr 5(1):6, 2013
19 Ruano Y, Mollejo M, Camacho FI, de Lope AR, Fiaño C, Ribalta T, Martínez P, Hernández Moneo JL, Meléndez B: Identificación de genes relacionados con la supervivencia de la vía de señalización fosfatidilinositol 3′ quinasa en glioblastoma multiforme. Cancer 112(7):1575-1584, 2008
20 Shen H, Decollogne S, Dilda PJ, Hau E, Chung SA, Luk PP, Hogg PJ, McDonald KL: Dual-targeting of aberrant glucose metabolism in glioblastoma. J Exp Clin Cancer Res 34(1):14, 2015
21 Soeda A, Hara A, Kunisada T, Yoshimura SI, Iwama T, Park DM: La evidencia de la heterogeneidad del glioblastoma. Scientific Reports 5:7979, 2015
22 Sottoriva A, Spiteri I, Piccirillo SG, Touloumis A, Collins VP, Marioni JC, Curtis C, Watts C, Tavaré S: Intratumor heterogeneity in human glioblastoma reflects cancer evolutionary dynamics. Proc Natl Acad Sci U S A 110(10):4009- 4014, 2013
23 Stupp R, Mason WP, Van Den Bent MJ, Weller M, Fisher B, Taphoorn MJ, Belanger K, Brandes AA, Marosi C, Bogdahn U, Curschmann J, Janzer RC, Ludwin SK, Gorlia T, Allgeier A, Lacombe D, Cairncross JG, Eisenhauer E, Mirimanoff RO, European Organisation for Research and Treatment of Cancer Brain Tumor and Radiotherapy Groups; National Cancer Institute of Canada Clinical Trials Group: Radioterapia más temozolomida concomitante y adyuvante para el glioblastoma. N Engl J Med 352(10):987-996, 2005
24 Quinn BJ, Kitagawa H, Memmott RM, Gills JJ, Dennis PA: Repositioning metformin for cancer prevention and treatment. Trends in Endocrinology & Metabolism 24(9):469-480, 2013
25 Whitburn J, Edwards CM, Sooriakumaran P: Metformina y cáncer de próstata: Un nuevo papel para un viejo fármaco. Informes actuales de urología 18(6):46, 2017
26 Yang SH, Li S, Lu G, Xue H, Kim DH, Zhu JJ, Liu Y: El tratamiento con metformina reduce la resistencia a la temozolomida de las células de glioblastoma. Oncotarget 7(48):78787-78803, 2016
27 Zhang X, Zhang W, Cao WD, Cheng G, Zhang YQ: Glioblastoma multiforme: Caracterización molecular y estrategia de tratamiento actual. Exp Ther Med 3(1):9-14, 2012
Contenido relacionado: